서 론
최근 질소비료, 농약의 사용증가에 따른 영양염류 및 질 산성질소 등 유해물질의 증가와 이로 인한 음용 지하수의 수질악화에 따른 농촌지역 주민의 건강 문제가 대두 되고 있다. 전국에 분포하는 지하수의 수질 측정 결과, 전체 지 하수(2011년, 총 4,879개 조사)의 수질 기준 초과율은 8.0%였으며, 이 중 농촌 지역 지하수는 16.8%(20/119)의 가장 높은 수질 기준 초과율을 보였다. 농촌 지역 지하수 의 주요 수질 기준 부적합 항목은 잔류염소, pH, 총대장균 군, 질산성질소 순으로 부적합 비율이 높았으며, 특히 음용 /비음용 지하수 중에는 각각 16.2%, 4.6%로 음용 지하수의 수질기준 초과율이 높았다. 이와 같은 조사 결과로부터 국 내 지하수 중 농촌지역 음용수로 섭취하는 물의 관리가 필 요하며, 특히 잔류염소, 총대장균군, 질산성질소에 대한 저 감화가 중요함에 따라 이에 관련된 연구들이 진행되고 있 다. 이 중 질산성질소의 인체 위해성이 보고되고 국내외 관련 기준이 마련되면서 음용 지하수에 존재하는 질산성질 소의 양을 저감화하는 기술 개발의 중요성이 주목 받고 있 다. Table 1은 음용수에 존재하는 오염물질의 저감화에 사 용되는 대표적인 음용수 처리공정의 원리 및 장단점을 나 타내고 있다.
| 여과 방법 | 여과 원리 | 장점 | 단점 | 참고문헌 |
|---|---|---|---|---|
| 역삼투 막분리 | 역삼투 원리 | - 중금속 제어 가능 | - 염류 제거 | |
| - 높은 효율(99% 이상 제거) | - 가압펌프, 전기설비 필요(고가) | |||
| - 순수한 물 확보 | - 재생 불가능 | |||
| - 걸러지는 물의 양이 적음 | ||||
| 활성탄 흡착 | 물리적, | - 운전조작이 용이 | - 전처리 시설 필요 | |
| 화학적 | - 재사용 가능 | - 활성탄 재생에 고비용 발생 | ||
| 흡착 이용 | - 비교적 긴 사용기간 | - 흡착이 진행될수록 효율 저하 | ||
| - 흡착력 우수 | 낮은 효율 | |||
| - 이온재생을 위해 역세주기가 빠름 | (Shannon et al.,2008) | |||
| 이온교환수지 | 이온화 | - 작은 전력으로 유지 | - 전력 공급 장치 추가 설치 | |
| 흡착 | 물질 교환 | - 이온으로 존재하는 물질 제거에 용이 | - 유지비용 높음 | |
| - pH에 따라 흡착률 차이 발생 | ||||
| 한외여과 | 공극 크기 | - 높은 에너지 효율 | - 탁한 물질이 많을 경우 효율 저하 | |
| 에 의한 | - 적용의 유연성 | - 공극 폐색 우려 | ||
| 물질 여과 | - 경제성 | |||
| 전하필터 | 전하에 의한 | - 높은 효율성 | - 색, 냄새, 맛 등 제거의 어려움 | |
| 물질 제거 | - pH 비의존성 | - 압력 조절이 필요 | ||
| - 유지관리가 용이 | - 고가의 유지관리 비용 |
질산성질소의 지하수 유입경로에 대해서는 많은 연구 및 조사가 이루어져 왔는데, 자연계에서 진행되는 질소의 순 환과정 중 동식물체에서 유래되는 유기성질소태인 단백질 및 그 분해산물인 폴리펩티드 등은 수중의 미생물에 의해 서 분해되어 암모니아성 질소를 생성한다. 또한 질소비료, 가축분뇨 등에 포함된 유기성질소태 및 무기성질소태도 분 해과정을 거쳐 암모니아성 질소화된다. 암모니아성 질소는 질화균에 의해서 아질산성질소(NO2-)로 산화되고, 추가적인 산화되는 과정을 거쳐 최종적으로 질산성질소(NO3-)가 생 성된다. U.S. Environmental Protection Agency(EPA) 에서 는 음용수 내 질산성질소(NO2-N 또는 NO3-N) 최대 허용 기준을 10 mg/L로 규정하고 있으며, 우리나라, 미국, 일본 등을 비롯한 세계 각국에서는 이 값을 채택하고 있는 나라 가 다수이다. 일반적으로 오염되지 않은 지하수에서 질산 성질소는 3 mg/L 미만으로 검출되나, 과도한 질소비료의 시비나 처리되지 않은 분뇨에 의해 지하수가 오염되면 지 하수 내의 질산성질소 농도가 급격하게 증가한다.
질산성질소는 체내에서 발암성물질인 나이트로아민 (nitroamine)으로 환원되어 암을 유발할 수 있으며, 영유아 에게는 체내에서 산소전달을 방해하는 청색증의 원인물질 로 알려져 있다(Duncan et al., 1997). 따라서 WHO에서는 고농도 질산성질소(22 mg/L이상)를 함유하는 음용수의 유 아식에 사용을 금지하고 있다.
본 논문에서는 기존에 사용되어 온 대표적인 음용수 내 질산성질소 저감화 기술의 특성 및 장단점을 살펴보고, 음 용수 처리에 가장 널리 이용되는 흡착기반 질산성질소 저감 화 기술에 대해 더욱 심층적으로 살펴보고자 한다. 특히, 흡착소재의 종류 및 특성에 따른 질산성질소 제거 메커니즘 을 살펴보고 흡착소재의 개질 및 새로운 소재 개발을 통한 질산성질소 제거효율 향상 기술에 대해 기술하고자 한다.
음용 지하수의 질산성질소 저감화 기술
음용수에 존재하는 질산성질소의 대표적인 저감화 기술 은 역삼투, 전기투석, 이온교환, 흡착, 생물학적 탈질소, 화 학적 환원공정으로 분류할 수 있으며, 처리하는 음용수의 양, 음용 원수의 오염도, 처리여건에 따라 적절한 공정을 선택하는 것이 중요하다(Bhatnagar & Sillanpää, 2011). Table 2은 음용수에 존재하는 질산성질소의 저감화에 사용 되는 대표적인 처리공정의 원리 및 특징을 나타내고 있다. 투석과 역삼투 공정은 질산성질소를 포함하여 대부분의 오 염물질에 대해 높은 제거율을 보이나, 막 자체의 노화 및 오염, 설치 및 유지관리 비용이 높은 단점이 있다(Sablani et al., 2001). 이온교환공정은 역삼투 공정에서와 같이 질 산성질소에 대해 높은 제거율을 보이나, 이온교환수지의 재생 및 재생 폐액 처리 문제 때문에 그 이용이 제한되고 있다. 흡착공정은 상대적으로 가격이 저렴하고 다양한 물 질에 대한 흡착률을 보이기 때문에 그 활용도가 높으나, 질산성질소에 대한 선택적 친화도가 낮으며 제조 조건 및 처리 환경에 따라 제거율이 달라지는 단점이 있다(Ahmad & Normanbhay, 2012). 생물학적 탈질소공정은 질산성질소 에 대한 높은 선택성 및 제거 효율을 나타내지만, 사용되 는 미생물에 의한 이차 오염 가능성이 높다(Matìjù et al., 1992). 화학적 환원공정은 비용이 저렴하고 조작이 간편하 나, 처리환경에 따라 질산성질소의 제거율이 달라지며 환 원공정에 의한 부산물이 생성되는 단점이 있다(Cheng et al., 1997). WHO에서는 생물학적 탈질공정 및 이온교환공 정을 가장 효율적인 질산성질소 제거공정으로 규정하고 있 으며, U.S. EPA에서는 이온교환, 역삼투, 전기투석공정을 가 장 효율적인 공정으로 규정하고 있다(Bhatnagar & Sillanpää, 2011). Fig. 1
| 저감화 방법 | 질산성질소 저감화 원리 | 처리 후 질소 형태 | 특징 | 문제점 | 참고문헌 |
|---|---|---|---|---|---|
| 전자공여체로 유기물 | 질소가스 | - 유지비용 저렴 | - 잔존유기물의 제거 어려움 | ||
| 생물학적 | 을 사용하여 생물학적 | - 대규모 처리 가능 | - 다량의 잉여슬러지 생성 | ||
| 으로 질산이온 환원 | - 유지관리 어려움 | ||||
| 이온교환 | 교환수지에 흡착제거 | 산성질소 | - 유지비용 저렴 | - 다량의 소금을 재생제로 사용하 여 고농도의 폐액발생 | |
| - 신속한 반응속도 | (Bhatnagar & Sillanpää, 2011) | ||||
| - 부산물이 없음 | |||||
| - 유지관리 용이 | |||||
| 역삼투 | 역삼투에 의한 질산이 온 제거 | 질산성질소 | - 부산물이 없음 | - 다른 염류도 제거 | |
| - 유지관리 용이 | - 폐농축액에 고농도 NO3 - 함유 | ||||
| - 적은 화학물질 사용 | - 고가의 처리비용 | ||||
| 전기투석 | 전기투석막에 의해 질산이온 제거 | 질산성질소 | - 부산물이 없음 | - 다른 염류도 제거 | |
| - 유지관리 용이 | - 폐농축액에 고농도 NO3 - 함유 | ||||
| - 적은 화학물질 사용 | - 고가의 처리비용 |
흡착공정을 이용한 음용 지하수 내 질산성질소 저감화 기술
흡착공정에 의한 질산성질소 저감화 기술은 편의성, 간 편성, 저비용, 다양한 물질에 대한 흡착력 등의 장점이 있 기 때문에 질산성질소 제거기술 연구에서 가장 큰 비중을 차지하고 있다(Ali & Gupta, 2007). 흡착공정의 메커니즘 은 반데르발스 힘, 정전기적 인력, 이온결합 등 다양한 물 리적, 화학적, 정전기적 작용의 복합적인 반응에 의해 일어 나기 때문에, 흡착소재의 표면 특성, 표면 작용기 특성, 공 극의 크기 및 분포, 흡착이 일어나는 환경 조건, 제거하고 자 하는 물질의 특성 등에 따라 흡착 효율이 달라진다 (Moreno Castilla, 2004)
흡착공정에 의한 질산성질소의 저감화 연구는 기존의 흡 착에 사용하는 물질의 제조 방법을 개선하여 질산성질소를 음용수에서 선택적으로 제거하는 기술 개발 등이 진행되고 있으며(Liou et al., 2005; Samatya et al., 2006), 질산성질 소를 포집할 수 있는 신규 담체 및 흡착소재 개발에 대한 연구도 수행되고 있다(Chen et al., 2004). 특히, 기존 흡착 소재의 질산성질소 흡착 효율 향상, 흡착소재의 재생효율 향상, 비용 절감을 위한 새로운 흡착소재 개발 연구 등이 활발히 수행되고 있으며(Tezuka et al., 2004; Afkhami et al., 2007; Mena-Duran et al., 2007), 흡착에 사용되는 소 재의 비용절감을 위하여 상대적으로 가격이 저렴한 흡착소 재나 농업 부산물 및 산업 부산물을 활용한 흡착소재의 개 발 연구가 이루어지고 있다(Jaafari et al., 2001; Jaafari et al., 2004; Yu et al., 2007; Rezaee et al., 2008). 또한, 다른 흡착원리의 질산성질소 흡착소재를 복합적으로 적용하여 질 산성질소 제거 효율을 향상시키려는 연구도 이루어지고 있 다(Back et al., 2003; Sim et al., 2008; Kim & Choi, 2010).
음용수 내 질산성질소 저감화에 가장 널리 연구 또는 이 용되는 흡착소재로 활성탄, 탄소나노튜브, 그래핀과 같은 탄소기반 흡착소재(Deb et al., 2012), 점토(Belfiore et al., 1984), 제올라이트(Mažeikiene et al., 2008)가 있으며, 이 외에도 키토산과 같은 생체 고분자 물질, 농업 및 산업 부 산물 유래 흡착소재 개발연구가 활발히 진행되고 있다 (Mishra & Patel, 2009; Patil et al., 2013). 특히, 질산성질 소와 친화성이 높은 작용기를 흡착소재 표면에 결합시켜 선택적으로 제거하고자 하는 연구가 활발히 진행되고 있다 (Bhatnagar & Sillanpää, 2011).
활성탄을 이용한 질산성질소 저감화 기술
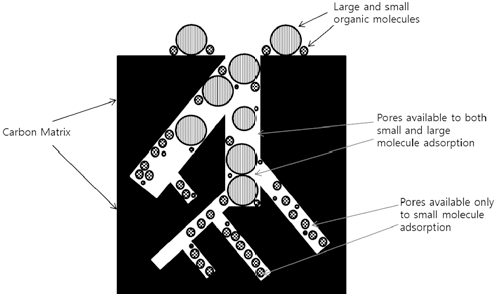
활성탄(activated carbon)은 나무, 토탄, 석유피치 또는 견 과류껍질과 같은 탄소가 주 골격이 되는 물질을 높은 온도 에서 가열하여 탄화시킨 후 고온 또는 염화아연이나 인산 과 같은 활성화 물질을 이용하여 활성화시킨 탄소기반 물 질이다. 활성탄은 표면적이 넓고 많은 미세 공극이 존재하 며, 활성화 과정 중에 생성되는 표면 카복실기, 수산기 또 는 에폭사이드기에 의해 다양한 물리흡착 및 화학흡착 특 성을 나타낸다. 활성탄은 다양한 물질에 대한 흡착력이 높 아 가장 널리 연구되고 산업적으로 이용되어 온 흡착소재 이다. 활성탄의 흡착 효율은 공극의 크기 및 분포, 표면적, 표면 작용기, 탄화 온도, 흡착 온도 및 용액의 pH에 따라 달라진다. Bhatnagar(2008) 등은 활성탄 제조 시 탄화온도 가 500℃ 일 때 질산성질소 제거 효율이 가장 높고, 그 이 상의 온도에서는 오히려 제거 효율이 낮아진다고 보고하였 다. 이는 활성탄 제조 시 500℃ 이상의 온도에서 탄소 입자 들이 서로 밀착하여 응고하며 수축하기 때문에 표면적이 감 소하고 공극의 분포가 감소하기 때문인 것으로 평가하였다. 활성탄은 다양한 물질에 대한 흡착력이 뛰어나지만, 음이온 에 대한 흡착력은 상대적으로 낮아, 질산성질소(NO3-) 제거 효율이 상대적으로 낮다(Bhatnagar & Sillanpää, 2011).
활성탄의 질산성질소 제거 효율 향상을 위해 많은 연구진 에 의해 다양한 방법이 제시되었으며, 대부분의 기술이 활 성탄의 표면개질(surface modification)을 통한 질산성질소 친화성 향상에 중점을 두고 있다. Mizuta(2004) 등은 대나 무 활성탄이 상업적으로 판매되고 있는 활성탄보다 질산성 질소 제거율이 더 뛰어나다는 것을 증명하였다. Khan (2011) 등은 ZnCl2로 표면개질 된 활성탄이 표면개질 하지 않은 활성탄보다 질산성질소 제거 효율이 높다는 것을 증명 하였으며, 이는 활성탄 표면에 존재하는 Zn2+ 에 의해 질산 성질소에 대한 친화력이 높아졌기 때문으로 분석하였다. Table 3
| 흡착소재 | 최대 흡착량 | Nitrate 농도 | 온도 (°C) | pH | 경쟁이온 | 흡착시간 (h) | 참고문헌 |
|---|---|---|---|---|---|---|---|
| Bamboo powder charcoal | 1.25 mg/g | 0-45 mg/L | 10-20 | - | - | 120 | (Mizuta et al., 2004) |
| ZnCl2 modified lignite granular activated carbon | 4.4 mg/g | 5-150 mg/L | 10-45 | 2-12 | Cl-, CO32-, PO43- | 2 | (Khan et al., 2011) |
| Rice husk activated carbon | 142.86 mg/g | 50-600 mg/L | 25 | 7 | - | 24 | (Ahmadzadeh Tofighy & Mohammadi, 2012) |
| Sugar beet bagasse activated carbon | 300 mg/g | 27.55 mg/L | 25-45 | 3-10 | - | - | (Demiral & Gündğzo lu, 2010) |
| ZnCl2 treated coconut granular activated carbon | 10.2 mg/g | 5-200 mg/L | 25 | 5.5 | - | 2 | (Bhatnagar et al., 2008) |
| Chitosan coated natural zeolite | 0.74 meq/g | 10-3100 mg/L | 4-20 | - | - | 72 | (Arora et al., 2010) |
| HDTMA functionalized clinoptilolite | 11.4 mg/g | 10-300 mg/L | 20-60 | 1.66-11 | - | 24 | (Onyango et al., 2010) |
| HDTMA functionalized organoclays | 14.76 mg/g | 100 mg/L | 25 | 5.4 | - | 17 | (Xi et al., 2010) |
| HDTMA modified UZM-5 | 18.62 mg/g | 30-100 mg/L | 25-60 | 3-11 | SO42-, HCO3-, PO43- | 12 | (Aghaii et al., 2013) |
| HDTMA, DODMAB modified clinoptilolite and montmorillonite | 125 mg/g | 160-280 mg/L | 30-40 | 3-11 | ~ 40 | (Bhardwaj et al., 2012) | |
| ODTMAC, CTMAB modified organoclay | 0.287 meq/g | 61.98 mg/L | 25 | - | SO42-, CO32-, HCO3- | ~ 24 | (Seliem et al., 2013) |
| Quaternized chitosan beads | ~ 70 mg/g | 50-1000 mg/g | 25 | 2-12 | SO42-, HCO3-, Cl- | ~ 2 | (Sowmya & Meenakshi, 2013) |
| NaHSO4 conditioned chitosan beads | 104 mg/g | 500 mg/L | 30 | 3-8 | - | 24 | (Chatterjee et al., 2009) |
| Chitosan beads | 92.1 mg/g | 50-1000 mg/L | 20-50 | 3-8 | - | 24 | (Chatterjee & Woo, 2009) |
제올라이트 및 점토를 이용한 질산성질소 저감화 기술
제올라이트와 점토는 광물의 일종으로 음용수의 처리 공 정에 흡착소재로 널리 이용된다. 제올라이트와 점토는 알 루미노 실리케이트를 주요 구성성분으로 하고 있으나 결정 모양 및 구조적인 차이로 인해 다른 특성을 나타낸다. 제 올라이트는 다공성의 결정으로 많은 미세 공극을 가지기 때문에 분자량이 작은 이온 물질의 흡착에 효과적이며, 점 토는 여러 층이 겹쳐진 층상구조로 이루어져 있기 때문에 제올라이트에 비해 큰 분자를 흡착시키는 성질을 지닌다.
제올라이트나 점토는 이온성 계면활성제나 분자 내 전하 를 가지는 폴리머로 표면을 코팅하여 다양한 물질에 대한 흡착 효율을 높일 수 있다. Arora(2010) 등은 천연 제올라 이트의 표면에 키토산을 결합시켜 질산성질소 흡착 효율을 향상시켰으며, Onyango(2010) 등은 hexadecyltrimethyl ammonium(HDTMA)를 결합시켜 표면개질 된 제올라이트 를 제조한 후 다양한 경쟁이온 존재 하에서 질산성질소의 흡착률을 향상시키는 연구를 수행하였다. HDTMA를 이용 하여 표면개질한 제올라이트 소재의 질산성질소 흡착량은 표면개질된 제올라이트의 사용량을 증가시킬수록 증가하며 경쟁이온의 존재는 질산성질소의 흡착률을 감소시킨다고 보 고하였다. Xi(2010) 등은 점토광물의 일종인 벤토나이트 (bentonite), 할로이사이트(halloysite), 카올리나이트(kaolinite) 에 hexadecyltrimethylammonium bromide(HDTMABr)을 결 합시킨 후 질산성질소를 흡착시킨 결과, 점토광물의 종류에 따라 다른 흡착률을 보였으며, 표면개질 된 벤토나이트에 서 질산성질소의 흡착률이 90% 이상으로 가장 높은 질산 성질소 흡착률을 보인 것으로 보고하였다. Zhang(2011) 등 은 나노영가철로 표면개질시킨 층간가교점토(pillared clay) 를 이용하여 질산성질소를 흡착시킨 결과, 표면개질 전보 다 더 높은 흡착률을 보였으며, 이는 층간가교점토의 흡착 성과 나노영가철의 환원성에 의한 상승효과 때문인 것으로 보고하였다.
키토산을 이용한 질산성질소 저감화 기술
키토산은 D-glucosamine(2-amino-2-deoxy-D-glucose)의 β-(1→4) 중합체로 갑각류 및 곤충 등의 외골격에 존재하 는 키틴을 탈아세틸화해서 만드는 탄수화물의 일종이다. 키토산은 생체 고분자 탄수화물로서 가격이 싸고, 다양한 물질에 대한 흡수력 및 흡착력이 뛰어나며, 분자 내 아마 인 작용기를 포함하고 있기 때문에 음이온성 물질에 대한 결합력이 크다. 음용수 처리를 위한 흡착공정에서 키토산 은 주로 중금속 제거용(Saifuddin & Kumaran, 2005)으로 연구 또는 이용되어 왔으나, 최근에는 중금속 뿐만 아니라 다양한 금속이온(Wan Ngah et al., 2002), 유기물 및 방사 성 물질(Stopa & Yamaura, 2010)에 대한 흡착소재로 연구 되고 왔다. 키토산 분자 내에 존재하는 아마인 작용기는 낮은 pH에서 양전하를 띄기 때문에 키토산 자체는 훌륭한 음이온성 물질 흡착소재로 작용한다. 음이온성 물질 흡착 은 키토산에 존재하는 아마인 작용기의 양전하와 흡착하고 자 하는 물질의 음전하 사이의 이온결합(ionic bond)에 의 존한다. 키토산은 분자 내에 아마인 작용기의 개수를 증가 시키기 위하여 음이온성 계면활성제 또는 유기산을 키토산 의 표면에 작용기로 결합시켜 용액 내에 존재하는 양이온 성 중금속 및 방사성물질을 높은 효율로 제거할 수 있다.
키토산은 중성 및 알칼리 조건에서 NH2 상태로 존재하 기 때문에 지하수의 평균 pH(약 pH 6-7)를 고려해 봤을 때 음용 지하수에서 질산성질소의 흡착소재로 이용하는 데 큰 제약이 따른다. 몇몇 연구진에 의해 키토산의 수소이온 첨가(NH2 -> NH3+) 반응에 의한 키토산의 질산성질소 제 거효율 향상 방안이 개발되었지만 질산성질소 제거 수준은 전반적으로 아직 미미한 실정이다(Chatterjee et al., 2009). Chatterjee & Woo(2009)는 키토산 하이드로겔 비드를 제조 하여 pH와 온도변화에 따른 수용액 내 질산성질소 흡착 특성을 연구하였다. 키토산 하이드로겔 비드의 질산성질소 흡착률은 30℃의 pH 3 수용액에서 가장 높았으며, pH와 온도가 증가할수록 감소하였고, 키토산 하이드로겔 비드를 재사용하기 위한 흡착된 질산성질소의 탈착은 pH 12에서 87%로 가장 높게 나타났다고 보고하였다. 또한, sodium bisulfate로 표면개질한 키토산 하이드로겔 비드를 이용하여 질산성질소 흡착률을 평가한 결과, 표면개질한 키토산 하 이드로겔 비드가 그렇지 않은 것보다 더 높은 흡착률을 보 였다고 보고하였다(Chatterjee et al., 2009). Jaafari(2001) 등은 HCl로 표면개질 한 가교 키토산 겔 비드를 이용하여 수용액 내 질산성질소 제거율을 평가한 결과 약 70% 의 질산성질소 제거율을 보였으며, 20 ppm의 질산성질소를 포 함하고 있는 지하수를 이용하여 고정 베드 컬럼에서 시뮬 레이션 하여 실제 질산성질소 제거율을 평가하였다(Jaafari et al., 2004). 질산성질소 제거율은 컬럼의 지름보다 길이 에 영향을 받으며, 지름 0.2 m, 길이 1.5 m의 컬럼 이용 시 5-10명의 하루 평균 섭취량의 물을 처리할 수 있을 것으 로 평가했다.
요 약
본 논문에서는 음용수 내 질산성질소 저감화 기술에 대 해 간략히 소개하였으며 그 중 흡착기술을 이용한 질산성 질소 저감화 기술에 대해 세부적으로 논의하였다. 또한, 기 존 흡착소재의 개질 및 새로운 소재 개발을 통한 질산성질 소 제거효율 향상 기술을 간략하게 소개하였다. 본문에서 살펴본 바와 같이 질산성질소 저감화 기술은 제거원리에 따라서 크게 몇 가지로 분류할 수 있으나, 본문에서 언급 되지 않은 새로운 기술이 지속적으로 연구 또는 개발되고 있다. 흡착소재는 가격, 설치 및 유지비가 상대적으로 저렴 하고, 설치 및 조작이 간편하며, 정수 규모에 상관없이 쉽 게 적용할 수 있기 때문에 수처리 산업에서 가장 널리 이 용되고 있다. 활성탄과 같은 탄소소재, 제올라이트나 점토 와 같은 실리케이트는 다양한 물질에 대한 흡착력을 보이 며 표면개질을 통한 특정 오염원의 제거 향상률이 높기 때 문에 오래 전부터 흡착소재로 가장 널리 연구되어 왔으며, 최근에는 키토산과 같은 생체고분자 물질이나 농업 및 산 업 폐기물을 재활용한 새로운 소재 개발이 활발히 진행되 고 있다. 음용수의 오염 및 소비자들의 물에 대한 불신이 커져가고 있는 시점에서 현재 연구되고 있는 새로운 흡착 소재의 개발 및 저렴하고 제거효율이 뛰어난 흡착소재의 개발은 안전한 음용수의 공급을 가능케 하여 국민 건강에 이바지 할 것이다.