서 론
배암차즈기(Salvia plebeia R. Br.)는 꿀풀과(Labiatae)에 속하는 식물로 알려져 있으며, 우리나라 전 지역에 분포하 는데 특히 산야, 길가, 개울가에서 자생하는 식물이다(Bae et al., 2007). 곰보배추, 뱀배추, 여지초, 나인초, 설견초 등 의 이명을 가지며 한방에서는 전초를 한약으로도 쓰이고 있다(Kang, 2008). 배암차즈기의 효능으로는 기침, 천식, 염증 등에 효과가 있다고 알려져 있으며, 쓴 맛, 떫은 맛, 매운 맛이 강하다는 특징이 있다(Jo et al., 2010). 주요 활 성 성분으로는 flavonoid와 phenol성 물질, saponin, 정유성 분, 강심배당체, 불포화 sterol 등이 보고되었다(Shin et al., 2001;Lim et al., 2007). 특히, luteolin-7-O-glucoside, nepetin, rosmarinic acid, caffeic acid, hispidulin, hispidulin-7-Oglucoside 등의 기능 성분이 알려져 있다(Jin et al., 2008). 또한 배암차즈기에 대한 생리활성 연구가 진행되고 있고 그 우수성이 알려지고 있으며 항산화 활성(Lim et al., 2007), 항염증 효과(Bae, 2016), 항알레르기 효과(Kim et al., 2014), 항균작용(Kamatou et al., 2005), 간세포 보호효 과(Qu et al., 2009) 등과 관련된 다양한 선행연구 결과가 보고되어 있다.
주로 식품을 생산 및 가공하는데 사용되고 있는 수용화 기술중에서도 효소를 이용한 효소처리 형태가 있으며 이는 식물체의 가수분해 효율을 높일 수 있을 뿐만 아니라 다당 류 분해 효소를 활용하면 복잡한 형태의 섬유질과 펙틴의 구조를 좀 더 용이하게 분해시킬 수 있다. 식품에 사용되고 있는 효소 중에서도 식물 세포벽 분해 효소인 pectinase, cellulase, viscozyme 및 전분 분해 효소인 α-amylase를 통 해 추출 수율 확대 및 기능성분 용출 증진 효과를 가져올 수 있다고 하였다(Nam et al., 2018). 효소처리를 이용한 선행연구로는 효소가수분해를 통한 청자파래의 환원당 생 산연구(Kim et al., 2015), 토마토 폐기물에 pectinase 처리 를 통한 카로티노이드 추출 증진(Strati et al., 2015), 생강 추출물의 기능성분 및 항산화 효과를 증진시키기 위한 발 효 및 효소 복합처리연구(Kim et al., 2022) 등이 있다. 반 면에, 다양한 효능이 확인되고 있는 기능성 소재 중 하나 인 배암차즈기에 효소처리를 적용하여 기능성분 용출의 극 대화 연구는 거의 이뤄지지 않은 상태이다. 또한 산업체에 서의 활용성을 높이기 위해 배암차즈기의 대량 추출을 통 한 제품 적용성 연구도 필요하다.
따라서 본 연구에서는 배암차즈기의 기능성분 추출을 증 진시키기 위해 효소처리 기술을 적용한 후 기능성분의 함량 을 분석하고, 항산화 및 항염증 활성을 평가하여 기능성식품 소재 개발의 산업화를 위한 기초 자료로 제공하고자 한다.
재료 및 방법
본 실험에 사용된 배암차즈기는 전북 부안군 동진농장영 농조합법인에서 2021년에 구입한 국내산 배암차즈기 열풍 건조 전초 및 열풍 건조 분말을 -20°C 냉동고에서 보관하 면서 실험에 사용하였다. 효소는 세포벽 분해 효소 pectinase (Pectinex Ultra SP-L), cellulase (Celluclast 1.5L FG), viscozyme (Viscozyme L)과 전분 분해 효소 α-amylase (Termamyl 2X)를 Novozymes (Novo Nordisk, Copenhagen, Denmark)사에서 구입하여 사용하였다. 분석에 사용된 시약은 dinitrosalicylic acid (DNS), Folin-Ciocalteu’s reagent, gallic acid, glucose, catechin, sulfuric acid, potassium persulfate (Sigma-Aldrich Co., St. Louis, MO, USA)을 사용하였다. 그 외 시약 및 용매는 분석용 특급시약(Sigma-Aldrich Co.)을 사용하였다.
구연산처리 조건 선정을 위하여 배암차즈기 분말 5 g에 구연산 분말(배암차즈기 분말 대비 0.8%, 효소 최적조건 pH 5.5 조절량과 동일)을 혼합한 후 증기 또는 압력 처리 하였다. 구연산 증기처리는 구연산 분말을 가정용 찜기에 서 온도 100°C, 15 min 동안 처리하였고, 구연산 압력처리 는 고압멸균기(Daihan Scientific, Wonju-si, Korea)에서 온 도 100°C, 압력 1 bar, 15분 동안 처리하였다. 구연산으로 전처리한 배암차즈기 분말을 효소처리에 사용하였으며 효 소처리는 세포벽 분해효소 pectinase (P), cellulase (C), viscozyme (V)를 1:1:1 비율로 혼합한 혼합효소 1종으로 진행하였다. 혼합효소는 1% (기질대비)를 첨가하여 50°C에서 2시간 동안 처리하였다. 2차 전분분해 효소인 Termamyl (T)를 동일량 첨가하여 93°C에서 2 h 동안 처리하여 구연 산 증기 효소처리구(S-PCV)와 구연산 압력 효소처리구(PPCV) 를 제조하였다. 효소의 불활성화를 위해 100°C에서 10min 동안 가열하였다. 추출물은 6,683×g, 15min 조건에서 원심분리(2236R, GYROZEN Co., Ltd., Gimpo-si, Korea) 를 하였고 여과지(Whatman No. 4, GE Healthcare Co., Bukinghamshire, UK)로 감압여과하였다. 이 상등액을 이용 하여 실험에 사용하였다. 대조구로 열수추출 처리구 (CON)는 분말 5 g에 20배에 해당하는 증류수를 가한 후 100°C, 2 h 동안 냉각환류추출장치(reflux)를 이용하여 추출 물을 제조하였다. 구연산 혼합 열수추출 처리구(C-CON)은 구연산을 혼합한 후 열수추출 처리구(CON)과 동일한 조건 으로 제조하였고 구연산 증기 전처리구(S-CON)은 구연산을 넣고 증기 전처리 한 후 열수추출 처리구(CON)과 동일한 조건으로 제조하였다. 구연산 압력 전처리구(P-CON)은 구 연산을 혼합하여 압력 전처리 한 후 열수추출 처리구(CON) 과 동일한 조건으로 제조하였다.
효소 종류 선정을 위한 구연산처리는 전처리 조건 선정 을 통해 선정된 압력처리 조건으로 진행하였다. 구연산 압 력처리된 배암차즈기 미분쇄 분말 5 g에 20배에 해당하는 증류수를 가하였다. 효소는 단일 또는 혼합 처리하였으며 고압멸균기를 사용하였다. 1차 세포벽 분해 효소처리는 pectinase (P), cellulase (C), viscozyme (V), pectinase와 cellulase를 1:1로 혼합 (PC), cellulase와 viscozyme을 1:1로 혼합 (CV), pectinase와 viscozyme을 1:1로 혼합 (PV), pectinase, cellulase, viscozyme을 1:1:1로 혼합 (PCV)하여 50°C에서 2 h 동안 진행하였다. 2차 전분분해 효소처리는 T를 배암차즈기 기질의 1% (w/w) 농도로 첨가하여 93°C 에서 2 h 동안 진행하였다. 전분분해효소 처리는 기존의 Nam et al. (2018)의 선행문헌을 변형하여 2시간으로 고정 하여 진행하였다. 대조구로 CON은 구연산처리 조건 선정 과 동일한 방법으로 제조하여 비교하였고, 다른 대조구 (CON-1)은 구연산과 효소를 첨가하지 않고 효소처리와 동 일한 방법으로 처리하였다. 구연산은 첨가하고 효소는 첨 가하지 않은 대조구(CON-2)도 효소처리와 동일한 방법으 로 제조하여 비교하였다.
효소처리 시간 선정은 효소처리 종류 선정 실험에서 최적 으로 선택된 P를 이용하여 진행하였다. 구연산 전처리 후 세포벽분해효소 P를 1% 첨가하여 50°C에서 1, 2, 4, 6 h 동 안 처리한 다음, 전분분해효소 T를 동일량으로 첨가하여 93°C에서 2 h 동안 처리하였다. 대조구로 CON은 구연산처 리 조건 선정과 동일한 방법으로 제조하여 비교하였다.
효소처리 농도 선정은 효소처리 시간 선정 실험에서 최 적으로 선택된 P 2시간 처리 조건을 이용하여 진행하였다. 구연산 전처리 후 세포벽분해효소 P는 0.2, 0.5, 1, 3% 농 도로 첨가하여 50°C에서 2 h 동안 처리한 다음, 전분분해 효소 T를 동일량으로 첨가하여 93°C에서 2 h 동안 처리하 였다. 대조구(CON)은 효소처리 시간 선정과 동일한 방법 으로 제조하여 비교하였다.
효소처리 대용량추출은 구연산, 효소처리 최적 조건으로 선정된 방법으로 진행하였다. 구연산처리는 배암차즈기 미분 쇄 분말 3kg에 구연산 분말(배암차즈기 분말 대비 0.8%, 24 g)을 혼합한 후 고압멸균기에서 121°C, 15min, 1 bar 조 건으로 처리하였다. 배암차즈기의 대용량 P 1% 처리구(L-P) 는 200 L 반응조에 물 57L를 넣고 예열하여 혼합물 내부 온도가 50°C에 도달하면 구연산처리된 배암차즈기 분말 3 kg을 넣고 혼합하였다. 1차 세포벽 분해 효소처리는 P를 기질 대비 1% (w/w)인 30 g을 투입 후 교반하여 50°C에서 2 h 처리하였다. 2차 전분 분해 효소처리는 T를 기질 대비 1%로 투입 및 교반하여 93°C에서 2 h 처리하였다. 효소 불 활성화를 위해 100°C에서 10min 동안 가열하였다. 각각의 추출액은 추출포(PP 부직포 재질, 60 × 70 cm, 2장)로 압착 여과하였고, 압착 여과된 추출액과 침전물은 각각 수분용해 지수(WSI)와 수분흡착지수(WAI) 분석에 사용하였다. 추출 과정 중 샘플링된 추출액은 6,683×g, 15min 조건에서 원심 분리(2236R, GYROZEN Co., Ltd., Gimpo-si, Korea) 한 후 상등액은 여과지(No. 4)로 감압여과 하였다. 이 상등액을 이 용하여 기능성분 함량 분석에 사용하였다. 효소처리에 대한 대조구(L-CON)은 구연산을 첨가하지 않고 동일한 분말시료 3 kg에 물 57L를 넣고 200 L 반응조에서 100°C, 2 h 동안 교반하여 열수추출하였고, 또다른 대조구(L-CP)는 업체 관 행 방법을 이용하여 앞과 동일량으로 100°C, 8 h 동안 열수 추출하였다. 대조구들은 L-P와 동일한 방법으로 여과한 후 분석에 사용하였고, lab-scale을 기준으로 하여 P와 L-P의 error range를 (%)로 나타냈다.
수분용해지수(water solubility index, WSI)는 배암차즈기 추출물을 여과한 후 상등액을 취하여 알루미늄 접시에 부 은 후 침전물 무게를 측정하고, 알루미늄접시를 열풍건조 기(ThermoStable OF-305, Daihan sci., Wonju-si, Korea)에 서 50°C, 24 h 동안 건조한 뒤 상등액의 고형분 함량을 측 정하였으며 산출식은 아래와 같다.
수분흡착지수(water absorption index, WAI)는 배암차즈 기 추출물의 상층액을 분리하고 침전물을 건조하여 그 무 게를 측정한 후 다음과 같은 식으로 구하였다.
총 폴리페놀(total polyphenols, TP) 함량은 Folin-Denis법 (Gutfinger, 1981)을 일부 변형하여 비색 정량하였다. 배암 차즈기 추출물 시료 0.1mL에 2% Na2CO3 용액 2mL를 가하여 실온에서 3min간 방치하였고, 50% Folin reagent 0.1 mL를 가하고 잘 혼합하여 실온에서 30min간 정치한 후 750 nm에서 흡광도 값을 microplate reader (Infinite 200 PRO, TECAN, Austria)를 이용하여 측정하였다. 총 폴리페 놀 함량은 gallic acid (GA)를 표준물질로 사용하여 시료와 동일한 방법으로 시험하고 얻은 표준검량 곡선으로부터 환 산하여 정량하였다(gallic acid equivalent, mg GAE/g).
총 플라보노이드(total flavonoids, TF) 함량은 추출액 250 μL에 증류수 1mL와 5% NaNO2 75 μL를 넣은 후에 실온에서 5min간 방치하였다. 이후 10% AlCl3·6H2O 150 μL를 첨가하고 6min간 방치한 후 1M NaOH 500 μL 를 가하였다. 11min 후, 510 nm에서 반응액의 흡광도 값을 microplate reader기를 사용하여 측정하였다. 표준물질로는 (+)-catechin hydrate (CE)를 이용하여 검량선을 작성하였고, 총 플라보노이드 함량은 시료 g당 mg으로 나타냈다.
총 당(total sugar, TS)은 Dubois et al. (1956)의 phenol sulfuric acid 법을 이용하였고, 감압여과한 상등액을 50배로 희석한 후 사용하였다. 희석하여 얻은 시료 0.5mL를 넣고 혼합한 후 sulfuric acid 2.5mL를 가하여 발열시켰다. 이 혼합 액을 실온에서 30min 동안 방치한 후 microplate reader기를 사용하여 470 nm에서 흡광도를 측정하였으며, 당 정량은 glucose를 표준물질로 사용하여 표준곡선으로부터 환산하였다.
환원당(reducing sugar, RS)은 Miller (1959)의 DNS 방 법에 의해 측정하였다. 감압여과한 상층액을 1-2배로 희석 하였고, 희석된 시료 1mL에 DNS 시약 3mL를 넣어 혼 합한 후 끓는 물에서 5min간 중탕한 다음 냉각하여 25 mL volumetric flask에 넣고 증류수로 정용하였다. 흡광 도는 550 nm에서 측정하였으며 포도당 함량에 상당하는 값(glucose equivalent, GE, g%)으로 나타냈다.
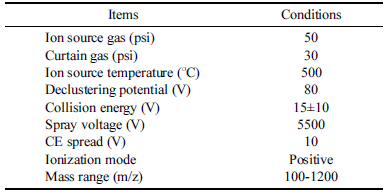
배암차즈기 추출물인 대조구(CON)와 효소처리 P 1% 처 리구(P)의 주요 기능성분들을 분석하기 위해 UPLC-DADQToF/ MS를 사용하여 실험을 진행하였다. 분석조건으로 CORTECS→ (UPLC→ T3, 2.1 × 150 mm, 1.6 μm) 칼럼과 CORTECS→ UPLC→ T3, 2.1 × 5mm, 1.6 μm pre 칼럼을 사 용하였다. 또한 액체크로마토그래피 SCIEX ExionLC AD UPLC와 연결된 X500R QTOF-MS (AB SCIEX, Framingham, MA, USA) 질량분석기를 이용하여 분석하였다. 검출 대표 파장은 210-400 nm이며, 페놀산은 320 nm, 플라보노이드는 350 nm를 대표파장으로 선정하였다. 칼럼 오븐온도는 30°C, 유속은 0.3 mL/min이었다. 이동상으로는 용매 A (0.5% formic acid in H2O)와 용매 B (0.5% formic acid in ACN)을 사용하였다. 용매 구배조건은 B를 5%로 시작 하여 20min까지 25%, 25 min까지 50%, 30min까지 90%로 증가시킨 다음 2 min 동안 유지하다가 35min까지 5%로 다시 감소시키고 40min까지 유지하였다. 질량분석기를 이 용한 질량 패턴분석은 positive ion mode로 진행하였다. 질 량 분석조건으로 capillary 전압은 3.5 kV, sampling cone 전압은 40V로 각각 설정하였다. Ion source 온도는 120°C 및 500°C로 설정하였고, 질량 스캔 범위는 m/z 100-1200 으로 설정하였다. 그 외 조건은 Table 1, 2에 나타내었으며, 개별 성분은 Flavonoid Data Base 1.0. (2016)을 참고, 각 성분의 질량 단편이온 패턴 분석 결과와 비교하여 구조 동 정하였다. 또한 성분 6종을 정량 분석하기 위해 내부 표준 물질로 nepetin 100 ppm 표준품을 구매하여 시료와 1:1로 희석하여 분석을 진행하였다.
마우스 유래 대식세포주인 RAW 264.7 세포(macrophase) 는 한국세포주은행(KCLB; Korea Cell Line Bank, Seoul, Korea)으로부터 구입하여 사용하였다. 세포는 10% fetal bovine serum (FBS; Gibco, Waltham, MA, USA)와 1% antibiotics (Invitrogen, Carlsbad, CA, USA)가 포함된 Dulbecco’s Modified Eagle Medium (DMEM; Gibco) 배지 를 이용하여 37°C, 5% CO2가 공급되는 배양기에서 배양 하였다. 배암차즈기 열수추출물(CON)과 효소처리 P 1% 추출물(P)는 각각 동결건조한 후 phosphate buffered saline (PBS; Gibco)에 용해 시켜 세포실험에 사용하였다.
RAW 264.7 세포를 96 well plate에 4 × 104 cells/well이 되도록 접종한 뒤 24 h 배양하였다. 각 시료를 농도별로 전처리하고, 1 h 후 0.5mM H2O2 또는 100 ng/mL LPS를 첨가하여 24 h 배양하였다. 반응 종료 후 세포 생존율은 Ez-Cytox cell viability assay kit (DAEIL Lab, Seoul, Korea)를 사용하였으며, 제조사의 지침에 따라 측정하였다. 대조군의 흡광도 값을 기준으로 상대적인 세포 생존율을 비교하였다.
RAW 264.7 세포를 96 well black plate에 4×104 cells/ well이 되도록 접종한 뒤 24시간 배양하였다. 각 시료를 농도별로 처리하고 1 h 후 0.5mM H2O2를 첨가하여 24 h 배양하였다. 세포는 PBS (Gibco)로 세척하고 10 μM 2',7'- dichlorofluorescin diacetate (DCFH-DA, Sigma) 용액을 처 리하여 10분간 반응시켰다. 반응 종료 후 PBS로 세척한 세포는 형광현미경(Leica Microsystems, Wetzlar, Germany) 및 fluorescence microplate reader (Tecan)로 형광도(Ex: 510 nm, Em: 560 nm)를 측정하였다. 대조군의 형광도 값 을 기준으로 상대적인 ROS 생성량을 비교하였다.
항산화 효소 지표 효소인 SOD (superoxide dismutase), catalase를 대상으로 활성을 측정하였다. RAW 264.7 세포 를 6 well plate에 1×106 cells/well이 되도록 접종한 뒤 24 h 배양하였다. 각 시료를 농도별로 처리하고 1 h 후 0.5 mM H2O2 첨가하여 24 h 배양하였다. 항산화 효소 활 성은 enzyme assay kit (BioVision, San Francisco, CA, USA)를 사용하였으며, 제조사의 지침에 따라 측정하였다. SOD 활성을 평가하기 위해 세포를 lysis buffer (BioVision) 로 용해한 후 효소 활성 평가를 위한 시료로 사용하였다. 96 well plate에 20μL 시료, WST working solution 200 μL, dilution buffer 20 μL, enzyme working solution 20 μL를 넣고 37°C에서 20min 반응시킨 후 450 nm에서 흡광도를 측정하였다. catalase 활성을 평가하기 위해 세포에 assay buffer로 용해한 후 효소 활성 평가를 위한 시료로 사용하였다. 96 well plate에 60μL 시료, assay buffer 18 μL와 catalase reaction solution 12 μL를 넣고 30min 반 응시킨 후 10 μL stop solution을 넣어 반응을 종료시켰다. 용액에 developer mix 50 μL를 넣고 10min 동안 반응시킨 후 570 nm에서 흡광도를 측정하였다. 대조군의 흡광도 값 을 기준으로 상대적인 효소 활성을 비교하였다.
RAW 264.7 세포를 96 well plate에 4× 104 cells/well이 되도록 접종한 뒤 24 h 배양하였다. 각 시료를 농도별로 처리하고 1h 후 100 ng/mL LPS를 첨가하여 24h 배양하였다. 반응 종료 후 상등액을 수거하여 NO 농도 측정을 위한 시료로 사용하였다. NO 농도는 Gries s r eagent a s sya k it (Promega, Madison, WI, USA)를 사용하여 측정하였으며, 제조사의 지침에 따라 측정하였다. 일산화질소 농도는 kit에 포함된 표준용액으로부터 산출된 표준곡선과 비교하여 결정하였다.
RAW 264.7 세포를 96 well plate에 4 × 104 cells/well이 되도록 접종한 뒤 24 h 배양하였다. 각 시료를 농도별로 처리하고 1시간 후 100 ng/mL LPS를 첨가하여 24 h 배양 하였다. 반응 종료 후 상등액을 수거하여 시료로 사용하였 으며, 사이토카인 농도는 ELISA assay kit (Bio-Rad Laboratories, Hercules, CA, USA)를 사용하였으며, 제조사의 지침에 따라 측정하였다. Tumor necrosis factor-α (TNF- α), interleukin-1β (IL-1β) 그리고 interleukin-6 (IL-6)의 농 도는 kit에 포함된 표준용액으로부터 산출된 표준곡선과 비 교하였다.
결과 및 고찰
배암차즈기 추출물의 구연산처리 조건에 따른 수분용해 지수(WSI), 총 폴리페놀(TP) 및 총 플라보노이드(TF) 함량 측정 결과는 Table 3에 나타냈다. WSI는 대조구로 열수추 출 처리구(CON)이 27.77%, 구연산 혼합 열수추출 처리구 (C-CON)이 28.32%였으며 두 대조구 간의 유의적 차이는 없었다. 증기 구연산처리(S-CON) 또는 구연산 압력처리(PCON) 를 가한 열수추출 처리구는 각각 33.12, 35.57%로 CON에 비해 유의적으로 증가하였다. 증기 구연산처리(SPCV) 또는 구연산 압력처리 한 효소처리구(P-PCV)는 각 각 40.38, 41.05%로 CON에 비해 약 1.5배 증가하였으며 유의적으로 가장 높은 값을 나타냈다(p<0.001). Go & Choi (2016)는 3% 농도에서 염산 처리한 쪽잎 열수추출물 을 고압멸균기에서 반응시켰을 때 최대 수율을 나타냈으며 이는 가수분해되어 생성물이 증가하였다고 보고했는데 본 연구결과를 뒷받침해주는 것이라 사료된다. 이러한 결과는 배암차즈기에 구연산 전처리를 통하여 1차적으로 산분해를 진행시켰고 효소가 작용할 수 있는 최적의 환경을 극대화 하여 수용화 정도가 높게 나타난 것으로 생각된다.
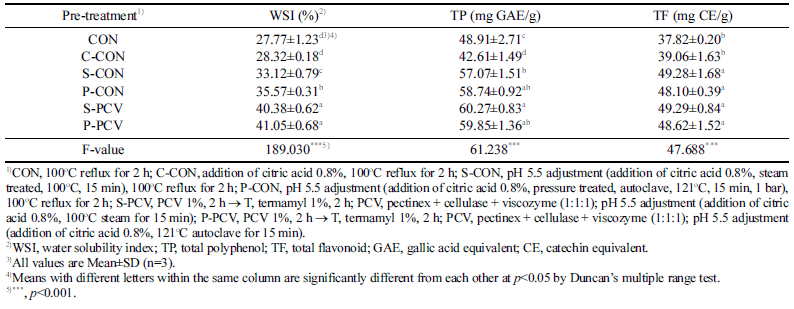
|
TP는 C-CON이 42.61 mg GAE/g이었으며 이와 비교했 을 때 S-CON (57.07 mg GAE/g)이 1.3배, P-CON (58.74 mg GAE/g)이 약 1.4배 많았으며, 동일한 구연산처리를 한 효소처리구인 S-PCV, P-PCV는 약 1.5배 정도 유의적으로 높게 나타났다(p<0.001). TF 또한 TP와 유사한 경향이었으 며 C-CON이 39.06 mg CE/g이었고, 구연산 증기 구연산처 리 또는 압력 구연산처리한 열수추출 처리구와 효소처리구 모두 CON (37.82 mg CE/g)에 비해 그 함량은 약 1.2배 증가하였다(p<0.001). 다양한 구조를 가진 폴리페놀계 물질 들은 한 분자 내에 phenolic hydroxyl (OH)기를 2개 이상 의 가진 방향족 화합물을 나타내며, 주성분은 탄닌 및 플 라보노이드로 항산화, 항암, 항고혈압 등 다양한 생리활성 기능을 가지는 것으로 알려져 있다(Yoshizawa et al,. 1987). 또한 폴리페놀 불용성 화합물이 식물의 세포벽에 결합되어 있다가 효소에 의한 가수분해로 다당류들과 이온결합 또는 수소결합하여 추출이 용이한 상태변화로 인해 용출되어 함 량이 증가한 것으로 생각된다(Cinar, 2005). 이상의 결과로 볼 때 물리적 처리(증기 또는 압력) 방법에 대한 차이는 없었지만, 화학적 처리(구연산) 및 효소적 처리에 따른 WSI, TP 및 TF 함량이 증가하는 것을 확인하여 압력 구 연산처리 후 효소처리를 하는 방법을 최적으로 선정하였다.
배암차즈기 추출물의 효소처리 종류에 따른 수용화 특성 및 기능성분 함량 측정 결과는 Table 4에 나타냈다. CON 은 WSI가 32.63%였고 혼합 효소처리구인 pectinase+ cellulase (PC), cellulase+viscozyme (CV), pectinase+ viscozyme (PV)는 43.44-44.03% 정도로 나타났으며 유의적 으로 가장 높게 나타났다(p<0.001). 수분흡착지수는(WAI) 5.52-9.96 g/g의 범위였고 단일 효소처리구인 pectinase (P), cellulase (C), viscozyme (V)와 혼합 효소처리구인 PC, CV, PV, PCV 시료 간에 유의적인 차이는 나타나지 않았 다. P의 TP함량은 59.55 mg GAE/g으로 가장 높은 함량을 나타냈으며 CON (34.56mg GAE/g)에 비해 1.7배 증가하 였다. Shirsat et al. (2011)은 배암차즈기를 열수추출하여 총 폴리페놀산을 측정한 결과 8.569mg/g으로 보고하였는 데, 이는 본 연구 결과보다 낮은 수치였다. 페놀 화합물의 함량변화는 재배지역, 추출조건(용매, 온도, 시간) 및 기타 환경조건 등을 포함하는 여러 가지 복합적인 요인으로 인 해 차이가 생기는 것이라고 추정된다(Makkar, 1999). CON 의 TF는 32.32 mg CE/g으로 가장 낮았고 P에서 56.84mg CE/g으로 유의적으로 가장 높았으며 TP와 비슷한 경향으 로 나타나는 것을 확인하였다(p<0.001). 총당(TS)는 4.91- 11.70%의 범위였으며 CV가 11.70%로 가장 많은 함량을 보였고, 환원당(RS)는 P (6.61%), V (6.87%), PC (6.51%), CV (6.60%), PV (6.76%), PCV (6.40%)가 가장 높게 나타 났다. 쌈잎채소 연구에서 75% 에탄올로 추출한 배암차즈 기의 총당 함량은 10.78%라고 보고하였으며 이는 본 연구 결과와 유사한 결과였다(Park et al., 2012). 이는 시료를 추출할 때 식물체의 복잡한 내부 및 세포벽 구조(셀룰로오 스, 펙틴 등)으로 인해 용매만으로는 모든 기능성 화합물 들의 유용성분을 용출하기 어렵기 때문에 물리적․화학적 또는 효소처리 등의 처리과정을 통해 좀 더 효과적으로 추 출한 것으로 판단된다(Nam et al., 2019). 이러한 결과로 효소처리에 적합한 효소종류로는 TP와 TF 함량이 가장 높 은 Pectinex Ultra SP-L (P) 펙틴분해효소로 결정하였다.
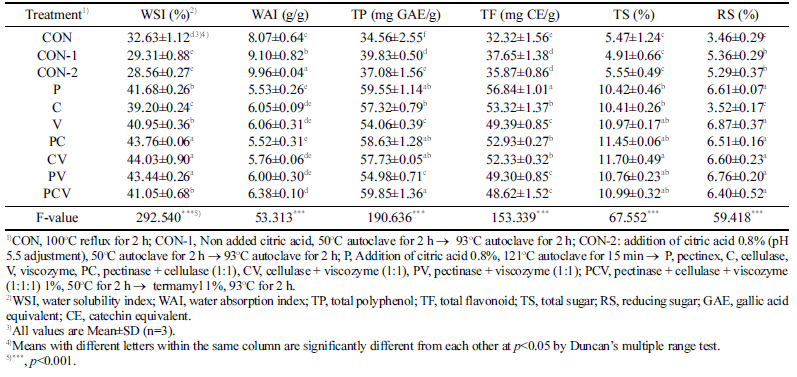
|
배암차즈기 추출물의 효소처리 시간에 따른 수용화 특성 및 기능성분 함량 측정 결과는 Table 5에 나타냈다. WSI 는 CON이 32.63%로 가장 낮았고 P 2h 처리구에서 41.68%로 CON에 비해 약 1.3배 유의적으로 증가하는 것 으로 나타났다(p<0.001). 이러한 결과로 P 2 h 처리시, 고 형분의 수용화 및 분해에 더 효과적인 것으로 확인되었다. Kim et al. (2015)는 청파래의 효소가수분해 연구에서 반응 시간에 따른 수율을 조사했는데 반응 6~36 h까지 수율이 증가하다가 48 h에서 감소했다고 보고하여, 본 연구에서도 일정시간 이후인 P 2 h 처리 이후부터는 WSI가 감소하는 것으로 나타나 본 실험결과와 유사한 경향이었다. WAI는 P 2 h 처리구에서 5.53 g/g으로 가장 낮게 나타나 다당류가 가장 많이 분해된 것으로 판단되었다. TP는 34.56-59.55 mg GAE/g 범위였으며 처리시간이 길어질수록 증가하다가 감 소하는 경향을 보였는데 P 2h 처리구에서 59.55 mg GAE/g으로 유의적으로 가장 높은 함량을 나타냈다 (p<0.001). TF 또한 TP와 유사한 경향이었으며 P 2 h 처리 구에서 56.84 mg CE/g으로 가장 높은 함량이었고 2 h 이 후로는 함량값이 감소하는 경향으로 나타났다. 총당은 5.47-10.98%, 환원당은 3.46-9.35% 범위였고 모두 P 6 h 처리구에서 각각 10.98, 9.35% 함량으로 가장 높게 나타났 다. 총당은 1, 2, 4 h 처리구간의 유의적인 차이는 없었고 환원당은 처리시간이 길어질수록 그 함량 값도 증가하는 경향으로 나타났다. Yan et al. (1998)은 식물체 세포벽을 분해하는 효소인 polygalacturonase와 글루코시드 결합의 가수분해를 촉매하는 효소인 β-glucoside 등의 효소작용을 보고하였다. 이러한 결과는 다양한 식물체 유형에 적절한 효소를 처리했을때 식물체의 가수분해 효율을 증대시킬 수 있는 요소라고 생각된다. 결과적으로 효소처리 최적시간은 TP 및 TF 함량이 가장 높게 나타난 P 2 h 처리로 선정하 였다.
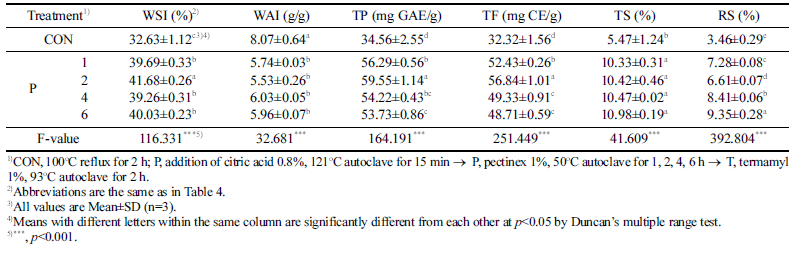
|
배암차즈기 추출물의 효소처리 농도에 따른 수용화 특성 및 기능성분 함량 측정 결과는 Table 6에 나타냈다. WSI 는 P 1% 처리구에서 41.68%로 유의적으로 가장 높았으며, CON (32.63%)에 비해 약 1.3배 증가하였다(p<0.001). WAI는 5.53-8.07 g/g 범위였고, P 1% 처리구에서 5.53 g/g 으로 가장 낮게 나타났다. WSI는 다당류가 가수분해되어 수용화된 정도를 나타내는 것이며 WAI는 물리적인 효소처 리에 의해서도 분해가 덜 일어나고 남은 고형분의 수분 흡 수량을 의미하는 것으로 WSI와 WAI의 결과는 서로 역의 상관관계에 있다. TP는 P 1% 처리구가 59.55 mg GAE/g 으로 가장 높게 나타났으며 CON (34.56 mg GAE/g)에 비 해 약 1.7배 증가한 것을 확인하였다. TF도 TP와 유사한 경향을 보였는데 CON이 32.32 mg CE/g으로 가장 낮았고 P 1% 처리구에서 56.84 mg CE/g으로 유의적으로 가장 높 았다(p<0.001). 동결건조한 배암차즈기 물 추출물을 연구한 선행연구에서 TF 함량을 38.7mg/g이라고 하였으며, 본 연 구의 P 1% 처리구의 함량값이 더 높게 나타났다(Jeong et al., 2015). 결과적으로 같은 물추출물인데 반해 본 연구의 TF 값이 더 높게 측정된 것은 시료의 처리 방법에 의한 것으로 생각되며 효소처리를 통해 플라보노이드 함량이 증 대된 것으로 판단된다. Nam et al. (2020)의 연구에서 생 강의 열수추출물에 비해 효소처리 추출액이 TP, TF 함량 이 높았다고 보고하였는데, 이는 본 연구와 유사한 결과를 나타냈다. 이는 배암차즈기에서도 효소처리 농도를 1% 첨 가하여 반응시켰을 때 가장 높은 함량을 보였으며 소재는 다르지만 동일한 효소 및 첨가농도를 사용하였을 때, 기능 성분을 수용화시키는 방법으로 효과적임을 확인할 수 있었 다. TS는 효소첨가량이 증가할수록 그 값도 증가하는 경향 을 나타냈는데 P 3% 처리구가 10.67%로 가장 많은 함량 을 나타냈다. RS도 TS와 비슷한 경향으로 나타났고 3.46- 8.89% 범위를 보였는데 P 3% 처리구에서 8.89%로 가장 높게 나타났다. Song et al. (2011)은 열처리한 톳의 효소 가수분해 연구에서 반응 24 h, 기질농도 1%인 경우 효소 량이 증가할수록 환원당 함량도 증가한다고 보고하였는데 본 연구결과와 유사한 경향을 나타냈다. 이는 구연산처리 및 효소에 의해 침투가 용이해진 세포벽에 효소가 깊숙하 게 작용하여 반응한 결과라고 생각된다. 효소처리 추출물 의 생산 단가 등의 경제적인 면(효소 2만원/100 g)을 고려 하여 적정 효소처리 농도는 TP 및 TF 함량값이 더 높게 나타난 P 1% 처리구(P)로 선정하였다.
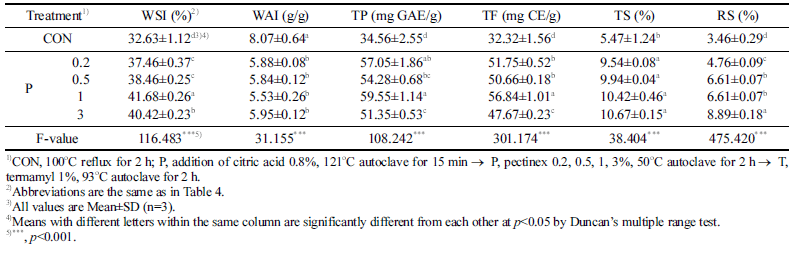
|
배암차즈기 추출물 CON과 P 처리구의 LC-QToF/MS 분 석으로부터 얻은 chromatogram과 fragmentation ion patten 을 비교한 결과는 Fig. 1과 같다. Flavonoid Data Base 1.0. (2016)을 토대로 최종 6종의 성분을 동정하였으며, 5 종의 플라보노이드와 1종의 페놀산 성분으로 규명하였다. 구조 동정된 화합물은 순서대로 6-hydroxyluteolin 7-Oglucoside, luteolin 5-O-glucoside (galuteolin), luteolin 7-Oglucoside (cynaroside), nepetin 7-O-glucoside (nepitrin), hispidulin 7-O-glucoside (homoplantaginin), rosmarinic acid 임을 확인하였다(Table 7). 또한 CON과 P 처리구의 크로마 토그램을 비교한 결과는 Fig. 2와 같다. 성분 6종을 정량 분 석하기 위해 내부 표준물질로 nepetin을 샘플에 넣고 함께 분석하였는데 24min대에 나타난 peak는 nepetin을 의미한다. 정량 분석 결과는 Table 8에 나타냈으며 6-hydroxyluteolin 7-O-glucoside, luteolin 5-O-glucoside (galuteolin), luteolin 7-O-glucoside (cynaroside), nepetin 7-O-glucoside (nepitrin), hispidulin 7-O-glucoside (homoplantaginin) 5종의 플라보노 이드 성분 및 rosmarinic acid 1종의 페놀산 성분 모두 CON보다 P 처리구에서 높은 함량을 나타내었다. 특히 플 라보노이드 성분들은 CON 대비 P 처리구가 6.6-9.5배까지 증진되는 효과를 확인하였다. Kil et al. (2020)은 열수추출 한 배암차즈기를 성분분석한 결과 rosmarinic acid가 전체 peak면적의 70%를 차지하고 있으며 가장 많은 양을 함유 한다고 보고하였는데, 본 연구에서도 6가지 기능성분들 중 에서 rosmarinic acid의 함량분포가 가장 많은 것으로 나타 나고 있어 본 연구의 분석결과를 뒷받침해주었다. 효소처 리를 함으로써 CON에 대비하여 5종류의 플라보노이드는 약 7.7배 증가하는 것으로 나타나 결과값이 높아진 것으로 사료된다.
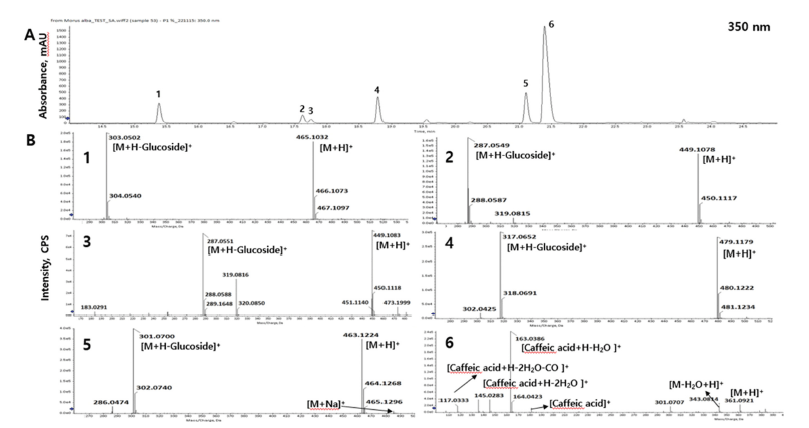
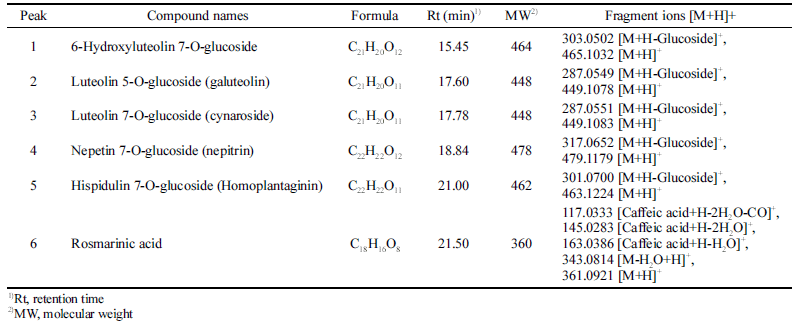
|
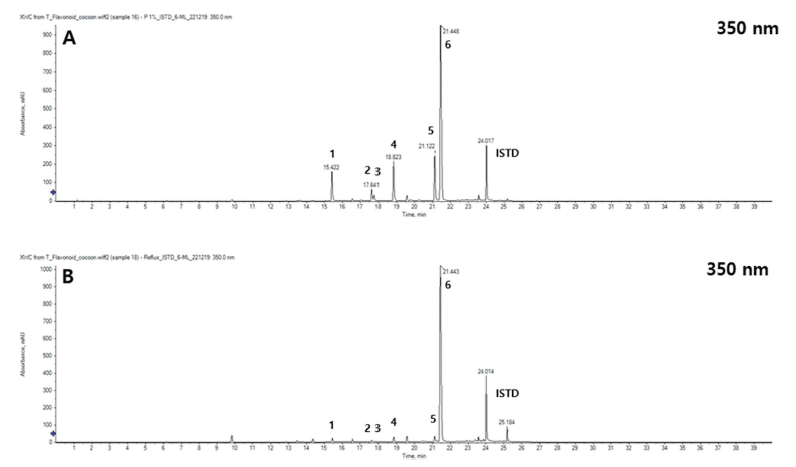

|
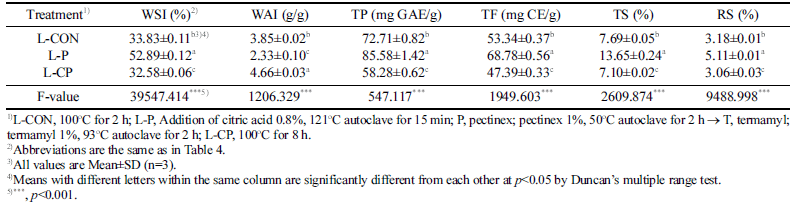
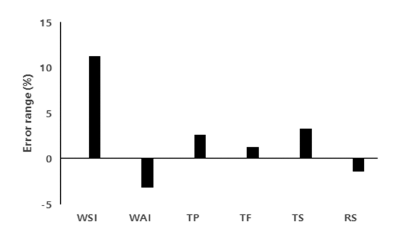
배암차즈기 효소처리 대용량 추출물의 수용화 특성 및 기능성분 함량 측정 결과는 Table 9에 나타냈다. WSI는 대용량 대조구 L-CON (33.83%)에 비해 대용량 P 1% 처 리구(L-P)가 52.89%로 약 1.6배 증가하였으며 유의적으로 가장 높았고, WAI는 L-P에서 2.33 g/g으로 가장 낮게 나타 났다(p<0.001). TP 및 TF는 L-P 처리구에서 각각 85.58 mg GAE/g, 68.78 mg CE/g이었으며 유의적으로 가장 높았 고 L-CON은 각각 72.71 mg GAE/g, 53.34 mg CE/g으로 이에 비해 약 1.2, 1.3배 증가하였는데 효소처리를 함으로 써 항산화 성분 함량 용출에 효과적임을 확인할 수 있었다. Shin et al. (2020)의 연구에 의하면 배암차즈기 열수추출물 의 TP와 TF 함량은 각각 99.10 mg/g, 48.71 mg/g으로 나 타나 본 연구결과의 L-P 처리구와 유사한 값을 확인하였다. 총당은 업체 관행 처리구(L-CP) 7.10%, L-CON 7.69%, L-P 13.65%의 순이었으며 L-P가 L-CON에 비해 약 1.8배 유의 적으로 더 높게 나타났다(p<0.001). Jeong et al. (2014)는 열풍건조한 배암차즈기 열수추출물의 총당 함량이 7.19% 라고 보고하였으며 본 연구의 효소처리한 L-P의 값이 더 높게 나타났다. 이는 효소작용에 의한 당류의 분해로 단당 류가 증가하여 총당 함량이 증대된 것으로 생각된다. 환원 당은 L-P 처리구가 5.11%로 가장 높았는데 효소처리를 통 한 효소적 분해가 진행되었고 이로 인해 포도당, 과당 등 의 단당류와 이당류의 당분해가 많이 일어나 배암차즈기의 환원당 함량이 증가한 것으로 추정된다(Lee et al., 2012). 최종 선정된 P 처리구의 처리방법이 대용량으로 적용되었 을 때도 기능성분 함량이 증가하는 경향으로 확인되어 산 업체에서도 대용량 처리의 적용 및 활용할 수 있을 것으로 판단된다. 이를 뒷받침하기 위해 효소처리의 최적으로 선 정된 P 처리구를 lab-scale과 pilot scale에서 연구된 범위의 P와 L-P 처리구간 처리 용량에 대한 차이를 비교하여 Fig. 3에 나타냈다. 대용량 추출 용량에 대해 P와 L-P 처리구의 차이점을 나타냈는데, 이는 lab-scale에서 사용하는 교반기 와 pilot scale에서 사용하는 대용량 반응조의 크기, 교반기 의 표면적에 닿는 power, speed 등에 의한 차이인 것으로 생각된다(Marques et al., 2010). 또한 시료를 효소처리 했 을 때 용량 차이에 따라 효소활성의 최적 반응시간까지 도 달하는데 서로 다른 시간적 영향도 있을 것으로 판단된다 (Tufvesson et al., 2010). 이상의 결과로 효소처리를 진행하 기전 구연산처리 과정을 통해 배암차즈기의 세포벽 성분을 기능성분이 용출되고 효소작용이 용이하도록 1단계에서 산 분해 한 다음, 다음 과정인 효소처리 단계를 통하여 다당 류를 분해하여 기능성분의 수용화를 증진시킬 수 있음을 확인하였다.
|
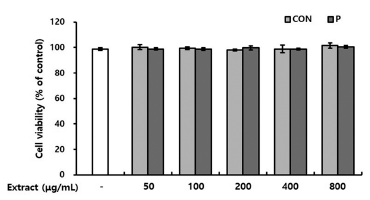
RAW 264.7 세포에서 CON과 P 처리구의 세포 내 항산 화 및 항염증 활성을 평가하기 위한 농도를 설정하기 위해 RAW 264.7 세포의 증식에 미치는 CON과 P 처리구의 세 포 생존율을 확인하였다. 다양한 농도(0-800 μg/mL)의 CON과 P가 처리된 조건에서 24시간 동안 반응한 RAW 264.7 세포 생존율의 결과는 Fig. 4와 같다. 대조군의 세포 생존율 100%와 비교하였을 때, CON과 P 처리구는 800 μg/mL 농도까지 대조군과 유사한 수준으로 생존율이 유지 되었으며, 그룹 간 유의적인 차이는 없었다. 이에 대식세포 내 항산화 및 항염증 활성을 평가하기 위한 CON과 P 처 리구의 최고 농도는 800 μg/mL로 선정하였다. 또한 선행연 구들을 토대로 RAW 264.7 세포에 염증성 자극원으로는 1 μg/mL LPS를(Kim et al., 2021), 산화적 스트레스 자극 원으로는 0.5mM H2O2를(Kwon et al., 2019) 각각 처리하 여 배암차즈기 추출물의 활성을 평가하고자 하였다.
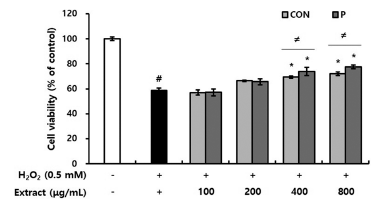
과량의 활성산소종(ROS; reactive oxygen species) 생산 으로 유도되는 산화적 스트레스는 세포를 손상시키고 조직 에 비가역적인 변화를 유도하는데, 반응성이 큰 ROS 중 하나인 H2O2도 다양한 세포와 조직의 손상 및 사멸을 유 도하는 것으로 알려져 있다(Simon et al., 2000). 이에 본 연구에서는 H2O2를 처리하여 RAW 264.7 세포에 산화적 스트레스를 유도한 후 CON과 P 처리구의 세포 보호 활성 을 평가하고자 하였다. CON과 P 처리구를 1 h 전처리하고 0.5 mM H2O2를 첨가하여 24 h 후 세포 생존율을 확인한 결과, H2O2 단독 처리군은 대조군과 비교하여 세포 생존율 이 59%로 감소하였으나 CON과 P 처리구를 전처리한 실 험군에서는 세포 생존율이 증가하였다. 특히, 800 μg/mL의 농도로 RAW 264.7 세포에 전처리했을 때, CON은 71%로, P 처리구는 77%로 크게 생존율이 증가하여 CON과 P 처리 구가 H2O2로 유도된 산화적 세포 손상을 억제할 수 있다 고 판단되었다. Meng et al. (2022)의 연구에서 배암차즈기 의 주요 플라보노이드 배당체인 dihydrohomoplantagin과 homoplantaginin이 산화 저밀도지단백질(ox-LDL)에 의해 유도된 제대정맥 내피세포의 산화적 손상 및 사멸을 억제 하는 것으로 보고하였다. 또한 Kim et al. (2023)은 배암 차즈기 에탄올 추출물 및 배암차즈기 주요 화합물인 rosmarinic acid가 dexamethasone에 의해 유도된 근육모세 포의 산화적 손상을 억제한다고 보고하였다. 이상의 결과 들로 보아, CON과 P 처리구의 대식세포 보호 활성은 배 암차즈기에 함유된 플라보노이드 및 페놀산에 의한 활성으 로 판단되었다. 또한 CON과 P 처리구의 활성을 비교하였 을 때, 400 μg/mL 이상의 농도로 전처리 시 P 처리구가 CON보다 유의적으로 높은 대식세포 보호 활성을 나타냈 다(Fig. 5). 이는 배암차즈기를 효소 처리했을 때 플라보노 이드 및 페놀산 함량이 증가한 결과와 일치하는 것으로, 효소 처리로 기능성분의 용출이 증대된 배암차즈기 효소처 리구는 H2O2로 유도된 산화적 스트레스로부터 대식세포 보호 효과를 높일 수 있었다. 다양한 연구에서 천연물 소 재로부터 플라보노이드, 폴리페놀 및 페놀산 등 지표성분 의 추출 수율을 높이기 위해 유기용매를 사용하고 있으며, 용매 혼합 사용은 100% 물보다 기능성분 추출에 유용하다 고 알려져 있다(Kim & Kim, 2019;Sultana et al., 2009). 배암차즈기의 주요 화합물로 알려진 nepetin, luteolin, homoplantaginin 및 rosmarinic acid 등은 용매 종류 및 비 율에 따라 추출 함량이 달라질 뿐 아니라(Li et al., 2014), 기능성에도 영향을 미친다(Ngo et al., 2018;Zengin et al., 2019). 본 연구에서 효소 처리로 배암차즈기의 기능성분 용출이 증대되어 산화적 스트레스로부터 대식세포 보호 효 과를 높였으나, 효소 처리 또한 추출용매가 100% 물인 것 을 감안하면 활성을 나타내는 CON과 P 처리구의 농도 (400 μg/mL 이상)가 다소 높을 수 있다고 판단되었다. 그 러나 유기용매의 잔존 위험성과 소비자 거부감이 큰 유기 용매 추출법보다 안전한 효소 처리법은 배암차즈기의 기능 성분 용출 및 기능성을 증대시킬 수 있는 효과적인 전처리 방법이라고 생각되었다.
CON과 P 처리구의 대식세포 보호 활성이 H2O2 처리로 증가한 ROS 소거 활성과 관련하는지 평가하였다. CON과 P 처리구를 1 h 전처리하고 0.5mM H2O2를 첨가하여 24 시간 후 DCFH-DA probe를 이용하여 세포 내 ROS 생성 정도를 확인하였다. 그 결과, H2O2 단독 처리군에서는 대 조군과 비교하여 210%로 ROS 생성이 증가하였다. 그러나 CON과 P 처리구를 전처리하였을 때, 400 μg/mL 이상의 농도에서 H2O2 단독 처리군과 비교하여 ROS 생성이 유의 적으로 감소하였다. 특히, 800 μg/mL 농도로 전처리하였을 때, CON은 172%, P 처리구는 135%로 ROS 생성이 감소 하였으며, P 처리구가 CON보다 유의적으로 높은 활성을 나타냈다(Fig. 6A). 또한 형광현미경 관찰 결과에서도 ROS 생성을 나타내는 초록 형광의 세기가 H2O2 단독 처리군에 서는 강하게 나타났으나 CON과 P 처리구를 800 μg/mL 농도로 전처리한 세포에서는 감소하는 것을 확인할 수 있 었다(Fig. 6B). Chang et al. (2015)은 높은 폴리페놀 및 플 라보노이드를 함유한 배암차즈기 물추출물이 tertbutylhydroperoxide (t-BHP)로 자극된 간세포에서 과발현된 ROS를 억제하여 세포 생존율을 증가시킬 수 있었다고 보고 하였다. 이상의 결과들로 보아, 폴리페놀 및 플라보노이드를 다량 함유하는 CON과 P 처리구는 H2O2 자극으로 증가한 과량의 ROS를 감소시킬 수 있었으며, 이로 인해 대식세포 의 생존율이 증가했을 것으로 판단되었다. 또한 CON보다 P 처리구의 세포 내 ROS 소거 활성이 더 크게 나타난 것 은 효소처리로 총 폴리페놀 및 총 플라보노이드의 용출 및 함량이 증가한 결과들과 일치한다고 판단되었다.
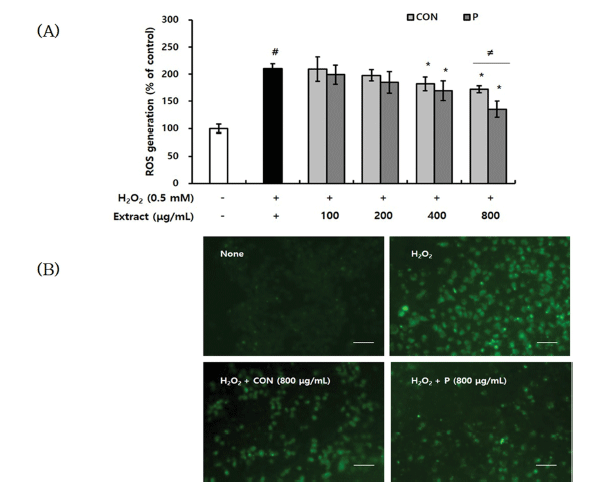
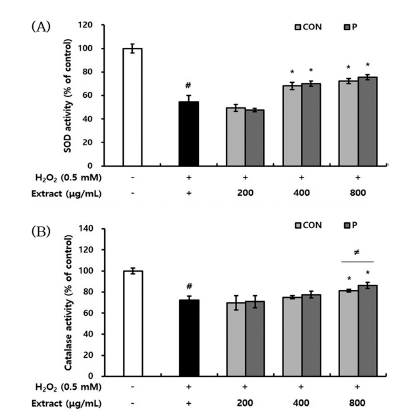
생체는 ROS에 방어하기 위해 비효소적 또는 효소적 항 산화 메커니즘을 가지는데, 효소적 작용은 ROS가 세포 내 물질에 손상을 주기 전에 ROS를 제거하는 직접적인 항산화 방어작용이다. 대표적인 항산화 효소인 SOD (superoxide dismutase)는 ROS의 하나인 superoxide anion radical을 H2O2로 변환시킨다. 또한 SOD에 의해 생성된 H2O2를 제 거하는 가장 효과적인 항산화 효소는 catalase로 산화적 스 트레스로부터 세포를 보호하는 역할을 한다(Kim & Ham, 2003). 본 연구에서는 H2O2 처리로 유발된 산화적 스트레 스에 대한 CON과 P 처리구의 대식세포 사멸 억제 및 ROS 소거 활성이 항산화 효소인 SOD와 catalase의 활성 과 관련하는지 확인하였다. CON과 P 처리구를 1 h 전처리 하고 0.5mM H2O2를 첨가하여 24 h 후 단백질을 추출하여 항산화 효소 활성을 평가하였다. 그 결과, H2O2 단독 처리 군에서는 대조군과 비교하여 SOD 활성은 55%, catalase 활성은 68%로 감소하였다. 그러나 CON과 P 처리구를 전 처리했을 때, SOD 및 catalase 활성이 증가하였다. SOD 활성은 400μg/mL 이상의 농도에서, catalase 활성은 800 μg/mL 이상의 농도에서 H2O2 단독 처리군과 비교하여 유의적으로 활성이 증가하였다. 특히, 800 μg/mL 농도로 전처리하여 catalase 활성 변화를 확인하였을 때, CON이 81%, P 처리구가 86%로 증가하였으며, P 처리구가 CON 보다 유의적으로 높은 활성을 나타냈다(Fig. 7). Kim et al. (2014)의 연구에서 배암차즈기 메탄올 추출물이 SOD 유 사 활성 및 항산화 활성을 나타낸 것을 주요 화합물인 rosmarinic acid, homoplantaginin, luteolin에 의한 것이라고 보고하였으며, Qu et al. (2009)의 연구에서는 배암차즈기 의 주요 화합물인 homoplantaginin이 항산화 효소의 활성 을 증가시켜 H2O2로 유도된 산화적 스트레스로부터 간세 포의 손상을 억제하였다고 보고하였다. 이상의 결과들로 보아, 산화적 스트레스에 대한 CON과 P 처리구의 대식세 포 보호 효과는 배암차즈기가 함유하는 플라보노이드, 페 놀산 등의 기능성분이 SOD, catalase와 같은 항산화 효소 의 활성을 높임으로써 ROS를 소거하고, 최종적으로는 대 식세포의 사멸을 억제한다고 생각된다. SOD 활성에서는 두 시료 간 유의적인 차이를 확인할 수 없었지만, catalase 활성 결과에서 CON보다 P 처리구의 항산화 효소 활성이 더 크게 나타난 것은 효소 처리로 기능성분의 용출 및 함 량이 증가한 결과와 일치한다고 판단되었다.
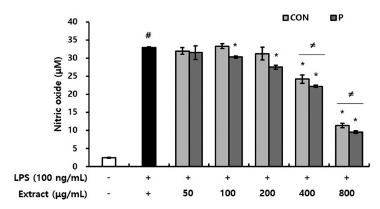
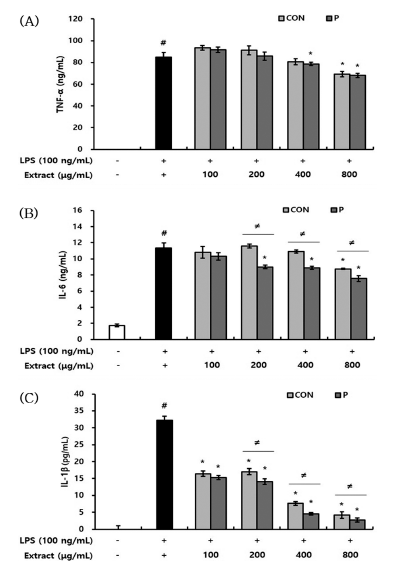
Lipopolisaccharide (LPS)는 대표적인 염증 매개 물질이 며, 대식세포의 과도한 활성을 유발하여 NO 및 염증성 사 이토카인의 생성을 증가시킨다. 이렇게 과발현된 NO 및 염증성 사이토카인은 염증반응 악화시켜 DNA 손상 및 돌 연변이를 일으키고 다양한 질병을 유발한다고 알려져 있다 (Yoon et al., 2009). CON과 P 처리구가 대식세포에서 LPS 자극에 의한 NO 및 염증성 사이토카인의 생성을 억 제할 수 있는지 평가하였다. 그 결과, LPS 단독 처리군에 서는 대조군과 비교하여 13배 이상의 NO가 생성되었다. 그러나 CON과 P 처리구를 전처리했을 때, CON은 400 μg/ mL 이상의 농도에서, P 처리구는 100 μg/mL 이상의 농도 에서 유의적으로 NO의 생성이 감소하였다. 특히, 800 μg/ mL 농도로 전처리했을 때, LPS 단독 처리군과 비교하여 CON은 2.9배, P는 3.4배 NO 생성을 감소시켰다. CON과 P 처리구의 NO 생성 억제 활성을 비교하였을 때, 400 μg/ mL 이상의 농도로 전처리 시 P 처리구가 CON보다 유의 적으로 높은 활성을 나타냈다(Fig. 8). 또한 LPS 단독 처 리군은 대조군과 비교하여 염증성 사이토카인인 TNF-α, IL-1β, IL-6의 생성이 현저히 증가하였다. 그러나 CON과 P 처리구를 전처리했을 때, 염증성 사이토카인의 생성이 감소하여 NO 생성 억제 활성과 유사한 결과를 보였다. 특 히, CON과 P 처리구는 IL-1β의 생성을 가장 효과적으로 억제하였다. 즉, CON과 P 처리구를 800 μg/mL 농도로 전 처리했을 때, LPS 단독 처리군과 비교하여 CON은 7.7배, P 처리구는 11.7배 IL-1β 생성을 감소시켰다. CON과 P 처리구의 염증성 사이토카인 생성 억제 활성을 비교하였을 때, TNF-α의 생성 억제 활성에는 두 시료 간 유의적인 차 이를 확인할 수 없었지만, IL-6와 IL-1β의 생성 억제 활성 에서는 200 μg/mL 이상의 농도로 전처리 시 P 처리구가 CON보다 유의적으로 높은 활성을 나타냈다(Fig. 9). LPS 로 염증을 유도한 대식세포에서 Jeong et al. (2012)은 배암차즈기 물 추출물이 NO와 prostaglandin E2 (PGE2)의 생성을 억제했다고 보고하였으며, Lee & Kang (2020)은 배암차즈기 용매 분획물의 항산화 활성이 높을수록 NO 및 염증성 사이토카인 생성 억제 활성이 높게 나타났다 고 보고하였다. Choi et al. (2015)은 rosmarinic acid, homoplantaginin 등 6종의 파이토케미컬을 함유한 배암차 즈기 메탄올 추출물이 관절염 마우스 모델에서 염증성 사 이토카인 생성을 억제하여 염증을 완화시켰다고 보고하였 다. 이상의 결과들로 보아, CON과 P 처리구가 LPS로 자 극된 대식세포에서 NO 및 염증성 사이토카인의 생성을 효 과적으로 억제한 것은 배암차즈기 내 플라보노이드, 페놀 산 등의 파이토케미컬과 관련되어 있다고 생각된다. NO 및 염증성 사이토카인 생성 억제 활성이 항산화 활성과 마 찬가지로 CON보다 P 처리구가 높게 나타난 것은, 배암차 즈기를 효소처리하였을 때 기능성분의 용출이 증가한 결과 와 일치한다고 판단되었다.
요 약
본 연구는 배암차즈기의 기능성분 추출을 증진시킬 수 있는 효소처리 최적조건을 선정하여, 수용화 특성 및 기능 성분 함량을 확인하였다. 또한 대용량 추출을 통하여 대량 생산 적용성을 평가하였고, 항산화 및 항염증 활성에 대해 확인하고자 하였다. 효소처리 조건 선정을 위하여 구연산 처리 방법 및 효소 종류, 농도, 시간별로 측정하여 CON과 비교하였고, 수용화 특성 및 항산화 함량을 측정하여 pectinase, 1%, 2 h 처리 (P)를 최적 조건으로 선정하였다. 측정 결과 CON 대비 P 처리구에서 WSI는 약 1.3배, TP 는 약 1.7배 증가하는 것으로 나타났다. LC-MS의 구조 동 정 결과, 플라보노이드 성분들은 CON 대비 P 처리구가 6.6-9.5배 증진되었다. Lab-scale과 p ilot s cale에서 처리 용 량에 대한 차이를 비교하기 위해 대용량 추출물을 제조하 여 P와 L-P 처리구간 수용화 특성 및 기능성분 함량을 측 정한 결과, L-CON에 비해 WSI, TP, TF는 각각 약 1.6배, 1.2배, 1.3배 증가하는 것으로 나타나 용량 차이에 대한 성 분함량 차이는 보이지 않았다. 플라보노이드, 페놀산 등의 기능성분을 함유한 CON과 P 처리구는 항산화 효소의 활 성을 증가시켜 H2O2 처리로 증가한 ROS를 소거하여 산화 적 스트레스로부터 대식세포를 보호하였다. 또한 CON과 P 처리구는 LPS로 자극된 대식세포 내 NO 및 염증성 사 이토카인의 생성을 효과적으로 억제하였다. 항산화 및 항 염증 활성 결과에서 CON보다 P 처리구가 높은 활성을 나 타낸 것은 효소처리로 기능성분의 용출 및 함량이 증가한 분석 결과와 일치한다고 판단되었다. 본 연구에서 확인된 배암차즈기의 기능성분 함유량을 증진시킬 수 있는 효소처 리 수용화 기술을 적용하여 그 효과를 확인하였으며 산업 적으로 활용을 위한 기초자료를 제공하고자 하였다. 또한 배암차즈기는 특유의 강한 쓴맛으로 인해 낮은 기호성으로 소비확대의 어려움이 있어 목 넘김 어려움 개선효과를 확 인할 수 있는 관능적 특성에 대한 심도있는 연구가 진행된 다면 활용가능한 기능성식품 소재 생산이 이루어질 수 있 을 것으로 생각된다.