서 론
식품첨가물(food additive)은 현행 식품위생법상 식품을 제조·가공·조리 또는 보존하는 과정에서 감미, 착색, 표 백 또는 산화방지 등을 목적으로 식품에 사용되는 물질을 말하며, 이 경우 기구·용기·포장을 살균·소독하는 데에 사용되어 간접적으로 식품으로 옮아갈 수 있는 물질을 포 함한다(MFDS, 2021a). 국내에서 식품첨가물은 2018년 이전 까지는 합성 및 천연 등 제조방법에 따라 분류하였으나, 2018년 ‘식품첨가물의 기준 및 규격’에 관한 개정고시에 따 라 31개 용도 중심으로 분류체계를 개편하였다(MFDS, 2021b). 즉, 감미료, 고결방지제, 발색제, 보존료, 산화방지제, 영양강화제, 착색료, 효소제 등 31개 용도로 분류하고, 국내 지정된 613 품목에 대해서 주용도를 명시하여 식품첨가물 사용 목적을 쉽게 확인할 수 있도록 하였다(MFDS, 2021b). 식품첨가물로 지정이 되려면 안전성, 효과, 제조방법, 시험법 및 독성자료가 구비되어 있어야 하므로 가공식품에 첨가되 는 수준에서 식품첨가물은 안전하다고 할 수 있다.
가공보조제는 식품의 제조 과정에서 기술적 목적을 달성 하기 위하여 의도적으로 사용되고 최종 제품 완성 전 분 해, 제거되어 잔류하지 않거나 비의도적으로 미량 잔류할 수 있는 식품첨가물로 정의되고, 살균제, 여과보조제, 이형 제, 제조용제, 청관제, 추출용제, 효소제가 이에 해당된다 (MFDS, 2021b). 효소제는 특정한 생화학 반응을 촉매하기 위한 용도로 첨가되며, 식품첨가물로 허가 받기 위해서는 반복투여독성시험, 유전독성시험 및 면역독성시험(알레르기 원성) 자료를 제출해야 한다(MFDS, 2021c). 특히 효소제 와 같이 미생물을 이용하여 제조된 식품첨가물은 식품첨가 물 생산균주에 대한 자료를 제출해야 하는데, 생산균주의 진위를 확인할 수 있는 자료, 최종산물에 균주의 사멸 또 는 잔류를 확인할 수 있는 자료, 식품으로서의 섭취 경험 에 관한 자료, 식품 등의 제조에 이용된 사례에 관한 자료, 그리고 인체 또는 동식물에 병원성 발현 여부를 확인할 수 있는 자료를 제출해야 한다(MFDS, 2021c).
효소는 위장 조건에서 작은 펩타이드와 아미노산으로 분 해되어 대사되기 때문에 가공식품에 사용된 효소제의 경우 경구 섭취를 통해 독성학적으로 유의미한 양만큼 체내 흡 수되지 않을 것으로 간주된다(Sewalt et al., 2016;Ladics & Sewalt, 2018). 대부분의 효소제들은 미생물로부터 생산 되는데, 자연종 미생물 뿐만 아니라 돌연변이 유발에 의한 선택 균주 또는 유전공학적 기법을 이용한 재조합 균주 등 에서 생산될 수 있다(Sewalt et al., 2016;Deckers et al., 2020). 효소제는 빵, 장류, 소스, 곡류 가공품, 과자, 맥주, 탁주 및 약주 등 다양한 가공식품의 제조에 중요한 역할을 하며, 동물용 사료에 있어서는 영양성분 공급원으로 활용될 수 있다(Ojha et al., 2019). 가공식품에 첨가되는 효소제의 경우 열처리나 가공공정에서 불활성화되는 경우가 대부분 이라서 안전성에 대한 우려는 낮은 편이라 할 수 있다. 그러나 유럽식품안전청(European Food Safety Authority; EFSA)에 따르면 효소제로 사용되고 있는 글루코아밀라아 제와 α-아밀라아제의 아미노산 서열이 알레르겐 한 종류와 유사성이 있음을 보고한 바 있다(EFSA, 2018;EFSA, 2020). 또한 효소제 자체에 의한 독성뿐만 아니라 효소제 생산과정 중 생성 및 잔류할 수 있는 대사 또는 발효산물 에 의한 독성 영향은 배제할 수 없으며, 이와 같은 부산물 의 고려한 독성 평가의 필요성이 제기되고 있다(Pariza & Johnson, 2001;Sivamaruthi et al., 2018).
따라서 본 연구에서는 국내에서 다빈도로 사용되는 천연 기원 첨가물 효소제 7종을 선정하여 세포수준에서 독성을 연구하였는데, 실제 가공식품에서 사용량 및 일일섭취량을 기반으로 세포실험 최고 농도를 설정 후 단기간 세포성장/ 사멸, 세포막 손상 및 활성산소종 유발을 평가하였다. 또한 식품첨가물 효소제의 경우 ‘식품첨가물의 기준 및 규격’에 관한 개정고시(MFDS, 2021c)에 따라 면역독성시험으로 알 레르기원성 자료가 요구되므로 면역세포에서의 탈과립화 정도를 분석하여 효소제 안전성에 대한 기반자료를 마련하 고자 하였다.
재료 및 방법
본 연구에서는 일일섭취허용량(acceptable daily intake)이 설정되어 있지 않고 품목제조보고서(1960년-2019년)와 수 입신고서(2017년-2019년) 기반 국내에서 다빈도로 사용되 는 효소제를 선정하였다. 이를 바탕으로 종국(백국, 황국, 흑국), 프로테아제(곰팡이성, 세균성, 식물성), 국(국내산 분 말 1종/낟알 1종, 미국산 낟알 1종), α-아밀라아제, 트랜스 글루타미나아제, 셀룰라아제, 글루코아밀라제 등 7종의 효 소제를 세포독성시험 대상으로 선정하였다. 각 효소제의 생산 균주 및 기원은 Table 1과 같다.
|
세포독성시험을 위한 최고 농도는 품목제조보고서(2017 년-2019년), 국민영양통(KHIDI, 2017) 및 소장액 부피를 고려하여 설정하였다. 즉, 품목제조보고서 신고대장에서 천 연기원 효소제 7종이 다빈도로 사용되는 가공식품 품목을 검토하고 최대사용량을 확인하였다. 일일섭취량은 품목제 조보고서 기반 효소제 7종이 다빈도로 사용되는 품목에 해 당하는 식품군(대분류) 또는 식품(소분류)을 국민영양통계 분류체계에 근거하여 조사하였다. 또한 체내 환경을 반영 하기 위해 실제 소장액 부피(100 mL)를 고려하여(Mudie et al., 2014) 다음과 같이 세포독성시험 최고 농도를 설정하 였다.
각 효소제별로 설정된 세포시험 최고 농도에서부터 2배 씩 희석하여 세포성장 저해 및 사멸 시험은 6개 농도에서, 젖산탈수소효소 분석 시험은 5개 농도에서, 세포 내 활성 산소종 생성 분석 시험은 6개 농도에서 수행하였다. 각 효소제의 경우 열처리하지 않은 활성화(native) 형태와 121°C, 15분 열처리에 의한 불활성화(inactivated) 두 형태 를 모두 세포실험에 사용하였다. 세포 처리 시간은 소장 내 체류시간(Römmele et al., 2016)을 고려하여 6시간으로 설정하였다. 각 효소제는 세포배양액에서 pH 및 세포독성 분석 파장에서 자체 흡광도를 확인 후 세포실험을 진행하 였다.
본 연구에서 사용한 장관상피세포인 Caco-2 세포와 흰쥐 호염기성 백혈병 RBL-2H3 세포는 한국세포주은행(Korean Cell Line Bank, Seoul, South Korea)에서 분양 받아 사용 하였고, 10% heat inactivated fetal bovine serum, 페니실린 (100 units/mL) 및 스트렙토마이신(100 μg/mL)이 첨가된 minimum essential medium (Welgene Inc., Gyeongsan, South Korea)과 Dulbecco’s modified eagle medium (Welgene Inc.)에서 37°C, 5% CO2 조건의 세포배양기(MCO-230AIC, PHCbi, Tokyo, Japan)를 이용하여 각각 배양하였다.
세포성장 및 사멸 시험은 water-soluble tetrazolium salt-1 (WST-1; Roche, Basel, Switzerland)을 이용하여 평가하였 는데, 각 효소제 자체의 흡광도가 440 nm에서 세포배양액 과 동일한 배경 수준으로 측정되었기 때문이다. Caco-2 세 포를 1 × 104 cells/100 μL로 배양한 후 효소제를 농도별로 첨가하여 6시간 동안 배양하였다. WST-1 시약 10 μL을 각 각 첨가하고 4시간 동안 배양한 후 440 nm에서 흡광도를 microplate reader (SpectraMax® M3, Molecular Devices, San Jose, CA, USA)를 이용하여 측정하였다.
효소제에 의한 세포막 손상은 CytoTox 96 Non-Radioactive Cytotoxicity assay (Promega, Madison, WI, USA) 를 이용하여 세포막 손상에 따라 배양액으로 유출된 젖산 탈수소효소(lactate dehydrogenase; LDH) 양을 측정하여 확인하였다. Caco-2 세포를 2 × 104 cells/mL로 배양한 후 각 효소제를 농도별로 6시간 동안 처리한 뒤 원심분리하 여 세포 배양액 상층액을 분석에 이용하였다. 즉, 상층액 50 μL에 substrate mixture 50 μL을 첨가하고 30분간 반 응시킨 뒤 stop solution 50 μL로 반응을 종료시킨 후 490 nm에서 흡광도를 측정하였다(SpectraMax® M3, Molecular Devices).
효소제에 의한 세포 내 활성산소종(reactive oxygen species; ROS) 생성 정도는 세포막 투과성 2',7'-dichlorofluoroescein diacetate (H2DCFDA; Molecular Probes Inc., Eugene, OR, USA)를 이용하여 분석하였다. Caco-2 세포 를 1 × 104 cells/100 μL로 배양한 뒤, 각 효소제를 농도별 로 6시간 동안 처리하였다. 이 후, 20 μM H2DCFDA 용 액 100 μL을 첨가하여 30분간 암소에서 반응시킨 뒤 phosphate buffered saline로 2회 세척한 후 2',7'-dichlorofluorescein (DCF) 형광을 excitation 485 nm와 emission 535 nm에서 측정하였다(SpectraMax® M3, Molecular Devices).
면역세포 탈과립화는 RBL-2H3 세포에서 히스타민 탈과 립 시 함께 용출되는 β-hexosaminidase의 양을 배양액에서 분석하여 확인하였다. RBL-2H3 세포를 3 × 104 cells/100 μL로 24시간 배양한 뒤, 배양액을 modified-Tyrode’s buffer (pH 7.3)로 교체하여 1시간 동안 배양하였다. Modified- Tyrode’s buffer 조성은 119 mM NaCl (Sigma-Aldrich Co. Ltd., St. Louis, MO, USA), 4.74 mM KCl (Ducksan Pure Chemical Co., Ltd, Ansan, Korea), 2.54mM CaCl2 (Ducksan Pure Chemical Co. Ltd.), 1.19 mM KH2PO4 (Sigma-Aldrich Co. Ltd.), 10 mM HEPES (N-(2-hydroxyethyl) piperazine- N′-(2-ethanesulfonic acid), 4-(2-hydroxyethyl) piperazine-1- ethanesulfonic acid, Sigma-Aldrich, Co. Ltd.), 5 mM glucose (Sigma-Aldrich, Co. Ltd.), 0.1% (w/v) bovine serum albumin (Sigma-Aldrich, Co. Ltd.)이다. 다양한 농도의 효소제 또는 양성 대조군으로서 compound 48/80 (C48/80, 1 mg/mL, Sigma-Aldrich, Co. Ltd.)을 처리한 후 30분간 배양하였다. 반응을 멈추기 위해 10분간 얼음위에 방치한 후, 50 μL의 상층액과 동량의 modified-Tyrode’s buffer에 제조된 기질 용액(1 mM ρ-nitrophenyl-β-acetyl-glucosaminide, pH 4.5, Sigma-Aldrich Co. Ltd.)을 혼합하여 1시간 동안 37°C에 서 반응시켰다. 효소-기질 반응을 멈추기 위해 100 μL의 sodium bicarbonate (pH 10)을 첨가하고 415 nm에서 microplate reader (SpectraMax® M3, Molecular Devices)를 이용 하여 흡광도를 측정하였다. 한편, 총 효소양을 측정하기 위 해 100 μL의 1% (v/v) Triton X-100 (Sigma-Aldrich Co. Ltd.)을 첨가하여 얼음위에서 30분간 반응시켜 남아있는 세 포를 lysis시킨 후, 동일한 방법으로 효소-기질 반응시켜 다 음과 같은 식에 의해 용출된 β-hexosaminidase의 양을 계 산하였다.
용출된 β-hexosaminidase (%) = 상층액의 흡광도/(상층액 + 세포 용해물) 흡광도
결과 및 고찰
품목제조보고서를 기반으로 효소제들이 첨가되는 품목 을 확인한 결과, 종국, 프로테아제, 국, α-아밀라아제, 트 랜스글루타미나제, 셀룰라아제, 글루코아밀라아제 순으로 가공식품에 다수 첨가되는 것으로 조사되어 이들 7종류 효소제를 시험물질로 선정했다. 이들 효소는 각각 장류, 소스, 탁주/약주, 빵/곡류가공품, 어묵/어묵소시지, 맥주/곡 류가공, 곡류가공/주류에 다빈도로 사용되고 있는 것으로 확인되었고 최대 사용량은 Table 1과 같다. 이는 국민영 양통계분류상 조미료, 주류, 곡류 및 그 제품, 어패류 등 의 식품군(대분류)에 해당되어 이를 기반으로 일일섭취량 을 조사하였다. 국민영양통계분류 대분류 식품군 중 본 시험대상 효소제가 첨가되지 않는 식품 항목도 다수 포함 되어, 효소제가 실질적으로 첨가되는 대분류 내 세부 식 품항목의 총합으로써 일일섭취량을 도출하였다(Table 1). 이와 같이 최대 사용량과 일일섭취량 기반 도출된 양을 장내 부피 100 mL을 고려하여 설정한 세포시험 최고 농 도는 Table 1과 같다. 단, 설정된 세포실험 최고 농도가 1,000 μg/mL을 초과할 경우, 고농도 자체에 의한 false positive 효과를 초래할 수 있고 일반적으로 세포실험에 사용되는 농도를 고려하여 1,000 μg/mL를 최고 농도로 설정하였다(Böhmert et al., 2018).
효소제의 생산 균주나 원산지 등 기원이 다르거나 분말 및 낟알 등 형태가 다른 경우 모두 시험대상으로 선정하였 고, 효소제가 일반적으로 가공과정에서 열처리나 가공공정 에 의해 불활성화되는 점을 감안하여 native와 inactivated 두 가지 형태의 효소제를 모두 시험대상에 포함하였다.
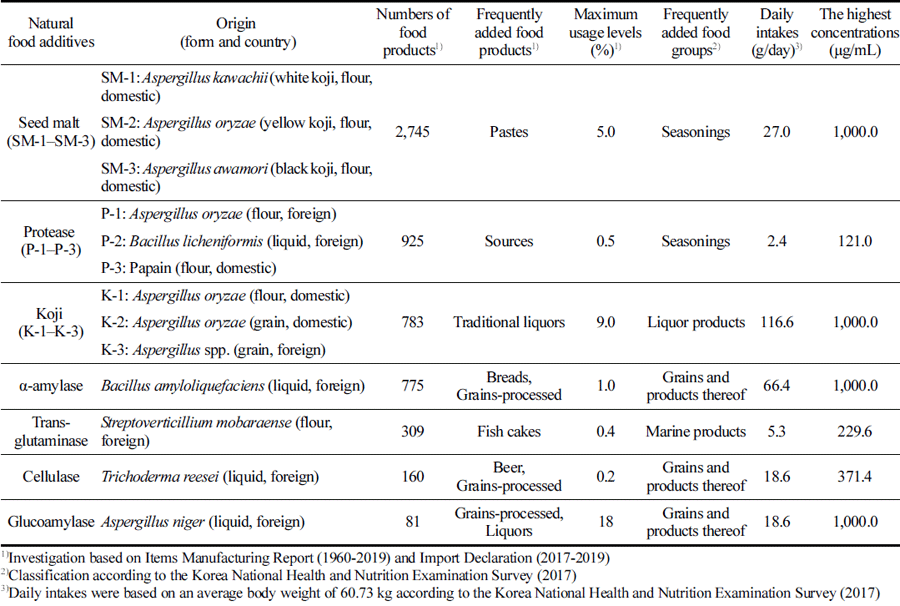
다빈도로 사용되는 효소제 7종이 세포 성장 및 사멸에 미치는 효과를 확인하기 전에 WST-1 시약이 최고 흡광도 를 나타내는 440 nm에서 모든 효소제가 세포배양액 수준 의 낮은 흡광도(0.04–0.06)를 나타내고 있음을 확인하였고, 세포배양액에 Table 1과 같이 설정된 최고 농도로 준비 시 급격한 pH 변화(7.6-8.4)를 유발하지 않는 것을 확인하였 다. 효소제에 의한 세포성장 저해 및 사멸에 미치는 영향 을 WST-1 분석법을 이용하여 평가한 결과, 모든 효소제가 영향을 미치지 않는 것으로 나타났다(p<0.05, Fig. 1). 이는 native나 inactivated 효소제, 다른 제조기원 및 형태의 효소 제 모두 세포성장 저해 및 사멸을 유발하는 않음을 제시한 다. 또한 세포시험에 사용된 최고 농도는 효소제의 가공식 품에서의 최고사용량, 일일섭취량, 소장액 부피 및 소장 체 류시간 등을 모두 고려하여 설정한 것임으로 실질적 노출 조건에서 세포독성이 낮음을 의미한다 할 수 있다.

다빈도로 사용되는 효소제 7종에 의한 세포막 손상 유발 여부는 세포 내 존재하는 젖산탈수소효소(LDH)가 세포막 손상에 따라 배양액으로 유출되는 정도를 측정하여 확인하 였다(Bae et al., 2018). 또한 젖산탈수소효소 용출은 세포 막 손상에 의해 세포가 사멸되었음을 의미하는 분석 지표 로 이용되기도 한다(Chan et al., 2013). 그 결과, native나 inactivated 효소제 모두 젖산탈수소효소를 세포 배양액으로 유의미하게 용출시키지 않는 것으로 나타났다(p<0.05, Fig. 2). 즉, WST-1 결과(Fig. 1)와 젖산탈수소효소 분석 결과 (Fig. 2)를 종합하면, native와 inactivated 효소제 모두 세포 성장 저해 및 세포막 손상에 의한 세포사멸을 유발하지 않 는 것으로 보여지며 이러한 결과는 세포독성이 낮음을 제 시한다.
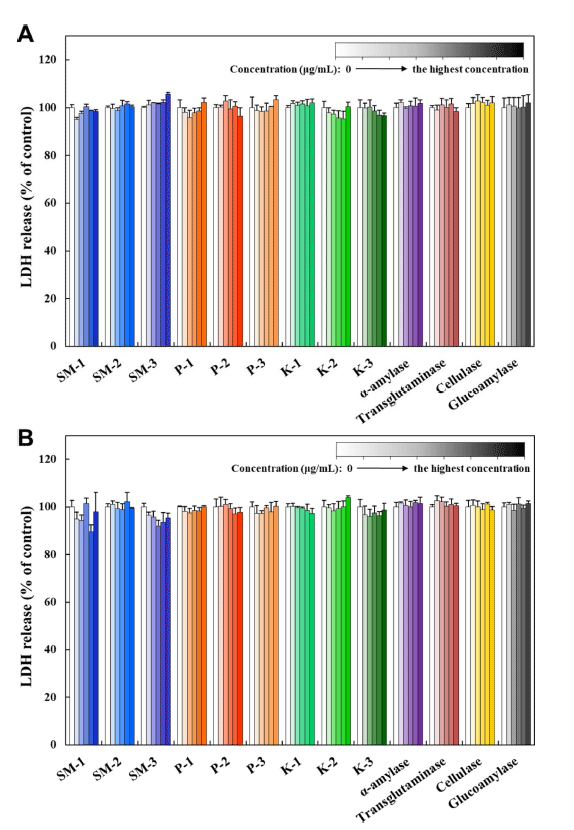
세포 내 활성산소종(ROS) 생성은 산화스트레스 유발의 지표로 이용되며, 이는 세포막 투과성 비형광 물질인 H2DCFDA가 세포 내 esterase에 의해 탈아세틸화된 후 ROS와 반응하여 생성되는 DCF의 형광을 측정하여 분석 할 수 있다(Zhao et al., 2010). Fig. 3A에서 보듯이 native 효소제 중 종국 3종(SM-1, SM-2, SM-3)에 의한 ROS 생 성이 농도 의존적으로 증가하는 것으로 나타났고(p<0.05), 그 외 6종 효소제에 의한 ROS 증가는 유의적으로 나타나 지 않았다(p>0.05). 이러한 결과는 일부 native 효소제가 식품에 그대로 잔존 시 ROS 유발 가능성을 제시한다 할 수 있으며, 연구에 사용한 종국 3종에서 모두 ROS가 유발 된 점을 감안하면 효소 자체에 의한 영향이거나 종국 생성 과정에서의 대사 및 발효산물 등 부산물과 관련이 있을 것 으로 보인다(Lee et al., 2014). 종국으로 사용되는 균주인 Aspergillus 속은 다양한 대사산물을 생성하는 것으로 알려 졌으며(Frisvad et al., 2018), 2차 대사산물 중 kojic acid는 ROS를 유발하는 것으로 보고된 바 있다(Rodrigues et al., 2011). 그러나, Aspergillus 속 생산 효소제인 P-1, K-1과 K-2에 의한 ROS는 유의적으로 증가하지 않아 효소 자체 에 의한 영향도 있는 것으로 보이며, inactivated 효소제는 모두 ROS를 유발하지 않는 것으로 나타나(Fig. 3B) 실질 적으로 가공제품에 잔존하는 불활성화된 효소제에 의한 ROS 생성 가능성은 낮을 것으로 보여진다.
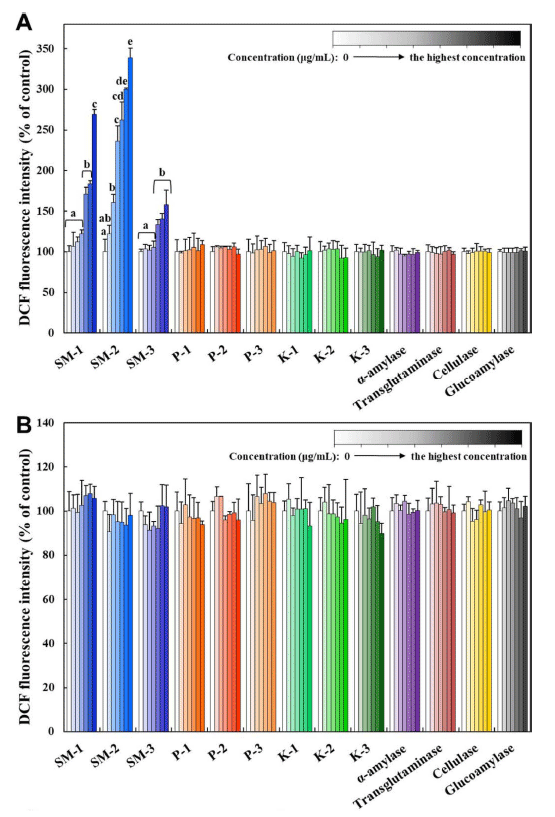
2018년 식품첨가물의 기준 및 규격 일부개정고시에 따라 식품첨가물 가공보조제로 효소제의 사용허가를 위해서는 독성자료로서 면역독성시험(알레르기원성) 자료가 요구된다 (MFDS, 2021c). 본 연구에서는 세포수준에서 알레르기원 성 평가방법으로 RBL-2H3 세포에서 β-hexosaminidase의 용출 정도를 확인하였다. RBL-2H3 세포는 흰쥐의 호염기 성 백혈병 세포로서 알레르기 반응을 측정하기 위해 가장 일반적으로 사용되는 세포이다(Chung et al., 2011). 면역 반응에 의해 분비되는 히스타민은 세포에서 농도가 매우 낮기 때문에 분석 결과에서의 편차가 큰 단점이 있는 반 면, β-hexosaminidase는 세포 내 높은 농도로 존재할 뿐 만 아니라 히스타민 탈 과립 시 함께 세포 밖으로 용출되 는 물질로서 배양액에서 β-hexosaminidase 활성 측정은 탈 과립의 지표로 이용될 수 있다(Choi., 2002). 양성대조 군으로서 C48/80을 사용하였는데, 이는 N-methyl-p-methoxyphenethylamine과 formaldehyde의 축합에 의해 생성된 중합체로서, 히스타민 방출을 촉진하고 비만세포 및 호염 기성 세포에서의 탈 과립을 촉진하는 물질로 사용된다 (Shipstone et al., 1999). 그 결과, 종국 1종(백국)과 프로테 아제 1종(곰팡이성)의 native 효소제가 β-hexosaminidase를 농도 의존적으로 세포 밖으로 용출시키는 것으로 분석되었 다(Fig. 4A). Aspergillus 속 기원의 곰팡이성 효소제가 알 레르기원으로 작용하며, 면역 반응을 유발할 수 있는 것으 로 보고된 바 있다(Shen et al., 2007;Balenga et al., 2015;Onami et al., 2019). 그러나 Aspergillus 속 기원의 다른 효소제나 다른 미생물에서 유래된 효소제에 의한 β- hexosaminidase 용출이 나타나지 않은 결과는 같은 효소 제의 경우에도 기원에 따라서 탈과립화에 의한 알레르기 원성 영향이 달라질 수 있음을 제시한다. 이는 효소제 자 체에 의한 영향보다는 미생물 기원에 따른 효소제 생성과 정에서 미량 잔류하는 대사 및 발효산물에 의한 영향으로 보여지며, 이를 뒷받침하기 위한 연구가 추후 요구된다. 그 러나, 열처리에 의한 모든 inactivated 효소제들의 경우 β- hexosaminidase를 용출시키지 않는 것으로 나타났다(Fig. 4B). 이는 양성대조군으로 사용한 C48/80에 의한 β- hexosaminidase의 용출이 확연히 나타난 것과 대조되는 결 과이다. 일반적으로 단백질이나 효소의 경우 면역반응에 의한 독성을 나타낼 수 있는 것으로 알려져 있으나(Merget et al., 1993;Bannon, 2004), 식품첨가물 가공보조제로 사 용되는 효소제의 경우 가공과정에서 사용된 후 최종제품에 불활성화되거나 제거되는 경우가 많으며, 특히 가공과정에 서 대부분 불활성화되기 때문에 알레르기원성으로의 독성 이 낮은 것으로 보고된 바 있다(Paschke, 2009;FSCJ, 2017). 본 연구 결과는 일부 native 효소제의 경우 탈 과 립화를 유발할 수 있는 것으로 보여지나, 최종 제품에서 불활성화된 형태의 효소제에 의한 알레르기원성 독성이 낮음을 제시하고 있다(Sewalt et al., 2018). 또한, 본 실험 은 국민영양통계분류 기준 효소제가 첨가되는 대분류 내 세부 식품항목의 총합으로 일일섭취량을 도출하여 세포독 성시험 최고 농도를 설정하였는데, 이와 같이 효소제들이 첨가된 세부 식품항목을 하루 동안 모두 섭취할 가능성은 극히 낮으므로 실질적 독성영향은 더욱 낮을 것으로 판단 된다.
요 약
본 연구에서는 국내 다빈도로 사용되고 있는 가공보조 제 효소제 7종에 대한 최대 사용량 기반 세포독성을 연구 하였다. 기원이나 원산지 및 제조형태가 다른 효소제가 시판되고 있는 경우 모두 시험대상에 포함하였고, 효소제 의 경우 가공과정에 사용 후 최종제품에서 잔존하지 않거 나 불활성화되기 때문에 native 및 inactivated 두 형태에 대한 세포독성을 확인하였다. 세포처리 최고 농도는 품목 제조보고서를 기반으로 다빈도 첨가 식품품목 및 그 최대 사용량과 국민영양통계 일일섭취량을 기반으로 설정하였 다. 그 결과, native 및 inactivated 효소제 모두 세포성장 및 세포막 손상에 의한 세포사멸을 유발하지 않는 것으로 나타났다. Native 효소제의 경우 종국 3종 모두에서 ROS 유발이 확인되었으나, inactivated 종국에서 ROS의 유의적 증가는 나타나지 않았다. 일부 native 형태의 종국 및 프로 테아제에서 β-hexosaminidase 용출에 의한 탈 과립화가 유 발될 수 있는 것으로 분석되었으나, 모든 inactivated 효소 제에서 탈 과립화는 유의적으로 나타나지 않았다. 이러한 결과는 효소제의 기원에 따라서 native 형태의 경우 ROS 유발에 의한 산화스트레스 및 탈 과립화와 같은 알레르기 원성 세포독성을 나타낼 수 있으나, 실제 가공제품에 잔존 하는 불활성화된 효소제에 의한 세포독성 영향은 낮음을 제시한다 할 수 있다. 이와 같은 연구결과는 안전성 정보 가 미흡한 가공보조제 효소제에 대한 구체적인 독성자료 및 향후 in vivo 독성연구를 위한 기초자료로 활용될 수 있을 것이다.