서 론
비만이라 함은 체지방이 과도하게 축적된 상태를 의미하 는 것으로 비정상적인 지방세포 크기(hypertrophy)와 숫자 의 증가(hyperplasia)가 지방축적의 직접적인 원인으로 알려 져 있으며 최근 여러 연구자들에 의해 비만의 예방을 위한 다양한 시도가 보고되고 있다(Chung et al., 2012). 특히, 지방세포의 숫자가 증가하는 hyperplasia는 전지방세포가 지방세포로 분화되는 adipogenesis 과정과 밀접한 관련이 있으며, adipogenesis는 특이적 전사인자(transcriptional factor)의 발현에 의한 체계적 신호전달 과정을 통해 진행 된다고 알려져 있다(Kim, 2009). Adipogenesis 과정을 직 간접적으로 조절하는 전사인자들이 여러 연구자들에 의해 보고되었는데 그 중 대표적인 것이 CCAAT/enhancer binding protein family(C/EBPs)와 peroxisome proliferatoractivated receptor γ(PPARγ)가 있다. 일반적으로 C/EBPβ는 adipogenesis 과정 초기에 발현되어 PPARγ와 C/EBPα의 발현을 유도함으로써 adipogenesis 과정을 촉진하는 것으로 알려져 있다. 소아 및 청소년기는 특히 지방세포 크기 및 수가 함께 증가하고 관련기관들이 형성되는 시기로써 전지 방세포가 지방세포로 분화되는 adipogenesis 과정의 조절은 비만예방 및 관리에 있어 중요한 타겟이라 할 수 있다.
체내에서 에너지 생산을 위한 산화과정 중에 상당량의 활 성산소(reactive oxygen specise, ROS)들이 생성된다. 이러한 활성산소들이 적정한 수준일 때에는 세포의 신호전달, 세포 의 성장, 그리고 분화에 작용하지만 과량의 활성산소가 생 성되거나 인체의 항산화 방어 체계의 균형이 깨지면 과량 의 활성산소는 산화적 스트레스를 유발할 수 있다. H2O2 (hydrogen peroxide), OH·(hydroxyl radicals), ROO· (peroxyl radicals), 그리고 1O2 -(singlet oxygen) 등의 의한 산화적 스트레스는 세포 구성성분인 지질, 단백질, 핵산, 당, DNA 등을 손상 시켜 각종 질환의 원인이 될 수 있다 (Coyle et al., 1983; Song et al., 2002; Ricci et al., 2003). 따라서 활성산소로부터 세포를 보호하고 각종 질환의 발생 을 예방 또는 지연시키기 위해서는 항산화 물질을 외적으 로 공급해 주거나 섭취하여 체내 항산화 방어 시스템을 향 상 시키는 것이 중요하다(Kim et al., 2009; Lee et al., 2011).
최근 여러 연구자들에 의해 천연물을 이용하여 체내 항 산화 방어 시스템을 향상시키는 다양한 연구가 시도 되었 다. 그 중에서 하고초(Spica prunellae)는 꿀풀과에 속한 다 년생식물로서 꿀풀의 지상부를 일컫는다. 하고초의 항알레 르기, 항염증, 항산화 및 항돌연변이 활성 등에 대한 보고 가 있으며, 하고초에는 ursolic acid, saponin, caffeic acid, carotenoid, rutin, vitamin, 그리고 tannin 등의 생리활성 물 질이 존재하는 것으로 보고되었다(Dorosh et al., 1954; Sandra, 1963a; Sandra, 1963b).
그럼에도 불구하고 세포주 모델에서 하고초 추출물의 항 비만 활성 및 다양한 산화적 스트레스에 대한 억제활성에 대한 연구는 아직 미흡한 실정이다. 따라서 본 연구에서는 하고초 추출물을 제조하고, 3T3-L1 지방세포 분화모델에서 항비만 및 HepG2 세포에서 AAPH 및 Cu2+에 대한 산화 적 스트레스 억제활성을 평가하여 하고초의 항비만 및 항 산화 기능성 소재로서의 가능성에 대해 고찰하고자 한다.
재료 및 방법
본 실험에 사용된 하고초는 강원도 인제 야산에서 자란 자연산으로 5월경에 채취하여 일광에 말린 지상부 전초를 강원약초(Wonju, Korea)에서 구입하여 사용하였다. Ethanol 과 methanol은 (주)삼전(Pyeongtaek, Korea)에서 구입하였 으며, Dulbecco's modified Eagle's medium(DMEM), fetal bovine serum(FBS), Hank's balanced salt solution(HBSS), streptomycin, penicillin은 Gibco BRL.(Carlsbad, CA, USA)에 서 구입하였다. Phosphate-buffer saline(PBS)은 WELGENE Inc.(Daegu, Korea)에서 구입하였다. Calf serum(CS)은 GE Healthcare Bio-Sciences Co.(Piscataway, NJ, USA)에서 구입 하였으며, Oil Red O(ORO), 3-isobutyl-1-methylxanthine (IBMX), dexamethasone(Dex), insulin, dichlorodihydro fluorescein diacetate(DCFH-DA), cupric sulfate는 Sigma- Aldrich Co.(St. Louis, MO, USA)에서 구입하여 사용하였 다. Acetone, 그리고 sodium hydroxide은 Junsei Chemical (Tokyo, Japan)사로부터 구입하였으며 2,2'-Azobis(2- amidinopropane) dihydrochloride(AAPH)은 Wako Pure Chemical (Osaka, Japan)로부터 구입하여 사용하였다. 분쇄 기는 Queensmate DCM-5500(Seoul, Korea), Enzymelinked immunosorbent assay(ELISA) reader 및 fluorescence reader는 Tecan (Salzburg, Austria)의 기기를 사용하였다.
건조된 하고초(전초)는 분쇄기를 이용하여 가루로 만든 후 50 g의 하고초를 1 L의 에탄올을 가하여 상온에서 shaking incubator HST-201MS-2R(Hanbaekst, Bucheon, Korea)를 이용하여 160 rpm의 조건에서 24 h 동안 추출하 였다. 추출물은 여과지(Hyundai micro No. 20)로 여과한 후, 이것을 진공회전농축기(Eyela N-1000, Tokyo Rikakikai, Co., Tokyo, Japan)로 40°C에서 농축하였다. 농축물은 100 mg/mL의 농도로 DMSO에 용해하여 이후 분석에 사용 하였다.
본 실험에 사용된 마우스 유래 3T3-L1 세포는 American Type Culture Collection(ATCC; Rockville, MD, USA)에서 분양받아 사용하였다. 3T3-L1 전지방세포는 10% CS와 100 unit/mL의 penicillin-streptomycin이 함유된 DMEM 배 지를 이용하여 37°C, 5% CO2 환경에서 배양되었다. 3T3- L1 전지방세포를 지방세포로 분화시키기 위하여, 전지방 세포가 confluent 상태가 된 2일 후 분화유도 배지로 교체 하였으며, 분화유도 배지(Differentiation medium; DM)로 교체한 날을 Day 0라 표기하였다. 분화유도 배지는 10% FBS와 100 unit/mL의 penicillin-streptomycin이 함유된 DMEM 배지에 500 μM IBMX, 1 μM Dex, 167 nM insulin을 포함하도록 준비하여 사용하였다. 분화유도 배지 는 Day 0에서 Day 2까지 48 h 동안 사용하였다. Day 2에 서 Day 4까지는 10% FBS와 100 unit/mL의 penicillinstreptomycin이 함유된 DMEM에 167 nM의 insulin만 포함 된 분화유도 후 배지(Post-differentiation medium; Post-DM) 를 사용하였으며, 이후 Day 4에서 Day 6까지 10% FBS와 100 unit/mL의 penicillin-streptomycin이 함유된 DMEM (normal medium)을 사용하였다. 지방세포분화는 Day 6에 종료하였다(Fig.1).

하고초 추출물의 항비만 활성을 평가하기 위해서, 지방 세포로 분화시킨 3T3-L1 세포의 지방축적량을 ORO 염색 법을 통해 정성 및 정량분석 하였다. 3T3-L1 전지방세포는 50 그리고 100 μg/mL의 하고초 추출물에 Day -2에서 Day 2까지 처리되었다. 지방세포분화는 위에 설명한 방법에 의하 여 실시하였다. ORO 염색은 Day 6에 실시하였으며, Kim 등(2012)의 방법을 일부 변형하여 사용하였다. 분화된 3T3- L1 지방세포(Day 6)는 3.7%(v/v)의 formaldehyde로 30 min 동안 실온에서 고정시켰다. 고정 된 세포는 3 mg/mL의 ORO를 이용해 15 min 동안 실온에서 염색시켰으며, 염색 후에는 증류수를 이용해 3회 씻어 주었다. 염색된 지방세 포는 scanner를 이용하여 이미지를 얻었다. ORO 정량분석 은 염색된 지방세포에 200 μL의 DMSO을 가하여 세포내 ORO를 녹인 후 96-well plate에 50 μL/well씩 옮겨 ELISA reader(Tecan, Salzburg, Austria)을 이용하여 490 nm에서 흡 광도를 측정하였다. 하고초 추출물을 처리하지 않은 분화 된 지방세포를 대조군으로 하여 lipid accumulation(% of control)을 계산하였다.
분화된 3T3-L1 지방세포의 지방구(lipid droplet)의 수와 크기는 현미경 관찰을 통해 정성 분석 하였다. 위의 처리 방법과 동일하게 3T3-L1 전지방세포는 50 그리고 100 μg/ mL의 하고초 추출물에 Day -2에서 Day 2까지 처리하였다. 지방분화 역시 위의 방법과 동일하게 실시하였다. 분화된 Day 6의 3T3-L1 지방세포를 3.7%(v/v)의 formaldehyde를 이용해 실온에서 30 min 동안 고정시킨 후, 건조방지를 위 해 PBS를 채운 후 현미경으로 관찰하였다.
본 실험에 사용된 인간유래 HepG2 세포는 American Type Culture Collection(ATCC; Rockville, MD, USA)에서 분양받 아 사용하였다. HepG2 세포는 10% FBS와 10% antibiotics 가 함유된 DMEM 배지에 배양하였으며 5% CO2, 37°C의 환경에서 일주일에 2-3회 1:3 ratio로 계대배양 하였다.
HepG2 세포를 5×105 cells/well의 수로 전배양하고 50 그리고 100 μg/mL의 하고초 추출물을 800 mM의 ethanol 과 같이 24 h 동안 처리한 후 5mg/mL의 MTT 용액을 1 h 처리하였다. 그 후 DMEM 배지를 제거하고 처리된 HepG2 세포를 1mL PBS(pH 7.4)로 씻어 주었다. 수용액에 용해 되지 않는 MTT formazan을 400 μL dimethyl sulfoxide (DMSO)를 가하여 녹여 준 다음 ELISA reader(Tecan, Salzburg, Austria)를 이용하여 570 nm에서 흡광도를 측정 하였다.
AAPH 및 Cu2+로 유도시킨 산화적 스트레스에 대한 하 고초 추출물의 세포내 항산화 활성을 DCFH-DA를 이용하 여 분석하였다. DCFH-DA를 이용한 세포내 항산화 활성 분석은 Lautraite 등의 방법을 일부 변형하여 사용하였다 (Lautraite et al., 2003). DCFH-DA는 세포막을 통해 세포 로 유입되면 세포질에 존재하는 esterase에 의해 DCFH로 가수 분해되는데 세포 내 활성산소가 존재하게 되면 쉽게 DCF로 산화되어 excitation 파장 485 nm, emission 파장 535 nm에서 그린색의 강한 형광을 나타낸다. 하고초 추출 물을 HepG2 세포에 처리한 뒤 산화적 스트레스를 유발하 면 세포내 항산화 활성 정도에 따라 차이적인 DCF 형광 강도를 나타내므로 이를 이용하여 하고초 추출물의 세포내 항산화 활성을 분석할 수 있다. HepG2 세포를 5×105 cells/well의 수로 24 h 전배양하고 하고초 추출물을 30 min 동안 처리하였다. 배지를 제거한 후 50 μL의 HBSS로 1회 세포를 씻어 준 후 DMEM 배지를 제거하고 형광의 간섭을 받지 않는 HBSS로 교체해 주었다. 60 μM의 AAPH 또는 10 μM의 CuSO4 용액을 가하고 30 min 동안 배양한 후 40 μM의 DCFH-DA를 처리해 준 후 30 min 동 안 추가 배양하였다. 형광분석기(Tecan, Salzburg, Austria)를 이용하여 excitation 485 nm, emission 535 nm에서 형광의 강 도를 측정하여 하고초 추출물의 세포내 항산화 활성을 정량 분석 하였다.
결과 및 고찰
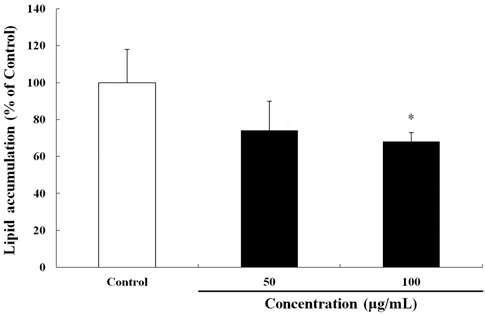
하고초 추출물의 항비만 활성을 평가하기 위하여 3T3- L1 지방세포 분화모델을 이용하였으며, 분화유도과정이 끝 난 후 ORO 염색법으로 평가하였다. ORO 염색시약은 세 포내 지질과 결합하며, 염색된 세포의 붉은색이 강할수록 세포내 중성지질 축적이 많이 이루어졌음을 의미한다. 본 실험에서 하고초 추출물이 3T3-L1 전지방세포에서 세포독 성을 나타내는지 알아보기 위해 MTT 분석법을 통하여 세 포 생존률을 분석하였으며, 하고초 추출물 100 μg/mL 이하 에서 세포 생존률에 영향을 미치지 않았다. 따라서 이후 실험에는 50 및 100 μg/mL의 하고초 추출물을 실험에 이 용하였다(data not shown). 하고초 추출물을 3T3-L1 세포 에 Day -2에서 Day 2까지 96 h 동안 처리하고, Day 6에 ORO 염색을 실시하였다. Day 6에 ORO 염색시약을 DMSO 로 용해하여 정량분석한 결과, 아무것도 처리하지 않은 대조 군(지방세포)을 100%로 하였을 때 50 및 100 μg/mL의 하고 초 추출물은 각각 25.87% 및 31.83%의 지방세포 분화를 억 제하였다(Fig. 2).
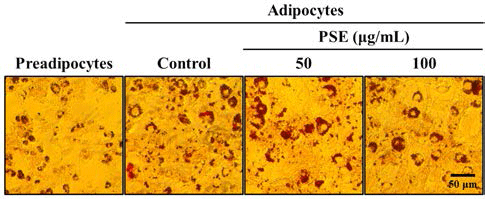
지방세포 분화유도 과정이 끝난 후 3T3-L1 지방세포내 축적된 지방구의 숫자와 크기를 현미경을 이용하여 정성분 석 하였다. 전지방세포에서는 거의 지방구가 발견되지 않았 으며, 하고초 추출물을 처리하지 않고 분화유도만 시킨 대 조군은 다량의 지방구가 형성되었음이 관찰되었다. Figure 2의 결과와 유사하게, 50 및 100 μg/mL의 하고초 추출물은 농도 의존적으로 3T3-L1 세포내의 지방구 수와 크기를 감 소시켰다(Fig. 3). 본 결과는 하고초 추출물이 비만의 예방 에 있어 중요한 adipogensis 과정을 억제하여 항비만 소재 로서의 가능을 보여주는 결과라 할 수 있다.
최근 연구들은 비만 및 대사성 질환 치료제 개발에 있어 부작용 및 독성의 위험성을 최소화하고자 천연물을 이용한 연구가 활발히 이루어지고 있다. 소리쟁이 ethyl acetate 추출 물이 PPAR 및 C/EBPα의 발현 감소를 통해 adipogenesis를 억제한다고 보고하였으며(Park et al., 2013), 기장 물 추출물 은 PPARγ와 SREBP1의 adipogenic 전사인자 조절을 통해 adipogenesis를 억제한다고 보고되었다. 참취 메탄올 추출 물은 PPARγ 및 C/EBPα의 발현을 억제함으로써 지방구 형성 및 중성지질 생성을 감소시켰다고 보고되었다(Choi et al., 2013). 선행 연구들과 같이, adipogenesis에 발현되는 adipogenic 전사인자의 조절은 비만예방에 있어 중요한 역 할을 하고 있음을 보여주는 결과이며, 추후 하고초 추출물 이 어떠한 신호 전달체계를 통해 adipogenesis를 조절하는 지에 대한 추가적 연구가 요구된다.
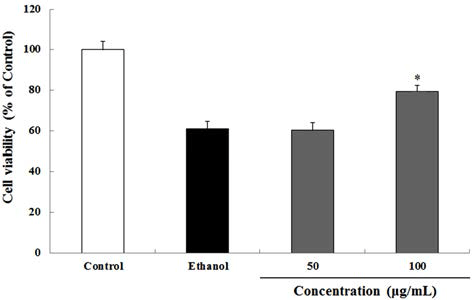
하고초 추출물을 50 및 100 μg/mL로 30 min 처리한 후 800 mM의 ethanol을 24 h 처리하여 세포독성을 유도하고 하고초 추출물이 HepG2 세포의 생존률에 미치는 영향을 분석하였다. 800 mM ethanol 처리에 의해 HepG2 세포는 대조군과 비교하여 60%의 세포 생존율을 나타냈다. 100 μg/mL의 하고초 추출물은 ethanol 처리군과 비교하여 유의적으로 ethanol에 의해 유도된 세포사멸을 79.3% 보호 하였다(Fig. 4). 비록 50 μg/mL의 하고초 추출물에서는 유 의적 차이는 없었지만 본 실험 결과는 하고초 추출물이 ethanol로 유도된 세포사멸을 감소시킬 수 있다는 결과를 보여주며, 하고초 추출물이 산화적 스트레스에 보호효과를 가질 수 있다는 가능성을 보여준다.
최근 세포내 활성산소를 측정하는 방법으로써 여러 연구자 들에 의해 DCFH-DA법이 널리 이용되고 있다(Lebel et al., 1990; Rosenkranz et al., 1992). 동물세포의 세포막 투과성을 가진 DCFH-DA가 세포질로 유입되게 되면 세포질에 존재 하는 esterase에 의해 DCFH-DA는 DCFH로 가수분해 되 고, 활성산소가 존재하게 되면 형광을 띄지 않던 DCFH는 활성산소에 의해 빠르게 산화되어 형광을 띄는 DCF의 형 태로 전환된다. 그러므로 형광현미경 및 형광분석기를 통 해 DCF의 형광강도를 측정하면 ROS 발생에 대한 정성 및 정량 분석이 가능하다. 본 실험에서는 HepG2 세포에 농도별 하고초 추출물을 처리하고 peroxyl radical generator로 잘 알려진 AAPH 및 hydroxyl radical 발생에 관여하는 전이금속 중 하나로 알려진 Cu2+를 처리하여 발 생되는 DCF의 형광 강도를 측정함으로써 하고초 추출물의 산화적 스트레스 억제활성을 평가하였다.
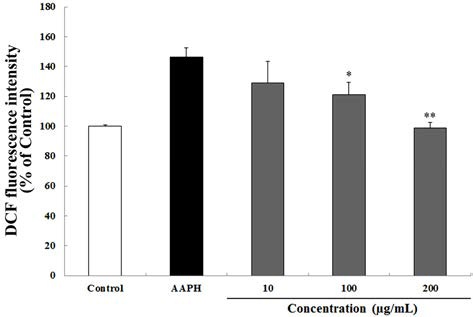
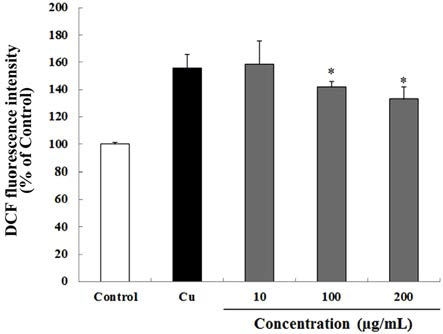
AAPH로 산화적 스트레스를 유도한 결과 대조군(100%) 대비 46.5%의 활성산소가 증가하였다. 반면 30 min 동안 하고초 추출물을 10, 100 및 200 μg/mL의 농도로 처리 한 뒤 60 μM의 AAPH를 처리하여 산화적 스트레스를 유도한 결과, 하고초 추출물은 농도 의존적이며 유의적으로 AAPH로 유도된 산화적 스트레스를 억제하였으며, 특히 200 μg/mL의 하고초 추출물은 대조군 수준 (98.9%)으로 산 화적 스트레스가 억제된 것을 알 수 있었다(Fig. 5). Cu2+로 산화적 스트레스를 유도하였을 때, 대조군(100%) 대비 55.65%의 활성산소가 증가한 것을 알 수 있었다. AAPH를 사용한 방법과 마찬가지로 30 min 동안 하고초 추출물을 10, 100 및 200 μg/mL의 농도로 처리 한 뒤 10 μM의 Cu2+를 처리하여 산화적 스트레스를 유도한 결과, 하고초 추출물은 농도 의존적이며(Fig. 6) 유의적으로 Cu2+로 유도 된 산화적 스트레스를 억제하였다. 특히 100 및 그리고 200 μg/mL의 하고초 추출물은 Cu2+로 유도된 산화적 스트 레스를 각각 24.8% 및 40.8% 감소시켰다. AAPH에 의해 발 생되는 ROO·은 항산화제의 수소전달에 의해 안정화 되는 것으로 잘 알려져 있다(Huang et al., 2005). 따라서 본 결과 는 하고초 추출물의 생리활성 성분에 의한 수소공여능이 AAPH에 의한 산화적 스트레스 억제에 기여했을 것으로 생 각된다.
최근 연구에 따르면 지방세포내 과도한 지방 축적은 ROS의 발생을 증가시킨다고 보고되었다. 지방세포는 에너 지 저장을 위해 에너지 대사경로를 통해 지방을 축적한다. 특히, hexose monophosphate (HMP) 경로는 지방 합성에 필수적인 NADPH를 생성하는데, 이는 NADPH oxidase (NOX)에 의하여 NADP+로 전환되게 된다. 이때, 다량의 ROS를 생성하게 되어 전지방세포의 분화를 증가시키며 주 변의 대식세포를 자극하여 다양한 ROS의 발생을 증가시키 므로 산화적 스트레스는 비만과 밀접한 관련이 있음이 보 고되었다(Lee et al., 2009; Lee et al., 2013). 또한, 전이금 속(철 또는 구리 이온)과 H2O2에 의한 hydroxyl radical 생 성의 억제에 기여하는 주요한 2가지 인자로서 전자공여능 (electron donating activity)과 metal chelating 활성이 잘 알 려져 있다. 전자공여능은 생성된 HO·에 전자를 주어 HO·를 안정시키는데 기여할 수 있으며, metal chelating 활성은 2가 전이금속이 H2O2와 반응하는 것을 차단 또는 지연시킴으로써 HO· 생성을 억제시킬 수 있다. 따라서 이 후 연구는 하고초 추출물의 어떠한 bioactive components 가 3T3-L1 adipogenesis의 억제에 관여하고 있는지를 밝혀 야 하며, AAPH와 Cu2+로 유도된 산화적 스트레스를 하고 초 추출물이 어떠한 기전으로 억제하는지에 대한 분자생물 학적 탐색이 추가적으로 요구된다.
요 약
체내에 과도하게 생성되는 활성산소는 산화적 스트레스 를 유발할 수 있으며 세포 구성성분들을 손상시키고 각종 질환의 원인이 될 수 있다. 또한 최근의 연구 결과에 따르 면 비만한 사람은 정상체중을 가진 일반인들에 비해 높은 산화적 스트레스 상태임이 알려졌다(Furukawa et al., 2004). 본 연구에서는 전통 한약재로 잘 알려진 하고초 ethanol 추출물의 항비만 및 스트레스 억제활성을 3T3-L1 및 HepG2 세포에서 평가하였다. 본 연구의 결과를 요약하 자면 다음과 같다. 첫째, 50 및 100 μg/mL의 하고초 추출 물은 각각 대조군 대비 78.4%, 및 72.3%의 3T3-L1 세포의 지방세포 분화를 억제하였다. 둘째, 100 μg/mL의 하고초 추 출물은 HepG2 세포에서 ethanol에 의해 유도된 세포사멸을 유의적으로 보호하였다(대조군 대비 79.3%). 셋째, 10, 100 및 200 μg/mL의 하고초 추출물은 60 μM의 AAPH 및 10 μM의 Cu2+로 유도된 산화적 스트레스를 농도 의존적이 며 유의적으로 억제하였다. 이상의 연구결과는 하고초 추출 물이 항비만 및 산화적 스트레스 억제를 통한 기능성 소재 로서의 가능성을 보여주는 결과라 생각된다.