서 론
비만(obesity)은 건강에 위험을 초래할 수 있는 비정상적 이거나 과도한 지방의 축적을 의미하며 전세계적인 사회적 문제로 대두되고 있다(World Health Organization, 2024). 대한 비만학회에 따르면 비만의 기준은 세계보건기구의 아시아- 태평양 기준에 따라 체질량지수(body mass index, 체중[kg]/ 신장[m2])가 25 kg/m2 이상인 것으로 정의되며, 복부비만은 남자는 허리둘레 90 cm 이상, 여자는 85 cm 이상으로 정의 된다(KSSO, 2024). 최근10년 간(2011-2021년) 국내 30세 이 상 전체 비만 유병률은 약 4.7% 증가했으며, 30세 이상 여 성은 0.9% 증가로 비슷한 추이를 보였지만 30세 이상 남 성은 8.4% 증가하는 추이를 나타내어 비만 유병률이 꾸준 히 증가하고 있음을 알 수 있다(KOSIS, 2024). 비만은 제 2 형 당뇨병, 이상지질혈증, 인슐린 저항성, 대사증후군, 관상 동맥질환, 고혈압, 암 등과 같은 대사질환의 위험을 증가시 킨다(Kim et al., 2021a). 비만 치료의 기본은 식사, 운동 및 행동수정 요법이며 보조적 치료법인 약물요법은 처방 가능 한 약물이 매우 제한적이라는 점과 더불어 부작용과 비용 문제 등의 한계점이 존재한다. 현재 국내에서 약물요법에 사용가능한 4가지 비만치료제에는 올리스타트(orlistat), 펜터 민/토피라메이트(phentermine/topiramate), 날트렉손/부프로피 온(naltrexone/bupropion), 리라글루타이드(liraglutide)가 있다. 이 중 대표적으로 사용되는 치료제인 올리스타트와 펜터민 은 상당한 효능에도 불구하고 지방변, 설사 등의 위장관 부 작용 혹은 두통, 불면증 등의 부작용이 보고되고 있다(Kim, 2013;Kim et al., 2021c;Son, 2022). 이와 같은 비만 약제의 부작용 및 비용부담을 최소화하기위해 항비만 효능을 나타 내는 식물 및 천연 생리활성 물질 연구가 활발히 진행되고 있다.
지방 조직은 구조와 기능에 따라 나뉘며 대표적인 백색 지방(white adipose tissue)은 몸 전체의 항상성을 조절하고 중성지방(triglyceride, TG) 형태로 에너지를 저장하는 기능 을 한다. 반면, 갈색지방(brown adipose tissue)은 상대적으로 많은 미토콘드리아를 가지고 있어 열 발생을 통해 지질을 소비한다. 중성지방 분해로 생성된 유리 지방산은 thermogenin이라고도 알려진 uncoupling protein1 (UCP1)을 사용하여 열을 생성한다(Park et al., 2014;Pan et al., 2019). 베이지지방세포(beige adipocyte)는 설치류와 인간의 백색지방 조직 내에 존재하며, browning이라는 과정을 통해 백색지방세포 표현형에서 갈색지방세포 유사 표현형으로 전환될 수 있다. 활성화된 베이지지방세포는 기질산화 및 에너지 소비를 증가시켜 비만 및 다양한 대사질환의 치료 표적으로 주목받고 있다(Whitehead et al., 2021). 베이지지방(beige adipose tissue)은 추위에 노출되거나 아드레날린성 자극을 받으면 미토콘드리아 수가 증가하며 UCP1을 발현한다(Frank et al., 2018). 포유류에 존재하는 비떨림 열 발생 시스템(non-shivering thermogenesis)은 갈색지방에서 ATP 합성 대신 영양소를 산화시켜 열을 생성함으로써 에너지를 소비하는 과정이다(Brownstein et al., 2022). 즉, 갈색 및 베이지지방세포는 열을 생성하는 이화과정에 연료로 포도당, 지질, 기타 기질을 소비함으로써 신진대사를 조절하고 에너지 소비를 개선할 수 있다는 것이 밝혀져 대사건강의 핵심으로 확립되었다(Wolfrum & Gerhart-Hines, 2022;Zhu et al., 2024).
예덕나무(Mallotus japonicus)는 대극과 식물(Euphorbiaceae)에 속하는 식물로서 국내 산기슭 및 산골짜기에서도 자생하며, 잎 부위에는 rutin, isoprenoid 유도체 및 geraniin, mallotusinic acid, mallotinic acid 등의 천연 생리활성 성분이 다량 함유되어 있다. 특히 예덕나무의 잎, 뿌리, 껍질과 같은 조직은 위장 장애, 과민성 대장 증후군, 류머티즘, 당뇨병 및 신경통을 포함한 여러 질병을 치료하는 데 사용되어 생리활성이 검증된 바 있다(Park & Na, 2019;Choi et al., 2023). 로틀린(rottlerin)은 예덕나무의 열매를 덮고 있는 분비샘 털에 주로 존재하는 천연 식물성 폴리페놀로 protein kinase C-delta (PKC-δ)의 선택적 억제제로 작용한다. PKC-δ는 세포 내 여러 표적 단백질을 인산화 하는 능력에 기반하여 복잡한 생리학적 기능에 관여한다(Parihar et al., 2018). 이러한 특성에 따라 로틀린은 세포 신호 전달 경로에 중요한 역할을 하며 항암, 항산화 및 항염증 효과가 입증되었다(Yin et al., 2016;Lee et al., 2020) . 또한 로틀린은 AMP-activated protein kinase (AMPK) 신호전달경로 및 β-glucosidase의 활성화를 통해 세포 밖으로의 지질 유출을 촉진시킴으로써 지질 대사 조절 가능성이 입증된 바 있다(Molina et al., 2022). 이처럼 로틀린의 다양한 생리활성 효능에도 불구하고 로틀린의 지질 대사 조절 기능은 연구가 더 필요한 실정이며 특히 열 발생에 의한 체중조절 가능성에 대한 연구는 상대적으로 밝혀지지 않았다.
비만을 예방하기 위한 지질대사의 주요 조절자 중 low density lipoprotein related protein 6 (LRP6)는 포도당 및 지질 대사 신호 전달 경로와 밀접하게 관련되어 있으며 TG, LDL 및 VLDL 합성 및 분비에 중요한 역할을 하는 것으로 알려져 있다. 선행연구에 따르면 LRP6의 기능을 상실한 LRP6 유전자의 돌연변이는 대사질환의 임상적 증상인 혈중 LDL과 TG의 수치 상승을 비롯한 혈압, 공복 혈당 및 당뇨병 유병률을 높여 관상동맥 질환의 위험요인을 증가시켰다(Mani et al., 2007;Wang et al., 2018). 최근 연구에서 로틀린이 LRP6 수용체의 분해를 촉진하는 것으로 보고되었으나 이는 항암기전에 관한 연구(Lu et al., 2014)로 체중조절 효능과 관련된 갈색지방분화 및 열 발생에 상관관계에 대한 연구는 미비한 실정이다.
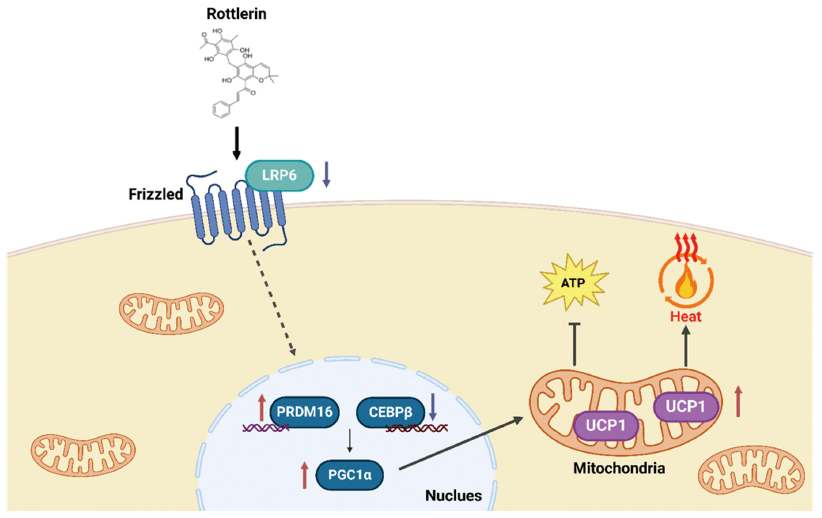
따라서 본 연구에서는 지질대사의 핵심인 LRP6 기능 억제를 중심으로 로틀린의 갈색지방분화 촉진 및 기질산화 증가에 따른 열 발생을 촉진 효과를 검증하였다. 이를 위해 분화 베이지지방세포 D16에 로틀린을 처리하여 non-shivering thermogenesis 관련 주요 단백질과 전사인자의 발현량 변화를 확인하고 로틀린 처리에 따른 LRP6 신호기전을 분석하였다.
재료 및 방법
본 실험에 사용된 로틀린(R5648)은 Sigma-Aldrich Co. (St. LOUIS, MO, USA)에서 구입하였다. 이후 100% dimethyl sulfoxide (DMSO; DAEJUNG, Seoul, Korea)에 용해시켜 20 mM의 stock solution으로 만들어 사용했다. 베이지지방세포 D16은 American type culture collection (ATCC, Manassas, VA, USA)에서 분양 받았다. Dulbecco’s modified eagle’s medium/nutrient mixture F-12 (DMEM/F12), phosphate-buffered saline (PBS), fetal bovine serum (FBS) 및 penicillin-streptomycin은 Welgene (Gyeongsan, Korea)에서 구입하였다. Insulin, 3-isobutyl-1-methylxanthine (IBMX), dexamethasone (DEX), 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide (MTT)는 Sigma-Aldrich Co. (St. Louis, MO, USA)에서 구입하였다. 사용한 1차 항체 UCP1 (PA1-24894), peroxisome proliferator-activated receptor gamma coactivator 1-alpha (PGC1α)(PA5-72948)는 Invitrogen (Thermo Fisher Scientific, Foster City, CA, USA)에서 구입하였다. PR domain containing 16 (PRDM16)(#5555)은 ProSci (Poway, CA, USA)에서, CCAAT/enhancer-binding protein alpha (C/EBPβ) (#3082), LDL receptor-related protein 6 (LRP6)(#3395), GAPDH (2118)는 Cell Signaling Technology (Danvers, MA, USA)에서 구입하였다. LRP6-pS1490 (SAB-5701936), β-actin (A5441)은 Sigma-Aldrich Co. (St. Louis, MO, USA)에서 구입하였다. 2차 항체는 HRP-conjugated goat anti-rabbit IgG와 HRP-conjugated goat anti-mouse IgG (Bio-Rad, Hercules, CA, USA)에서 구입하여 1차 항체에 따라 사용하였다.
베이지지방세포 D16은 10% FBS와 1%의 penicillin-streptomycin이 첨가된 DMEM/F12 배지를 이용하여, 5% CO2의 조성으로 이뤄진 37°C 세포배양기에서 배양하였다. 세포는 confluency가 70-80% 정도일 때 0.25% trypsin-EDTA solution으로 2-3일에 한 번씩 계대배양하였다. D16의 분화는 세포가 충분히 밀집되도록 배양시켜 confluent 상태가 된 후, 0.5 μM IBMX, 5 μM DEX, 0.5 μg/mL insulin, 1 μM rosiglitazone (Rosi), 1 nM 3,3′,5-triiodo-L-thyronine (T3), 10% FBS를 첨가한 배지에서 4일 동안 배양하였다. 이후 이틀 간격으로 0.5 μg/mL insulin, 1 nM T3, 10% FBS를 포함하는 배지로 교체하며 총 12일 동안 분화를 진행하였다. 분화된 D16 세포에 로틀린을 0, 5, 10, 20 μM로 48시간 동안 처리하였다.
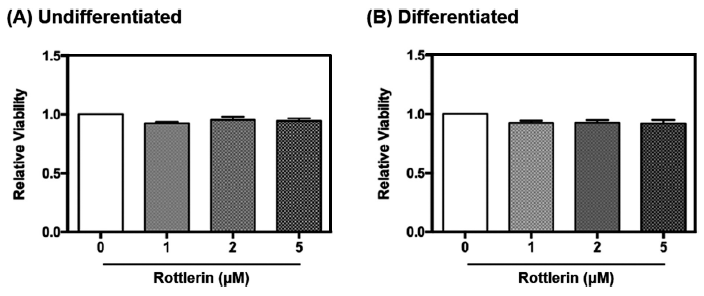
로틀린의 세포 독성은 MTT assay로 평가하였다. 베이지지방세포 D16을 96-well plate에 5.0 × 103로 배양한 후, 로틀린을 0, 5, 10, 20 μM 농도별로 처리하여 48시간 동안 배양하였다. 세포배양액에 20배 희석한 MTT 용액을 로틀린 처리가 끝난 세포에 처리하여 세포배양기에서 2시간 동안 배양하였다. 세포배양액을 제거한 후, MTT 용액에 의해 유래된 결정체인 formazan을 100% DMSO로 회수하여 분광 광도계(BioTek, Winooski, VT, USA)로 540 nm의 파장에서 흡광도를 측정하여 세포 생존율을 확인하였다. 또한 베이지지방세포 D16을 분화 시킨 후 로틀린을 농도별로 처리하여 위와 동일한 방법으로 세포 생존율을 측정하였다.
로틀린 처리가 끝난 D16 분화세포는 세포긁개를 이용하여 긁어내고, phosphatase inhibitor와 protease inhibitor (Cell Signaling Technology)가 첨가된 RIPA buffer를 넣고 bullet blender를 이용하여 세포를 분쇄하여 단백질을 추출하였다. 추출한 단백질은 Bradford 법으로 단백질 농도를 측정한 후, 2× laemmli sample loading buffer (Bio-Rad Laboratories, Hercules, CA, USA)와 혼합하였다. 준비된 시료는 10% acrylamide gel에서 SDS-PAGE 전기영동을 진행하고 총 단백질을 polyvinylidene fluoride (PVDF) 막으로 옮겼다. 막은 5% bovine serum albumin (BSA)으로 실온에서 50분 동안 blocking한 후 1차 항체를 4°C에서 18시간 처리하였다. 0.1% tris buffered saline with tween 20 (TBST)로 세척한 후 HRP-conjugated 2차 항체를 실온에서 1시간 처리하였다. 0.1% TBST로 세척한 후 화학 발광 시약인 Enhanced chemiluminescence (ECL)를 이용하여 ChemiDoc (Bio-Rad Lab., Hercules, CA, USA), Bio-Rad Image Lab software로 단백질의 양을 정량하였다. 실험에 사용된 항체는 UCP1, PGC1α, C/EBPβ, PRDM16, LRP6, LRP6-pS1490, β-actin, GAPDH이다.
결과 및 고찰
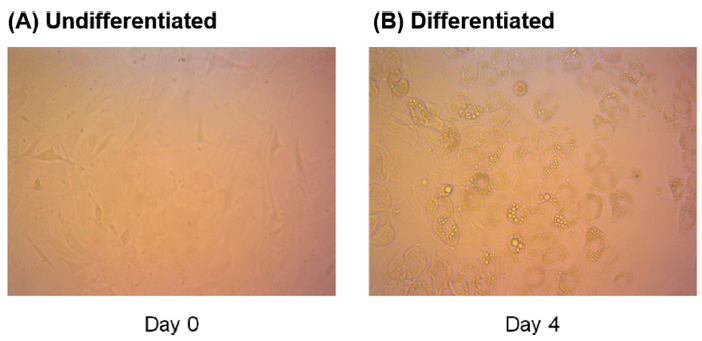
분화하지 않은 베이지지방세포와 함께 분화된 베이지지방세포의 세포독성을 측정하기 위해 세포의 confluency를 100%로 배양한 후, 4일이 지나 분화가 시작되면서 지방구가 생성되는 것을 육안상 확인하였으며(Fig. 1), 분화는 12일차에 종료하였다. 로틀린이 베이지지방세포 D16에 미치는 독성을 평가한 후, 처리 농도를 설정하기 위해 MTT assay를 진행하였다(Fig. 2). MTT assay는 in vitro 실험에서 세포 생존율을 평가하는데 사용되는 대표적인 실험 기법으로 tetrazolium salt MTT가 완전한 미토콘드리아와 세포막을 갖고 살아있는 세포와 반응하여 보라색 formazan 결정으로 환원된다. 보라색 formazan 결정체의 색에 따라 물질처리로 인한 세포사멸 후 남은 생존세포를 측정할 수 있다(Rai et al., 2018). 선행연구에 따르면, BeWO 세포에 로틀린을 48시간 동안 0.5, 1, 2, 5 μM 농도로 처리했을 때 대조군과 비교하여 세포 생존율의 차이가 관찰되지 않았다(Ietta et al., 2017). 이와 유사하게 본 연구에서 분화하지 않은 베이지지방세포와 분화가 완료된 베이지지방세포에 각각 로틀린을 0, 1, 2, 5 μM로 처리하였을 때, 각 처리군 사이의 세포생존율은 유의적인 차이가 나타나지 않았다. 이후 기질산화 정도를 측정하기 위한 실험에서 세포 독성시험 결과를 토대로 로틀린 처리 농도를 0, 1, 2, 5 μM로 설정하였다.
PGC1α는 미토콘드리아 및 에너지 대사와 관련된 저온 유도성 전사 보조 활성화제로 UCP1의 발현 유도와 갈색지방의 열 발생을 조절하는 PPARγ의 보조 활성화제로 알려져 있다(Boström et al., 2012). PGC1α의 억제제인 twist-related protein1 (Twist-1)의 과발현은 갈색지방에 더 많은 지질을 축적시키고, UCP1과 지방산 산화 유전자의 발현을 감소시켰다. 또, 고지방식이를 급여했을 때, Twist-1 과발현 마우스의 체온이 대조군 마우스보다 낮아 갈색지방의 지방연소 및 열 발생이 부족함을 시사하였다(Pan et al., 2009). 지방 조직 내 PGC1α에 특정 결실이 있는 마우스는 UCP1 발현이 감소하고 미토콘드리아 유전자의 전사물이 감소하여 피하 백색지방의 기초 미토콘드리아 및 열 발생 유전자 발현을 손상시킨 바 있다(Kleiner et al., 2012). 또한 PGC1α를 제거한 마우스를 단식시켰을 때, TG 합성이 비정상적으로 활성화되고 간 지방 생성 경로의 주요 단백질인 sterol regulatory element binding protein-1c (SREBP-1c) 및 stearoyl-CoA desaturase-1 (SCD1)을 코딩하는 유전자의 발현이 적절하게 하향 조절되지 않음이 발견되었다(Leone et al., 2005). 이처럼 PGC1α는 갈색지방의 미토콘드리아 내 열 발생을 촉진하고 지질 합성을 억제할 수 있어 지질대사의 주요한 조절 단백질이다. 분화시킨 베이지지방세포 D16에 로틀린을 0, 1, 2, 5 μM 농도로 처리한 결과, 로틀린 5 μM 처리에 따라 UCP1 조절인자인 PGC1α가 유의적으로 약 70% 증가함을 확인하였다(p<0.05)(Fig. 3A). 로틀린은 이러한 PGC1α의 발현량을 증가시켜 열 발생을 촉진함을 검증하였고, 이에 따라 PGC1α의 조절을 받는 열 발생 관련 단백질인 UCP1의 발현량을 측정하였다.
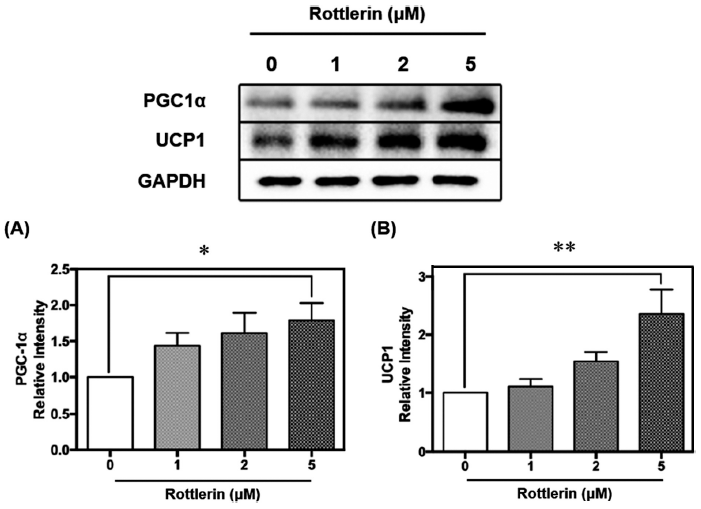
갈색지방 내 기질산화를 통한 열 발생은 UCP1에 의해 조절된다. UCP1은 기존의 양성자 기울기에 따른 ATP 합성 대신 기질을 산화시켜 열을 발생시키는 조절 단백질로 갈색지방 조직의 내부 미토콘드리아 막에 광범위하게 분포되어 있고 높은 에너지 소비 능력을 가지고 있다. UCP1은 생리학적 조건 하에서 비활성 상태를 유지하며, 퓨린 뉴클레오타이드에 의해 억제되기 때문에 자극을 받지 않으면 열을 생성하지 않는다(Park et al., 2014;Jagtap & Paul, 2023). 높은 수준의 전자 수송 사슬 복합체는 미토콘드리아 내부 막을 가로질러 양성자 기울기를 생성하고, UCP1은 미토콘드리아 막 외부에서 내부로 양성자의 누출을 촉진시켜 양성자 기울기를 감소시키고 ATP 합성 대신 열을 생성한다(Chang et al., 2018). 따라서 본 실험에서는 로틀린 처리에 따른 대표적인 열 발생 단백질인 UCP1 발현량을 측정하였다. 갈색지방세포에서 기질산화를 통한 열 발생에 관여하는 단백질인 UCP1이 농도 의존적으로 증가하는 경향을 나타냈다(Fig. 3B). 로틀린을 5 μM로 처리하였을 때, UCP1이 유의적으로 2배가량 증가하였다(p<0.01). 선행연구에 따르면, UCP1이 제거된 마우스의 미토콘드리아의 형태는 비정상적이며, 갈색지방 조직의 발열효과가 추위에 노출된 후에도 감소하 여 기질산화를 통한 열 발생에 UCP1이 필수적인 단백질임을 검증한 바 있다(Kazak et al., 2017). 또한 UCP1 결핍은 사타구니 백색지방 조직의 지방생성과 지방세포 증식을 촉진하며, 지방산의 불포화 증가 및 간 지질 축적을 증가시킨다(Bond & Ntambi, 2018). 결론적으로, 로틀린 처리에 따른 갈색지방화가 유도된 베이지지방세포 D16에서 기질산화를 통한 열 발생 관련 주요 단백질인 PGC1α와 UCP1이 유의적으로 증가하였다. 이후 주요 단백질 발현에 영향을 끼치는 전사인자의 발현량을 분석하였다.
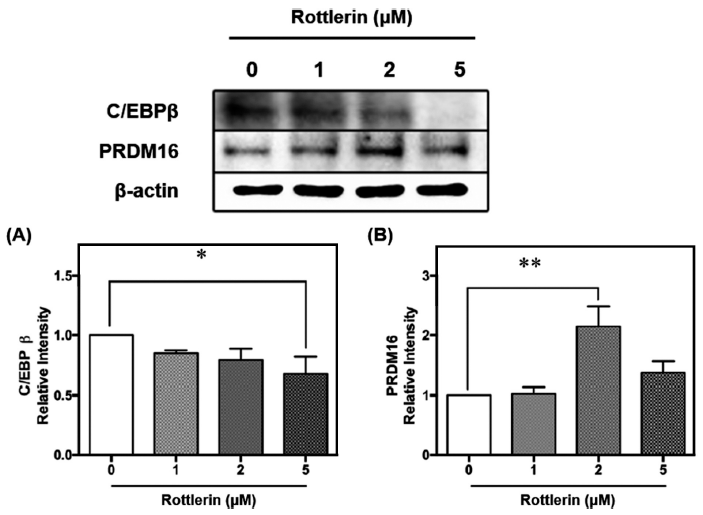
C/EBPβ는 지방세포 분화 초기에 발현되어 지방 형성을 조절하며, C/EBPα와 PPARγ의 유전자 발현을 유도하여 지방생성을 진행하는 데 관여하는 것으로 알려져 있다(Kim et al., 2016a). 지방세포 분화 초기에 C/EBPβ는 일시적으로 상승하여 PPARγ의 발현을 유도하고, PPARγ는 retinoid X receptor (RXR)와 heterodimer를 형성하며 C/EBPα를 포함한 지방분화와 관련된 하위 유전자의 전사 발현을 활성화한다(Rosen & MacDougald, 2006). C/EBPβ는 세라마이드에 의해 탈인산화 및 조기 핵 유출이 향상되고 C/EBPα 및 PPARγ 유전자 발현을 억제하여 지방생성을 억제할 수 있다(Sprott et al., 2002). 또한 C/EBPβ의 browning 관점에서 바라보면, C/EBPβ를 제거한 마우스의 부고환 백색지방 조직에서 wild type 마우스에 비해 PGC1α가 약 18배가 유의적으로 증가하였다(Rahman et al., 2012). 로틀린의 경우 미토콘드리아의 산화적 인산화를 분리함으로써 세포 ATP 수준의 용량 의존적 감소를 유발하고 인슐린 자극 포도당 수송에서도 용량 의존적으로 감소시킨 선행연구가 있다. 이는 로틀린이 미토콘드리아 uncoupler로 작용하는 능력과 관련이 있음을 시사한다(Kayali et al., 2002). 또한, 로틀린이 산화적 인산화를 분리하는 역할을 하여 호흡사슬을 방해할 수 있다는 것을 기반으로 진행한 연구에서 로틀린이 내부 미토콘드리아 막 전위를 소실시킴으로써 전자전달을 가속화하고 탈수소효소 활동, 산소 소비 및 NADH 산화를 증가시킴을 확인하였다(Maioli et al., 2009). 갈색지방화 초기 단계의 주요 전사인자인 PRDM16은 갈색지방세포의 발달을 조절하는 기능을 한다(Lee, 2012). 갈색지방 전구체에서 PRDM16이 손실되면 갈색지방 특성이 손실되고 근육분화가 촉진되기에 갈색지방의 열 발생 기능을 보존하기 위해서는 PRDM16의 발현이 필수적이다. PRDM16은 PPARγ에 결합함으로써 전사 기능이 활성화되고 갈색지방 생성을 자극하며 PRDM16이 결핍된 갈색지방에서는 비정상적인 형태, 열 발생 유전자 발현 감소 및 골격 근육 유전자(myod, myogenin, muscle creatine kinase, myf6)의 발현 증가를 나타낸다(Seale et al., 2008).
로틀린 처리에 따른 기질산화를 통한 열 발생 관련 조절 단백질 UCP1과 PGC1α 발현량의 증가를 바탕으로 이들을 조절하는 주요 전사인자인 C/EBPβ과 PRDM16의 발현량을 측정한 결과, C/EBPb는 농도 의존적으로 감소했으며 특히 5 μM에서 약 30% 유의적으로 감소하는 것으로 나타났으며(p<0.05)(Fig. 4A), PRDM16은 로틀린 2 μM에서 유의적으로 약 2배 증가하였다(p<0.01)(Fig. 4B). 선행연구에 따 르면, 고지방식이를 급여한 마우스에게 로틀린을 투여했을 때, 열 발생 관련 인자인 PRDM16, UCP1이 로틀린에 의해 자극되었다. 또한 RNA 서열분석 결과에서 로틀린이 백색지방 조직에서 베타 산화, 열 발생 및 갈색지방세포 분화를 상향 조절한다는 것이 밝혀졌다(Kim et al., 2021b). 따라서 본 연구에서는 선행연구와 유사하게 로틀린이 베이지지방세포 내에서 갈색지방화를 유도하였고 특히 주요 전사인자인 C/EBPβ의 감소, PRDM16의 증가와 함께 기능 단백질인 PGC1α과 UCP1을 증가시켜 기질산화를 통한 열 발생을 촉진시킴을 검증하였다.
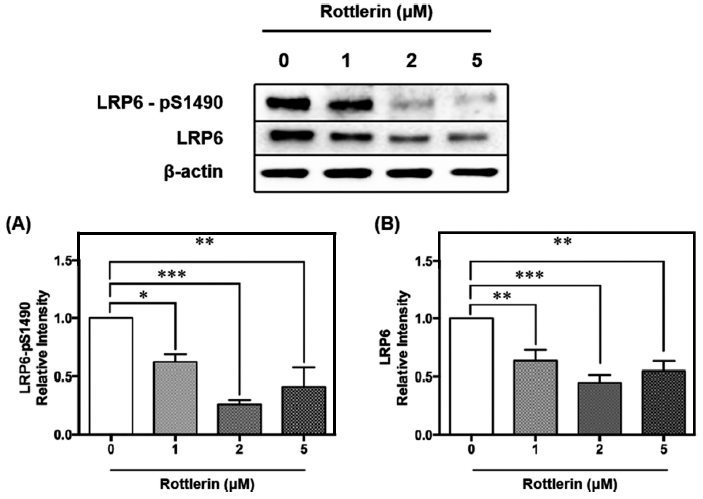
LRP6는 Wnt의 보조 수용체로, 지단백질 수용체 및 신호조절 물질 수용체로서 지질 항상성에 주요한 기능을 담당한다(Go & Mani, 2012). LRP6의 인산화는 원형질막의 Axin 복합체와의 상호작용에 필요하며, 이는 하위의 Wnt/β-catenin 신호전달의 활성화에 필요하다. 인산화된 LRP6는 Axin을 원형질막으로 모집하여 세포질 β-catenin을 안정화시키며, 축적된 세포질 β-catenin은 핵으로 이동하여 전사인자 T-cell factor/lymphoid enhancer factor 1 (TCF/LEF1)을 활성화하고 상황에 따라 세포 증식 및 세포 운명 결정 조절에 관여하는 표적 유전자의 발현을 유도한다(Kim et al., 2016b). 선행연구에 따르면, LRP6는 털과 흉선이 없는 마우스의 생체 내 종양 형성뿐만 아니라 시험관 내 세포 증식, 세포이동 및 침입을 향상시켜 LRP6의 과발현이 Wnt/β-catenin 신호전달의 과활성화에 기여한다고 보고되었다(Tung et al., 2012). LRP6의 유전자 돌연변이가 Low-density lipoprotein cholesterol (LDL-C) 상승에 영향을 미치며, 지질 대사의 잠재적인 분자 조절자임을 입증했다(Tomaszewski et al., 2009). LRP6의 돌연변이로 인한 기능억제에 관한 연구에서는 추가조사에 의해 LRP6 돌연변이가 Insulin-like growth factor 1 (IGF1), AKT, mTORC1, mTORC2의 Sp1 의존적 활성화에 의해 간 신생 지방 합성, 지질 및 콜레스테롤 생합성, apoB 분비를 유발한다고 밝혔다(Go et al., 2014). 또한 LRP6 hetero knockout (LRP6+/‑) 마우스는 대조군 대비 PGC1α 발현이 증가하였고, 복부 백색지방 조직의 UCP1이 유의하게 증가하였다(Liu et al., 2012). 이는 LRP6의 기능 억제가 미토콘드리아 생합성, 에너지 소모, 열 발생에 관여하는 단백질 발현과의 높은 연관성을 시사한다.
LRP6의 활성형에 따라 증가하는 β-catenin의 발현은 UCP1, PGC1α 뿐만 아니라 다른 발열성 및 미토콘드리아 관련 유전자의 mRNA 및 단백질 발현을 감소시키는 것으로 알려져 있다. UCP1 양성 지방세포에서 β-catenin을 제거하였을 때, 에너지 소비가 향상되어 체중이 감소하고 포도당 대사가 향상되었다(Chen et al., 2023). 이처럼 LRP6는 지질 항상성 뿐 아니라 기질산화를 통한 열 발생과 밀접한 관련이 있어 신호 기전을 분석하는 것이 중요하다. 선행연구에 따르면 로틀린은 LRP6의 프로테아좀 분해를 향상시켜 표준 Wnt/β-catenin 경로를 억제할 수 있기에 uncoupler로서 갈색지방 내 열 발생을 촉진할 가능성을 가지고 있다(Kim et al., 2023).
본 연구에서 LRP6와 활성형인 Serine-1490 인산화 형태의 LRP6 (LRP6-pS1490) 단백질 발현량을 분석한 결과, 활성형 LRP6-pS1490은 농도 의존적으로 감소하는 경향을 나타냈다(Fig. 5A). 특히 2 μM의 로틀린 처리에서 대조군 대비 약 80% 감소하였다(p<0.001). LRP6는 농도 의존적으로 감소하지는 않았지만 2 μM에서 약 60% 유의적으로 감소하였다(p<0.001)(Fig. 5B). 종합하면, 로틀린은 갈색지방화가 유도된 베이지지방세포 내에서 LRP6의 활성을 감소시킴으로써 갈색지방화의 주요 전사인자인 PRDM16의 발현량이 증가하였고 이에 따라 UCP1, PGC1α의 발현량을 유의적으로 증가시켜 기질산화에 따른 열 발생의 촉진 효능을 검증하였다. 즉, 로틀린은 비만을 예방하기 위한 체중조절 효능의 천연 생리활성 물질로서 가능성을 입증하였다.
요 약
본 연구는 베이지지방세포 D16를 이용하여 로틀린에 의한 갈색지방분화 촉진 및 기질산화로 인한 열 발생 효과를 검증하였다(Fig. 6). 베이지지방세포 D16에 로틀린을 0, 1, 2, 5 μM로 처리하고 세포독성, 열 발생을 통한 기질산화 관련 단백질, 전사인자의 발현량 변화를 분석하였다. 로틀린은 모든 농도에서 베이지지방세포 D16에 대해 세포독성을 나타내지 않았으며, 베이지지방세포 내 기질산화를 조절하는 UCP1, PGC1α의 단백질 발현량을 유의적으로 증가시켰다. 또한, 갈색지방으로의 분화 및 발달을 조절하는 PRDM16도 발현량이 유의적으로 증가하였으며, 지방 생성 및 PGC1α의 발현에 관여하는 C/EBPβ의 발현량은 감소했다. 이에 대한 상위 기전으로 LRP6 신호 경로를 측정한 결과, LRP6 발현량과 활성형 LRP6-pS1490의 발현량이 유의적으로 감소함을 입증하여 베이지지방세포 내 로틀린의 열 발생 촉진 기전을 밝혀냈다. 따라서 로틀린은 D16 세포주에서 갈색지방분화를 촉진하며 기질산화로 인한 열 발생을 증가시켰다고 판단되며 천연 생리활성 물질로서 체중조절 효능의 가능성이 입증되었다.