서 론
전 세계 경제가 지속해서 발전하며 영양적으로 우수 한 식품의 개발 및 수요공급이 원활해지고 공중보건과 의 료기술이 발전함에 따라 고령인구가 증가하면서 국가들 에 따라 차이는 있지만 전반적으로 고령화사회(총 인구의 7% 이상), 고령사회(총 인구의 14% 이상) 또는 초고령사회 (총 인구의 20% 이상)로 빠르게 진입하고 있다(Jang et al., 2021b). 우리나라의 고령화 현상은 전 세계적 고령화 추세 와 다르지 않아, 2022년 65세 이상 고령자 비율은 17.5%로 이미 고령사회로 진입하였고, 2025년에는 국내 총 인구의 약 20.6%가 65세 이상 고령자로 예측되어 초고령사회로 진 입할 것으로 전망된다(Statistics Korea, 2022). 고령자는 노 화로 인해 감각, 신경조절, 소화 및 운동 기관들의 기능이 저하되면서 성인병과 노인성질환에 노출되기 쉽다(Boo et al., 2020). 특히 치아 결손과 함께 소화 및 운동 기관들의 저하는 고령자가 식품의 저작 및 삼킴을 어렵게 노인성질 환의 발병 및 노화를 가속화시키는 결과를 초래하고 있다 (Boo et al., 2020;Jang et al., 2021b). 그래서 고령자들의 삶 의 질 향상을 위해 국가적 차원에서 다양한 지원책들을 수 립하여 추진하고 있으며, 식품산업계에서도 고령자를 위한 맞춤형 고령친화식품을 개발하여 지속해서 상업화하고 있 다(Boo et al., 2020;Jang et al., 2021b;Lee et al., 2020). 이 에 식품의약품안전처에서도 식품공전에 “고령자용으로 표 시하여 판매하는 식품(고령친화식품)”에 대한 정의와 기준 규격을 설정하여 등제하였고(MFDS, 2020), 국가기술표준 원에서는 고령친화식품의 물성적 및 영양학적 표준규격을 확립하여 국가표준으로 제시하고 있다(Korean Standards & Certification, 2022).
고령친화식품을 위해 국내에서는 저작장애 고령자를 위 한 식품의 질감을 약화시킨 연화식과 삼킴장애 고령자를 위한 식품의 유변학적 특성을 조절한 연하식과 연하보조제의 연구개발 및 산업화가 주를 이루고 있다(Lee, 2015;Lee et al., 2017;Park et al., 2019;Boo et al., 2020;Lee et al., 2020;Kim et al., 2022;Park, 2022;Park et al., 2022). 그러나 국내 고령친화식품의 기준규격에 영양 기준이 제시되고 있음에도(MFDS, 2020;Korean Standards & Certification, 2022) 고령친화식품의 영양학적 특성에 대한 연구는 시판 고령친화식품의 영양특성에 대한 실태조사 정도에 머무르고 있는 실정이다(Boo et al., 2020;Jang et al., 2021b;Lee, 2015;Lee et al., 2020;Park et al., 2019). 저작장애 및 삼킴장애 고령자들은 에너지 섭취율에 근거할 때, 단백질과 지질의 섭취가 부족한 것으로 조사되었다(Park et al., 2019;Boo et al., 2020). 이러한 단백영양 결손을 보완하기 위해 분쇄육가공품을 중심으로 효소처리 및 물리적 처리를 적용한 고령친화식품을 개발하여 산업화되고 있으나(Park et al., 2019;Lee et al., 2020), 분쇄육가공품 이외의 식품군에 대한 단백영양 강화에 대한 고려와 연구는 부족한 실정이다.
국내외 식물성 대체식품 산업의 성장과 함께 최근 고단백 식품에 대해 연령대와 관계없이 소비자들의 관심과 소비가 증가하고 있다(Lee et al., 2021). 특히 고령자들은 노화로 인한 근력 및 근육량이 감소하는 근감소증의 예방을 위해 분지아미노산이 다량 함유된 단백질 보충제나 단백질을 강화한 유동식 등에 대한 관심을 가지고 있다(Lee et al., 2020). 이런 근력 강화 및 근감소증을 예방할 수 있는 고단백 식품의 원료로 분지아미노산이 풍부하며 산업적으로 활용도가 높은 유단백(유청, 카제인염) 및 이의 가수분해물이 각광받고 있다(Kim, 2018). 그러나 유단백은 수급 및 가격 변동성이 높은 문제점을 가지고 있어, 최근 식품가공업체들은 유단백을 대체제로 식물성 단백질을 선호하고 있다(Kim, 2018). 국내 식품산업에서 대두유래 단백질(분리대두단백, 농축대두단백)이 증량제, 결착제, 단백영양 강화제, 겔화제 등의 목적으로 널리 활용되고 있다(Kim, 2018). 식물성 단백질에 대한 최근 관심으로 대두단백 이외에 쌀단백질 및 펄스류(pulses) 작물 유래 단백질(잠두단백, 완두단백, 병아리콩단백 등)의 활용이 시도되고 있다(Kalman, 2014;Berrazaga et al., 2019;Lee et al., 2021). 그러나 단백영양 측면에서 식물성 단백질은 유단백보다 필수아미노산 및 분지아미노산 함량이 여전히 부족하다. 또한 단백질 함량 및 영양 강화를 위해 식물성 단백질의 첨가는 식품 고유의 질감을 변형시키는 문제점을 나타낸다. 최근 연구에서 대두의 고초균 발효(Jang et al., 2021a)와 밀기울의 유산균 발효(Aung et al., 2022)를 통해 필수아미노산 및 분지아미노산 함량을 증가시킬 수 있음이 보고되었다.
그러므로 본 연구는 분지아미노산 함량이 상대적으로 풍부하다고 알려진 농축잠두단백과 병아리콩가루를 고초균으로 고상 발효하여 발효식물단백을 제조하고, 이의 단백영양 강화소재로의 이용가능성을 평가하기 위해 쌀가루에 첨가하여 쌀가루의 물리화학적 특성에 미치는 영향을 조사하였다.
재료 및 방법
농축잠두단백과 병아리콩가루는 ㈜에이치엔아이(Seongnam, Korea)에서 구매하였다. 농축잠두단백은 기류분급법(air classification)을 이용하여 잠두분말로부터 단백질이 풍부한 분획을 회수하여 제조한 것이었다. 쌀가루는 추청 품종의 멥쌀을 파주시농협쌀조합공동사업법인(Paju, Korea)에서 구매하여 Kim et al. (2019)의 습식 제분법에 따라 제조하였다. 분지아미노산을 포함하는 필수아미노산을 종 평균보다 높은 수준으로 생성하는 고초균(Bacillus subtilis SRCM 100333) (Kim, 2022)을 (재)발효미생물산업진흥원(Sunchang, Jeollabuk, Korea)에서 공급받아 사용하였다. 발효식물단백 및 쌀가루-발효식물단백 혼합물의 물리화학적 특성 분석을 위해 사용한 용매와 시약은 최소 ACS 등급의 것을 사용하였다.
고초균은 Difco tryptic soy agar (TSA, BD Diagnostic Systems, Sparks, MD, USA)를 이용하여 37°C에서 18 h 이상 배양하고, 1 colony를 Difco tryptic soy broth (TSB, BD Diagnostic Systems, Sparks, MD, USA)에 접종하여 vortexing하고 37°C에서 12 h 이상 배양하였다. 계대배양을 위해 신선한 TSB에 배양액을 1% (v/v)가 되도록 가하고 37°C에서 O.D.가 0.7-0.8이 되도록 배양하여(6-8 h) 고초균 배양액을 제조하였다.
고상 발효를 위한 용기는 열탕 소독 후 30°C에서 건조하였고, 식물단백(농축잠두단백과 병아리콩가루)는 진공포장하여 121°C에서 15분간 autoclave하고, 탈이온수는 끓인 후 밀봉하여 상온으로 식혀 사용하였다. 농축잠두단백(200 g), 고초균 배양액(40 mL)와 탈이온수(80 mL)를, 병아리콩가루(200 g), 고초균 배양액(40 mL)과 탈이온수(160 mL)를 각각 반죽 볼에 넣고 beater가 장착한 키친에이드반죽기(5K5SS, KitchenAid Commercial, Seoul, Korea)를 이용하여 저속(setting 3)에서 농축잠두단백과 병아리콩가루가 쌀 낱알과 대두 낱알 사이의 크기로 응집될 때까지 반죽하였다. 형성된 응집물은 스테인리스강 용기에 넣고 밀봉하여 37°C에서 10일간 발효하였다. 발효 종료 후 80°C에서 6시간 동안 1차 건조한 다음, 50°C에서 48시간 건조하였고, 건조된 발효산물은 분쇄하여 60 mesh 표준체를 통과시켜 발효농축잠두단백(FMFP)과 발효병아리콩가루(FMCF)를 제조하였다. 대조 군은 발효하지 않은 농축잠두단백(UTFP)과 병아리콩가루(UTCF)로 하였다. FMFP와 FMCF의 수율은 각각 발효 전후의 농축잠두단백과 병아리콩가루의 건조중량의 백분 비율로 하였다.
쌀가루의 건조 중량 대비 10%와 20%의 식물단백을 각각 쌀가루에 첨가하여 60 mesh 표준체를 5회 반복하여 통과시켜 쌀가루-식물단백 혼합물을 제조하였다.
쌀가루, 식물단백 및 발효식물단백의 수분 함량은 105°C에서 상압가열건조법을, 조단백질 함량은 Kjeldahl 질소 정량법(%N 6.25)을, 조지방 함량은 Soxhlet법을, 조회분 함량은 건식회화법을 이용하여 분석하였고, 총 탄수화물 함량은 100에서 건물기준의 조단백질, 조지방과 조회분 함량의 총합(dry weight basis 또는 d.b)을 차감하여 계산하였다(AOAC, 2000). 총 전분 함량은 total starch assay kit (Megazyme Int., Wicklow, Ireland)를 이용하여 정량하였고(AACC, 2000), 비전분성 탄수화물고분자 함량은 총 탄수화물 함량에서 총 전분 함량을 차감하여 결정하였다. 환원당 함량은 dinitrosalicylic acid (DNS) 정량법을 이용하여 분석하였다. 구성아미노산 및 유리아미노산 조성은 high performance liquid chromatography (HPLC)를 이용하여 서울대학교 농생명과학공동기기원(NICEM, https://nicem.snu.ac.kr)에서 분석하였고, 대조군(발효하지 않은 식물단백)과 발효식물단백의 조단백질 함량을 고려한 건조 중량에 대한 아미노산 함량의 백분비율로 나타내었다. 또한 발효식물단백의 냉수가용성 단백질 함량을 위해 발효식물단백(1 g, d.b)을 탈이온수(40 mL)와 혼합하여 상온에서 30분간 교반하고 원심분리(2,500×g, 20 min)하여 상층액을 100 mL 정용플라스크로 옮기고 탈이온수를 가하여 100 mL로 정용하였다. 상층액 내 단백질 농도는 Bradford 법을 이용하여 측정하였고, 다음의 계산식에 따라 냉수가용성 단백질 함량을 결정하였다.
쌀가루, 식물단백(무발효 및 발효) 및 쌀가루-식물단백 혼합물 각각을 0.5 g (d.b)씩 50 mL 원심분리관에 넣고 탈이온수 25 mL를 가하여 혼합하고 95°C의 항온수욕조에 30분간 가열하였다. 30분 가열하는 동안 최초 5분은 1분 간격으로, 이후에는 5분 간격으로 vortexing하였다. 가열을 종료한 후 상온에서 20분간 냉각하고 원심분리(2,500×g, 20 min)하여 상층액과 침전물로 분리하였다. 침전물은 무게를 측정하였고, 상층액은 100 mL 정용플라스크로 옮겨 탈이온수를 가하여 정용하였다. 희석된 상층액을 교반하며 일정량(5 mL)를 취하여 105°C에서 건조하여 항량을 측정하고, 희석된 상층액의 가용성 고형물 농도를 결정하였다. 또한 희석된 상층액 내의 총 당은 sulfuric acid-phenol 법을 이용하여 정량하였다. 팽윤력과 용해도(가용성 고형물 기준)는 다음의 계산식에 따라 계산하였다.
쌀가루, 식물단백(무발효 및 발효) 및 쌀가루-식물단백 혼합물의 호화특성은 DSC (DSC 4000, PerkinElmer Inc., Waltham, MA, USA)를 이용하여 분석하였다. 쌀가루와 식물단백(무발효 및 발효) 각각을 1 g (d.b)씩 eppendorf 튜브(5 mL)에 넣고 탈이온수를 가하여 총 무게를 4 g으로 하였고, vortexing하여 혼합하고 상온에서 3시간 동안 방치하였다. 쌀가루-식물단백 혼합물을 위해, 쌀가루 1 g (d.b)을 eppendorf 튜브(5 mL)에 넣고, 식물단백을 각각 0.1 g (d.b, 쌀가루 건조 중량 대비 10%)과 0.2 g (d.b, 쌀가루 건조 중량 대비 20%)을 넣은 후 탈이온수를 가하여 총 무게 4 g으로 하고, vortexing 하여 상온에서 3시간 동안 방치하였다. 수화된 시료 20 mg을 스테인리스강 팬에 넣고 기계적으로 밀봉한 후 DSC를 이용하여 5°C/min의 가열속도로 25°C에서 100°C까지 가열하여 endothermic thermogram을 얻었다. 대조군은 빈 팬을 이용하였다. Endothermic thermogram으로부터 호화개시온도(To), 호화최고온도(Tp), 호화종결온도(Te)와 호화엔틸피(ΔH)를 결정하였다.
식물단백(무발효 및 발효)의 온도에 따른 유변학적 특성은 plate geometry (지름 20 mm)가 장착된 동적점탄성계(DHR1, TA Instruments, New Castle, DE, USA)를 이용하여 측정하였다. Peltier plate와 geometry 사이의 간격은 1 mm이었고, 분석 중 수분의 손실은 solvent trap module을 이용하여 제어하였다. 식물단백은 탈이온수와 혼합하여 총 고형분 함량 20%의 식물단백 현탁액을 제조하고 일정량을 Peltier plate에 올려 25°C에서 5분간 conditioning한 후 1 Hz와 1% strain (선형점탄성 영역 내에서 결정됨)에서 2°C/min의 가열속도로 25°C에서 95°C까지 온도를 상승하며 temperature sweep test하고, 95°C에서 5분간 time sweep test한 후 2°C/min 의 냉각속도로 95°C에서 25°C까지 temperature sweep test를 하였다.
쌀가루, 식물단백(무발효 및 발효) 및 쌀가루-식물단백 혼합물의 페이스팅 점도 특성은 신속점도분석기(RVA-3D, Newport Scientific, Warriewood, Australia)를 이용하여 측정하였다. 쌀가루와 식물단백은 각각 2 g (d.b)을 알루미늄 시료 컵에 넣고 총 무게가 28 g이 되도록 탈이온수를 가하였다. 쌀가루-식물단백 혼합물은 알루미늄 시료 컵에 쌀가루 2 g (d.b)을 넣은 후 식물단백을 각각 0.2 g (d.b, 쌀가루 건조 중량 대비 10%)과 0.4 g (d.b, 쌀가루 건조 중량 대비 20%)을 넣고 총 무게가 28 g이 되도록 탈이온수를 가하였다. 제조된 혼합물은 spatula를 이용하여 혼합하고 플리스틱 회전축을 이용하여 30초간 분산시켜 신속점도분석기에 장착하여 미리 결정된 온도프로파일에 따라 분석하였다. 플라스틱 회전축은 측정하는 동안 160 rpm으로 일정하게 유지하였다. 온도프로파일은 50°C에서 2분간 유지하고 가열속도 12°C/min으로 95°C까지 가열한 후 95°C에서 2분 30초간 유지하고 냉각속도 12°C/min으로 50°C까지 냉각하여 50°C에서 2분간 유지하는 것이었다.
결과 및 고찰
본 연구의 원료로 사용한 쌀가루(RF), 농축잠두단백(UTFP)과 병아리콩가루(UTCF)의 화학적 조성을 Table 1에 나타내었다. RF의 건조중량 대비 조단백질, 조지방, 조회분, 총 탄수화물, 총 전분 및 비전분성 탄수화물고분자 함량은 각각 7.7%, 1.0%, 0.7, 90.6%, 89.6%와 1.1%이었고, Han et al. (2012)이 보고한 멥쌀로부터 습식제분하여 제조한 쌀가의 화학적 조성과 유사하였다. UTFP와 UTCF의 조단백질 함량은 각각 57.3%와 21.7%, 조지방 함량은 각각 3.2%와 6.6%, 조회분 함량은 각각 5.9%와 2.6%, 총 탄수화물 함량은 각각 33.6%와 69.1%, 총 전분 함량은 각각 13.4%와 52.4%, 비전분성 탄수화물 함량은 각각 20.2%와 16.8%이었다. 이러한 결과는 문헌상에 보고된 기류분급법에 따른 농축잠두단백(Felix et al., 2018)과 병아리콩가루(Kaur & Singh, 2005)의 화학적 조성과 유사하였다.
고초균을 이용하여 농축잠두단백과 병아리콩가루를 고상발효하여 제조한 발효식물단백의 수율과 화학적 조성을 Table 2에 제시하였다. 발효농축잠두단백(FMFP)과 발효병아리콩가루(FMCF)의 수율은 초기 투입한 UTFP와 UTCF의 건조중량 대비 각각 89.4%와 92.0%이었다. 초기 투입량 보다 회수된 FMFP와 FMCF의 건조중량이 적은 것은 UTFP와 UTCF의 일부가 고초균의 생육을 위해 질소원과 탄소 원으로 이용되었기 때문으로 생각된다. 냉수가용성 단백질 함량에 있어, FMFP가 4.3%로 UTFP (7.6%)보다 낮았고, FMCF는 1.5%로 UTCF (0.5%)보다 높으나 차이가 미미하였다. FMFP가 UTFP보다 냉수가용성 단백질 함량이 낮은 것은 고초균이 생육하며 배출하는 단배질분해효소(Kim, 2022)에 의해 UTFP의 단백질이 부분적으로 가수분해 되며 소수성 아미노산이 외부로 노출된 결과인 것 같다. 환원당 함량은 FMFP와 FMCF가 각각 7.7%와 10.5%로 UTFP (5.3%)와 UTCF (5.1%)보다 높았다(Table 2). 이 결과는 고초균이 생육하며 배출하는 탄수화물 가수분해효소들(amylase 및 cellulase)에 의해 UTFP와 UTCF의 전분 및 비전분성 탄수화물고분자가 가수분해 되었기 때문으로 생각된다(Lee & Kim, 2017). 총 전분 함량은 FMFP와 FMCF가 각각 12.0%와 21.4%이었고(Table 2), 이들의 원료인 UTFP (13.4%)와 UTCF (52.4%)보다 낮았다(Table 1). 이러한 현상은 FMFP와 FMCF의 높은 환원당 함량이 뒷받침하는 것처럼 고초균이 생육하며 배출한 amylase가 UTFP와 UTCF의 전분을 가수분해하여 탄소원으로 이용하였기 때문으로 판단된다. 조단백질 함량은 FMFP와 FMCF가 각각 69.3%와 68.9%를 나타내었으며(Table 2), 이들의 원료인 UTFP (57.3%)와 UTCF (21.7%)보다 높았다(Table 1). 이처럼 고초균 발효 후 조단백질 함량이 증가하는 것은 전술한 것처럼 전분과 비전분성 탄수화물고분자가 고초균의 탄소원으로 소비되며 상대적으로 조단백질 함량이 증가하였을 뿐만 아니라 고초균의 증식에 따른 고초균 자체의 단백질 함량과 고초균의 단백질 대사에 따라 아미노산들의 생성(Jang et al., 2021a)도 일조한 것으로 생각된다.
Mean value of three replicate measurements; values sharing the lowercase letters within columns are not significantly different at p<0.05.
무발효 식물단백(UTFP 및 UTCF)과 발효식물단백(FMFP 및 FMCF)의 구성 및 유리 아미노산 조성을 Table 3과 4에 나타내었다. 무발효 식물단백과 발효식물단백 소재가 실제 함유하고 있는 아미노산 함량을 결정하기 위해 무발효 식물단백과 발효식물단백 각각의 조단백질 함량을 고려한 무발효 식물단백과 발효식물단백 건물기준으로 환산하여 제시하였다. 구성아미노산 함량에 있어, UTFP와 UTCF의 모 든 아미노산은 고초균 발효에 따른 FMFP와 FMCF에서 증가하였다(Table 3 & 4). UTFP보다 FMFP의 총 아미노산 함량, 필수아미노산 함량과 분지아미노산 함량은 각각 1.3배씩 증가하였다. UTCF보다 FMCF의 총 아미노산 함량은 3.2배, 필수아미노산 함량은 3.3배, 분지아미노산 함량은 3.3배 증가하였다. 유리아미노산 함량에 있어, FMFP의 aspartic acid, arginine, asparagine과 tryptophan은 UTFP의 것보다 감소하였으나 나머지는 증가하였고, FMCF는 arginine을 제외하고 모든 아미노산에서 증가하였다. UTFP와 UTCF보다 FMFP와 FMCF의 총 아미노산 함량은 각각 1.2배와 12.3배, 필수아미노산 함량은 각각 8.4배와 51.5배, 분지아미노산은 각각 18.5배와 241.5배 증가하였다. 이러한 결과는 고초균 발효를 통해 FMFP와 FMCF의 조단백질 함량이 UTFP와 UTCF보다 각각 1.2배와 3.2배 증가하였기(Table 1 & 2) 때문으로 생각된다. 그럼에도 FMFP와 FMCF의 필수아미노산과 분지아미노산의 증가율은 이들의 조단백질의 증가율을 초과하였고, 이는 구성아미노산보다 유리아미노산에서 더욱 두드러졌다. 이러한 현상은 고초균의 아미노산 대사과정에서 필수아미노산과 분지아미노산이 생성되었기 때문으로 생각된다(Jang et al., 2021a).
쌀가루(RF), 무발효 식물단백(UTFP 및 UTCF), 발효식물단백(FMFP 및 FMCF)과 RF-식물단백 혼합물의 팽윤력을 Table 5에 제시하였다. RF, 무발효 식물단백 및 발효식물단백의 팽윤력은 RF가 11.7 g/g, UTFP가 6.2 g/g, FMFP가 7.1 g/g, UTCF가 7.3 g/g, FMCF가 7.7 g/g 이었다. 무발효 식물단백(UTCF 및 UTCF)보다 발효식물단백(FMFP 및 FMCF)의 팽윤력이 소폭 높았으나 통계적으로 유의적 차이는 없었다. 본 연구의 모든 시료는 팽윤에 주로 이바지하는 전분을 함유하고 있고(Table 1 & Table 2), 이러한 전분은 단백질로 둘러싸여 있다. 농축잠두단백과 병아리콩가루의 단백질은 80-85°C에서 겔화가 진행되는 열 겔화(thermogelling) 단백질로 알려져 있다(Papalamprou et al., 2009;Nivala et al., 2021). 팽윤력 측정을 위해 무발효 및 발효 식물단백-물 현탁액을 95°C에서 가열하는 동안 농축잠두단백과 병아리콩가루의 단백질은 이미 겔화가 진행 중이거나 겔을 형성하고 있어 전분의 팽윤을 억제할 것이며, 전분보다 보수력이 높은 단 백질과 비전분성 탄수화물고분자가 무발효 및 발효 식물단백에 풍부하여(Table 1 & Table 2) 전분의 수화와 팽윤에 이용할 물을 제한되었을 것으로 생각된다(Bae et al., 2020). 또한 본 연구에서 팽윤력 측정을 위해 적용된 원심분리 조건에서 쌀가루와 식물단백(무발효 및 발효) 페이스트의 침전물과 상층액은 명확히 분리되었다. 그러나 쌀가루에서는 투명한 상층액을 얻을 수 있었지만, 무발효 및 발효 식물단백에서는 미세입자들이 분산된 것처럼 보이는 불투명한 상층액을 얻었다. 따라서 이러한 현상이 복합적으로 작용하여 무발효 및 발효 식물단백의 팽윤력이 쌀가루보다 낮은 것으로 판단된다. 한편 RF-식물단백 혼합물의 팽윤력에 관하여, 농축잠두단백(UTFP 및 FMFP) 첨가 혼합물은 농축잠두단백 첨가량이 증가하며 팽윤력이 증가하였다(Table 5). 그러나 RF에 농축잠두단백의 첨가로 팽윤력 측정을 위한 현탁액의 총 고형분 함량이 증가하였음에도 RF-농축잠두단백 혼합물의 팽윤력은 RF와 비교해 통계적으로 유사하거나(UTFP 20% 첨가군) 낮은 수준을 나타내었다. 이것은 RF-농축잠두단백 혼합물에 있어 보수력이 높은 단백질과 비전분성 탄수화물고분자의 함량이 RF보다 상대적으로 높아져 혼합물의 전분이 팽윤에 이용할 수 있는 물이 상대적으로 적어졌기 때문으로 생각된다(Bae et al., 2020). 반면에 RF-병아리콩가루(UTCF 및 FMCF) 혼합물은 RF보다 높은 팽윤력을 나타내었으며, 병아리콩가루 첨가량이 증가하며 팽윤력이 증가하였다. 이와 같은 결과는 냉수가용성 단백질 함량이 매우 적어(Table 2) RF 과립의 팽윤 억제에 기여를 못 하면서 병아리콩가루 유래 전분이 혼합물의 팽윤에 이바지한 것으로 생각된다. 게다가 UTCF보다 FMCF를 첨가한 혼합물이 첨가율 내에서 낮은 팽윤력을 나타내었는데, 이는 UTCF보다 FMCF의 전분 함량이 적기 때문으로 생각된다.
쌀가루(RF), 무발효 식물단백(UTFP 및 UTCF), 발효식물단백(FMFP 및 FMCF)과 RF-식물단백 혼합물의 용해도를 Table 5에 제시하였다. 용해도는 팽윤력 분석 시 회수한 상층액의 총 고형분과 총 당 함량으로 나타내었다. RF의 총 고형분 및 총당 기준 용해도는 각각 10.7%와 10.3%이었고, 이는 RF의 용해도는 주로 쌀전분에서 유래되었음을 가리킨다. 무발효 및 발효 식물단백의 총 고형분 기준 용해도는 RF보다 약 3.0-4.8배 높았고, UTFP와 UTCF는 각각 FMFP와 FMCF보다 높은 수준을 나타내었다. 이들의 총당 기준 용해도는 총 고형분 기준보다 낮은 수준이었는데, 이것은 식물단백의 용해도는 주로 가용성 단백질 및 겔화된 단백질 미세입자 때문이라는 것을 암시한다. 그래서 팽윤력 분석에서 관찰된 미세입자가 분산된 것 같은 불투명한 상층액은 식물단백 유래 단백질들 때문으로 생각된다. 또한 발효 식물단백의 용해도가 무발효 식물단백의 것보다 낮은 것은 전술한 것처럼 고초균이 배출한 단백질분해효소에 의해 단백질의 부분적 가수분해로 소수성 아미노산들이 외부로 노출된 결과로 판단된다. 한편 RF-식물단백 혼합물에 있어, UTFP와 UTCF를 10% 첨가한 혼합물의 총당 기준 용해도는 RF보다 낮았는데, 이는 이들의 낮은 팽윤력 때문인 것 같다. 그렇지만 이들의 총 고형분 기준 용해도는 RF의 것과 통계적으로 유사하였데, 이것은 UTFP와 UTCF 유래 가용성 단백질 때문으로 생각된다. 그러나 UTFP와 UTCF를 20% 첨가한 혼합물은 RF보다 높은 총 고형분 및 총당 기준 용해도를 나타내었는데, 이는 UTFP와 UTCF 첨가량이 증가하며 가용성 단백질과 비전분성 탄수화물고분자 함량이 상대적으로 풍부해졌기 때문이다. 게다가 10% 첨가군에서 관찰된 총당 기준 용해도가 총 고형분 기준 것보다 낮은 현상과 같았다. 반면에 UTCF와 FMCF의 모든 첨가군은 RF보다 총 고형분 및 총당 기준 용해도가 높았고, 총 고형분 기준 용해도와 총당 기준 용해도는 유사하였다. 이들의 용해도는 주로 전분 과립에서 용출된 전분 분자와 UTCF와 FMCF의 비전분성 탄수화물고분자 또는 환원당이 책임진다는 것을 가리키며, 팽윤력에서 설명한 것처럼 병아리콩가루 단백질은 용해되지 않고 불용성 겔을 형성한 것으로 생각된다. 또한 UTCF와 FMCF의 첨가량이 증가하며 팽윤력이 증가하였음에도 총 고형분 및 총당 기준 용해도가 소폭 감소하였는데, 이는 아마도 병아리콩가루 단백질이 겔화되며 병아리콩가루의 팽윤된 전분과립에서 전분 분자의 용출을 부분적으로 억제하였기 때문인 것 같다.
쌀가루(RF)와 RF-식물단백 혼합물의 호화특성을 Table 6에 제시하였다. RF의 호화개시온도는 52.2°C, 호화최고온도는 65.6°C와 호화종결온도 73.3°C는 이었다. RF-식물단백 혼합물의 호화개시온도는 55.5-57.9°C, 호화최고온도는 67.3-68.3°C와 호화종결온도는 74.5-76.9°C의 범위에 있었다. RF-식물단백 혼합물의 호화온도는 식물단백의 종류, 발효 여부 및 첨가량에 따른 통계적 유의성은 발견되지 않았지만, 전체적으로 RF보다 높았다. 한편 호화엔탈피는 RF가 11.3 J/g이었고, RF-식물단백 혼합물은 7.3-8.3 J/g의 범위에 있었다. RF-식물단백 혼합물의 호화엔탈피는 RF보다 유의적을 낮았으나, 식물단백의 종류, 발효 여부 및 첨가량에 따른 통계적 유의성은 없었다. 이처럼 RF보다 RF-식물단백 혼합물의 높은 호화온도와 낮은 호화엔탈피는 RF에 식물단백을 첨가하며 RF의 쌀전분보다 보수력이 큰 단백질과 비전분성 탄수화물고분자 함량이 증가하며, 쌀전분의 호화에 필요한 물의 이용을 제한한 결과이다(Bae et al., 2020).
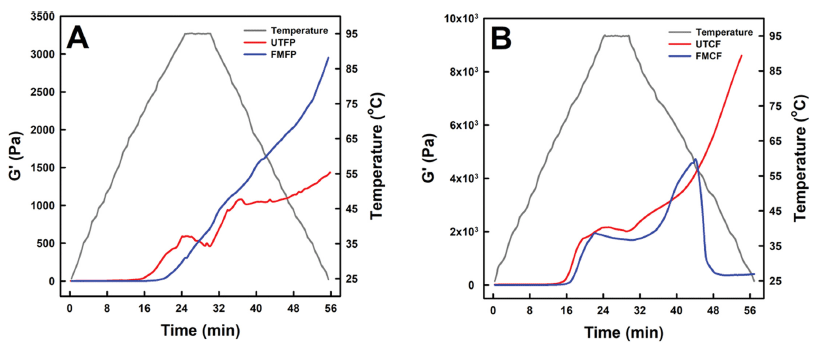
무발효(UTFP 및 UTCF) 및 발효(FMFP 및 FMCF) 식물단백의 온도 변화에 따른 탄성계수의 변화를 Fig. 1에 제시하였다. 농축잠두단백과 관련하여(Fig. 1A), UTFP의 탄성계수(storage modulus)는 69°C 근처에서 상승하기 시작하여 95°C (약 25분경)에서 1차 peak를 형성한 후 95°C 유지영역 마지막까지(약 29분경) 소폭 감소하고, 95°C에서 60°C까지 다시 급격히 증가한 다음 25°C까지 지속해서 완만히 증가하는 양상을 나타내었다. 이러한 탄성계수의 변화양상은 UTFP의 전분의 팽윤과 단백질의 열 겔화 때문으로 판단되며, 특히 95°C 유지영역에서 탄성계수의 일시적 감소는 UTFP 내 팽윤된 전분 과립의 붕괴로 인한 것으로 생각된다(Nivala et al., 2021). UTFP와는 달리 FMFP의 탄성계수는 77-79°C 근처에서 상승하기 시작하여 95°C까지 상승하여 95°C에서 유지한 후 25°C에 도달할 때까지 지속해서 상승하였고, 25°C의 최종 탄성계수(2,954.4 Pa)는 UTFP (1,435.8 Pa)보다 월등히 높은 수준을 나타내었다. 이는 UTFP의 고초균 발효를 통해 FMFP의 낮은 전분 함량과 높은 단백질 함량 때문이며(Table 2), 농축잠두단백의 열 겔화는 전분보다 단백질에 의한 영향이 더욱 큰 것으로 생각된다(Nivala et al., 2021). 한편 병아리콩가루와 관련하여(Fig. 1B), UTCF의 탄성계수는 61°C부터 95°C (약 25분)까지 급격히 상승하여 95°C 유지영역에서 소폭 감소한 후 25°C까지 낮아지며 매우 급격히 상승하였다. 이러한 양상은 병아리콩가루의 주성분인 전 분의 팽윤과 열 겔화 단백질이 팽윤된 전분 과립의 붕괴를 최소화하였기 때문으로 생각된다(Papalamprou et al., 2009). 반면 FMCF의 탄성계수는 63°C에서 91°C까지 급격히 증가한 후 95°C 유지영역을 거처 88°C까지 냉각되며 서서히 감소하였고, 이후 56°C까지 냉각되며 다시 급격한 증가를 나타내었다. 56°C 이후에는 FMCF의 탄성계수가 47°C까지 급락한 다음 25°C까지 큰 변화 없이 일정한 수준을 유지하였다. FMCF의 탄성계수가 급락한 현상은 형성되었던 단백질-전분 복합 겔 구조가 연속적인 oscillation에 의해 붕괴하였기 때문이다. 이것은 고초균 발효 시 배출되는 amylase와 protease에 의해 병아리콩가루의 전분과 단백질의 구조가 손상되었음을 가리키며, 이러한 설명은 UTCF보다 FMCF의 낮은 전분 함량(Table 2)과 감소한 용해도(Table 5)에 의해 설명된다. 결과적으로 FMCF는 안정한 겔 구조를 형성하지 못하는 것으로 판단된다.
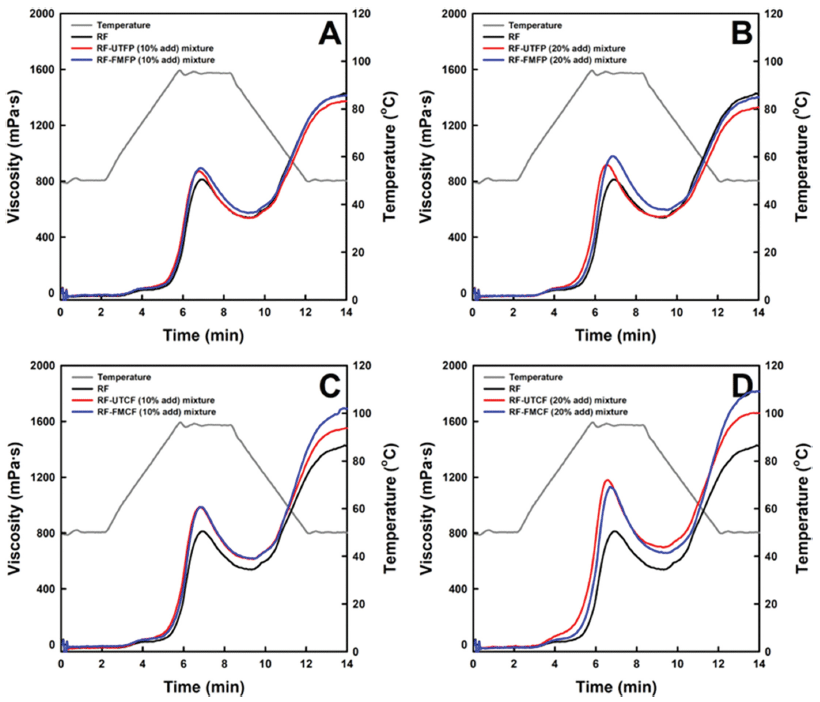
쌀가루(RF)와 RF-식물단백 혼합물의 페이스팅 점도 프로파일과 점도 특성을 각각 Fig. 2와 Table 7에 나타내었다. RF의 페이스팅 점도 프로파일은 문헌상에서 보고된 것과 유사하였다(Bae et al., 2020). UTFP와 FMFP를 RF의 건조중량 대비 10% 첨가하였을 때, 페이스팅 점도 프로파일은 RF의 것과 같은 양상을 보였으나(Fig. 2A), 최고점도(peak viscosity), 최저점도(trough viscosity)와 붕괴점도(breakdown viscosity)는 RF보다 상승하였지만, 최종점도(final viscosity)와 치반점도(setback viscosity)는 감소하였다(Table 7). 게다가 UTFP와 FMFP를 RF의 건조중량 대비 20% 첨가한 경우의 페이스팅 점도 프로파일은 10% 첨가한 경우와 같았고, 페 이스팅 점도 특성값들은 10% 첨가한 경우보다 높아졌으며 UTFP와 FMFP 사이의 차이는 10% 첨가군에서 관찰된 양상과 같았다. 이처럼 최고점도, 최저점도와 붕괴점도가 RF의 것들보다 상승한 것은 페이스팅 점도 분석을 위한 현탁액에 있어 UTFP와 FMFP의 첨가로 총 고형분 함량이 증가하였기 때문이다. 또한 최종점도와 치반점도가 RF의 것들보다 감소한 것은 UTFP와 FMFP의 첨가로 인해 단백질과 비전분성 탄수화물고분자 함량이 현탁액 내에서 상대적으로 증가하여 쌀전분 페이스트의 겔화를 방해하였기 때문으로 생각된다. 한편 무발효 및 발효 병아리콩가루를 RF에 10%와 20% 첨가한 RF-병아리콩가루 혼합물의 페이스팅 점도 프로파일은 RF의 것과 유사하였으나, 이들의 페이스팅 점도 특성값들은 RF의 것보다 높은 수준을 나타내었다. 이는 페이스팅 점도 분석을 위한 현탁액의 총 고형분 함량이 증가하였을 뿐만 아니라 고초균 발효 후에도 병아리콩가루는 상당한 수준의 전분과 높은 함량의 열 겔화 단백질을 함유(Table 2)하고 있기 때문으로 생각된다. 특히 병아리콩가루를 10%와 20% 첨가하였을 때의 RF-병아리콩가루 혼합물의 최고점도, 최저점도와 붕괴점도는 UTCF와 FMCF 사이의 통계적 유의성은 없었지만 UTCF가 FMCF보다 각 페이스팅 점도 평균값이 소폭 높았다. 이는 온도에 따른 병아리콩가루의 탄성계수 변화(Fig. 1B)에서 보고된 것처럼 95°C까지 가열하고 95°C에서 유지한 후 75°C까지 냉각되는 구간에서 UTCF가 FMCF보다 높은 탄성계수를 보인 것과 일치한다. 그러나 병아리콩가루 10%와 20% 첨가한 경우의 RF-병아리콩가루 혼합물의 최종점도와 치반점도는 FMCF가 UTCF보다 유의적으로 높은 수준을 나타내었다. 이러한 결과는 FMCF의 탄성계수가 55-70°C 범위에서 UTCF의 탄성계수를 초과한 것에 기초할 때(Fig. 1B), UTCF보다 FMCF가 RF-병아리콩가루 혼합물 페이스트의 겔화에 더욱 이바지한다는 것을 암시한다.
요 약
농축잠두단백(UTFP)과 병아리콩가루(UTCF)를 고초균(Bacillus subtilis)을 이용한 고상 발효를 통해 발효농축잠두 단백(FMFP)과 발효병아리콩가루(FMCF)를 제조하고, 이들의 단백 영양 강화제로의 효과를 규명하기 위해 쌀가루(RF)에 첨가하여 물리화학적 특성을 조사하였다. UTFP와 UTCF의 고상 발효에 따른 FMFP와 FMCF의 조단백질 및 환원당 함량은 증가하였으나 전분 함량은 감소하였다. 냉수가용성 단백질 함량은 FMFP는 감소하였으나, FMCF는 소폭증가하였다. UTFP와 UTCF에 비해 FMFP와 FMCF의 구성아미노산 및 유리아미노산은 조단백질 증가와 함께 아미노산 대부분에 있어 증가하였으며, 특히 필수아미노산과 분지아미노산의 증가는 조단백질 함량 증가율을 초과하였다. 농축잠두단백(UTFP 및 FMFP)을 RF에 첨가는 이들 혼합물의 팽윤력을 대체로 낮추었으나, 용해도는 상승시켰다. 이들 혼합물의 용해도는 용출된 전분 분자와 용해된 비전분성 탄수화물고분자 이외에 상당량의 가용성 단백질의 결과였다. 병아리콩가루(UTCF 및 FMCF)를 RF에 첨가는 팽윤력과 용해도를 RF보다 증가시켰으며, 이들 혼합물의 용해도는 주로 용출된 전분 분자와 용해된 비전분성 탄수화물고분자로부터 얻어졌다. RF-식물단백 혼합물의 호화온도와 호화엔탈피는 RF보다 각각 상승하였고 낮아졌다. 본 연구의 무발효 및 발효 식물단백은 모두 온도가 상승하며 겔을 형성하는 열 겔화 특성을 보유하고 있었으며, 고초균 발효는 농축잠두단백에 있어 안정적인 겔화 특성을 부여하였으나, 병아리콩가루에 있어서는 냉각하면서 형성된 겔이 약하고 불안정하였다. 무발효 및 발효 식물단백을 RF에 첨가하였을 때, 이들 혼합물의 페이스팅 점도 프로파일은 RF의 것과 유사한 경향을 보였다. RF에 UTFP와 FMFP의 첨가는 페이스팅 점도를 RF보다 소폭 상승시켰으나, UTCF와 FMCF의 첨가는 유의미한 수준으로 증가시켰다. 전반적으로 고초균을 이용한 고상발효에 따른 발효식물단백은 무발효 식물단백보다 고령친화식품의 단백 영양(총 단백질, 필수아미노산 및 분지아미노산) 강화에 유리하며, 발효병아리콩가루보다 발효농축잠두단백을 단백 영양 강화를 위해 이용하는 것이 기존 고령친화식품의 단백 영양 강화에 따른 물성 변화를 최소화할 수 있을 것으로 판단된다.