서 론
단백질은 생체의 생명 활동을 유지하기 위한 필수 영양 소로, 양질의 단백질 자원 개발과 공급 문제는 전 세계적 인 화두로 부각되고 있다. 이에 대해 육고기의 대체식품 개발과 지속가능한 소비증대가 해결안으로 제시되면서, 동 물성 단백질 대체 소재로서 식물성 단백질, 식용곤충, 해조 류, 미생물, 배양육 등의 활용방안이 쟁점으로 떠오르고 있 다(Lee et al., 2021). 특히, 식물성 단백질 원료들은 동물 성 원료에 비하여 저지방, 저칼로리에 영양적으로 손색이 없으면서도 동물성 단백질에는 존재하지 않는 폴리페놀 및 각종 생리활성 물질이 함유되어 건강상 유익하다는 장점이 있다(Cho & Ryu, 2022). 건강, 환경 및 윤리적인 이유로 인해 식물성 대체육에 대한 관심이 증가하면서 이러한 식 물성 식재료를 이용하여 만든 식물성 고기나 배양육 등의 대체육 산업이 성장하였다(Rajpurohit & Li, 2023). 대체육 은 질감, 향미, 외관과 같은 육류의 심미적, 화학적, 영양적 특성이 육류와 유사한 식품을 말하며, 특히 가장 많이 알 려져 있는 것은 식물성 대체육으로 특히 콩단백질을 활용 한 식물성 대체육의 연구가 활발하게 진행되고 있다(Jeong & Jo, 2018, Cha et al., 2020, Zhan et al., 2022).
완두(Pisum sativum L ., P ea)는 콩과에 딸린 한해살이 또 는 두해살이 식물로써 부족한 영양분을 보충하고 각종 생 리활성기능으로 다양한 면에서 우수한 효과를 나타내어 식 품학적 관심도가 높아지고 있다(Lam et al., 2018). 완두는 수분 8.1 g, 단백질 20.7 g, 지질 1.3 g, 회분 2.8 g 및 탄수 화물 65.1 g로 구성된다(RDA, 2016). 일반적으로 식물성 단백질의 이용은 현재 동물성 단백질에 비해 상대적으로 물리적 기능성(유화, 겔화, 거품형성능 등)이 떨어지기 때 문에 식품산업에서 제한적이지만, 완두콩 단백질은 다른 두류에 비하여 비교적 높은 겔화 능력과 유화 안정성으로 인해 상업적 이용가능성, 저렴한 가격, 낮은 알레르기 유발 성 그리고 우수한 지속가능성을 가진 재료로 알려져 있다 (Shand et al., 2007;Lam et al., 2018). 따라서 완두콩 단 백질의 높은 영양 가치와 그에 상응하는 기능적 특성(특히, 향상된 겔화 능력)을 개발함으로써 현재 식품산업에서 동 물성 단백질뿐만 아니라 대두 단백질의 대안으로 고려되고 있다.
일반적으로 단백질의 열 유도 겔화는 싸이올(-SH), 소수 성, 수소결합 및 정전기적 그룹의 상호작용 부위를 노출시 키는 천연 단백질 구조의 열 유도 전개, 소수성 상호작용 을 통한 전개된 단백질 분자의 응집 및 이황화 결합의 형 성, 3차원 네트워크를 형성하는 단백질 응집체의 결합에 의해 이루어진다(Nicolai & Chassenieux, 2019). 최근 콩류 단백질(완두, 렌틸 등)의 구조화 기반 겔화식품은 대체육 제품 개발에 대한 관심을 끌고 있으나, 대두 단백질에 비 해 겔화 능력이 현저히 낮다는 단점이 있다(Shand et al., 2007). 이는 낮은 함량의 시스테인 아미노산으로 인해 콩 류 단백질 겔에서 이황화 결합이 적게 형성되는 것이 단백 질 겔화능력을 감소시키는 것으로 나타났다(O’Kane et al., 2004;Shand et al., 2007). 단백질 구조의 변화는 단백질을 안정화하려는 힘과 불안정화하려는 힘 간의 균형의 결과물 이며, 단백질 변성을 통해 생성된 응집체는 단백질의 소수 성을 증대시켜 겔화 능력을 향상시킬 수 있다. 이러한 식 품 단백질의 겔화 능력은 단백질 입자의 구조화를 이용하 여 개선될 수 있으며, 개발된 변형 단백질 소재는 식품 및 생체활성 물질의 질감 개선뿐만 아니라 캡슐화의 목적으로 이용될 수 있다.
따라서 이 연구에서는 pH, 단백질 함량 및 가열시간에 따라 분리완두단백으로부터 제조된 열 유도 겔의 구조적 및 물성학적 특성을 조사하여 새로운 식물성 단백질 기반 대체육류의 대안으로서의 완두콩 단백질 응집체의 잠재력 여부를 확인하고자 한다.
재료 및 방법
분리완두단백(Pea protein isolate: PPI, >80% on dry basis)은 PEVESA BIOTECH S.A. (El Viso del Alcor, Sevilla, Spain)에서 제공받았다. 분리완두단백(7.5%, 10%, 12.5%, w/v)은 3차 증류수와 혼합하고, 단백질 부패방지를 위해 0.02% (w/v) sodium azide (Sigma-Aldrich, USA)를 첨가한 뒤 하루동안 실온에서 교반하였다. 다음날 초음파 분산기(ultrasonication, VCX-500, Sonics & Materials, USA) 를 이용하여 40Hz에서 5분(10 s ON, 5 s OFF) 동안 용액 을 균질화 한 후 6M HCL을 이용하여 pH 2로 적정하였 다. 그 후 혼합물은 겔 형성을 유도하기 위해 90°C에서 16 시간동안 300 rpm으로 교반하며 가열하였다. 실온(25°C)에 서 식힌 뒤 냉장고(4°C) 하루동안 안정화시켰다.
분리완두단백 응집체의 미세구조는 투과전자현미경(FETEM; JEOL, JEM-2000EX, Tokyo, Japan)을 이용하여 관찰 하였다. 각 pH가 조절된 증류수를 이용하여 100배 희석한 응집체 용액 한 방울을 투과전자현미경용 그리드(Support Flims Grid, TED PELLA, USA)에 30초간 고정시킨 후 2% uranyl acetate를 이용하여 30초간 음성 염색시켜 준비하였다.
단백질 겔의 미세구조는 Zeiss EVO MA 10 주사전자현 미경(FE-SEM; Inspect-F, FEI, Finland)을 사용하여 20 kV 의 가속 전압에서 관찰하였다. 제조된 겔을 액체 질소에서 동결시키고 동결 건조한 후 겔의 단면을 금으로 코팅하여 관찰하였다.
추가적으로 공초점 현미경(Confocal laser scanning microscope) (CLSM, Stellaris5, Leica, Wetzlar, Germany) 을 사용하여 겔의 미세구조를 분석하였다. 염색재료로 형 광염료인 nile red (Sigma Aldrich, St. Louis, MO, USA)를 isopropyl alcohol에 1 mg/mL의 농도로 희석하여 분리완두 단백 용액과 혼합하여 위의 방법에 따라 겔을 제조한 후, 488 nm 및 argon laser 조건에서 시료를 분석하였다.
제조된 단백질 겔의 텍스쳐 특성은 CTX texture analyzer (Brookfield Engineering Labs Inc., Stoughton, USA)를 사 용하여 분석하였다. 제조된 겔(두께 10 mm, 지름 13 mm)은 5 kg load cell과 a flat stainless-steel plate probe (TAAACC36) 를 이용하여 deformation 50% 및 test speed 1 mm/min 조건에서 2번 압축하였다. 얻어진 힘-시간 그래프로부터 텍스쳐 변수인 hardness (경도), springiness (탄력성) 및 cohesiveness (응집성)을 계산하였다. 각 시료의 측정치는 8 회 이상 반복 측정하여 평균값과 표준편차 값으로 나타내 었다.
보수력은 Lee and Jo (2023)의 방법을 이용하여 측정하 였다. 제조된 단백질 겔 2±0.1 g을 ultrafiltration tube (Vivaspin Turbo 50, MWCO 5 kDa, Sartorius Stedim Biotech GmbH, Goettingen, Germany)에 넣고, 원심분리기(LaboGene 1736R, GYROGEN, Daejeon, Korea)를 이용하여 4,000 rpm으로 25°C에서 10분간 처리하였다. 원심분리 전과 후의 시료의 무게를 측정하여 다음의 식을 이용하여 보수력을 계산하였다.
pH 2에서 분리완두단백 현탁액의 열 유도 겔화 거동을 PP 50 (Parallel plate 직경: 50 mm, 간격: 1 mm)이 장착된 레오미터(MCR 302e, Anton Paar GmbH, Granz, Austria)를 이용하여 분석하였다. 온도는 P eltier 시스템을 사용하여 조 절하였으며, 측정 중 탈수를 방지하기 위해 실리콘 오일을 사용하였다. 시간-온도 변화시험은 1Hz의 진동수와 1%의 변형률을 사용하여 저장계수(G')와 손실계수(G'')를 기록하 였다. 먼저, 20°C에서 90°C까지 2°C/min의 속도로 증가시킨 후 90°C에서 1시간 동안 유지한 다음 4°C/min의 속도로 90°C에서 4°C로 냉각하였다. 그 후 1시간 동안의 냉각유지 단계를 거쳐 시간-온도 변화시험을 완결하였다. 추가적으로 레오미터 내에서 형성된 겔의 서로 다른 온도에서의 안정성 을 확인하기 위해 4°C, 25°C 또는 37°C에서 진동수 변화시 험(Frequency sweep test: 0.01-10 Hz)을 수행하였다.
변형률 변화시험(Strain sweep test)은 제조된 겔 시료 제 조된 겔(두께 10 mm, 지름 13mm)를 PP 25 (Parallel plate 직경: 25 mm, 간격: 1 mm)이 장착된 레오미터를 이용하여 분석하였다. 제조된 겔은 레오미터 내에서 원래 높이의 90%로 압축하여 P P 2 5 사이에 빈 공간 없이 위치시켰으 며, 변형률은 0.1%에서 100%까지의 수준으로 수행하였다.
결과 및 고찰
분리완두단백기반 하이드로겔의 형성을 확인하고 물성학 적 특성을 조사하기에 앞서, 서로 다른 pH에서의 겔화 능 력을 확인하기 위하여 분리완두단백 10% 용액을 pH 2, pH 7 및 pH 11에서 6시간 동안 가열 후의 겔화 능력을 평가하였다(Fig. 1). 그 결과, pH 2에서는 단백질 겔 형성 을 확인하였으며, pH 7에서는 약한 겔이, pH 11에서는 겔 형성이 진행되지 않은 것을 확인하였다. 따라서, 본 연구에 서는 pH 2의 산성조건에서 서로 다른 단백질 농도(7.5%, 10%, 12.5%) 및 가열시간(1, 3, 6, 16시간)에 따른 분리완 두단백 겔 형성 능력을 비교 분석하였다.

Fig. 2는 시각적 튜브반전법(visual tube-inversion method) 으로 분리완두단백으로부터의 겔 형성 능력을 나타낸 결과 이다. 일반적으로 단백질 기반 하이드로겔은 단백질의 일 정농도 이상에서 형성되며, 이 때의 농도를 단백질 임계농 도(critical protein concentration)라 하며 겔화 능력의 지표 로 사용한다. 단백질 임계농도가 낮을수록 겔을 형성하는 데 필요한 단백질 함량이 적다는 것을 의미한다(Nicolai & Chassenieux, 2019;Jo et al., 2020). Fig. 2에 제시한 대로 pH 2에서 분리완두단백의 겔화를 위한 임계농도는 10% 이상(가열시간 6시간)으로 보이며, 가열시간이 증가함에 따라 겔화를 위한 단백질 임계농도는 감소하는 것으로 나타났다. 즉, 가열 시간이 6시간에서 3시간으로 감소함에 따라 분리 완두단백 겔 형성에 요구되는 단백질 농도가 10%에서 12.5% 으로 증가하였다. 따라서, 자립형 겔(self-standing gel) 형성 을 위해서는 최소 10% 이상의 분리완두단백과 최소 3시간 이상의 가열시간이 필요함을 시사한다. 이는 단백질 변성 온도에서 단백질 농도와 가열시간이 상호 의존성이 있기 때문에 분리완두단백 겔화는 pH뿐만 아니라 단백질농도와 가열시간을 동시에 고려해야 한다는 것을 의미한다.
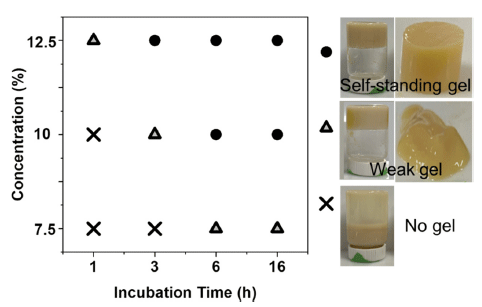
 : 10% PPI) weak-gel, (●: 12.5% PPI) gel.
: 10% PPI) weak-gel, (●: 12.5% PPI) gel.
Fig. 3는 열 유도 분리완두단백 응집체의 미세구조를 나 타낸 TEM 이미지이며, 이는 단백질 농도 7.5%에서 가열시 간 3시간 동안 처리되었다. 이 조건에서 단백질 분자는 변 성되고 응집되며, 그 결과 5 nm 크기 내외의 불균일한 구형 의 응집체(aggregates) 분산이 관찰되었다. 이러한 응집체는 가열시간의 증가로 인해 충분한 단백질 풀림(unfolding)을 일으키고, 활성 그룹이 노출되어 상호 연결된 3차원 하이드 로겔 형성하게 된다(Jo et al., 2020).

서로 다른 단백질 농도(10%, 12.5%) 및 가열시간(3, 6, 16시간)에 따른 분리완두단백 겔의 미세 구조(CLSM 및 SEM 이미지)를 Fig. 4에 제시하였다. Fig. 4A에 나타낸 SEM 이미지의 경우, 같은 가열 시간 하에 겔의 단백질 농 도가 10%에서 12.5%로 증가함에 따라 더욱 조밀하고 균 일한 기공 분포를 가진 미세 구조가 형성되었다. 이는 높 은 단백질 농도가 보다 우세한 단백질-단백질 사이에 상호 작용을 증가시켜 고도로 연결된 겔 네트워크 구조를 나타 냄을 의미한다(Jo et al., 2020). 또한, 예상한 바와 같이 같 은 단백질 농도에서 겔의 가열 시간이 3시간에서 6시간, 16시간으로 차례로 증가함에 따라 매우 균질하고 상호 연 결된 겔 네트워크가 형성됨을 확인하였다. 이러한 SEM 이 미지 결과는 Fig. 4B에 제시된 CLSM 이미지 결과와 유사 하게 나타났다. CLSM 이미지에서 붉은색 점으로 표시된 것이 단백질 입자들의 분포 형태를 의미하며, 단백질 겔 네트워크의 밀도가 단백질 농도 및 가열시간과 비례 관계 가 있음을 나타낸다. 즉, 단백질 농도 및 가열시간이 증가 함에 따라 겔을 형상하고 있는 단백질 입자(응집체)가 매 우 고르게 분포하여 겔의 네트워크의 균질성을 보여준다. 본 연구결과는 콩, 렌틸 및 녹두 단백질로부터 열 유도된 하이드로겔의 미세구조 특성과 동일한 결과를 나타내었다 (Jo et al., 2020;Lee & Jo, 2023). 따라서, 이는 단백질 농도 및 가열 시간의 증가가 균일하고 조밀한 겔 미세구조 형성에 영향을 미친다는 것을 시사하며, 겔 미세구조의 특 성은 겔의 기계적 강도 및 물성학적 영향에도 영향을 미칠 것이라 판단된다.

Fig. 5는 단백질 농도 변화(10%, 12.5%)와 가열 시간 변 화(3-16 h)에 따른 분리완두단백 열 유도 겔의 기계적 특성 (Fig. 5A and B)과 보수력(Fig. 5C)을 나타낸 결과이다. 일 반적으로 조직감과 보수력은 겔화 식품을 섭취하였을 때 혀와 치아에 의해 다즙성 및 용이한 섭취능력을 비교하는 평가하는 기준이 된다(Lee & Jo, 2023). Fig. 5A와 같이 단백질 농도가 증가할수록 겔 강도는 유의적인 증가를 보 였으며, 이는 높은 단백질 농도에서 우세한 단백질 입자간 상호작용에 의해 조밀한 겔 네트워크 형성을 유도하였음을 의미한다. 예측한바와 같이 가열시간의 증가에서도 겔 강 도를 증가시키는 경향을 보였으며, 이는 완두단백질 분자 의 활성그룹의 전개에 의해 응집체 형성이 유도되었고, 그 결과 높은 겔 강도를 갖는 안정적이고 단단한 겔이 제조되 었음을 나타낸다. 이러한 겔 강도 증가에 따른 결과는 SEM 결과와 일치한다. 게다가, 제조된 겔의 탄력성 또한 겔의 강도와 유사한 경향성을 나타내었다. 탄력성은 겔에 가해진 힘이 제거된 후 처음 높이를 회복하는 정도를 나타 내며, Fig. 5A에서 보는 바와 같이, 단백질 함량이 높을수 록 가열시간이 길수록 겔의 탄력성이 증가하는 경향을 보 였으며, 특히 10% 단백질/16 h 가열시간의 겔 시료와 12.5% 단백질/3 h 가열시간의 겔 시료의 겔 강도 및 탄력 성이 유사한 것으로 나타났다. 그러나 겔 미세구조에서는 비교적 낮은 단백질 함량이라도 높은 가열시간에서 제조된 겔의 미세구조가 더욱 균일하게 관찰되었다.
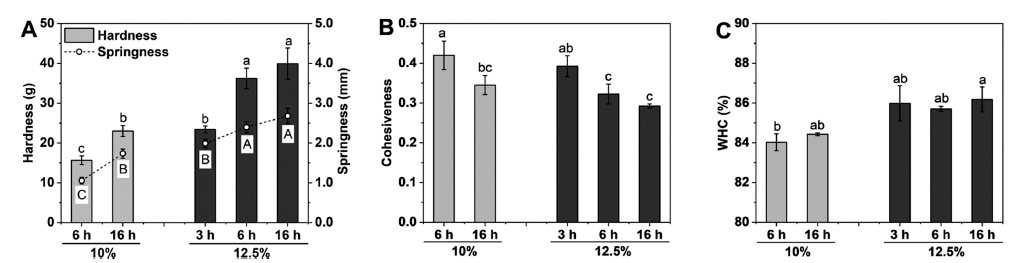
겔의 응집성은 겔 내부의 결합의 강도를 나타내는 지표 이며, 이는 겔 네트워크 구조를 형성하는 연속성과 밀접한 관련이 있다(Lee & Jo, 2023). 따라서, 응집성은 응력에 저항할 수 있는 구조가 필요한 식품제형의 중요한 특성을 나타낸다. Fig. 5B에 보는 바와 같이, 겔의 응집성은 단백 질 함량 및 가열시간이 증가함에 따라 유의적으로 감소하 는 것으로 나타났다. 이는 높은 단백질 함량과 가열시간으 로 제조된 겔의 경우 겔의 내부 결합이 약해지면서 구조가 많이 파괴되어 취성(부서지는 성질)의 특성이 우세하게 나 타냄을 의미한다. 이러한 결과는 분리녹두단백으로 제조된 겔의 특성과 동일하다(Lee & Jo, 2023).
겔의 보수력은 식품(특히, 육제품)에서 부드러운 수분감 을 제공하는 중요한 요소이다. 본 연구 결과, 보수력은 단 백질 함량이 10%에서 12.5%로 증가함에 따라서는 유의미 하게 증가했으나, 가열 가열시간의 증가에 따라서는 유의 미한 차이를 보이지 않았다(Fig. 5C). 수분 함량을 더 잘 유지하는 것에 있어 더 높은 단백질 함량으로 제조된 겔 내부의 더 작고 균일한 기공 크기로 더 많은 수분보유능력 을 가질 수 있음을 시사한다. 또한 분리완두단백으로 제조 된 겔의 경우 전체적으로 84% 이상의 우수한 겔화 능력을 보여주었으며, 이는 다른 식물성 단백질(예, 콩, 땅콩, 렌틸 단백질)과 유사한 수준으로 나타났다(Jo et al., 2020;Li et al., 2020;Wang et al., 2022).
pH 2에서 분리완두단백 현탁액으로부터 겔화 거동을 조 사하기 위한 시간-온도 변화에 따른 유변학적 특성을 Fig. 6A에 나타내었다. 유변학적 특성에서 물질의 점탄성 성질 을 예측할 때 저장계수(G')는 탄성, 손실계수(G'')는 점성을 나타내는 물성학적 지표로 사용된다. Fig. 6A에 나타낸 바 와 같이, G'은 가열단계 (20°C®90°C)에서 급격한 증가를 보여주고 있으며, 특히 50°C 이상에서는 G'보다 G''가 더 큰 것으로 보인다. 이는 50°C 이상에서 고체 점탄성 (G'>G'') 성질이 강하게 나타나 단백질 겔화가 우세하게 작 용되었음을 시사한다. 그 후 가열유지단계에서 G'의 완만 한 증가를 보였으며, 5도까지 냉각단계(90°C→5°C)에서도 급격한 G' 증가를 나타내었다. 냉각단계동안 G'의 증가는 겔을 형성하기 위한 단백질 입자(응집체)의 이동성 감소를 인한 것으로 판단된다(Jo et al., 2020). 또한, 냉각유지단계 동안 G'은 일정하게 나타났으며, 이는 냉각유지단계가 겔 의 안정화에 기여할 수 있음을 시사한다.
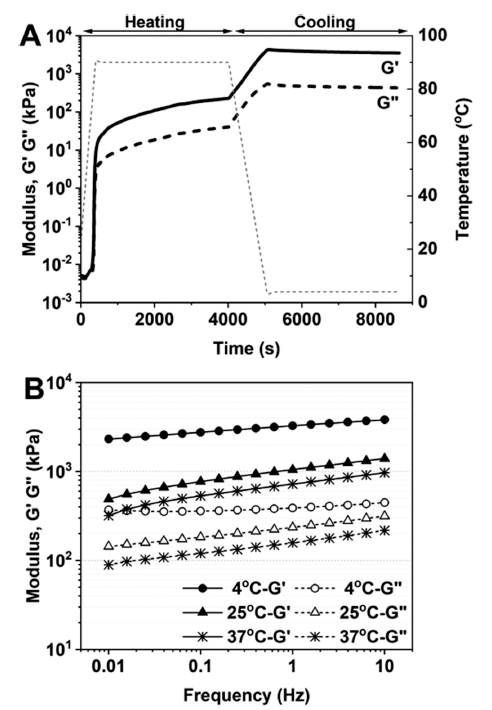
Fig. 6B는 시간-온도 변화 시험 후에 레오미터 내에서 제조된 단백질 겔의 진동수(frequency) 변화시험을 측정한 결과이다. 진동수 변화시험은 단백질 겔에 변형률을 가하 는 시간을 달리했을 때 점탄성 변화를 측정한다. 일반적으 로 점탄성 성질을 가는 단백질 겔의 경우 변형이 가해지는 속도가 느리면 액체와 같은 특성을 확인할 수 있고, 변형 속도가 빨라질수록 고체적 성질이 강해지는 것을 관찰할 수 있다(Mezger, 2020). 즉, 점탄성-진동수 그래프의 기울 기가 클수록 제조된 단백질 겔이 물리적으로 불안정(액체 적 성질이 강함)하며, 기울기가 작을수록 안정(고체적 성질 이 강함)함을 의미한다. Fig. 6B는 시간-온도 변화 시험의 냉각유지단계 이후 온도의 변화(4°C, 25°C, 37°C)를 주어 겔의 안정성을 평가하였다. 고체적 성질인 탄성을 나타내 는 물성학적 지표인 G'은 온도가 낮을 수록 점탄성의 진동 수 의존성이 낮아짐을 보여주었다. 즉 점탄성-진동수 그래 프의 기울기가 낮기 때문에 겔의 안정성이 상대적으로 낮 은 온도(4°C)에서 더 유리함을 보여준다. 이러한 낮은 온도 에서의 진동수 변화에 의한 비의존성은 형성된 겔이 수소 결합에 의해 안정화가 이루어지며, 이는 저온에서 더욱 강 화될 수 있음을 시사한다.
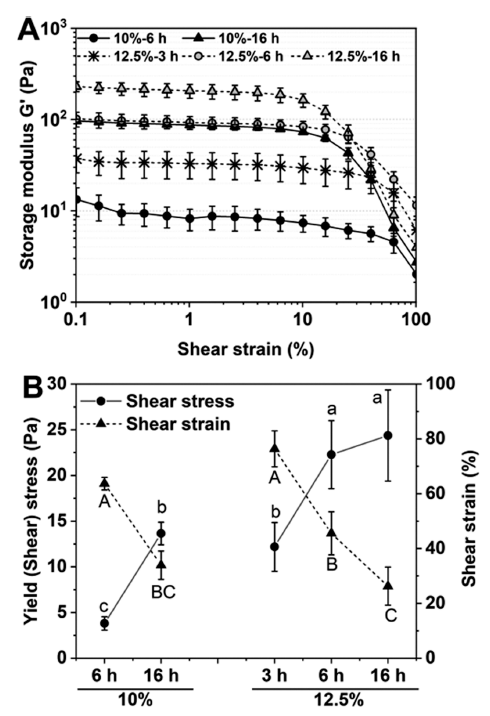
추가적으로 제조된 분리완두단백 하이드로겔의 파단 (fracture) 능력을 평가하기 위하여 변형률(strain) 변화시험 을 진행하였다(Fig. 7). 변형률 변화시험은 일반적으로 식품 가공 및 섭취에 실질적인 영향을 미치고, 겔을 파괴할 수 있는 임계 응력(break to critical stress)을 측정할 수 있다 (Alavi et al., 2020). 이 때, 항복응력(yield stress)는 손실계 수가 저장계수보다 우세하는 지점(즉, tan δ>1.0)의 탄젠트 (tan δ) 값 분석에 의해 결정된다(Jo & Chen, 2023). Fig. 7A에 나타낸 바와 같이, 변형률(Strain%)를 증가시키면서 점탄성을 측정함으로써 일정한 선형 점탄성 구간을 얻을 수 있다. 이 때 이 선형구간이 짧을수록 고체의 성질이 강하 며, 선형구간이 길수록 액체의 성질을 나타내는데(Mezger, 2020), 단백질 농도가 낮을수록 가열시간이 짧을수록 선형 구간이 길어져 액체적 성질을 강하게 나타내는 것으로 나 타났다(Fig. 7A). 이를 항복응력과 임계 변형률 값으로 환 산한 결과(Fig. 7B), 단백질 농도 및 가열시간의 증가는 항 복응력이 높게 측정되었다. 단백질 겔의 항복응력은 단백 질-단백질 상호작용의 증가, 겔 네트워크 구조의 안정성, 겔 미세구조의 특성 등과 같은 다양한 매개변수에 영향을 받을 수 있다. 본 연구결과에서 관찰된 항복응력의 증가는 단백질 응집체의 우세한 상호작용에 의한 단단한 겔 형성 으로 설명될 수 있으며, 반면 임계 변형률의 감소는 형성된 겔이 부서지기 쉬운 조직감을 가지고 있음을 예측할 수 있 다. 이러한 임계 변형률 감소로 인한 부서지기 쉬운 조직 감은 위의 T PA의 결과에서 응집력 측정 결과와 일치한다.
요 약
본 연구에서는 분리완두단백질로부터 열 유도화된 응집 체 및 겔을 제조하기 위한 단백질 함량 및 가열시간을 체 계적으로 확립하고자 하였다. 열 유도 응집체는 5 nm 크기 내외의 불균일한 구형의 형태로 관찰되었으며, 증가된 단 백질 함량 및 가열시간에 의해 미세하고 고도화된 겔 네트 워크 구조를 형성하였다. 열 유도 겔화는 가열뿐 아니라 냉각과정에서 또한 겔의 고체적 특성을 강화시키고, 단백 질 입자(응집체)의 이동성 감소를 시켜 겔의 안정성을 보 장하는 것으로 나타났다. 이러한 특성은 식물성 단백질을 기반으로한 대체계란 및 대체육의 조직감 구현을 위한 결 착제로 사용 가능할 것으로 판단되며, 추후 새로운 겔 제 형의 식품 개발 및 공정 최적화를 확장하는데 도움이 되는 기초연구로 사료된다. 다만, 분리완두단백을 이용한 응집체 및 겔 형성 과정동안 단백질 입자간 상호작용에 따른 결합 메커니즘을 이해하기 위한 후속연구가 필요하다.
