서 론
Protease는 대표적인 단백질 가수분해 효소로 제약, 세제 산업 및 식품 산업 등 다양한 분야에서 폭넓게 이용되고 있다(Hamza, 2017;Singh et al., 2016). 곰팡이, 세균 및 효모와 같은 다양한 미생물로부터 생산되는 protease는 전 세계 효소 시장에서 약 60% 이상를 차지하고 있으며, 효 소활성 및 생산성에 대해 높은 효율을 가지고 있어 산업적 측면에서 매우 유용하다(Razzaq et al., 2019). 특히, 세균 성 protease는 식물 및 동물성 protease와 달리 복잡한 발 현과정 없이 단순 배양만으로 세포 외 효소로 발현되어 높 은 protease 생산에 높은 경제성을 가지고 있다(Supuran et al., 2001). Protease 생산 미생물은 다양한 발표 식품에 존 재하는 것으로 알려져 있으며, 이 중 우리나라의 된장, 간 장, 고추장 등과 같은 콩 유래 발효식품은 발효과정 중 Bacillus sp.가 생성하는 protease에 의해 단백질이 아미노산 및 펩타이드로 분해되며 단백질 분해 산물로 구수한 맛과 향기에 영향을 주는 것으로 보고되었다(Ali & Bavisetty, 2020;Nam et al., 2012). 또한, 전통 발효식품 유래 미생 물들은 안전한 생물자원인 GRAS (generally recognized as safe)로 인정을 받아 오랫동안 식품 및 바이오산업에 안전 한 생물자원으로 활용이 되고 있다(Hamza, 2017;Jeong & Lee, 2014). 이러한 관점에서 protease의 산업적 생산을 위 해서 높은 활성 및 특이성을 가지는 protease 발현 미생물을 전통 식품에서 발굴하며 이를 대량 생산을 위한 배양 기술 연구는 필수적인 연구 분야라고 할 수 있다(Matkawala et al., 2021).
미생물 유래 효소를 산업적으로 활용할 경우, 미생물 생 장에 영향을 줄 수 있는 배지 조건인 탄소원, 질소원, pH 등의 조절이 매우 중요하다(Gupta et al., 2002). 특히, 질 소원의 경우 크게 동물성 및 식물성 질소원으로 구분되는 데 동물성 질소원의 경우 황을 함유하고 있는 아미노산이 풍부할 뿐만 아니라 균 생장에 요구되는 다양한 생장인자를 많이 함유하고 있다(Elisashvili et al., 2008;Kachlishvili et al., 2006). 하지만, 동물성 질소원은 산업적으로 이용하는 데 높은 비용 뿐만 아니라 동물 유래 전염병인 광우병 등 의 위험성 때문에 최근 식물성 질소원으로 대체되고 있다 (Bae et al., 2016). 식물성 질소원은 가격이 저렴할 뿐 아 니라 동물성 성분에 비해 안전성이 높고, 높은 용해성과 열에 대한 안정성을 또한 가지고 있어 미생물 배지 산업에 큰 주목을 받고 있다(Brune et al., 2009). 이와 같은 여러 조건에 대한 최적화 기술은 대표적으로 One Factor At a Time (OFAT)법과 반응표면분석법(RSM, response surface methodology)이 있다(Singh et al., 2017). OFAT 법은 다른 통계적 방법에 비해 많은 시간이 소모되지만, 효소 생산에 영향을 주는 탄소원과 질소원의 종류 및 농도를 검증하는데 비교적 경제적인 측면을 가지고 있다(Saha & Mazumdar, 2019). 하지만, 여러 변수에 대한 상호작용을 확인하고, 최적 조건을 얻기는 어렵다는 단점을 가지고 있다. 최근, 이를 보완하여 반응표면분석법인 통계적 방법을 활용하여 생산 공정의 최적화 연구는 활발하게 진행되고 있다(Yolmeh & Jafari, 2017). 반응표면분석법은 각 독립변수들의 복잡한 상호작용을 통계적인 방법을 통해 최소값과 최대값을 예측 할 수 있으며, 이를 토대로 실험을 통해 검증하여 최적조건 을 확립하는데 효과적인 방법이다(Khuri & Mukhopadhyay, 2010). 특히, 미생물 생장에 영향을 주는 많은 요인들의 상호 관계를 확인하여 효소 생산 배지 최적조건을 확립하 는데 유용하게 사용되고 있으며, 고전적인 방법에 비해 간단한 생산공정과 비용 절감 등의 경제적인 효과를 나타 내므로, 여러 분야에서 최적조건을 확립하기 위한 방법으 로 널리 활용되고 있다(Dey & Dora, 2014;Wejse et al., 2003).
본 연구에서는 전통발효식품 내 분리된 Bacillus sp. 균 주들 중 높은 protease 활성을 가진 균주를 선발하였으며, OFAT 법을 통해 탄소원 8종, 저렴한 식물성 질소원 9종을 평가하여 최적 배지성분을 선정하고 이에 적정 농도를 설 정하여 배양시간에 따른 생산조건을 확인하였다. 최종적으 로 선별된 Bacillus sp.의 protease 생산을 위한 최적 배지 조건 확립을 위해 탄소원 및 질소원의 농도와 pH 범위를 설정하여 반응표면분석을 수행하였다. 또한, 대량 생산 가 능성을 확인하기 위해 pilot scale (3.5 L 발효기)에서 확립 된 최적 조건에서의 protease 생산성을 확인하였다.
재료 및 방법
본 실험에서 사용한 발효 식품 유래 미생물 Bacillus sp. 50종이며 (재)발효미생물산업진흥원(Sunchang, Korea)으로 부터 분양 받았다(Table 1). Bacillus sp.의 액체 배양은 nutrient broth (Difco, Sparks, MD, U.S.A)에 접종하여 37°C 에서 24시간 동안 진탕 배양하였으며, 전배양 한천 배지는 nutrient agar (Difco, Sparks, MD, U.S.A)를 사용하여 37°C에서 24시간 동안 정치 배양하였다. protease 활성 균 주 선별에는 1%의 skim milk가 첨가된 한천 배지(Difco, Sparks, MD, U.S.A)를 사용하였다. 한천 배지에 배양된 50 종 Bacillus sp. 균주의 단일 콜로니를 무작위로 선별하여 skim milk가 첨가된 한천 배지에 접종한 뒤 37°C에서 24 시간 배양 하였다. 배양 후, 생성된 콜로니 대비 투명환 크기를 측정하여 protease 생산 및 활성을 확인하였다.
선발된 균주의 protease 생산능에 영향을 미치는 영양원 을 조사하기 위해, protease 생산 배지 0.5% (w/v) glucose (DAEJUNG Co., Ltd., Siheung, Korea), 0.5% yeast extract (Becton, Dickinson & Co., Paris, France), 0.5% KH2PO4 (DAEJUNG Co., Ltd., Siheung, Korea), 0.5% MgSO4·7H2O (DAEJUNG Co., Ltd., Siheung, Korea), 0.001% FeSO4· 7H2O (DAEJUNG Co., Ltd., Siheung, Korea) pH 7.5를 기본으로 하여 탄소원의 경우 glucose을 fructose, galactose, lactose, maltose, starch, sorbitol (DAEJUNG Co., Ltd., Siheung, Korea)로 각각 같은 농도로 교체하였으며, 식물성 질소원의 경우 yeast extract gistex LS (Gistex LS Powder, DSM, the Netherlands), yeast extract springer 0202 (Bio Springer, Maisons-Alfort, France), yeast extract 751 MG (Procelys, Maisons-Alfort, France), yeast extract FM888 (Angel Yeast Co., Ltd., Yichang, China), potato peptone E210 (Organotechnie S.A.S, La Courneuve, France), soy peptone HSP-349 (Tatua, Morrinsville, New Zealand), soy peptone F (Solabia, Pantin, France), soy peptone FP410 (Angel Yeast Co., Ltd., Yichang, China), yeast peptone FP102 (Angel Yeast Co., Ltd., Yichang, China)로 각각 0.5% 농도로 교체하였다. 이후, protease 생산에 영향을 미 친 영양원의 농도를 0.1-1.0% 범위로 나누어 protease 생산 을 확인하였다. 모든 실험군은 균주 전배양액(seed culture) 을 2% 접종하고 37°C에서 24시간 배양하였다. 배양 후 배 양액을 10,000×g, 4°C에서 20분간 원심분리하여 상등액을 조효소액으로 사용하였다.
선발된 균주의 배양시간이 protease 생산에 미치는 영향 을 확인하기 위하여 선발된 영양원 배지에 배양된 균주 2%를 접종한 다음 37°C에서 24시간 동안 배양하면서 1-2 시간 간격으로 배양액을 회수하여 protease 활성 측정과 미 생물 생장을 확인하였다. 미생물 생장은 회수된 배양액을 microplate reader spectrophotometer (SpectroMax iD3, Molecular Devices, San Jose, CA, USA)를 이용하여 흡광 도 600 nm에서 측정하였다. Protease 생산 배지에 사용되 는 최적 탄소원인 glucose가 미생물 생육 및 효소생산에 영향을 미치는 요인을 확인하기 위해 High Pressure Anion Exchange Chromatography (HPAEC) (Dionex, Sunnyvale, CA, USA)를 통해 이용하였으며, CarboPacTM PA1 컬럼 (Dionex, Sunnyvale, CA, USA)을 통해 glucose의 양을 정 량하였다. α-Amylase 활성은 0.1% soluble starch를 50mM sodium phosphate pH 7.0에 녹인 후, 기질 용액 0.25mL 과 조효소액 0.25mL를 37°C에서 20분간 반응시킨 후, DNS 용액 0.5mL를 혼합하여 100°C에서 10분동안 효소 불활성화를 하였다. 효소 활성(1 U/mL)은 기질인 soluble starch에서 단위시간(min)당 1 μmol의 glucose를 생산하는 효소량으로 정의하였다.
Protease 활성 측정은 casein in milk (SHOWA, Chemical CO, Ltd, Japan)을 기질로 하였으며, 50 mM potassium phosphate buffer pH 7.5로 0.65% casein을 용해 시킨 뒤, 다시 pH 7.5로 조절하여 기질 용액으로 사용하였다. 기질 용액 0.5mL과 조효소액 0.1mL를 가하고 37°C에서 10분간 반응시켰다. 반응 정지를 위해 110 mM trichloroacetic acid (Sigma-Aldrich, St. Louis, MO, USA) 5 mL를 가하고, 37°C 에서 30분간 정치하였다. 이후 원심분리하여 침전물을 제거 하고 상등액 0.2mL를 취하였다. 여기에 500 mM Na2CO3 (DAEJUNG Co., Ltd, SIiheung, Korea) 0.5 mL과 Folin- Ciocalteu’s phenol reagent (Junsei Chemical Co., Ltd, Tokyo, Japan) 0.1 mL를 가하고 37°C에서 30분간 발색시킨 후, 660 nm에서 흡광도를 측정하였다 효소 활성(1 U/mL)은 기 질인 casein에서 단위시간(min)당 1 μmol의 tyrosine에 상응 하는 유리 아미노산을 생성하는 능력으로 정의하였다.
본 연구에서는 protease의 생산에 영향을 줄 수 있는 요 인들 중 탄소원, 질소원, pH 3가지를 이용하여 효소 생산 을 최적조건을 확립하기 위해 Design Expert 7 (Design Expert 7, Stat-Easy Co., Minneapolis, MN, USA)를 이용 하였다. 선행 실험결과를 토대로 탄소원의 농도(X1), 질소 원의 농도(X2), pH (X3)를 독립변수로 고정하고, 3개의 수 준 (-1, 0, +1)으로 설정하였다(Table 2). 이때, pH는 설정 된 배지 조성을 완전히 용해시키고 pH meter (DocuClip pH Meter, Sartorius Co., Gottingen, Germany)를 이용하여 1 N HCl이나 1 N NaOH 용액으로 조절하였다.이는 중심합 성계획법(Central Composite Design)을 통해 각각 다른 20 개의 실험군을 거쳐 protease 생산을 확인하였으며, 이에 따른 모델 식은 다음과 같다.
종속변수 Y는 protease 생산량이며, protease 생산에 영향을 주는 요인들을 각각 X1, X2, X3의 독립변수로 설정하였다.
반응표면분석에 의해 확립된 최적조건 중 protease 생산 이 높았던 Bacillus amyloliquefaciens SRCM 102139 균주 를 통해 protease 대량생산 가능성을 확인하였으며, 이때 5 L 발효기(Biotron Co., Korea)를 이용하여 배양시간에 따 른 protease 생산을 확인하였다. 본 배양액은 0.5% (w/v) glucose, 0.347% yeast extract springer 0202, 0.5% KH2PO4, 0.5% MgSO4·7H2O, 0.001% FeSO4·7H2O를 제조 후 1N NaOH를 이용해 pH 6으로 조절하여 3.5L 배양액을 제조 하였다. 발효기의 종배양은 전배양액 2%를 접종하였으며, 배양온도는 37°C, 교반속도는 200 rpm으로 설정하였으며, 72시간까지 protease 생산성을 확인하였다.
결과 및 고찰
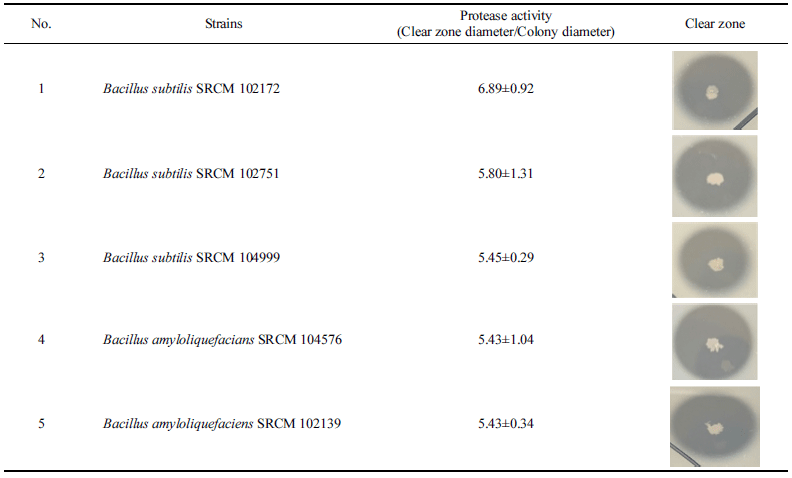
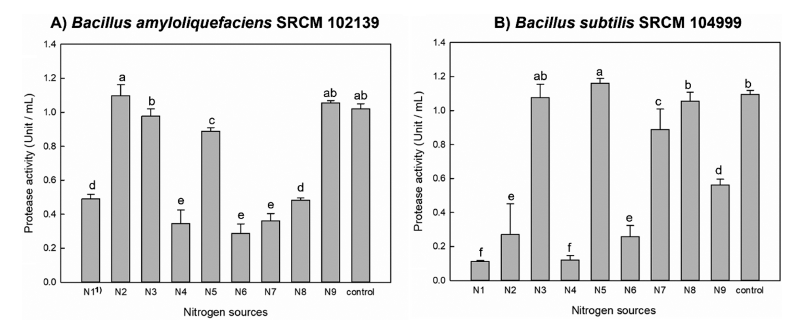
다양한 전통 장류 식품에서 분리된 미생물 중 protease 활성이 존재하는 Bacillus sp. 50종 균주를 (재)발효미생물 산업진흥원에서 제공받았다(Table 1). Protease 활성이 높은 균주를 선발하기 위해 skim milk가 첨가된 고체배지에서 배양하였으며 균 집락 주변에 생성되는 투명환으로 protease 활성을 간접적으로 측정하였다(Table 3). 이 때, protease 활성은 균 집락 대비 투명환의 크기의 상대적인 값을 통 해 비교하였다. 비교한 결과, 모든 50종 Bacillus sp.에서 protease 활성이 나타났으며, 이중 가장 높은 활성이 가 진 Bacillus subtilits SRCM 102172, Bacillus subtilis SRCM 102751, Bacillus subtilis SRCM 104999, Bacillus amyloliquefaciens SRCM 102139, Bacillus amyloliquefaciens SRCM 104576 5종 균주를 1차로 선발하였다(Table 3). Bacillus amyloliquefaciens와 Bacillus subtilis는 다양한 연 구를 통하여 protease에 대한 생산성이 높은 것으로 알려져 있을 뿐 아니라 산업적으로 안전성이 입증된 생물자원으로 활용되고 있다(Jeong & Lee, 2014). Protease 활성이 가장 높은 Bacillus amyloliquefaciens 2종와 Bacillus subtilis 3종 을 식품 및 바이오산업에 유용한 미생물 자원으로 판단하 여 대량생산을 위한 최적조건의 균주로 선정하였다.
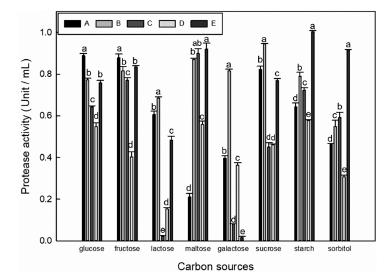
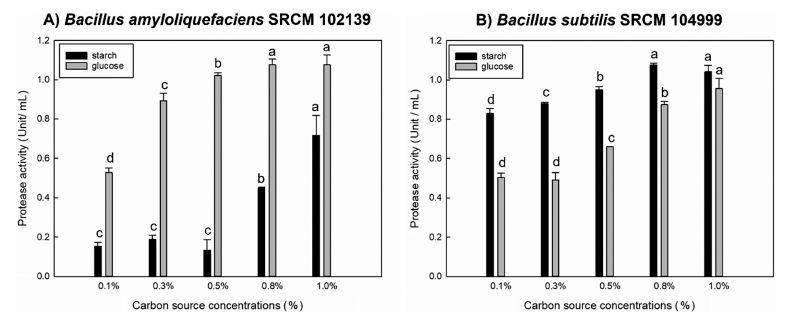
미생물은 배양배지 내 탄소원의 종류에 따라 성장하는 것이 다르며 이에 따라 생산되는 효소의 양에 영향을 준다 (Ruiz et al., 2010). 1차로 선발된 5종 균주를 protease 생 산배지의 탄소원을 각각 0.5% (w/v) glucose, fructose, lactose, maltose, galactose, sucrose, starch와 sorbitol로 교 체하였다. 선발된 균주를 탄소원이 교체된 생산 배지에 24 시간 배양한 후 상등액을 조효소액으로 protease 활성을 측 정하였다. 그 결과 Fig. 1과 같이 starch에서는 Bacillus subtilis SRCM 104999가 1.01±0.01 U/mL로 가장 높은 생 산성을 보였으며, 또한 glucose, maltose, sucrose에서 비교 적 높은 효소 생산성이 보였다. 이러한 결과는 보고된 Bacillus subtilis IB NO. 11와 비슷한 결과를 보여주었다 (Lee et al., 2009). Bacillus subtilis는 starch를 분해할 수 있는 amylolytic 효소들을 생산하여 다른 Bacillus sp.에 비 하여 고분자 탄소원인 starch를 잘 이용하는 것으로 추측 할 수 있다(Konsula & Liakopoulou-Kyriakides, 2004). 탄 소원이 glucose일 경우 Bacillus amyloliquefaciens SRCM 102139에서 가장 높은 protease 생산성을 보였다. 이와 같 은 결과는 Bacillus amyloliquefaciens JH-35의 protease 생 산에 영향을 미치는 0.5% (w/v) glucose에서 1.06±0.25 U/mL 로 유사한 결과를 나타내었다(Yoo et al., 2016). 위 결과를 토대로 낮은 비용으로 높은 protease 생산 최적 조건을 확 립하고자 Bacillus amyloliquefaciens SRCM 102139와 Bacillus subtilis SRCM 104999를 선정하였으며, 각각 protease 생 산이 가장 높았던 glucose와 starch을 선정하였다. 선정된 탄소원들의 첨가 농도에 따른 protease 생산에 미치는 영향 을 확인하기 위해 0.1-1.0% (w/v)로 농도를 달리하였으며, Bacillus amyloliquefaciens SRCM 102139는 glucose 0.8% 와 1.0%에서 가장 높게 나왔으며(Fig. 2A), Bacillus subtilis SRCM 104999는 starch 0.8%와 1.0%에서 가장 높 은 protease 생산성을 보였다(Fig. 2B). 각각 높았던 탄소원 농도의 protease 생산성에 대한 통계적으로 유의적인 차이가 나타나지 않아, Bacillus amyloliquefaciens SRCM 102139와 Bacillus subtilis SRCM 104999의 탄소원의 농도는 glucose 0.8% 및 starch 0.8%로 결정하였다. 이와 같은 결과는 동 일한 균주에서 glucose와 starch의 농도가 증가함에 따라 protease 생산성이 높아지는 것으로 나타났다 (Yang et al., 2021;Yoon et al., 2006).
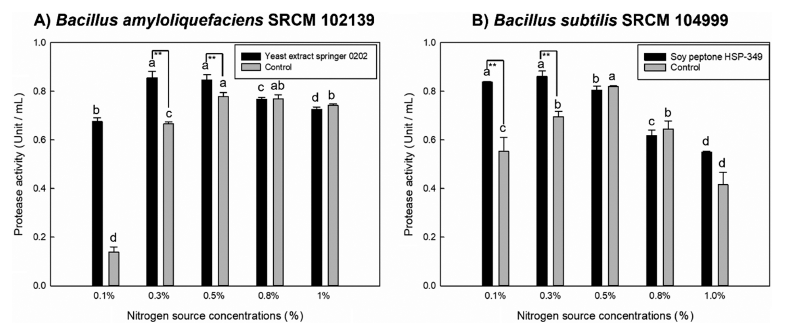
선택된 Bacillus amyloliquefaciens SRCM 102139와 Bacillus subtilis SRCM 104999 균주의 최적 protease 생산을 위한 식물성 질소원을 확인하기 위해 각각의 최적 탄소원 을 0.8%로 고정하였다. 기존 질소원인 Bacto yeast extract 을 대조군으로 하여 식물성 질소원 성분인 yeast extract gistex LS, yeast extract springer 0202, yeast extract 751 MG, yeast extract FM888, potato peptone E210, soy peptone HSP-349, soy peptone F, soy peptone FP410, yeast peptone FP102을 0.5% (w/v)로 교체한 배지에 배양된 균 주를 접종하여 protease 생산성을 확인하였다. 그 결과 Bacillus amyloliquefaciens SRCM 102139와 Bacillus subtilis SRCM 104999는 각각 yeast extract springer 0202 (N2)와 soypeptone HSP-349 (N5)에서 대조군보다 높은 값인 1.09±0.07 U/mL와 1.16±0.02 U/mL으로 가장 높은 생산성 을 보여, 각각의 최적 식물성 질소원으로 선정하였다 (Fig. 3). Bacillus amyloliquefaciens 균주의 경우 glucose와 yeast extract에서 protease 생산성이 높다는 보고된 바 있으며, 다른 Bacillus sp. 균주들도 위와 같은 결과를 나타내었다 (Kim et al., 2002;Yang et al., 2021). 또한, 재래식 된장 에서 분리된 Bacillus sp.의 protease 생산성이 soy peptone 을 첨가하였을 때 높은 것으로 보고되었으며, 된장 유래 미생물로 대두 질소원을 활용하여 protease 생산성이 우수 할 것으로 판단하였다(Bae & Yoon, 2012). 선정된 질소원 들의 첨가 농도에 따른 protease 생산에 미치는 영향을 확 인하기 위해 0.1-1.0% (w/v)로 농도를 달리하였으며 각각 의 농도에 맞게 Bacto yeast extract를 대조군으로 제조하여 비교하였다. 그 결과 Bacillus amyloliquefaciens SRCM 102139는 N2 0.3%와 0.5%에서 가장 높게 나왔으며(Fig. 4A), Bacillus subtilis SRCM 104999는 N5 0.1%와 0.3%에 서 가장 높은 protease 생산성을 보였다(Fig. 4B). 각각 높았 던 질소원 농도 범위에서 protease 생산성에 대한 통계적으 로 유의적인 차이가 보이지 않아, Bacillus amyloliquefaciens SRCM 102139와 Bacillus subtilis SRCM 104999의 질소 원의 농도는 N2 0.3% 및 N5 0.1%로 결정하였다. 이는 기 존 연구에서 일정량 이상의 질소원의 농도가 첨가되었을 때, protease 생산이 억제됨이 나타났기 때문이다(Yoon & Shin, 2010). 비록 된장 유래 Bacillus licheniformis 균주는 1.5% soypeptone에서 가장 높은 protease 생산성을 보였지 만, 본 연구결과는 산업적 관점에서 0.1%의 낮은 식물성 질소원 성분 농도로 배지의 원가를 절감할 뿐만 아니라 protease을 고생산을 할 수 있음을 의미한다(Bae & Yoon, 2012).
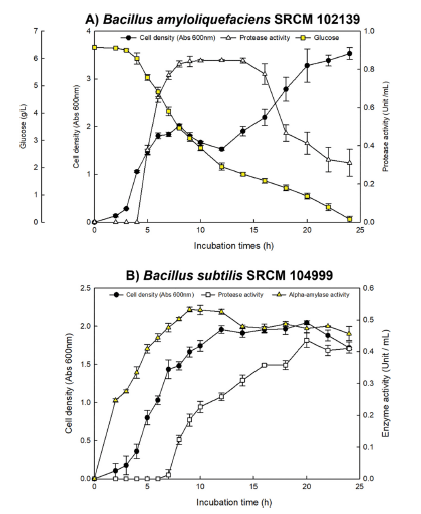
Bacillus amyloliquefaciens SRCM 102139와 Bacillus subtilis SRCM 104999의 선정된 각각의 탄소원 및 질소원 의 농도를 사용하여 배양시간에 따른 protease 생산성과 균 생장의 관계를 확인하였다. Bacillus amyloliquefaciens SRCM 102139는 배양시간 8-14시간 사이에서 가장 높은 생산성을 보였으며, 14시간 이후 protease 생산이 억제되는 것을 확인하였다(Fig. 5A). 이는 protease가 자가소화 현상 이 일어나 효소활성이 강할수록 이와 같은 현상이 일어나 는 것으로 추측할 수 있으며, 효소 최대 생산 시점이 exponential phase와 반드시 일치하지 않음을 보고하였다 (Lim et al., 2000). 또한, 균 생장은 7시간부터 급격히 감 소하다가 12시간부터 다시 급격히 증가되는 경향을 확인하 였다(Fig. 5A). 이는 탄소원인 포도당의 소모량을 확인하였 을 때, 12시간 전에는 포도당의 소모가 빠르지만 12시간 이후부터 소모가 느려지는 것을 확인하였다. 이와 같은 결 과는 초기 Bacillus amyloliquefaciens 균주는 protease 생산 하는데 glucose을 활용하는 것을 의미한다(Kole et al., 1988). 12시간 이후, SRCM102139의 세포 성장이 급격히 증가하였는데, 이는 생산된 protease 등이 배지 성분들과 반응하여 생성되는 물질에 의해서 나타난 현상으로 추측된 다(Beg et al., 2002). Bacillus subtilis SRCM 104999는 20-24시간에서 가장 높은 protease 생산성을 보였으며, 균 의 생장과 비슷한 경향으로 나타났다(Fig. 5B). Bacillus amyloliquefaciens SRCM 102139에 비해 생산 속도가 현저 히 낮은 것을 확인되었으며, 이는 α-amylase 생산을 확인 해본 결과 2시간부터 생산되어 탄소원인 starch를 균주로부 터 분비되는 α-amylase가 직접 분해하여 영양성분을 제공 하기 때문으로 판단된다(Kim et al., 2002).
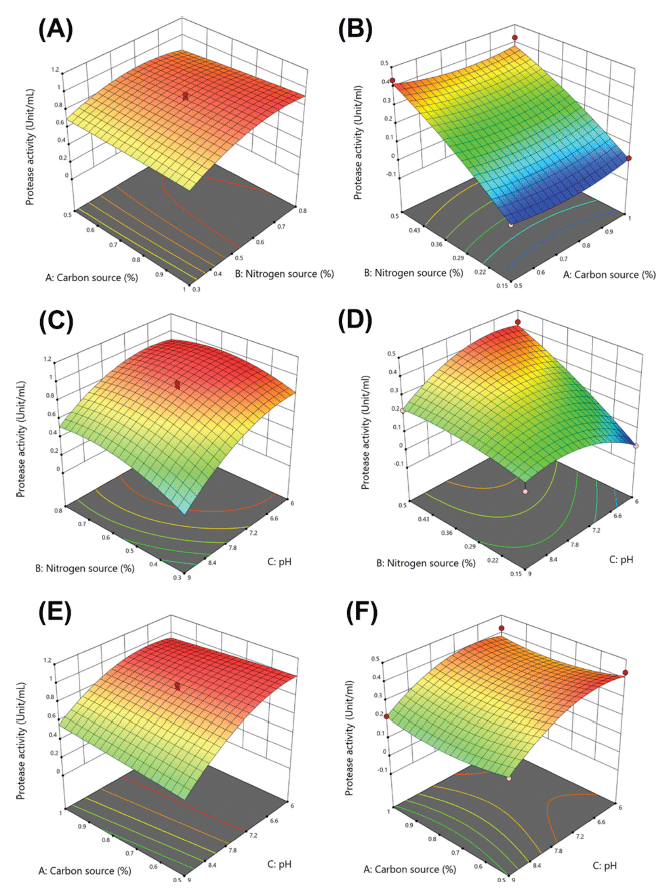
Bacillus amyloliquefaciens SRCM 102139와 Bacillus subtilis SRCM 104999 균주의 protease 생산을 위한 배지 조성의 최적 조건을 확립하기 위해 Central Composite Design (CCD)를 이용하여 실험을 설계하였다. 위 결과를 토대로 각 균주의 탄소원 및 질소원의 농도와 pH를 각각 중심값으로부터 저농도와 고농도 수준으로 하여 Bacillus amyloliquefaciens SRCM 102139은 탄소원(glucose)은 0.75± 0.25% (w/v), 질소원(yeast extract springer 0202)은 0.55± 0.25% (w/v), pH 7.5±1.5로 설정하였으며, Bacillus subtilis SRCM 104999 균주는 탄소원(starch)은 0.75±0.25% (w/v), 질소원(soypeptone HSP-349)은 0.325±0.25% (w/v), pH 7.5±1.5로 설정하였다. CCD 실험 설계에 따른 각 20개 실 험군의 종속변수인 protease 생산량(Y, protease U/mL)에 미치는 독립변수의 영향을 3D surface plot으로 나타내었다 (Fig. 6). Bacillus amyloliquefaciens SRCM 102139 균주는 설정한 범위 내에서 pH 증가함에 따라 protease 생산량이 감소되는 경향을 보였으며, 질소원인 yeast extract springer 0202가 증가함에 따라 protease 생산량이 증가되는 경향이 보이지만, 탄소원인 glucose의 농도는 큰 영향을 미치지 않았다(Fig. 6A, C, E). 이 결과는 Fig. 5에서의 배양시간 의 한 시점에서부터 균의 성장이 급격히 증가하는 것이 질 소원에 영향임을 추측해볼 수 있다. Bacillus subtilis SRCM 104999 균주는 pH 변화에 따라 탄소원과 질소원의 영향을 크게 받는 것으로 나타났으며(Fig. 6B, D, F), 탄소원인 starch의 농도가 감소함에 따라 protease 생산량이 증가하는 반면, 질소원인 soypeptone HSP-349는 증가함에 따라 protease 생산이 증가되는 경향을 나타내었다. 이를 기반으 로하여 Bacillus amyloliquefaciens SRCM 102139는 0.5% (w/v) glucose, 0.347% (w/v) yeast extract springer 0202, pH 6의 최적조건이 예측되었으며, Bacillus subtilis SRCM 104999는 0.5% (w/v) starch, 0.5% (w/v) soypeptone HSP- 349, pH 6.7의 최적 조건으로 예측되었다. 특히, 두 균주의 최적 조건의 배지 pH는 상대적으로 낮은 범위에서 protease 생산 최적 조건을 가졌으며, 선행연구결과에 따르 면 콩 발효식품에서 분리된 Bacillus subtilis strain 38가 pH 6.5에서 최적의 pH로 나타났으며, 이러한 배지 pH의 영향은 세포막을 통한 여러 영양성분의 전달 및 효소 생산 과정에 큰 영향을 준 것으로 사료된다(Chantawannakul et al., 2002;Sharma et al., 2017). 반응표면분석을 통해 얻어 진 Bacillus amyloliquefaciens SRCM 102139와 Bacillus subtilis SRCM 104999의 protease 생산 배지 최적조건을 검증하기 위해 직접 배지를 제조하고, 각 균주를 배양한 후 protease 생산량을 측정하였다. 각 최적배지에서 반복 수행한 결과, Bacillus amyloliquefaciens SRCM 102139는 0.926±0.01 U/mL로 CCD로부터 얻어진 예측값인 0.929 U/mL과 0.33% 차이를 보였으며, Bacillus subtilis SRCM 104999는 0.428±0.06U/mL로 예측값인 0.431 U/mL과 0.78% 차이가 나타났다(Table 4). 두 균주 모두 1%미만의 오차범 위로 CCD를 통한 최적조건이 신뢰할 수 있음을 확인하 였다.

|
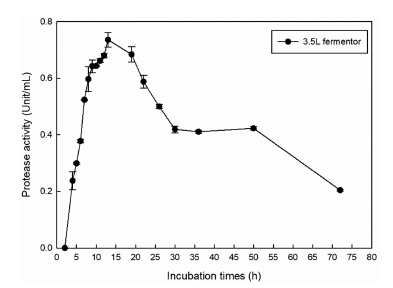
Protease 생산이 높았던 Bacillus amyloliquefaciens SRCM 102139를 통해 3.5 L pilot scale 발효를 통하여 확립된 최 적 배지 조성에서 대량 생산 가능성을 확인하였다. 최적조 건의 protease 생산배지에 전배양액 2% 접종 후 배양시간 에 따라 효소 생산성을 확인하였다. 그 결과 Fig. 7과 같이 3.5 L 발효기의 protease 최대 생산 시점은 15시간에서 0.736±0.03 U/mL으로 가장 높은 protease 생산성을 보여주 었다. Fig. 5에서 protease 최대 생산 시점과 비슷한 경향을 보였으나 Table 4의 최적조건의 실제 값에 비해 protease 생산성이 0.19 U/mL 낮아짐이 확인되었다. 이는 배양조건 인 회전속도 및 용존산소 조절 등의 영향을 받은 것으로 판단된다(Gupta et al., 2012). 하지만, 확립된 최적 조건은 부피를 35배 증가하여도 protease 생산성에 유의적 영향을 주지 않는다고 판단되며 이는 확립된 최적 조건으로 대량 생산이 가능함을 확인하였다.
요 약
전통 발효식품에서 분리된 50 Bacillus sp. 중 Bacillus amyloliquefaciens SRCM 102139와 Bacillus subtilis SRCM 104999의 protease 생산량을 증가시키기 위해 OFAT 법을 통해 탄소원과 식물성 질소원을 선정하였으며, 이후 반응 표면분석법을 통해 protease 최대 생산 배지의 최적조건을 확립하였다. 탄소원, 식물성 질소원의 배지성분 및 배양시 간이 protease 생산에 미치는 영향을 확인해본 결과 Bacillus amyloliquefaciens SRCM 102139는 0.8% glucose와 0.3% yeast extract springer 0202 배지 조성에서 8-14시간에 가장 높은 protease 생산성을 보였으며, Bacillus subtilis SRCM 104999는 0.8% starch와 0.1% soypeptone HSP-349 배지 조성에서 20-24시간에 가장 높은 protease 생산성을 보였다. 이는 탄소원의 영향으로 protease 생산 속도의 차이가 보 이는 것으로 판단된다. 이 후, 반응표면분석을 통해 최적 조건은 central composite design (CCD)로 실험을 설계 하였으며, 실험 모델에 대한 최적 조건 결과 Bacillus amyloliquefaciens SRCM 102139는 0.5% glucose, 0.347% yeast extract springer 0202, pH 6.0이며, Bacillus subtilis SRCM 104999는 0.5% starch, 0.5% soypeptone HSP-349, pH 6.7로 예측되었다. 이 때, Bacillus amyloliquefaciens SRCM 102139와 Bacillus subtilis SRCM 104999의 최적 조건에서 protease 생산량은 각각 0.929U/mL과 0.431U/mL 으로 예측되었으며, 이를 검증해본 결과 0.926±0.01U/mL과 0.428±0.06 U/mL으로 protease 생산 최적조건이 신뢰할 수 있음을 확인하였다. 최종적으로, 대량생산 가능성을 확인하기 위해 Bacillus amyloliquefaciens SRCM 102139로 3.5L pilot scale로 배양시간에 따른 protease 생산량을 확인해본 결과 3.5 L pilot scale에서 0.736±0.03 U/mL로 배양시간 15시간 에서 가장 높은 protease 생산성을 보였으며, 비록 flask scale 의 최적조건의 실제 값에 비해 protease 생산성이 0.19U/mL 낮은 생산성이 보였지만, 배지 부피가 35배가 증가하여도 protease 생산에 유의적 영향을 미치지 않 았다.