서 론
염증반응은 병원체, 손상된 세포 또는 자극 물질로 인한 조직손상을 제어하고 치유하는 과정에 나타나는 정상적인 숙주 방어 반응이다(Kang et al., 2011). 염증 과정은 대식 세포, 호중구, 호산구 및 단핵 식세포와 같은 염증 세포에 의해 매개된다. 대식세포는 박테리아 내독소, 지질다당류 (lipopolysaccharide, LPS)와 같은 자극으로 유도성 산화질 소 합성효소(iNOS), 사이클로옥시게나제-2(COX-2) 및 염 증성 사이토카인(TNF-α, 인터루킨-1β, 인터루킨-6)이 활성 화 되어 산화질소(nitric oxide, NO), 프로스타글란딘과 같 은 염증 매개 물질을 분비한다(Asanka Sanjeewa et al., 2019). 그러나 NO는 과량으로 존재할 때 신경의 손상 및 부종을 일으키고 유전자 변이를 유도하는 등 과도한 염증 반응을 일으킨다(Gabay, 2006;van Triel et al., 2010). 대 부분의 경우 염증은 조직에 침투한 대식세포에서 생성되는 활성산소종(reactive oxygen species, ROS)이 여러 경로를 통해 염증성 사이토카인의 발현을 조절함으로써 염증반응 을 매개한다고 알려져 있다(Hensley et al., 2000). 산화 스 트레스는 체내의 ROS 생성과 세포내 항산화 작용들에 의 해서 다양한 세포 및 조직에 심각한 손상을 일으켜, 노화, 암, 당뇨병 및 염증과 같은 여러 가지 질병들의 원인이 된 다(Kim et al., 2021). 여러 가지 합성 항산화제와 항염제 는 이러한 활성산소종 및 염증 매개 물질의 생성 억제에 많이 사용되고 있지만 부작용과 독성이 발견되기 때문에 합성 물질을 대체하기 위한 천연 항산화제 및 항염제 발굴 은 필수적이다.
제주 용암해수는 바닷물이 화산암반층에 의해 지하로 자 연 여과되어 생성되는 제주만의 독특한 지하수자원이다 (Lee et al., 2016). 제주 용암해수는 항비만(Noh et al., 2010), 대사 활동 개선(Kim et al., 2012), 피부보습(Lee et al., 2016) 등의 여러 생리활성이 있는 것으로 알려져 있어 식품 가공, 화장품 제조와 식물재배 등 다양하게 연구 및 활용되고 있다. 한국의 「먹는 물 수질기준(2018)」에 따르 면 물의 경도는 1,000mg/L (수돗물의 경우 300 mg/L, 먹는 염지하수 및 먹는 해양심층수의 경우 1,200 mg/L)를 넘지 않아야 한다고 규정되어있다. 용암해수 원수자체는 NaCl과 미네랄 함량이 매우 높기 때문에(Jung et al., 2009), 현재 국내에서는 경도 100-500 mg/L의 용암해수가 먹는 샘물로 시판되고 있다. 용암해수는 또 다른 해양 수자원인 심층해 양수와 유사하게 다량의 미네랄 성분을 가지고 있으나 약 100-200 m의 지하에서 얻을 수 있으므로 350m 이상 심해 에서 채수하는 심해수에 비해 더 경제적인 이점을 가진다 (Kang et al., 2021).
갈조류인 감태(Ecklonia cava)는 일본과 한국 남부 해안 에 분포하며 우리나라 연안을 따라 조간대 수심 5-25m 에서 자라며, 항산화, 항염증(Kang et al., 2011), 항응고 (Wijesinghe et al., 2011), 항바이러스(Ryu et al., 2011), 항 당뇨(Lee et al., 2012b) 효과 등의 생리활성을 갖는 카로 티노이드, 후코이단, 플로로탄닌과 같은 다양한 천연 물질 을 함유하는 것으로 보고된 바 있다(Wijesinghe & Jeon, 2012). 이 때문에 감태는 최근 몇 년 동안 의약품 및 기능 성 식품으로 개발되기 위한 연구가 꾸준히 진행되고 있으 며(Ahn et al., 2007), 최근에는 일반 자연의 감태보다 제 주 용암해수로 배양한 감태가 미백 효능이 뛰어나다는 연 구가 보고되었다(Ding et al., 2019). 그러나 지금까지 용암 해수를 용매로 이용한 감태추출물에 대한 항산화 및 항염 증 활성에 대한 연구는 수행되지 않았다. 따라서 본 연구 에서는 용암해수를 이용한 감태 추출물의 Vero 세포에의 항산화 효능과 Raw 264.7 세포에서 항염증 효과를 평가하 였다.
재료 및 방법
본 실험에 사용된 감태(E. cava)는 제주도 제주시 소재 의 (주)생생드림 업체에서 구입하였으며, 추출용매인 용암 해수는 제주시 소재의 (재)제주테크노파크 용암해수센터에 서 제공받아 사용하였다. 용암해수의 경도는 국내 시판 중 인 먹는 샘물의 경도를 참고하여 100, 300 mg/L의 두 가 지 경도를 선정하여 실험에 사용하였다.
감태를 100, 300 mg/L의 경도의 용암해수를 이용하여 2% (w/v) 용액을 만들어 실온에서 24시간 동안 교반 추출 을 진행하였다. 추출액을 3,000 rpm에서 10분 동안 원심분 리하여 No.1 filter paper (Whatman Ltd., Maidstone, UK) 를 통해 여과하여 고형물을 제거하고 수득률를 측정하여 비교하였다. 제조된 추출물을 경도별로 ECE-JLS100, ECEJLS300 (E. cava extract using Jeju Lava Seawater)으로 명 명하고 이를 동결 건조하여 실험에 사용하였다.
추출물의 총 폴리페놀 함량은 Jung et al. (2009)의 방법 을 이용하여 측정하였다. 농도가 0.1 mg/mL인 추출물에 95% 에탄올을 가하여 2배 희석시킨 후 추출물 시료 1mL 에 증류수 2.5mL를 가하였다. 50% Folin-ciocalteu reagent (Sigma-Aldrich Co., St. Louis, MO, USA) 250 μL를 첨가 하여 5분 반응시키고 이후 5% sodium carbonate (Sigma- Aldrich Co., St. Louis, MO, USA) 용액 500 μL를 첨가하 였다. 암실에서 1시간 반응시킨 후 725 nm에서 흡광도를 측정하였다. 표준물질로 gallic acid (Sigma-Aldrich Co., St. Louis, MO, USA)를 사용하여 추출물의 총 폴리페놀 함량을 산출하였다.
총 플라보노이드의 함량은 Davies et al. (2018)의 방법을 일부 변형하여 분석하였다. 2 mg/mL 농도인 추출물 100 μL 에 diethylene glycol (Sigma-Aldrich Co., St. Louis, MO, USA) 1 mL와 1 N NaOH (Sigma-Aldrich Co., St. Louis, MO, USA) 100 μL를 혼합하여 37°C에서 반응시켰다. 1시간 후 420 nm에서 흡광도를 측정하였으며, 표준물질로 quercetin (Sigma-Aldrich Co., St. Louis, MO, USA)을 사용하였다.
ECE-JLS의 SOD 유사활성을 측정하기 위해 EZ-SOD assay kit (DG-SOD400, DoGenBio, Korea)를 사용하였다. 제조사의 프로토콜에 따라 20 μL의 샘플에 WST working solution 200 μL와 enzyme working solution 20 μL를 첨가 하여 37°C에서 20분 반응시킨 후 450 nm에서 흡광도를 측 정하였다. 샘플을 넣지 않은 blank 1, enzyme working solution을 넣지 않은 blank 2와 샘플 및 enzyme working solution을 넣지 않은 blank 3을 각각 계산하여 아래의 식 을 통해 SOD 유사활성도를 계산하였다.
SOD activity (%) = 1 - [(blank 1 absorbance - blank 2 absorbance) /(blank 1 absorbance - blank 3 absorbance)] × 100
CAT 유사 활성은 EZ-Catalase assay kit (DG-CAT400, DoGenBio, Korea)를 사용하여 측정하였다. 25 μL의 샘플 에 40 μM H2O2를 20 μL 넣고 실온에서 30분간 반응시킨 후 50 μL의 oxi-Probe/HRP working solution을 첨가하였다. 이후 560 nm에서 흡광도를 측정하였으며, 샘플을 넣지 않은 control 및 HRP가 제외된 oxi-Probe/HRP working solution 을 첨가한 blank를 각각 계산하여 아래의 식을 통해 C AT 유사활성도를 계산하였다.
결과를 바탕으로 MS Excel 2016 (Microsoft, Redmond, WA, USA)을 이용하여 EC50을 산출하였다.
1,1-Diphenyl-2-picryl-hydrazyl (DPPH; Sigma-Aldrich Co., St. Louis, MO, USA)의 환원에 의한 자유 라디칼 소거 활 성 측정은 샘플 20 μL를 0.15 mM DPPH solution 180 μL 와 혼합하여 상온에서 30분간 반응시킨 후 515 nm에서 흡 광도를 측정하여 계산하였다.
Hydrogen peroxide 라디칼 소거능은 Park et al. (2000)의 방법에 따라 측정하였다. 샘플 20 μL에 0.1M의 sodium phosphate buffer 100 μL와 10mM의 hydrogen peroxide 20 μL를 첨가하여 37°C에서 5분간 반응시켰다. 이후 1.25 mM 2,2'-azino-bis(3-ethylbenzthiazoline-6-sulphonic acid) (ABTS; Sigma-Aldrich Co., St. Louis, MO, USA)와 1 unit/ mL의 peroxidase (Sigma-Aldrich Co., St. Louis, MO, USA) 를 각각 30 μL를 첨가하여 다시 37°C에서 10분간 반응시 키고 405 nm에서 흡광도를 측정하여 계산하였다. 양성 대 조군(positive control)으로는 N-acetyl cysteine (NAC; Sigma- Aldrich Co., St. Louis, MO, USA)을 사용하였다.
원숭이 신장 세포인 Vero 세포와 마우스 대식세포인 Raw 264.7 세포는 한국세포주은행(KCLB)에서 구입하여 실험에 사용하였으며, 각각 1% Penicillin-Streptomycin (Gibco, Grand Island, NY, USA), 10% fetal bovine serum (Gibco, Grand Island, NY, USA)을 함유하는 Rosewell park memorial institute 1640 (RPMI 1640; WELGEN, Korea) 배지와 Dulbecco’s modified Eagle’s medium (DMEM; Gibco, Grand Island, NY, USA) 배지를 사용하여 37°C, 5% CO2 세포 배양기 내에서 배양하였다.
ECE-JLS의 세포에 대한 독성을 확인하기 위해 3-(4,5- dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide (MTT; Sigma-Aldrich Co., St. Louis, MO, USA) assay 방법을 사 용하였다. Vero 세포를 0.5 × 105 cells/mL 농도로 96 well plate에 분주하여 37°C, 5% CO2 세포 배양기에서 24시간 배양한 후, 샘플을 농도 별로 처리하였다. 24시간 후 5 mg/mL의 MTT 용액을 처리하여 3시간 반응시켜 형성된 포르마잔(formazan) 결정을 dimethyl sulfoxide (DMSO; Daejung Chemicals & Metals Co., Ltd., Siheung, Korea) 로 용해시키고 540 nm에서 흡광도를 측정하였다.
ECE-JLS의 처리에 따른 Vero 세포 생존률을 확인하기 위해 MTT assay을 사용하였다. Vero 세포를 0.5 × 105 cells/ mL 농도로 96 well plate에 분주하여 37°C, 5% CO2 세포 배양기에서 24시간 배양한 후, 샘플을 농도 별로 처리하였다. 1시간 후 최종 처리 농도 0.15mM의 hydrogen peroxide 를 첨가하여 24시간 후 5mg/mL의 MTT 용액을 처리하여 3시간 반응시켰다. 형성된 포르마잔(formazan) 결정을 DMSO로 용해시키고 540 nm에서 흡광도를 측정하였다.
ECE-JLS의 ROS 생성 저해 활성을 확인하기 위해 2'-7'- dichlrofluorescin diacetate (DCF-DA; Sigma-Aldrich Co., St. Louis, MO, USA)를 사용하였다. DCF-DA가 ROS에 의해 DCF로 산화되어 초록색을 띠는 형광 물질로 전환되는데 이 를 측정하여 ROS 생성을 확인하였다. Vero 세포를 96 well plate에 0.5×105 cells/mL의 농도로 분주하여 37°C, 5% CO2 세포 배양기에서 24시간 배양한 후, 샘플을 농도 별로 처 리하였다. 1시간 후 세포에 최종 처리 농도 0.15mM의 hydrogen peroxide를 첨가하여 37°C, 5% CO2 세포 배양기에 서 30분 반응시키고 DCF-DA를 처리하였다. 암실에서 5분간 반응 후 형광값(Ex/Em= 485/528 nm)을 측정하여 계산하였다.
세포 투과성 DNA 염색 시료인 Hoechst 33342 (NucBlueTM Live ReadyProbesTM Reagent, Invitrogen, Carlsbad, CA, USA)를 사용하여 핵 형태를 확인하였다. Vero 세포를 3 × 105 cells/mL 농도로 4 well chamber slide (Sigma-Aldrich Co., St. Louis, MO, USA)에 분주하여 37°C, 5% CO2 세포 배양기에서 24시간 배양한 후, 샘플을 농도 별로 처리하였다. 1시간 후 최종 처리 농도 0.15mM의 hydrogen peroxide를 첨가하여 6시간 동안 배양한 뒤 confocal microscope (SP8 Lightning, Leica, Wetzlar, Germany)를 이용하여 세포를 관 찰하였다.
Raw 264.7 세포 생존율은 EZ-Cytox (EZ-3000, DoGenBio Co. Ltd., Seoul, Korea)를 사용하여 측정하였다. 96 well plate에 세포를 2 × 105 cells/mL로 분주하여 37°C, 5% CO2 세포 배양기 내에서 24시간 배양한 후 추출물을 농도 별 로 처리하였다. 1시간 후, 염증 유발물질인 LPS를 최종 농 도 1 μg/mL로 처리하여 24시간 배양하였다. 이후 EZCytox 용액을 처리하여 1시간 30분 뒤에 450 nm에서 흡광 도를 측정하였다.
Raw 264.7 세포를 96 well plate에 2×105 cells/mL로 분주하여 37°C, 5% CO2 세포 배양기 내에서 24시간 배양 한 후 실험에 사용하였다. 각 추출물을 농도 별로 1시간 처리 후 최종 농도 1 μg/mL의 LPS를 처리하였다. 24시간 후 세포배양 상등액 100 μL와 Griess 시약(0.5% sulfanilamide, 0.05% N-(1-naphthyl) ethylenediamine dihydrochloride in 2.5% phosphoric acid) 100 μL를 혼합하여 10분 동안 반응 시킨 후 540 nm에서 흡광도를 측정하였다.
Raw 264.7 세포를 96 well plate에 2×105 cells/mL로 분주하여 37°C, 5% CO2 세포 배양기 내에서 24시간 배양 한 후 농도 별로 추출물을 1시간 처리하였다. 최종 농도 1 μg/mL의 LPS를 처리하여 24시간 후, 세포 배양액으로부 터 분비된 TNF-α의 생성 변화를 mouse TNF-α ELISA Set II kit (BD Biosciences, San Jose, CA, USA)로 측정 하였다. 세포 배양액을 10배 희석한 후 kit 제조사의 프로 토콜에 따라 TNF-α의 단백질 양을 측정하였다.
결과 및 고찰
폴리페놀 또는 페놀 화합물은 효과적인 항산화 효능 및 자유 라디칼 소거 능력이 있으며, 해조류는 이러한 폴리페 놀이 풍부하다고 알려져 있다(Fernando et al., 2016). Wang et al. (2009)의 해조류 추출물의 항산화 연구에 의 하면 홍조류 및 녹조류보다 갈조류가 더 많은 양의 폴리페 놀을 함유하며 용매에 따라 총 폴리페놀 함량과 항산화 활 성에 영향을 준다고 보고되어 있다. 특히 감태는 항산화, 항암 및 항고혈압 등의 기능이 있는 폴리페놀인 플로로탄 닌 등이 함유되어 있다고 알려져 있다(Kim et al., 2014). ECE-JLS100 및 ECE-JLS300의 추출 수율은 각각 31.82± 1.73, 35.83±1.74%였으며, 총 폴리페놀 함량은 각각 156.41± 1.15, 166.16±2.27 mg gallic acid equivalent (GAE)/g으로 나타났다. 또한, ECE-JLS100 및 ECE-JLS300의 플라보노 이드 함량은 각각 343.76±2.40, 373.90±3.67 mg quercetin equivalent (QE)/g으로 나타났다(Table 1). Chan et al. (2015) 은 홍조류 물 추출물의 총 페놀 및 플라보노이드 함량(각 각 6.06 mg/g 및 22.14 mg/g)을 조사하였으며 Farasat et al. (2013)은 갈파래 메탄올 추출물의 총 페놀 및 플라보노 이드 함량(각각 1.37-4.47 mg/g 및 7.96-45.58 mg/g)을 보고 하였다. 이러한 결과와 비교하였을 때, ECE-JLS가 더 높은 총 폴리페놀과 플라보노이드 함량을 갖는 것으로 나타났다. 또한, Lee et al. (2013b)의 연구에 따르면, 일반적인 추출 방법인 물을 용매로 한 감태 추출물의 수율은 28.67±1.4% 와 총 폴리페놀 함량은 47.7 mg/g을 나타내, 물 추출물보 다 용암해수를 이용한 감태 추출물의 수율과 폴리페놀 함 량이 더 높은 것으로 나타났다.
|
SOD는 체내에 유해한 superoxide를 H2O2로 전환시킨 후 catalase에 의해 최종적으로 물과 산소로 변환시켜 활성산 소로부터 세포를 보호하는 항산화 효소이다(Choi et al., 2009). SOD 및 C AT 유사 활성은 superoxide를 정상의 산 소로 전환시킬 수는 없으나 반응성을 억제하여 생체를 산 화적 손상으로부터 보호할 수 있는 물질의 활성을 의미한 다. ECE-JLS의 SOD 및 C AT의 유사 활성을 분석한 결과, ECE-JLS는 용암해수 경도에 상관없이 31.25-2,000 μg/mL 의 범위에서 추출물의 농도가 증가함에 따라 SOD 및 CAT 유사 활성 수준을 증가시키는 것으로 나타났다(data not shown). 특히, SOD 유사 활성의 EC50은 ECE-JLS100 및 ECE-JLS300이 각각 166.94±17.21 및 116.39±24.88 μg/ mL로 나타났으며, CAT 유사 활성의 EC50은 ECE-JLS100 및 ECE-JLS300이 각각 214.59±4.93 및 187.20±10.55 μg/ mL로 나타나, ECE-JLS100보다 ECE-JLS300이 더 높은 활성을 보였다(Table 1). 이러한 결과는 ECE-JLS100과 ECE-JLS300의 총 폴리페놀 및 플라보노이드 함량의 차이 에 영향을 받았을 것으로 판단된다.
항산화제는 여러 질병의 원인과 관련된 자유 라디칼로 인한 손상으로부터 보호해준다(Devasagayam et al., 2004). DPPH 라디칼 소거능 측정은 다양한 화합물의 항산화 효 능을 빠르고 간단하며 정확하게 측정할 수 있으며, 식품 및 음료 등의 항산화 활성을 평가하기 위해 많이 사용되고 있는 방법이다(Marinova & Batchvarov, 2011). Lee (2013) 의 증류수, 수돗물 및 미네랄수를 이용한 오미자 추출액의 이화학적 품질을 평가한 연구에 따르면, 미네랄수를 이용 한 오미자 추출물의 DPPH 소거능이 가장 높은 것으로 보 고되어 있다. 또한 홍조류, 녹조류 및 갈조류 등 여러 해 조류의 항산화 평가 연구에서 갈조류인 Fucus vesiculosus, Fucus serratus와 Ascophyllum nodosum이 가장 우수한 산 소 라디칼 흡수능과 DPPH 소거 활성을 나타냈다고 보고 되어 있다(Wang et al., 2009). ECE-JLS의 농도에 따른 DPPH 라디칼 및 hydrogen perxide 소거능은 양성 대조군 인 0.25mg/mL의 N AC (각각 96.5±0.1, 82.1±5.1%)에 비 해 적지 않은 활성을 나타내었다(Fig. 1). ECE-JLS100 및 ECE-JLS300은 0.25, 0.5, 1, 2 mg/mL의 농도에서 각각 85.4±0.1, 95.5±0.3, 96.7±3.3, 109.2±8.5% 및 82.8±0.1, 96.4± 0.3, 96.3±1.5, 101.2±10.6%의 높은 DPPH 라디칼 소거능 을 나타냈다(Fig. 1A, B). ECE-JLS100 및 ECE-JLS300은 0.25, 0.5, 1, 2 mg/mL의 농도에서 각각 82.3±0.4, 93.9±1.1, 97.5±2.2, 100.9±1.8% 및 80.7±0.2, 94.0±0.2, 101.0±1.8, 102.5±1.0%의 hydrogen peroxide 소거활성을 보였으며 농도 의존적으로 활성이 증가하는 것을 확인하였다(Fig. 1C, D).

MTT assay는 MTT 시약이 세포 내로 흡수되어 보라색의 불용성 포르마잔(formazan)으로 환원시키는 미토콘드리아의 활성을 측정하는 방법으로, 세포 생존율 측정에 사용되는 대표적인 방법이다. ECE-JLS의 세포 독성 결과는 Fig. 2에 나타내었다. Vero 세포에서 추출물을 25, 50, 100, 200 μg/ mL의 농도로 각각 처리하여 독성이 없음을 확인하였고 이 후 위 농도로 실험을 수행하였다.
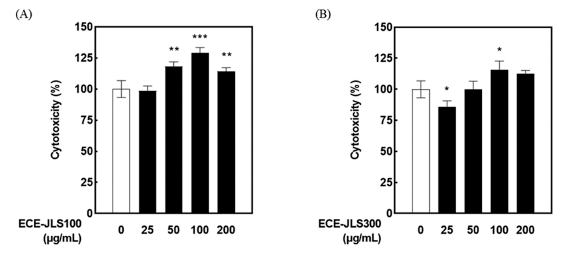
H2O2로 산화 유도된 Vero 세포에 E C E-JLS를 농도 별로 처리하여 세포 생존율 및 ROS 생성을 측정하였다. 그 결 과, ECE-JLS가 H2O2에 의한 산화적 스트레스에 대한 농 도 의존적인 세포 보호효과가 있음을 확인하였다(Fig. 3A, B). 세포 보호효과와 마찬가지로 E C E-JLS는 H2O2 산화에 의한 ROS 생성을 농도 의존적으로 억제하였다. H2O2 처 리군에 비해 ECE-JLS100은 25, 50, 100, 200 μg/mL 농도 에서 각각 40.9±0.7, 32.7±1.5, 26.0±0.9, 21.4±0.4%의 ROS 를 저해하는 것으로 나타냈다(Fig. 3C). 또한, ECE-JLS300 은 25, 50, 100, 200 μg/mL의 농도에서 각각, 45.1±1.2, 36.4±0.4, 30.2±0.5 23.9±0.3%의 ROS를 저해하는 것으로 나타냈다(Fig. 3D). H2O2를 처리한 Vero 세포에서 Hoechst 33342 염색 후 핵 형태를 관찰한 결과, ECE-JLS를 전처리 한 세포에서 농도의존적으로 세포사멸이 감소하는 것을 확 인하였다(Fig. 4). 따라서 E C E-JLS가 H2O2로 유도된 Vero 세포에서 우수한 세포 보호효과와 ROS 생성 억제효능이 있음을 확인하였다. 이전 연구에 따르면 감태에서 추출한 플로로탄닌, phlorofucofuroeckol-A 등이 ROS 소거능을 갖 고 있는 것으로 알려져 있다(Heo et al., 2005;Lee et al., 2013a). 이러한 폴리페놀이 ECE-JLS에도 함유되어 있어 항산화 활성을 나타내는 것으로 판단된다.
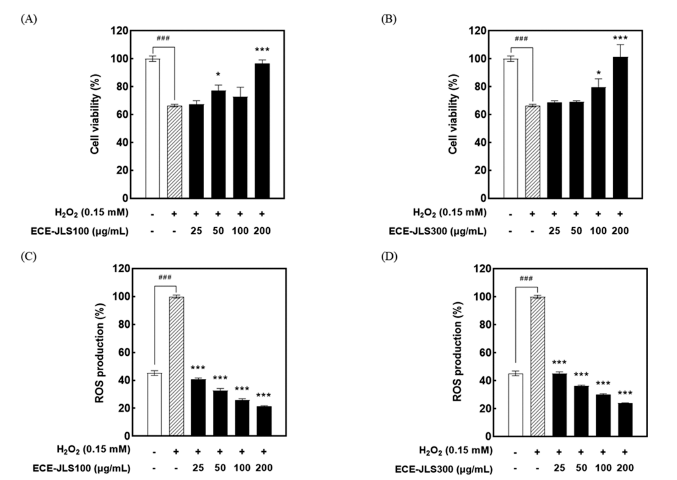

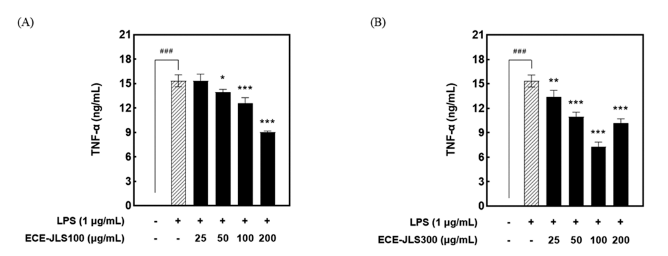
ECE-JLS의 항염증 활성은 LPS로 자극된 Raw 264.7 세 포를 사용하여 측정하였다. LPS 처리군에 비해 E C EJLS100은 25, 50, 100, 200 μg/mL의 농도에서 각각 90.5± 2.6, 82.6±3.3, 68.7±2.1, 55.0±2.4%로 유의하게(P<0.01) NO 생성을 감소시켰다(Fig. 5C). ECE-JLS300은 25, 50, 100, 200 μg/mL의 농도에서 각각 85.7±0.5, 79.1±2.3, 66.7±3.0, 56.5±1.8%로 유의하게(P<0.01) NO 생성을 저해하였다(Fig. 5D). 이를 통해 ECE-JLS가 LPS에 의해 유도된 NO 생성 을 농도 의존적으로 억제하여 효과적인 항염증 활성이 있 는 것을 확인하였다. ECE-JLS가 LPS로 유도된 NO 생성 을 저해하는 활성을 나타냈으므로, 전염증 사이토카인인 TNF-α의 생성을 확인하였다(Fig. 6). 그 결과 LPS를 처리 하였을 때 15.34±0.73 ng/mL의 TNF-α가 분비되었으나, ECE-JLS의 처리에 의해 TNF-α의 분비가 억제된 것을 확 인하였다. 따라서 ECE-JLS는 NO와 TNF-α의 생성을 효과 적으로 감소시키는 활성을 나타내어 천연 항염증제로서의 가능성이 확인되었다. 다양한 in vitro 및 in vivo 실험에서 여러 페놀 화합물이 항염증 작용을 하는 것으로 알려져 있 으며, 산화질소(NO)와 관련된 만성 염증성 질환의 치료에 효과적인 것으로 보고되어 있다(Jiang & Dusting, 2003). 또한 감태 유래 추출물의 항염증 활성은 다양하게 보고되 어 있으며, 에탄올 등을 이용한 갈조류 추출물의 플로로탄 닌이 LPS로 유도된 Raw 264.7 세포의 NO 및 전염증성 사이토카인 생성을 효과적으로 억제한다고 보고되었다 (Yang et al., 2010;Lee et al., 2012a;Asanka Sanjeewa et al., 2019). 따라서 ECE-JLS에도 플로로탄닌과 같은 폴리페 놀 성분이 함유되어 있어 NO 및 TNF-α의 생성을 저해하 는 것으로 판단된다.
요 약
본 연구에서는 감태 추출 시에 용매로서 제주 용암해수 의 잠재적 활용 가능성에 대해 확인하기 위하여 100, 300 mg/L 경도의 제주 용암해수를 이용하여 감태를 추출한 후, 이 추출물의 화학적 특성, 항산화 및 항염증 효능을 분석 하였다. 그 결과 용암해수를 이용한 감태 추출물은 약 160 mg GAE/g 및 약 350 mg QE/g의 폴리페놀 및 플라보노이 드를 함유하며 우수한 DPPH 라디칼 및 hydrogen peroxide 소거능을 나타냈다. 또한, 용암해수 경도에 따른 차이는 없 었으나 세포 독성에 영향을 미치지 않으면서 항산화뿐만 아니라 항염증 활성을 갖는 것을 확인하였다. 따라서 제주 용암해수를 용매로 한 감태 추출물은 향후 기능성 식품 및 화장품 개발이 가능할 것으로 기대된다. 제주 용암해수는 영양염류와 미네랄 등이 풍부하여 항비만 및 피부 보습 등 의 생리활성이 우수하다고 알려져 있으며 다른 해양 수자 원에 비해 채수가 용이하여 심층해양수를 대체할 수자원으 로 주목받고 있다. 하지만 현재 국내에는 경도 100-500 mg/L의 제주 용암해수 제품이 판매되고 있을 뿐, 산업제품 개발 시에 발생하는 이점에 관한 실질적인 연구는 부족한 실정이다. 본 연구에서 제주 용암해수를 이용한 추출물의 산업적 이용 가능성을 확인하였으나, 제주 용암해수의 활 발한 활용을 위해 이를 이용한 다양한 추출물의 생리활성 분석 연구 등이 지속적으로 필요할 것으로 생각된다.