서 론
고령화 사회의 가속화와 더불어 건강에 대한 소비자들의 관심이 증대됨에 따라 건강증진과 질병예방의 목적으로 기 능성식품에 대한 수요가 증가하고 있다. 특히 세계적으로 광범위한 연구를 통하여 장내마이크로바이옴(intestinal microbiome)이 장 질환뿐만 아니라 대사질환, 아토피, 노화, 정신질환 등 다양한 질병과 관련이 있다는 연구 결과가 보 고되면서, 장내미생물 및 장건강과 밀접하게 연관된 프로바 이오틱스(probiotics) 시장이 급성장 하고 있다. 프로바이오 틱스는 ‘적정량을 섭취하였을 때 숙주의 건강에 유용한 작 용을 하는 살아있는 미생물’로 장내 균총 개선, 장 점막 기 능 강화, 변비 개선, 아토피 개선, 콜레스테롤 감소, 항비만, 항산화, 항염증, 면역조절, 중추신경계 기능 향상 등 다양한 생리활성 효능이 있는 것으로 보고되고 있다(Jayaprakasha et al., 2005; Ohashi & Ushida, 2009; Choi, 2019). 대표적 으로 이용되는 프로바이오틱스 균주는 Lactobacillus 속, Bifidobacterium 속, Enterococcus 속 등으로, 프로바이오틱 스로 이용되기 위해서는 인체에 무해한 안전한 generally recognized as safe (GRAS) 균주로 인정을 받아야 하며, 섭취 후 장까지 도달하여 유용한 효과를 나타내야 하므로 기본적으로 위산과 담즙에 대한 내성, 장 점막과 상피세포 에 대한 부착능, 병원균에 대한 항균활성을 갖고 있어야 한다(Lee et al., 2016). 하지만 생균의 경우 열과 산에 취 약하다는 단점을 갖고 있고 생균의 과다 복용에 따른 부작 용 발생 사례가 증가하고 있어, 생균보다 안전한 사균체 (파라프로바이오틱스)와 대사산물(포스트바이오틱스)을 이 용한 연구가 주목을 받고 있다.
파라프로바이오틱스(paraprobiotics)는 비활성화된 프로바 이오틱스 균주의 사균체로 생균에 비하여 매우 안전하고 생균 처방이 어려운 고위험군에게 대체제로 처방할 수 있 으며, 보관이 용이하며, 천연첨가물로써 건강기능식품, 일 반식품, 제약, 화장품 등 광범위한 분야에 적용을 할 수 있는 장점이 있다(Kim et al., 2018; Piquéet et al., 2019). 최근에는 프로바이오틱스의 열처리 과정에서 용출되는 peptidoglycan, nucleic acid, lipoteichoic acid, lipoprotein, exopolysaccharide (EPS), cell wall protein 등의 세포 성분 이, 항산화, 항염, 면역조절, 장내 미생물 균총 조절, 장내 세포장벽 강화, 콜레스테롤 저하, 인지기능 향상 등 다양한 생리활성을 나타낸다고 보고되었다(Lee et al., 2015; Kim, 2018; Akter et al., 2020; Nataraj et al., 2020). 사균체의 제조 방법으로 열처리, 자외선, 고압, 초음파 처리, 옴가열 기술 등이 있으며, 그 중에서 열처리에 의한 방법은 공정 이 단순하고 멸균처리가 가능하며 온도에 따라 세포벽의 파괴 정도를 조절할 수 있는 장점이 있어 가장 널리 이용 되고 있다(Adams, 2010; de Almada et al., 2016). 하지만 현재까지 유산균을 완전히 사멸시키는 온도조건을 설정하 여 사균체를 제조한 후 열처리에 따른 생리활성 효과를 평 가한 연구는 거의 전무한 실정이다.
생체 대사과정에서 발생하는 활성산소종(reactive oxygen species, ROS)이 스트레스, 흡연, 환경오염, 질병 등에 의해 체내에 과도하게 축적되면 세포의 구성성분인 지방, 단백질, DNA 등이 산화적으로 손상되어 염증을 유발하고 암, 심혈 관계질환, 당뇨, 뇌졸중, 알츠하이머 등과 같은 다양한 질병 을 유발할 수 있다(Reddy et al., 2009). 염증(inflammation) 은 내독소, 세균 감염 등 외부 자극에 의한 손상으로부터 신체를 방어하기 위한 작용기작으로, 정상적인 염증반응은 nitric oxide (NO), cyclooxygenase 2 (COX-2)에 의해 생성 되는 prostaglandin E2, 염증성 cytokine 등 염증성 매개인자 들이 관여하는 대식세포의 활성화에 의해 조절된다. 하지만 과량의 산화적 스트레스 또는 그람음성 세균의 외막 성분인 lipopolysaccharide (LPS) 등에 의해 과도하게 활성화된 대식 세포는 염증성 매개인자들의 발현을 촉진하여 염증을 악화 시키고 만성 염증을 유발하여 암, 심혈관질환, 뇌졸중, 퇴행 성신경질환 등 각종 질환의 발병 요인으로 작용한다. 현재 까지 우리나라의 전통발효식품에서 분리한 유산균이 항산화 및 항염 효능을 갖고 있다는 여러 연구 결과가 보고되었지 만, 유산균의 열처리 사균체를 활용한 생리활성 연구는 매 우 부족하므로 이에 대한 광범위한 연구가 필요하다.
본 연구에서는 김치로부터 분리한 유산균 중 내산성, 내 담즙성, 항산화 활성 및 항균 활성이 우수한 2종의 균주를 선별하고 프로바이오틱스 활성을 평가하였다. 또한 선별한 2종의 유산균을 다양한 온도 조건에서 열처리 하여 멸균된 사균체를 제조하고 항산화 활성과 항염 활성을 측정함으로 써 사균체 연구의 기초자료를 확보하고자 하였다.
재료 및 방법
본 연구에 사용된 유산균는 천안과 아산지역의 전통시장 에서 수집한 김치로부터 분리하여 사용하였다. 프로바이 오틱스 유산균 Lactiplantibacillus plantarum ATCC14917 (KCTC3108)과 병원성 지시균주인 Escherichia coli KCTC1039, Staphylococcus aureus KCCM11335는 생물자원 센터(Daejeon, Korea)에서 분양받아 사용하였다. 인간 결장 유래 HT-29 세포(KCLB30038)와 마우스 유래 RAW264.7 세포(KCLB40071)는 한국세포주은행(Seoul, Korea)에서 분양받아 사용하였다. Pepsin, DPPH (1, 1-diphenyl 1-2- picrylhydrazyl), ABTS (2,2'-azino-bis 3-ethylbenzothiazoline- 6-sulphonic acid), MTT (3-(4,5-dimethyl thiazol-2-yl)-2,5- diphenyl tetrazolium bromide), LPS (lipopolysaccharide) 등 시약은 S igma-Aldrich C o. ( St. Louis, M O, U SA)에서 구 입하였다.
김치시료에 멸균 생리식염수를 1:9 (w/v) 비율로 첨가하 고 Stomacher (BagMixer 400W, Interscience, Saint Nom, France)를 이용하여 5분간 마쇄하였다. 마쇄한 용액을 십 진법으로 희석하여 EdMan Rogosa Sharpe (MRS, DifcoTM, Franklin Lakes, NJ, USA) 고체배지에 도말하고 37° C, overnight 배양하였다. MRS 고체배지에서 분리된 단일 콜 로니를 BCP 고체배지(Eiken chemical Co., Ltd., Tokyo, Japan)에 도말하여 배양한 후 노란색 환을 생성하는 콜로 니를 유산균으로 간주하고 선별하였다. 선별된 유산균주의 Gram 염색성과 catalase 활성을 확인하였으며, 현미경 (AE31 Trinocular, Microscope World, Carlsbad, USA)을 이용하여 형태학적 특성을 관찰하였다. 16S rRNA 유전자 염기서열 분석에 의해 선별된 유산균주를 동정하였다. 선별 된 균주의 16S rRNA 유전자 염기서열은 universal rRNA gene primer (27F and 1492R)를 이용하여 증폭하였으며, BIOFACT사 (Daejeon, Korea)에 염기서열 분석을 의뢰하였 다. 분석된 16S rRNA 염기서열 데이터는 National Center for Biotechnology Institute (NCBI)의 BLAST online program 을 이용하여 Genbank database와 비교하였다.
인간 결장 유래 HT-29 세포는 Roswell Park Memorial Institue 1640 (RPMI, Welgene, Gyeongsan, Korea)에 10% Fetal Bovine Serum (FBS, GW Vitek, Seoul, Korea)과 1% penicillin-streptomycin solution (Cytiva, Marlborough, MA, USA)을 혼합하여 배양하였다. 마우스 유래 RAW264.7 세포 는 Dulbecco’s modified Eagle’s medium (DMEM, Welgene) 에 10% FBS와 1% penicillin-streptomycin solution을 혼합 하여 배양하였다. 두 세포주 모두 37°C, 5% CO2 환경을 유지하는 incubator (Thermo Fisher, Weltham, MA, USA) 에서 배양하였다.
유산균의 내산성과 내담즙성 평가는 Lertcanawanichakul et al. (2015)의 방법을 일부 수정하여 진행하였다. MRS 액체배지에서 37°C, overnight 배양한 유산균 배양액을 실 험에 사용하였다. 내산성 평가를 위하여 0.3% pepsin (Sigma-Aldrich)이 첨가된 MRS 액체배지(pH 2.5)에 유산 균을 약 1 × 107 CFU/mL 수준이 되도록 1% (w/v) 접종하 고 3시간 반응시켰다. 반응액을 MRS 고체배지에 도말하 여 배양한 후 생균수를 측정하여 균의 생존율을 확인하였 다. 내담즙성 평가를 위하여 0.3% oxgall (DifcoTM)이 첨가 된 MRS 액체배지에 유산균을 약 1 × 107 CFU/mL 수준이 되도록 1% (w/v) 접종하고 24시간 반응시킨 다음 MRS 고체배지에 도말하여 배양한 후 생균수를 측정하여 균의 생존율을 확인하였다.
유산균의 항균활성은 Kim et al. (1999)의 방법을 일부 수정하여 측정하였다. MRS 액체배지에서 배양(37°C, overnight)한 유산균 배양액을 원심분리(12,000×g, 4°C, 10 min, CT15RE, Hitachi Chemical Co., Tokyo, Japan)하여 균체를 제거하고 0.45 μm syringe filter로 여과한 후 상등액 을 실험에 사용하였다. 병원성 지시균주(E. coli KCTC1039, S. aureus KCCM11335)를 tryptic soy broth (TSB, DifcoTM) 에 각각 접종하고 37° C, overnight 배양한 다음 0.85% saline 용액으로 약 1 × 106 CFU/mL 수준으로 희석하여 사 용하였다. 희석한 지시균주를 Nutrient agar (NA. DifcoTM) 에 100 μL씩 균일하게 접종하고 멸균한 면봉으로 도말한 후 37°C에서 1시간 배양하였다. 예비 배양한 평판배지 위 에 paper disc (8 mm)를 올려놓고 유산균 상등액을 100 μL 씩 균일하게 분주하여 흡수시킨 후 37°C에서 24시간 배양 하였다. 유산균의 항균활성은 paper disc 주변에 형성된 억 제환의 크기를 측정하여 평가하였다.
결장 유래 HT-29 세포에 대한 유산균의 부착능은 Shin et al. (2015)의 방법을 일부 수정하여 측정하였다. MRS 액체배지에서 배양(37°C, overnight)한 유산균을 PBS 용액 (pH 7.2)으로 두 번 세척한 후 1 × 109 CFU/mL 수준으로 조정한 현탁액을 사용하였다. HT-29 세포를 6 well plate (SPL Life Sciences Co., Ltd, Pocheon, Korea)의 RPMI 배 지에 1 × 106 CFU/mL 수준으로 접종하고 37°C, 5% CO2 조건에서 24시간 배양한 후 상등액을 제거하였다. 상등액 이 제거된 HT-29 세포에 RPMI 1 mL와 현탁액 1mL를 분주하여 37°C, 5% CO2 조건에서 1시간 동안 반응하였다. 세포를 PBS 용액으로 3회 세척하여 부착되지 않은 유산균 을 제거한 후 Triton X-100 (Samchun, Seoul, Korea) 200 μL를 가하여 세포에 부착된 유산균을 회수하였다. 회수한 유산균을 십진법으로 희석하고 MRS 고체배지에 도말하여 배양한 후 생균수를 측정하고 다음의 계산식에 따라 유산 균의 장부착능(%)을 계산하였다.
MRS 액체배지에서 배양(37°C, overnight)한 유산균을 PBS 용액으로 두 번 세척하고 약 1 × 109 CFU/mL 수준이 되도록 조정한 후 70°C, 80°C, 100°C, 121°C의 온도에서 각각 15, 30, 60, 90, 120, 150, 180분 동안 Autoclave (AC-12, eion Tech, Daejeon, Korea)를 이용하여 열처리하 였다. 열처리한 균액을 주입평판법(pour plate method)을 이용하여 MRS 평판배지에 1mL씩 접종하고 37°C에서 24 시간 배양한 후 생균수를 측정하여 사멸율을 확인하였다. 열처리 조건에 따른 유산균의 사멸율을 파악하기 위해 생균 수가 10배 감소할 때 걸리는 시간인 D값(D-value, decimal reducion time)을 계산하였다. 유산균이 완전히 사멸되는 열처리 조건인 70°C (180분), 80°C (120분), 100°C (30분), 121°C (15분)에서 열처리 후 동결건조하였으며, 이후 사균체 실험은 동결건조된 사균체를 1mg/mL (약 1× 109 CFU/ mL)의 농도로 PBS 용액(pH 7.4)에 현탁하여 사용하였다.
사균체의 세포독성 평가는 HT-29 세포를 사용하여 MTT 방법에 의해 측정하였다(Chuah et al., 2019). HT-29 세포 (약 1×105 cell/mL)를 RPMI 배지에 접종하고 96 well plate에 100 μl씩 분주하여 37°C, 5% CO2 조건에서 24시 간 배양하였다. 세포 상등액을 제거한 후 RPMI 배지 180 μl와 유산균 사균체(1, 2, 5, 10 mg/mL) 20 μl를 가하여 37°C, 5% CO2 조건에서 24시간 배양하였다. 배양 후 상등 액을 제거하고 PBS 용액으로 3번 세척한 다음 RPMI 배 지 180μl와 MTT 시약(5 mg/mL) 20 μl를 가하고 37° C, 5% CO2에서 4시간 반응하였다. 반응 후 상등액을 제거하고 Dimethyl sulfoxide (DMSO, Daejung, Siheung, Korea) 100 μl를 가하여 반응에 의해 생성된 formazan 침전물을 용해시킨 후 microplate reader (Biochrom, Cambridge, UK) 를 이용하여 570 nm에서 흡광도를 측정하였다. 공시험은 PBS 용액(pH 7.4)을 사용하였으며 다음의 계산식에 따라 세포 생존율(%)을 계산하였다.
DPPH 라디칼 소거능은 Wang et al. (2016)의 방법을 일 부 수정하여 진행하였다. 유산균 사균체(1 mg/mL) 2 mL와 OD517 nm = 1.2로 조정한 0.4mM DPPH 용액 2mL를 혼합 하고 암실에서 30분간 반응시킨 후 혼합액을 원심분리 (12,000×g, 4°C, 10 min)하여 상등액을 회수하였다. 회수한 상등액의 흡광도를 OD517 nm에서 측정하고 다음의 계산식에 따라 DPPH 라디칼 소거능(%)을 계산하였다. 대조구는 PBS 용액(pH 7.4)을 사용하였다.
ABTS (2,2'-azino-bis 3-ethylbenzothiazoline-6-sulphonic acid) 라디칼 소거능은 Re et al. (1999)의 방법을 일부 수 정하여 진행하였다. 0.2M sodium phosphate buffer (pH 7.4)에 3.9 mg/mL의 7mM ABTS와 1.3 mg/mL의 5mM Potassium persulfate를 혼합하고 암실에서 16시간 반응시켜 ABTS+ 라디칼을 만들었다. 증류수를 이용하여 ABTS+ 라 디칼의 농도를 OD734 nm = 0.7로 조정한 후 실험을 진행하였 다. ABTS+ 라디칼 용액 1.35mL에 유산균 사균체 150 μL 를 첨가하고 호일로 감싸 37°C에서 10분간 반응한 후 원 심분리(12000×g, 4°C, 10 min)하여 상등액을 회수하였다. 회수한 상등액의 흡광도를 OD734 nm에서 측정하고 다음의 계산식에 따라 ABTS 라디칼 소거능(%)을 계산하였다. 대 조구는 PBS 용액(pH 7.4)을 사용하였다.
유산균 사균체의 NO 생성 억제 활성은 RAW264.7 세포 를 이용하여 진행하였다(Son & Kang, 2021). RAW264.7 세포를 96 well plate의 DMEM (1% penicillin, 10% FBS) 배지에 1 × 105 cell/well 수준으로 접종하여 37°C, 5% CO2 에서 24시간 배양하였다. 배양 후 상등액을 제거하고 LPS (1 mg/μL)가 첨가된 DMEM 배지 180 μl와 유산균 사균체 20 μl를 가하여 37°C, 5% CO2 조건에서 24시간 배양하 였다. 배양 후 세포 상등액 100μl에 griess 시약(0.1% naphthylethyl : 1% sulfanilic cid : 5% phosphoric acid) 100 μl를 가한 후 15분간 반응시켰다. Microplate reader를 이용 하여 540 nm에서 흡광도를 측정하고 다음 계산식에 따라 NO 생성 억제 활성(%)을 계산하였다. 공시험은 PBS 용액 (pH 7.4)을 사용하였다.
TNF-α, iNOS, COX-2 mRNA 발현은 quantitative reverse transcription-PCR (qRT-PCR) 방법을 이용하여 진행하였다 (Cheon et al., 2020). RAW264.7 세포를 6 well plate에 1 × 106 cell/well 농도로 접종한 후 상등액을 제거하였다. 각 well에 1 μg/mL의 LPS가 첨가된 DMEM 배지와 1mL 의 사균체(1 mg/mL)를 첨가한 후 12시간 반응하였다. 반응 후 세포를 PBS 용액으로 두 번 세척하고 세포를 회수하여 PCR 분석에 사용하였다. Total RNA는 RNeasy mini kit (Qiagen, Hilden, Germany)를 이용하여 추출하였으며 NanoDrop (Biochrom)을 이용하여 농도를 정량하였다. cDNA는 2 μg의 RNA를 주형으로 cDNA synthesis kit (TAKARA, Shigaken, Japan)를 이용하여 합성하였다. cDNA 합성과 PCR은 StepOnePlusTM Real-time PCR System (Thermo Fisher)을 이용하였으며 SYBR green (Cosmogenetech, Seoul, Korea) 10 μL, cDNA 2 μL, primer (Cosmogenetech) 2 μL, 증류수 6 μL를 혼합하여 총 20 μL의 용량으로 PCR을 수행하였다. Reference gene으로 GAPDH 를 사용하였으며, delta-delta Ct (ΔΔCt) 법으로 계산하여 결과를 분석하였다. PCR에 사용한 primer는 코스모진텍 (Seoul, Korea)에서 구매하였으며 Table 1과 같다.
결과 및 고찰
BCP 고체배지에서 노란색 환을 형성하고 크기가 상대적 으로 큰 200개의 콜로니를 유산균으로 간주하고 1차 선별 하였다. 1차 선별균주 중에서 생육능, 내산성, 내담즙성, 항 산화활성(DPPH 및 ABTS 라디칼 소거능)이 우수한 20종 의 균주를 2차 선별한 후 생균과 비교하여 사균체의 항산 화 활성이 우수한 2종의 균주(SMF743, SMF796)를 최종 선별하였다. 최종 선별된 2종 균주의 형태학적 및 생화학 적 특성을 분석한 결과, Gram 양성의 간균으로 catalase 음성 반응을 나타내는 것이 확인되었다. 16S rRNA 유전 자 염기서열을 바탕으로 NCBI nucleotide BLAST search 를 진행하였으며, Genbank database에서 상동성을 비교한 결과, 분리한 2종의 균주는 Limosilactobacillus fermentum, Lactiplantibacillus plantarum과 각각 99.79%, 99.05%의 높은 상동성을 나타내어 Limosilactobacillus fermentum SMF743과 Lactiplantibacillus plantarum SMF796으로 명명 하였다.
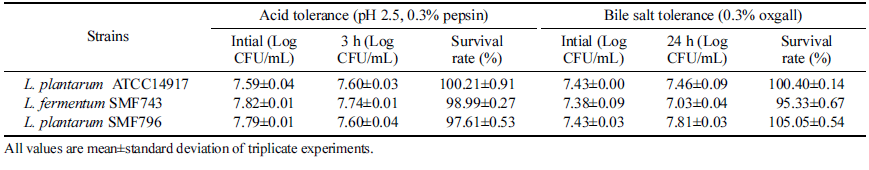
유산균이 프로바이오틱스로서 기능을 발휘하기 위해서는 낮은 pH 조건인 위산과 담즙이 존재하는 환경에서 생존 하여 최종 목적 부위인 장에 도착해야 하므로, 유산균의 내산성과 내담즙성은 프로바이오틱스 균주 선정을 위한 가장 중요한 요소 중의 하나이다(Sim et al., 1995). 선별 된 유산균의 내산성과 내담즙성은 Table 2와 같다. pH 2.5의 인공위액에서 Limosilactobacillus fermentum SMF743 과 Lactiplantibacillus plantarum SMF796의 생존율은 각 각 98.99%, 97.61%로 상업용 프로바이오틱스 균주인 Lactiplantibacillus plantarum ATCC14917 (100.21%)과 유 사한 생존율을 나타내었다. Oxgall이 0.3% 첨가된 배지에서 SMF743과 SMF796의 생존율은 각각 95.33%, 105.05%로 ATCC1491 (100.40%)과 유사하거나 높은 생존율을 보였다 (Table 2). Lee et al. (2016)은 pH 2.5의 조건에서 4종의 Lactiplantibacillus plantarum 유산균이 72.2-93.4%의 생존율 을 나타내었다고 보고하였으며, Tulumoglu et al. (2013)은 0.3% bile salt 환경에서 Lactiplantibacillus pentosus T13과 Lactiplantibacillus plantarum T15 균주가 각각 96%와 93% 의 생존율을 나타내었다고 보고하였다. 따라서 본 연구에 서 선별한 2종의 유산균은 내산성과 내담즙성이 우수한 균 주로 프로바이오틱스 선별 조건에 부합한다고 볼 수 있다.
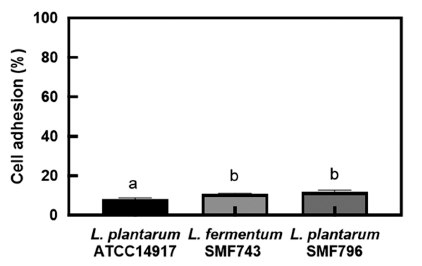
유산균이 장내에서 생존하면서 인체에 유용한 효과를 발 휘하기 위해서는 위와 십이지장을 통과한 후 장에 도달하 여 장세포에 부착할 수 있는 능력이 요구된다(Dunne et al., 2001). 인간 결장 유래 HT-29 세포에 대한 유산균주의 장부착능은 Fig. 1과 같다. SMF743과 SMF796의 장부착 능은 각각 10.78%와 10.59%로, ATCC14917 (8.18%)와 비 교하여 높은 장부착능을 나타내었다. Jung & Kim (2015) 은 프로바이오틱스 활성을 나타내는 L. plantarum BSM-2 와 EHJ-1 균주의 HT-29 세포에 대한 장부착능이 각각 4.01%, 4.62%로 보고한 바 있다. 따라서 본 연구에서 선별 된 SMF743과 SMF796 균주는 내산성과 내담즙성이 우수 하고 장세포에 대한 부착능이 우수하여 프로바이오틱스 균 주의 조건에 부합하는 것으로 사료된다. 유산균은 장관 상 피세포벽에 부착되어 mucin 생산을 촉진하고 병원균의 부 착을 억제함으로써 상피세포의 손상을 막아 장내 병원균으 로부터 숙주의 방어체계 시스템을 강화한다고 알려졌다 (Saulnier et al., 2009).
병원성 지시균주인 E. coli KCTC1039와 S. aureus KCCM11335에 대한 유산균주의 항균활성을 측정한 결과는 Table 3과 같다. SMF743은 E. coli KCTC1039에 대하여 10 mm의 저해환을 생성하였으며, SMF796은 ATCC14917 (12.0 mm) 보다 우수한 15.00 mm의 저해환을 생성하였다. S. aureus KCCM11335에 대하여 SMF743, SMF796, ATCC14917은 각각 16.67, 14.83, 17.00 mm의 높은 저해 환을 생성하였다. 따라서 본 연구에서 선별된 SMF743과 SMF796 균주는 항균활성이 우수하여 프로바이오틱스 균 주의 조건에 부합하는 것으로 확인되었다. 프로바이오틱스 활성이 있는 유산균은 장내에서 젖산, 아세트산, 박테리오 신, H2O2 등의 항균물질을 생산하여 유해균의 증식을 억제 하고 장내 균총을 개선하는 등의 정장작용을 갖고 있다고 보고되었다(Herich & Levkut, 2002).
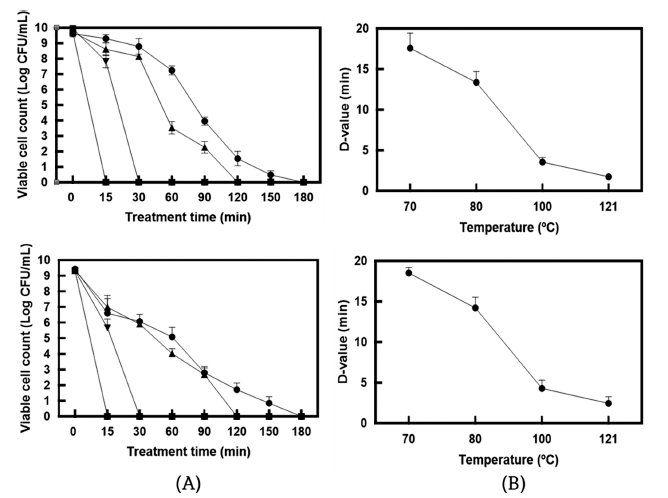
완전히 사멸된 유산균체를 제조하기 위한 열처리 조건을 설정하기 위하여 다양한 온도조건에서 유산균을 열처리한 후 생균수를 측정하였다. 즉, MRS 액체배지에서 배양 (37°C, overnight)한 유산균을 PBS 용액으로 두 번 세척하 고 균체(1 mg/mL =약 1× 109 CFU/mL)를 회수한 후 70, 80, 100, 121°C의 온도 조건에서 15, 30, 60, 90, 120, 150, 180분 동안 열처리하여 생균수의 변화를 측정하였다 (Fig. 2A). 3종의 유산균 균체(1 mg/mL) 모두 70° C에서 180분, 80°C에서 120분, 100°C에서 30분, 121°C에서 15분 의 열처리에 의해 완전히 사멸되는 것이 확인되었다. 열처 리에 따른 각 균주의 D값(일정한 온도에서 90%의 미생물 을 사멸하는데 걸리는 시간)은 Fig. 2(B)에 나타내었다. 70, 80, 100, 121°C의 온도에서 처리한 SMF743의 D값은 각각 17.96, 11.98, 2.99, 1.50분, SMF796의 D값은 각각 19.15, 12.77, 3.19, 1.60분으로 나타났다. Kim et al. (2017) 은 70, 80, 90° C에서 중탕 열처리한 Lacticaseibacillus rhamnosus IDCC3201 균주의 D값이 각각 21.0, 9.8, 4.9분 으로 보고한 바 있다. 본 연구 결과 70°C (180분), 80°C (120분), 100°C (30분), 121°C (15분)을 유산균 사균체 제 조를 위한 열처리 조건으로 선정하고 이후 실험을 진행하 였다.
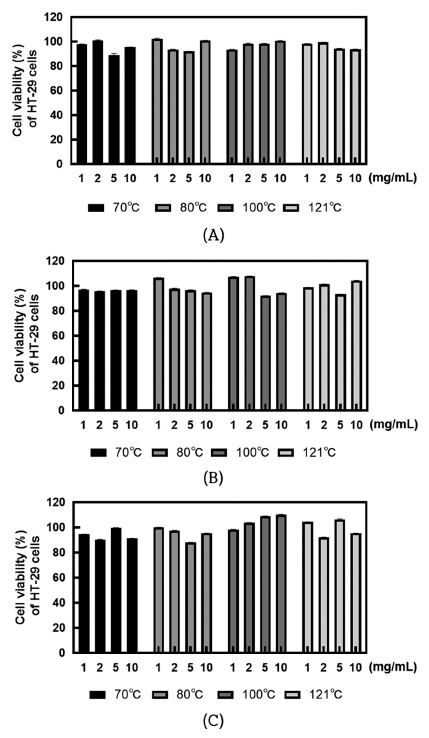
MTT assay를 이용하여 열처리 사균체의 농도에 따른 HT-29 세포의 세포 생존율을 분석한 결과는 Fig. 3과 같다. HT-29 세포에 SMF743, SMF796, ATCC14917 균주의 열 처리 사균체를 1, 2, 5, 10 mg/mL의 농도로 처리한 후 HT-29 세포의 생존율을 평가하였다. 3종의 균주 모두 열처 리 온도 및 사균체 농도에 따른 뚜렷한 세포 생존율의 변 화는 없었으며, 10 mg/mL의 고농도에서도 90% 이상의 높 은 생존율을 보였다.
 ), 70°C (180 min); (
), 70°C (180 min); ( ), 80°C (120 min); (
), 80°C (120 min); (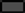 ), 100°C (30 min); (
), 100°C (30 min); ( ), 121°C (15 min).
), 121°C (15 min).
70°C (180분), 80°C (120분), 100°C (30분), 121°C (15분)의 열처리에 의해 제조한 유산균 사균체(1 mg/mL)의 DPPH 라디칼 소거능과 ABTS 라디칼 소거능을 측정한 결과는 Fig. 4와 같다. SMF743, SMF796, ATCC14917의 사균체 모두 80°C와 100°C 보다 70°C와 121°C에서 항산화 활성 이 우수하였으며, 동일한 온도 조건에서 사균체가 생균 보 다 높은 항산화 활성을 나타내었다. SMF743 사균체, SMF796 사균체는 각각 70°C에서 19.46%, 21.12%, 121°C 에서 20.89%, 20.03%의 DPPH 라디칼 소거능을 보였으며, SMF743 생균(13.85%), SMF796 생균(17.21%)과 비교하여 유의적으로 높은 소거능을 보였다(p<0.05). ABTS 라디칼 소거능의 경우에도 70°C와 121°C에서 열처리된 사균체의 라디칼 소거능이 높은 것으로 확인되었다. SMF743 사균체, SMF796 사균체는 각각 70°C에서 39.43%, 34.08%, 121°C 에서 48.79%, 39.60%의 소거능을 보였으며, SMF743 생균 (32.91%), SMF796 생균(32.70%)과 비교하여 유의적으로 높은 소거능을 나타내었다(p<0.05).
 ), L. plantarum ATCC14917; (
), L. plantarum ATCC14917; ( ), L. fermentum SMF743; (
), L. fermentum SMF743; ( ), L. plantarum SMF796.
), L. plantarum SMF796.
Cho et al. (2021)은 121°C에서 15분 열처리한 26종의 유산균 사균체(1 mg/mL)가 0.13-35.88% 범위의 DPPH 라 디칼 소거능을 보였으며, Son & Kang (2021)은 121°C에 서 15분 열처리한 8종의 L. plantarum 사균체(1 mg/mL)가 15.14-31.29%의 ABTS 라디칼 소거능을 보였다고 보고 하였다. 따라서 본 연구에서 선별된 SMF743 사균체와 SMF796 사균체가 높은 DPPH와 ABTS 라디칼 소거능을 나타낸다는 것을 알 수 있으며, 향후 기능성 항산화제로 활용 가능할 것으로 판단된다. 유산균의 항산화 활성은 대 사과정에서 생성된 glutathione과 α-tocopherol, 세포질에 존재하는 polysaccharide, 세포 표면의 EPS 물질 등이 관 여한다고 알려져 있다(Kim & Park, 2021). 또한 열처리에 의해 세포에 존재하는 당류와 단백질이 반응하여 항산화활 성을 갖는 Maillard 반응물을 생산하는 것으로 보고되었다 (Liu et al., 2011). 본 연구에서 온도 조건에 따라 사균체 의 항산화 활성에서 뚜렷한 차이가 보였는데, 이는 열처리 온도에 따라 세포질과 세포벽에서 용출되는 항산화물질과 생성된 Maillard 반응물의 농도 및 구조적인 차이에 기인 되는 것으로 생각된다.
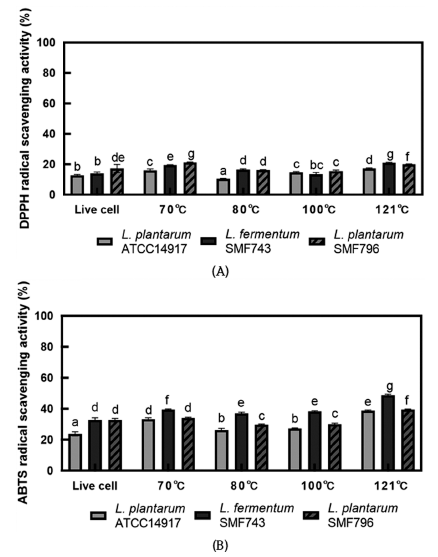
LPS 등 외부자극에 의해 과도하게 활성화된 대식세포는 inducible nitric oxide synthases (iNOS) 발현에 의해 Larginine으로부터 nitric oxide (NO)의 생성을 촉진시키며, 과도한 NO 생성은 염증 반응을 촉진하여 조직의 손상 및 병적 반응을 일으킨다(Kim et al., 2009). 유산균 사균체의 NO 생성 억제 활성을 측정하기 위하여 RAW264.7 대식세 포에 LPS (1 μg/mL)가 첨가된 DMEM 배지와 사균체 시료 (1 mg/mL)를 첨가하여 NO 생성량을 분석하였다(Fig. 5). LPS로 처리한 대조군(+)이 LPS 비처리군(-)에 비해 NO 생성량이 많은 것으로 나타나 염증이 유도된 것을 확인하 였다. ATCC14917 사균체와 비교하여, SMF743 사균체는 모든 열처리 조건에서 유의적으로 높은 NO 생성 억제 활 성을 보였으며(p<0.05), SMF796 사균체는 70°C와 121°C의 열처리 조건에서 유의적으로 높은 억제 활성을 보였다 (p<0.05). 특히 70°C에서 SMF743과 SMF796 사균체는 각 각 65.08%와 66.14%의 높은 억제 활성을 나타내었으며, 121°C에서는 각각 63.76%와 58.99%의 억제 활성을 나타 내었다. Son & Kang (2021)은 121°C에서 15분 열처리한 L. plantarum 사균체(1 mg/mL)가 22.32%의 NO 생성 억제 활성을 나타내었다고 보고하였으며, 이와 비교하여 SMF743 과 SMF796 사균체의 NO 생성 억제 활성이 매우 우수하 다는 것을 알 수 있다.
 ), L. plantarum ATCC14917; (
), L. plantarum ATCC14917; ( ), L. fermentum SMF743; (
), L. fermentum SMF743; ( ), L. plantarum SMF796.
), L. plantarum SMF796.
본 연구 결과 70°C (180분) 또는 121°C (15분)의 열처리 가 80°C (120분), 100°C (30분)의 열처리와 비교하여 사균 체의 항산화활성과 NO 생성 억제 활성에서 우수하였다. 따라서 70°C (180분)와 121°C (15분)의 열처리 조건을 기능 성 유산균 사균체 제조를 위한 최적의 열처리 조건으로 선 정하였다.
정상적인 염증반응은 염증성 매개인자들이 관여하는 대 식세포의 활성화에 의해 조절되지만, LPS와 같은 면역자극 물질에 노출될 경우 과도하게 활성화된 대식세포는 tumor necrosis factor-α (TNF-α) 등의 염증성 cytokine, inducible nitric oxide synthase (iNOS), cyclooxygenase 2 (COX-2)의 과도한 발현을 촉진하여 염증을 악화시키고 조직을 손상시 킨다(Lawrence et al., 2002). TNF-α는 염증성 cytokine으 로 염증성 자극에 노출될 경우 염증을 촉진하며, 염증반응 의 대표적인 지표물질인 nitric oxide (NO)는 iNOS의 효소 작용에 의해 L-arginine으로부터 합성된다(Kim & Kim, 2015). 또한 COX-2는 arachidonic acid로부터 통증과 발열 에 관여하는 염증 매개물질인 PGE2의 합성을 유도하는 효소로 iNOS와 더불어 염증반응에 주요 역할을 한다 (Liden et al., 2000). 따라서 염증성 cytokine, iNOS, COX- 2의 발현 억제는 염증성 질환의 치료와 예방을 위한 주요 목표가 된다.
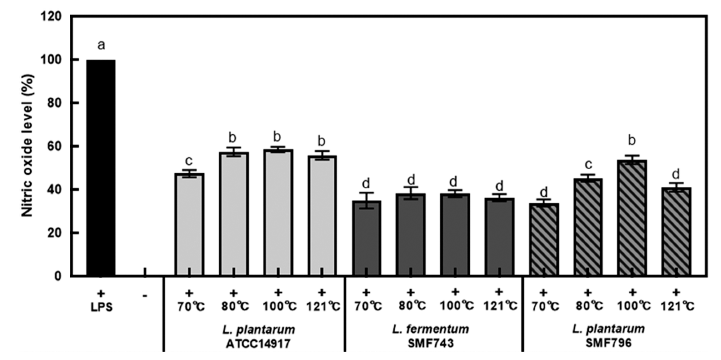
유산균 사균체의 항염 활성을 알아보기 위하여 LPS의 자극으로 염증을 유도한 RAW264.7 대식세포에 사균체(1 mg/mL)를 첨가한 후 TNF-α, iNOS, COX-2의 발현 변화 를 qRT-PCR을 이용하여 측정하였다(Fig. 6). 사균체 시료 는 항산화 활성과 NO 생성 억제 활성이 가장 우수한 70°C와 121°C에서 열처리한 시료를 이용하였으며, 세포와 환경의 여러 조건에서도 발현 정도에 차이가 거의 없는 house keeping gene인 GAPDH를 내부 대조군으로 사용하 였다. LPS 비처리군(-)에 비해 LPS로 처리한 대조군(+)에 서 TNF-α, iNOS, COX-2의 발현이 현저하게 증가되었으며, 유산균 사균체 첨가에 의해 LPS에 의해 증가된 TNF-α, iNOS, COX-2의 발현이 유의적으로 감소되었다(p<0.05). 모든 유산균 사균체 시료에서 70°C (180분)와 비교하여 121°C (15분)에서 열처리한 사균체의 TNF-α, iNOS, COX- 2의 발현 억제 활성이 높았다. LPS를 처리한 대식세포에 121°C (15분)에서 열처리한 SMF743과 SMF796 사균체를 첨가하였을 경우, LPS 단독처리군과 비교하여 TNF-α, iNOS, COX-2의 발현이 각각 최대 53.33%, 58.67%, 83.67% 저해되는 것으로 나타났다.
본 연구 결과, 김치에서 분리된 L. fermentum SMF743과 L. plantarum SMF796 균주는 프로바이오틱스 활성을 나타 내었으며, 70°C (180분) 또는 121°C (15분)의 열처리에 의해 항산화 및 항염 활성이 우수한 사균체를 얻을 수 있었다. 따라서 선별된 SMF743과 SMF796 균주는 프로바이오틱스 생균제 또는 스타터로 활용 가능하며, 사균 처리 시 안전 하게 섭취할 수 있는 항산화제 및 항염제로의 개발이 가능 할 것으로 기대된다.
요 약
김치로부터 분리된 유산균 중 프로바이오틱스 활성이 우수한 2종의 유산균을 선별하여 다양한 온도 조건에서 사균체를 제조하고 항산화 및 항염 활성을 평가하였다. Limosilactobacillus fermentum SMF743과 Lactiplantibacillus plantarum SMF796 균주는 위산과 담즘염에 대한 저항성 및 장세포(HT-29)에 대한 부착능이 우수하였으며, E. coil KCTC1039와 S. aureus KCCM11335에 대한 강한 항균활 성을 나타내었다. 열처리 조건에 따른 유산균의 사균율과 세포독성을 측정한 결과, 70°C에서 180분, 80°C에서 120분, 100°C에서 30분, 121°C에서 15분의 열처리에 의해 완전히 사멸된 사균체(1 mg/mL)를 얻을 수 있었으며, 장세포는 10 mg/mL의 고농도에서도 90% 이상의 높은 생존율을 보였다. SMF743과 SMF796 사균체는 생균과 비교하여 유의적으로 높은 항산화 활성(DPPH 및 ABTS 라디칼 소거능)을 보였 으며(p<0.05), 70°C (180분) 또는 121°C (15분)의 열처리에 의해 항산화활성과 NO 생성 억제 활성이 높은 사균체를 얻을 수 있었다. SMF743과 SMF796 사균체 처리에 의해 LPS를 처리한 RAW264.7 대식세포에서 염증성 매개인자들 의 유전자 발현을 유의적(p<0.05)으로 감소시켰으며, 121°C (15분)의 열처리에 의해 제조된 사균체는 TNF-α, iNOS, COX-2의 발현을 각각 최대 53.33%, 58.67%, 83.67% 억 제하였다. 따라서 본 연구 결과, 김치에서 분리한 L. fermentum SMF743과 L. plantarum SMF796 균주는 프로 바이오틱스 생균제로 활용 가능하며, 70°C (180분) 또는 121°C (15분)에서 열처리 시 항산화 및 항염 활성이 우수 한 기능성 사균체로의 개발이 가능할 것으로 기대된다.