서 론
혈관은 외막, 중막, 내막의 3개 층으로 구성되어 있고, 내막은 혈관의 내부 표면에 위치한 단일 층의 내피세포 (endothelium cell)와 내피층을 둘러싸는 기저막으로 구성된 다(Bonetti et al., 2003;Widlansky et al., 2003;Hildebrandt & Chao, 2020). 혈관 내피세포는 혈관의 최안쪽 단층의 세포층으로 이루고 있으며, 혈류의 흐름에 의해 자극을 받 고 혈액 내의 다양한 활성 인자 및 면역 세포 등과 상호 작용을 하는 세포이다. 혈관 내피는 내피 장벽의 기능을 가지고 있으며(Bonetti et al., 2003;Rho et al., 2017) 내피 및 주변 혈관 평활근 세포 내에서 작용하는 다양한 혈관 활성 분자(angiotensin, bradykinin, histamine, nitric oxide 등)를 합성하고 자가분비(autocrine) 또는 측분비(paracrine) 방식으로 혈행 기능 및 혈관 항상성 조절에 관여한다 (Lüscher & Barton, 1997;Cines et al., 1998). 혈행 기능 및 혈관 항상성에는 혈관의 수축과 이완 기능을 포함하고, 혈액의 흐름, 혈액 공급을 통한 체내 산소와 영양분의 제 공 기능까지 모두 포함된다. 혈관 내피세포에 의해 혈관 기능이 일정하게 유지되지만, 외부 요인에 의해 장기간 혹 은 비정상적인 염증반응 및 산화적 스트레스 상태가 유지 될 경우에는 혈관 기능 이상 및 심혈관계 질환을 유도하기 때문에 혈관 내피세포 기능 조절은 매우 중요하다.
동맥과 정맥, 그리고 동맥과 정맥 시스템을 연결하는 모 세혈관에 존재하는 혈관 내피세포는 혈장액, 단백질 및 세 포의 혈액 조직 교환을 위한 반투과성 장벽을 형성하고, 내피 투과성 조절은 혈류의 순환 항상성과 체내 생리적 기 능을 유지하는 데 필수적이다. 혈관 내피세포에서 분비되 는 혈관 확장 및 수축 물질의 불균형 시 혈관벽 손상 및 혈관 투과성의 유도로 인해 혈관 내벽 두께를 증가시키게 된다. 이는 주로 동맥에서 발생하는 심혈관계 질환의 기전 으로 설명된다. 정맥의 경우는 산화적 스트레스 및 염증반 응 시 혈관 투과의 유도가 증가되는 부위로 알려져 있다 (Majno et al., 1961). 혈관 직경은 동맥보다 크지만 혈관벽 의 두께는 훨씬 얇기 때문에(Nathaniel et al., 2009), 혈관 내피세포 기능이 더욱 중요하다 할 수 있다. 혈관 내피세 포의 조절 기능 이상 발생 시 모세혈관에서는 조직 간질 세포로의 과도한 누출이 발생할 수 있으며, 이는 혈관성 부종 상황을 유발하여 조직 손상을 유발할 수 있다(Oakely & Tharakan, 2014; Claesson-Welsh, 2015). 혈관 내피 기능 의 조절 이상은 미세 혈관에서 발생할 가능성이 더 높으며 (Oakely & Tharakan, 2014), 이로 인해 발생하는 미세혈관 질환은 혈류 및 혈관 긴장도의 조절 장애로 인해 조직으로 의 산소 전달 장애, 산화 스트레스 증가, 모세혈관의 직경이 감소되는 등의 증상이 보고되었다(Behroozian & Beckman, 2020).
혈관 내피세포 기능 장애에 관여하는 인자는 다양하게 존재하며, 노화 및 이로 인해 발생하는 염증, 산화적 스트 레스, 질병 상태에 따라 기능 이상이 발생함이 보고되고 있다. 혈관 내피세포 기능 장애 발생 시 운동을 통해 회복 이 가능하다는 연구 논문(Hurley et al., 2019)이 일부 있으 나, 식이패턴이나 건강기능식품과 혈관 내피세포 기능 장 애에 대한 연관성을 살펴본 연구는 아직 부족한 실정이다. 따라서 본 연구에서는 혈관 내피세포 기능에 관여하는 여 러 인자와 노화와의 연관성을 살펴보고, 식이패턴이나 건 강기능식품이 기능 장애를 조절할 수 있는지에 대해 조사 검토하고자 한다.
혈관 내피 기능 조절 인자
혈관의 내피 기능은 내피세포를 직접적으로 구성하게 되 는 내피 전구 세포(endothelial progenitor cell, EPC)와 내 피세포에서 분비되는 산화질소(nitric oxide, NO), 내피세포 와 세포 사이를 연결하는 세포접착 분자 등에 의해 조절되 며, 이들에 의한 세포 내 신호전달에 영향을 미치게 된다.
EPC는 혈액 순환에 유입되어 증식 및 여러 세포 유형으로 분화할 수 있는 세포이다(Arjmand et al., 2021). Khakoo & Finkel (2005)의 연구에 따르면 E PC 수와 기능은 내피 세포 손상 및 기능 장애와 밀접하게 관련되어 있기 때문에 혈관 투과성에 영향을 미치게 되고 임상에서 혈관 기능 및 심혈관계 질환에 위험을 높이는 것으로 보고되었다.
내피세포는 NO를 생성하는 내피 산화질소 합성효소 (endothelial nitric oxide synthase, eNOS)를 발현시키며, eNOS에 의해 생성되는 NO에 의해 혈관 내피 기능이 주 로 조절된다(Seals et al., 2011). NO는 혈관 평활근 이완, 혈소판 활성화의 억제 및 내피 표면에 대한 부착(Loscalzo, 2001), 사이토카인 및 세포 부착 분자의 합성 및 발현 (Hossain et al., 2012), EPC 기능 보존 등에도 관여하게 된다.
혈관 내피 기능과 밀접한 관련이 있는 내피세포 접합부 는 밀착 접합부와 유착 접합부로 구성된다(Reglero-Real et al., 2016). 세포 접합부는 상피 조직의 지지 상태를 유지하 고 세포 간의 신호 전달을 조절하는 세포 간 접착 부위이 다(Knights et al., 2012). 밀착 연접은 상피 세포막의 선단 부 영역 내에 존재하며, 세포 사이에는 claudin과 occlusion 이 존재하며 이를 지지하고 있는 zonular occludens (ZO) 와 액틴은 세포 내부에 위치한다(Knights et al., 2012). 혈 관 내피세포의 경우 주된 밀착 연접 단백질은 occludin과 claudin-5이며, 단층 세포층의 투과도에 영향을 미치게 된 다(Saker et al., 2014). 유착 접합부에서는 E-cadherin (epithelial cadherin)은 세포 간 접착 접합의 주요 구성 요 소이며(Vila Cuenca et al., 2019), VE-cadherin (vascular endothelial cadherin)은 내피세포에서 주로 발견된다. 세포 내부에는 α- 및 β-catenin을 포함하는 복합체가 존재하며, 내피세포 접착 분자 및 VE-cadherin은 말초 미세혈관 내피 기능을 조절하는 데 중요한 역할을 한다(Childs et al., 2007;Childs et al., 2008;Kumar et al., 2009).
Angiopoietin 1-4 (Ang1-4)는 혈관 특이적 성장 인자이며, 티로신 키나제 수용체인 Tie-1 및 Tie-2를 통해 활성이 매 개된다(Davis et al., 1996). Ang1과 Ang2는 혈관주변세포 (pericytes)와 내피세포에 의해 각각 생성되며(Davis et al., 1996), Ang1-Tie2 결합은 인산화(Gaengel et al., 2009)를 혈관 신생을 유도하고 혈관 내피 기능을 조절하는 다중 신 호 전달 경로의 활성화를 유도한다(Brindle et al., 2006;Augustin et al., 2009). Ang-1에 의한 Tie-2 수용체의 자극 은 세포 신호전달 경로인 Akt를 통해 eNOS 활성을 유도 한다고 Augustin et al. (2009)과 Babaei et al. (2003)이 보 고하였으며, Alfieri et al. (2014)은 eNOS와 VE-cadherin 조절이 통해 eNOS 활성화 및 미세혈관 내피 기능을 조절 함을 보고하였다.
미세입자(microparticle, MP)는 다양한 유형의 세포(내피 세포, 혈소판 및 백혈구)들의 세포 사멸, 염증 활성화 및 세포 스트레스 상태에서 분해되어 나온 인자이다(Boulanger et al., 2006). 내피 미세입자(endothelial microparticle, EMP) 는 0.1 μm에서 1 μm 크기의 세포막에서 파생된 소포로서 혈관 평활근 세포, 단핵구, 내피 전구 세포 및 기타 내피 세포와 같은 표적 세포와 직접적으로 상호 작용하며 (Carmona et al., 2017;Favretto et al., 2019;Ryu et al., 2019), 표적 세포 내 신호전달 경로를 직접적으로 활성화 시키는 역할을 한다(Ryu et al., 2019).
최근 연구에서는 세포 신호 전달 경로 중 caspase-3 활 성이 말초 미세혈관 과투과성을 유발하는 주요 기전으로 보고되고 있으며(Childs et al., 2008;Tharakan et al., 2008;Tharakan et al., 2012), 이는 세포접착 분자와 연관 되는 것으로 보고되고 있다(Steinhusen et al., 2000;Wu et al., 2014). Caspase-3 활성은 내피세포에서 세포-세포 접착 의 핵심 역할을 하는 VE-cadherin-β-catenin 복합체를 파괴 하고(Childs et al., 2007). VE-cadherin-β-catenin 복합체의 손상은 미세혈관 과투과성을 유발하게 된다(Steinhusen et al., 2000;Tharakan et al., 2012).
또 다른 신호전달 경로 중 Sirtuin-1 (SIRT-1)은 에너지 보존 및 스트레스 저항 경로를 활성화하는 경로 중 하나이 다. 세포질에서 SIRT-1은 eNOS를 직접 탈아세틸화하여 NO 합성을 증가시키는 역할을 하며(Mattagajasingh et al., 2007), SIRT-1 저해 시 동맥에서 NO 매개 혈관 확장을 감 소시키는 것으로 나타났다(Mattagajasingh et al., 2007;Donato et al., 2011). 핵에서 SIRT-1의 활성화는 NO 합성 유지 및 NO 분해 억제 단백질의 유전자 발현을 조절함으 로써 간접적으로 NO 생체 이용률을 증가시킨다(Olmos et al., 2013;Xia et al., 2013).
혈관 내피 기능과 노화
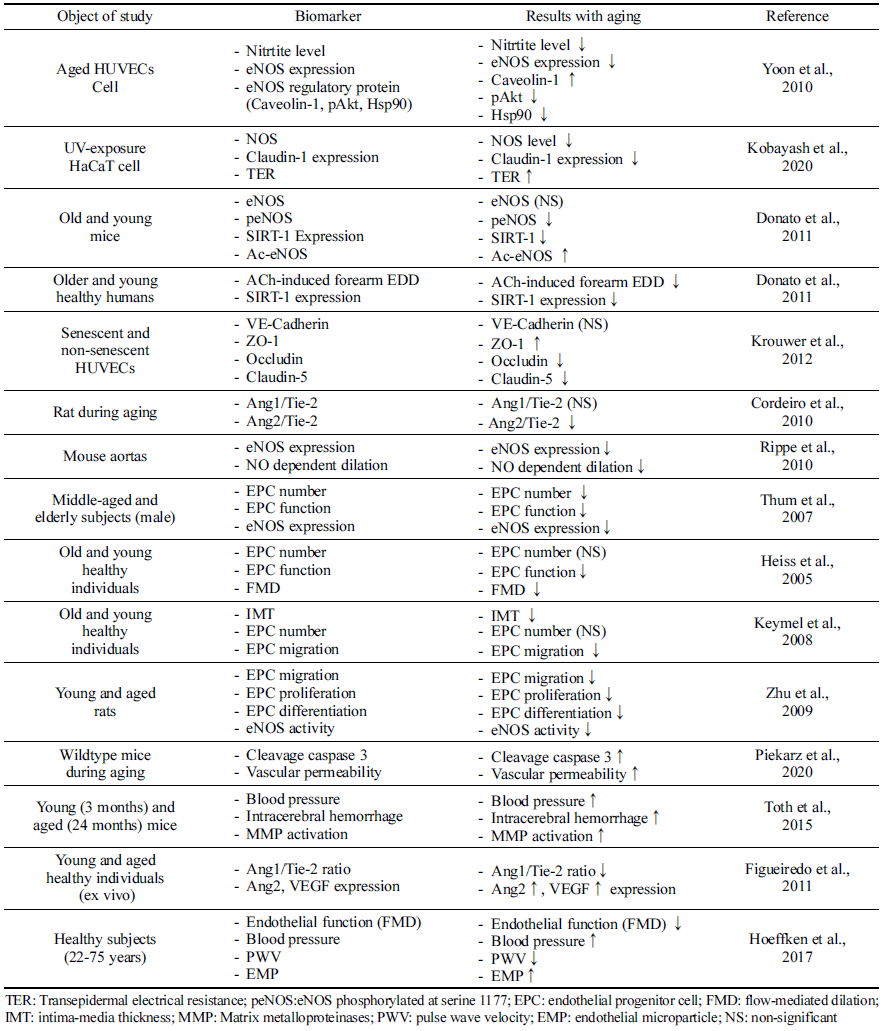
내피 전구 세포의 노화는 혈관 노화 과정과 밀접한 연관 을 가진다(Table 1). 건강한 개인의 EPC 수는 나이가 들면서 감소한다(Thum et al., 2007). 이는 손상된 혈관벽의 회복을 어렵게하며, 만성 염증 상태를 유발하며 이는 다시 EPC 기능을 손상시키게 되는 악순환 구조를 만든다(Csiszar et al., 2003). Thum et al. (2007)은 인체시험을 통해 노인에서 의 E PC 수가 감소하고 E PC 기능(EPC 생존율, 분화 정도 등)이 저해하는 것을 확인하였다. 더불어, 노화된 동물모델 에서도 성장인자(성장호르몬 혹은 인슐린 유사 성장인자) 투여 시 EPC 기능이 향상됨을 확인하였고, eNOS 발현 역 시 노화 시 발현이 억제되었으나, 성장인자 투여 시 정상 대조군과 유사한 수준으로 회복시키는 것으로 보고하였다. 또 다른 동물시험 연구에서도 노화에 따라 EPC 기능 저하 와 eNOS 활성이 저해되는 것으로 나타났다(Zhu et al., 2009). 인체적용시험 연구에서도 노화와 EPC 연관성에 대 한 여러 보고들이 있다. Keymel et al. (2008)의 연구에서는 노화에 따라 intima-media thickness (IMT) 두께는 증가하고, EPC migration은 저해됨을 보고하였다. Heiss et al. (2005) 의 연구에서도 노화에 따라 E PC 수에는 영향이 없었으나 EPC 기능 저해를 보고하였고, flow-mediated dilation (FMD) 는 EPC migration과 분화 정도와 밀접한 연관성이 있었다. 따라서 노화에 따라 E PC 기능이 감소되는 것은 NO 생성 능에 영향을 미치고, 심혈관계 질환 위험도를 높이는 것으 로 판단된다.
NO 생체 이용률은 NO 분해 가속 및 내피에 의한 NO 합성 감소의 결과로 노화에 따라 내피세포에서의 생성이 감소한다(Csiszar et al., 2003;Seals et al., 2011). 이는 혈 관 내피 기능 변화로 연결된다(Irani, 2000;Seals et al., 2011). HUVEC (Human umbilical vein endothelial cell) 세 포에 노화를 유도하여 확인한 결과, 자가분비 또는 측분비 에 관여하는 내피 기능 관련 물질이 저해됨이 보고되었고 (FAN et al., 2022) Yoon et al. (2010)의 보고에서 HUVEC 에서 NO 생산은 세포 노화에 따라 크게 감소하였으며, 세 포 노화에 따라 eNOS 단백질 수준이 낮은 것으로 확인되 었다. Ser-1177(활성)에서의 eNOS 인산화는 세포 doubling 이 진전될수록 점진적으로 감소하였고, Thr-495(비활성)에 서의 eNOS 인산화는 노화된 세포에서 증가하였다. 노화에 따른 산화적 스트레스 또한 NO 생성 감소의 기전으로 알 려져 있다(Seals et al., 2011). 과산화물의 공급은 NO와 빠 르게 반응하여 2차 자유 라디칼인 과산화아질산염(ONOO-) 을 형성하여 NO의 생체 이용률을 감소시키고 산화 스트레 스에 더욱 기여하게 된다. 과산화아질산염에 노출된 eNOS 는 eNOS dimer를 불안정화 시킴으로써 용량 의존적으로 eNOS의 활성이 저해되는 것으로 확인되었다(Chen et al., 2010).
혈관 내 SIRT-1 활성은 일반적으로 노화와 함께 감소하 고 eNOS 활성 감소 및 내피세포 노화 증가를 통해 혈관 기능 장애에 기여한다(Donato et al., 2011;Bai et al., 2014). HUVEC를 이용한 세포실험에서 노화에 따라 SIRT-1 활성 이 감소함이 보고되었고(He et al., 2015), Donato et al. (2011) 연구에서는 아세틸화된 eNOS의 축적은 노화쥐의 혈관에서 주로 발생하며 eNOS 활성화의 핵심 마커인 eNOS 인산화 감소 및 NO 생체 이용률 감소에 영향을 미 친다고 보고하였다. 동물실험뿐만 아니라 인체에서도 SIRT-1의 발현은 젊고 건강한 성인에 비해 노인의 내피세 포에서 더 낮은 것으로 보고되어(Donato et al., 2011) 종 합적으로, 노화에 따른 혈관 내피 기능은 eNOS 발현과 NO 생성에 밀접하게 연관이 있으며 SIRT-1 발현 및 활성 의 감소가 노화에 따른 혈관 내피 기능 장애에서 중요한 역할을 하고 있다는 것을 의미한다.
Krouwer et al. (2012)은 세포 노화에 따라 부착 접합부에 영향을 미치고 특히 밀착 접합부에 영향을 미치면서 내피 장벽의 보존성을 손상시키는 것으로 보고하였다. 노화 세 포로 구성된 단층의 장벽 기능은 손상되고, 접합 단백질 분포의 변화 및 occludin 및 claudin-5 발현의 감소가 동시 에 확인되었다(Krouwer et al., 2012). 노화 시 인체조직에 서 Ang1/Tie-2의 비율이 감소하였으며(Figueiredo et al., 2011), 동물실험에서도 Ang2의 발현은 6개월 된 쥐와 비 교했을 때 12개월째에 유의한 감소가 관찰되었다(Cordeiro et al., 2010). 산화적 스트레스 상태에 노출한 H aC aT 세포 에서 노출 시간에 따라 CLDN1의 불안전성을 유도하여 밀 접 접합부 장벽의 파괴가 유도되고, 이는 세포 과투과성으 로 확인되었다(Kobayashi et al., 2020). 이는 내피세포 노 화가 세포접합단백질에 영향을 미치며, 내피세포 투과성에 영향을 미치는 것을 시사한다.
내피세포 노화는 내피세포 사멸이 증가와 연관이 있으 며, 이는 내피세포 노화의 회복 능력 감소시키고, 이는 심혈관질환의 위험도 증가시키게 된다(d'Alessio, 2004;Brandes et al., 2005). 심혈관 위험 인자가 있는 환자 및 심혈관계 질환 진단을 받은 환자에서 세포 사멸로 인한 EMP 농도가 증가되는 것이 알려져 있으며(Baron et al., 2012), EMP가 주로 죽상동맥경화증, 다발성경화증, 패혈 증 등의 염증성 혈관 기능 장애 시 발견되기 때문에 혈관 내피세포의 손상 바이오마커로서 활용되고 있다(Deng et al., 2017;Shantsila, 2009). 일반적으로 세포 사멸 및 Caspase-3 등의 활성은 노화 유도 모델 세포에서 증가된 다(Chen & Goligorsky, 2006). 동물모델에서도 노화에 따 라 척수에서의 caspase-3의 발현도가 유의적으로 높았으며, 혈관의 투과성도 높은 것으로 나타났다(Piekarz et al., 2020). 결과적으로 노화에 따른 세포자멸사 및 caspase-3 활성화는 내피 손상 및 사멸을 가속화시키게 된다.
혈관 기능 장애 및 식이 영향
여러 연구 결과에 따르면 식이 패턴은 내피세포 손상 및 내피 기능 장애 감소와 연관이 있다(Zuchi et al., 2010;Klonizakis et al., 2013;Ungvari et al., 2018, Table 2).
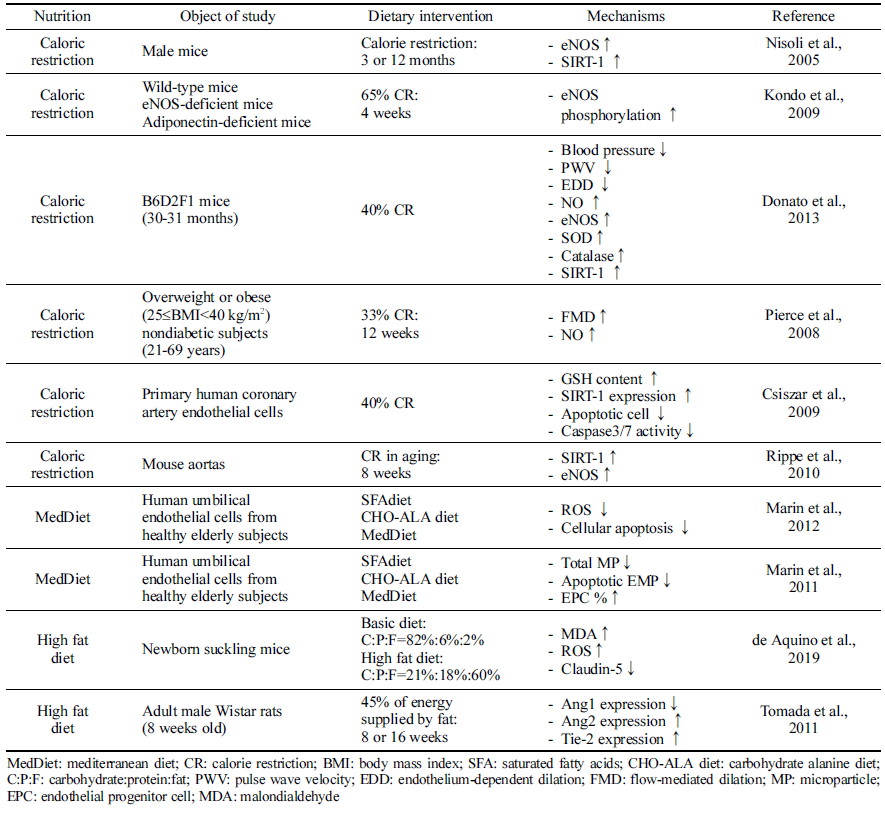
열량 제한은 동물의 노화모델(Nisoli et al., 2005;Kondo et al., 2009) 및 노인(Pierce et al., 2008)에서 eNOS를 상 향 조절하고 활성화함으로써 혈관 기능 저해를 지연시키는 것으로 나타났다. 혈압, 동맥벽두께, pulse wave velocity가 감소되며, NO 합성을 증가시키며 동시에 항산화 시스템을 활성화시키고, SIRT-1 등 다양한 기전을 통해 내피 기능 노화를 방지하는 것으로 나타났다. Donato et al. (2013)의 연구에서는 40%의 열량 제한을 실시한 시험동물에서는 NO 생체 이용률을 유지하여 설치류의 동맥에서 내피 기능 의 노화를 방지하며, 동맥 산화 스트레스 및 염증 개선 (Csiszar et al., 2009;Donato et al., 2013)에 도움을 주는 것으로 나타났다. 특히 열량 제한은 노화 동물모델의 동맥 내 eNOS 단백질 발현을 어린 대조군 수준으로 증가시키 는 것으로 보고되었다(Donato et al., 2013). 열량 제한이 eNOS 활성을 증가시키고, SIRT-1 발현을 증가시키는 것은 여러 연구를 통해 보고되고 있고(Nisoli et al., 2005;Kondo et al., 2009), Rippe et al. (2010)의 연구에서도 8주간의 열량 제한으로 SIRT-1이 활성화되고 설치류 대동맥에서 eNOS 단백질 발현이 증가함을 보고했다. 인체적용시험에 서는 12주 동안 열량의 33%를 식이 제한한 결과, FMD가 증가하고 NO 생성량이 증가하는 것을 확인하였다(Pierce et al., 2008). 따라서 열량 제한은 에너지 감지 신호 경로 중 하나인 SIRT-1 경로 및 NO 합성에 영향을 주어 혈관 내피 기능에 관여하는 것으로 파악된다.
지중해식 식단은 생선, 야채, 과일, 통곡물, 콩류, 올리브 오일을 풍부하게 포함하는 식이 패턴이다. 노인을 대상으 로 한 연구에 따르면 지중해식 식단을 섭취 시 포화지방산 이 풍부한 식단이나, 고탄수화물 식단에 비해 NO 생체 이 용률이 증가하여 결과적으로 내피세포 기능이 개선되었다 (Marin et al., 2011;Marin et al., 2012). 특히 지중해식단 은 중재 기간 후 환자의 혈청과 함께 HUVEC를 배양한 결과 세포 내 ROS 생성이 낮고 세포 자멸사 수준이 저하 되었으며, apoptotic EMP의 수준은 감소하고, EPC 비율은 증가하였다. 이는 지중해식 식단이 포화지방산 혹은 고탄 수화물 식이에 비해 내피세포를 보호한다는 것을 의미하고, 활성산소종과 관련이 있는 것으로 파악된다.
동물모델을 이용하여 일반식이와 고지방식이의 비교에서 고지방식이를 섭취한 실험군에서는 지질과산화물의 생성이 증가하고 활성산소종의 수준이 높아졌다. 더불어 세포 간 claudin-5 발현도가 감소하는 것으로 나타났다(de Aquino et al., 2019). Tomada et al. (2012)의 연구에서는 고지방식 이(열량의 45%)로 Ang1 발현이 감소되었으나 Ang2 발현도 는 증가하였으며, Tie-2 발현은 증가하는 경향을 보였다.
혈관 기능 장애 및 건강기능성 소재
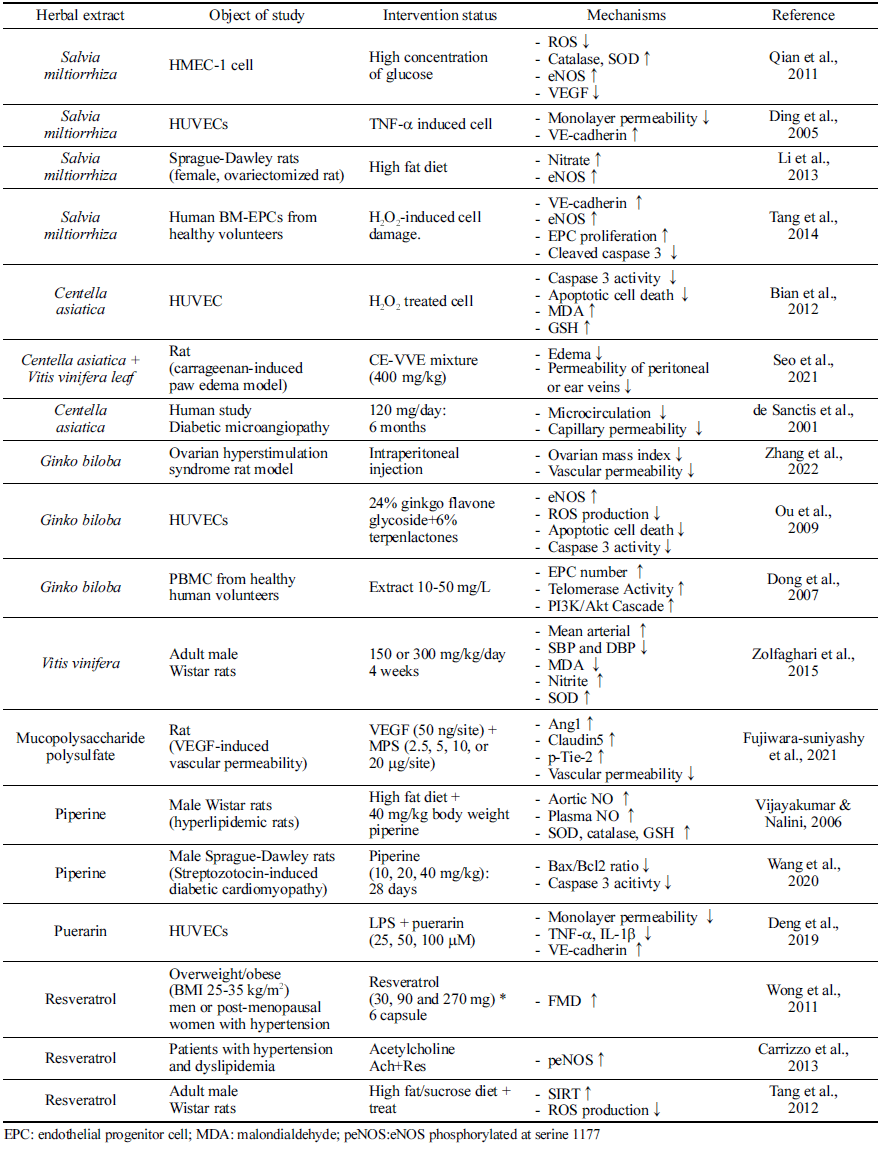
혈관 기능 장애에 건강기능성 소재가 미치는 영향에 대 해서는 다양한 소재들에 대해 연구되어 왔다(Table 3). 단 삼(Salvia miltiorrhiza Bunge)은 중국에서 “Danshen”으로도 알려져 있으며 중국과 일본에 분포한다. 단삼의 뿌리, 뿌리 줄기, 줄기 및 잎은 중국 전통 의학에서 다양한 질병, 특 히 심혈관계 질환을 치료하는 데 사용되어 왔다(Su et al., 2015). 단삼은 혈관 확장제 및 항염증 활성 및 혈관 신생 조절 능력으로 인해 내피세포를 보호함으로써 미세 순환에 유익한 역할을 한다. 내피의 보호 역할과 관련하여 산화적 스트레스 뿐만 아니라 TNF-α에 의해 유발되는 내피 과투 과성을 단삼추출물이 저해하였으며, 특히 VE-cadherin의 발현을 증진시키는 것과 연관이 있는 것으로 확인되었다 (Ding et al., 2005). 고지방 식단을 먹인 난소 절제된 쥐 모델에서 단삼의 보충은 eNOS 발현을 상향 조절하고 NO 분비를 증가시켰다(Li et al., 2013). 단삼 중 대표적 기능 성분인 salvianolic acid B의 경우는 EPC 분화를 촉진하고, eNOS 및 VE-cadherin의 발현을 촉진하며, caspase-3 발현 을 저해하여 혈관 내피세포 기능 유지에 도움을 준다(Tang et al., 2014).
Puerarin은 주로 Radix puerariae (갈근)에서 발견되는 이 소플라본 중 하나로 LPS 유도 혈관 내피세포 과투과성으 로부터 보호한다. TNF-α 및 IL-1β와 같은 전염증성 사이 토카인의 증가가 VE-cadherin의 발현을 저해시켰으나, puerarin이 이를 다시 회복시키는 세포실험 결과가 제시되 었으며, LPS로 유도된 단세포층의 투과성이 puerarin에 의 해 억제되는 것으로 나타났다(Deng et al., 2019).
포도(Vitis vinifera L.)는 미세혈관 질환을 예방하는 것으 로 알려져 있다(Agarwal et al., 2004;Lin et al., 2016), 구체적으로는 NO 합성을 증가시켜 내피 의존성 혈관 이완 을 강화하며(Carrizo et al., 2013), 여러 동물 모델에서 포 도추출물이 NF-κB 경로를 억제하여 NO 생성을 증진시키 고, 항산화 시스템을 강화시키는 것으로 보고되었다 (Zolfaghari et al., 2015). 쥐 대동맥 및 소 대동맥 내피세 포(BAEC)에서 세포의 노화 및 활성산소종 생산을 저해하 였고, 동물실험에서 resveratrol은 고지방식이로 유도된 활 성산소종의 생성을 저해함을 확인하고, 그 기전으로는 SIRT1/NADPH 산화효소 경로를 제시하였다(Tang et al., 2012). 또한 포도추출물의 주요 생리활성 화합물인 resveratrol을 6주 동안 보충한 경우, FMD가 23% 증가한 결과가 인체적용시험에서 보고되었다(Wong et al., 2011).
내피 보호 활성과 관련하여 은행(Ginkgo biloba L.)은 내 피세포에서 eNOS의 발현을 농도 의존적으로 증가시킨다. 또한 활성 산소종의 생성을 저해하여 내피세포에서 oxLDL로 유도된 산화 스트레스를 저해하고, 세포사멸 경 로, 특히 caspase-3 활성을 억제하였다(Ou et al., 2009). 동 물모델에서의 난소 혈관의 투과성을 저해하는 것까지 확인 이 되었으며, 인체적용시험에서는 건강한 성인의 말초혈액 을 분리하여 EPC의 정도를 살펴본 결과, 은행잎추출물을 처리한 경우 telomerase 활성을 증가시켜 EPC의 노화를 감소시키는 것이 보고되었다(Dong et al., 2007).
병풀(Centella asiatica)에서 분리된 triterpenoid saponin인 madecassoside는 산화 스트레스로부터 내피세포를 보호한 다(Bian et al., 2012). Madecassoside는 내피세포의 항산화 효소 수준을 증가시키고, H2O2로 유도된 지질과산화물의 수준을 감소시킨다. 더불어 세포자멸사를 약화시켜 caspase- 3의 활성화을 저해하고, HUVEC를 보호할 수 있음을 시사 하였다. 병풀과 포도복합추출물을 이용한 Seo et al. (2021) 의 연구에서는 vascular permeability model에서 염증을 저 해하고 부종을 약화시키는 효과를 나타내었으며, 세포 과 투과성을 유의적으로 감소시키는 것으로 나타났다. 인체적 용시험에서는 6개월 동안의 병풀추출물 섭취 시 미세순환 을 증진시키고 혈관 내피 기능을 감소시키는 것이 보고되 었다(de Sanctis et al., 2001).
자바후추(Piper retrofractum)는 인도 및 태국 전통 의학 에서 다양한 질병의 치료제로 사용되었으며, 항산화활성 및 항균활성이 강하고, 항고지혈제, 항고혈압제로서의 효과 를 가지는 것으로 알려져 있다(Duangjai et al., 2011;Neamsuvan et al., 2018) 자바후추 열매의 주된 기능성분 인 piperine을 이용하여 동물실험을 진행한 연구에서는 LNAME를 투여하여 eNOS 발현을 억제한 모델을 사용하였 으며, eNOS 발현이 억제된 모델에서 piperine을 4주간 보 충했을 경우 eNOS 발현이 증가되고, 감소되었던 NO 생성 이 정상적으로 회복됨을 보고하였다(Vijayakumar & Nalini, 2006). 또 다른 동물모델에서 당뇨유발 동물모델을 이용하 여 미세혈관이상 상태를 유도한 후 세포자멸사 경로를 분 석한 결과, piperine의 경우는 Bax/Bcl2 ratio를 저해하고 caspase-3 활성을 억제하여 자바후추 열매의 경우 세포 사 멸 기전에 관여하여 내피세포 기능에 이바지하는 것으로 보고되었다(Wang et al., 2020).
요 약
본 연구에서는 노화를 통해 야기될 수 있는 혈관 투과성 및 내피세포 기능 장애에 식이패턴 및 건강기능성 소재가 활용될 수 있는지 살펴보고자 하였다. 내피 기능 장애는 혈관 투과성에 영향을 미치고, 이는 혈관 및 미세혈관 질 환을 야기하게 된다. 혈관 내피 기능에는 eNOS, NO, EPC, occludin, cludin-5, apoptotic pathway, SIRT1, Ang1/ Tie-2 등의 다양한 인자가 영향을 미친다. 노화는 산화적 스트레스와 만성 염증상태가 점진적으로 발생하는 과정이 며, 이로 인해 혈관 내피 기능 관여인자들 역시 일련의 과 정으로 기능이상이 발생하게 된다. 그러나 열량 제한, 지중 해식 식단, 저지방 식단과 같은 식이패턴의 변화는 노화로 인한 혈관 내피 기능 변화를 회복시킬 수 있으며, 병풀, 자바후추, 단삼, 포도, 은행잎 등의 추출물 혹은 함유된 기 능성분 역시 eNOS 활성, NO 생성, 항산화 시스템 강화, VE-cadherin 등의 투과성 관여인자를 조절하여 내피세포 투과성에 영향을 미치게 된다. 다만, 식이패턴이나 각 건강 기능성 소재들의 연구가 주로 세포 실험 및 동물실험에 국 한되는 경우가 많아 추후 인체적용시험 등을 통해 과학적 기능 검증을 추가적으로 진행할 필요가 있다. 현재 혈관 내피 기능 개선에 관한 제품 개발은 아직 미비한 상태이다. 그러나 내피세포 기능 이상과 혈관 투과성 장애는 노화로 인해 자연스럽게 발생할 수 있기 때문에 식이 혹은 식품을 활용하여 예방할 필요성이 있다. 혈관 내피 기능 개선에 대한 제품 개발을 진행한다면, 노화로 인한 혈관건강을 예 방을 도모할 수 있을 것으로 생각되며, 건강기능식품의 새 로운 분야로 성장할 수 있을 것으로 사료된다.