서 론
셀룰로오스(cellulose)는 지구상에서 가장 풍부하게 존재 하는 천연 다당류로 제지, 펄프를 비롯한 다양한 분야에 서 사용되고 있다(Abitbol et al., 2016). 셀룰로오스는 다 양한 바이오 매스로부터 쉽게 얻을 수 있을 뿐만 아니라 (Gallegos et al., 2016) 폐기 시 토양 속에서 다시 생분해 되는 특성으로 셀룰로오스를 활용한 친환경적인 기능성 소재 개발 연구에 대한 수요와 관심은 갈수록 높아지고 있다(Cho & Park, 2010). 셀룰로오스는 그 제조방법에 따 라 크게 4가지로 분류할 수 있다. 산 가수분해방법을 활 용한 나노 휘스커(Nanowhisker), 기계적-물리적 처리 방법 을 통한 나노(혹은 마이크로) 피브릴 셀룰로오스(Nanofibrillated cellulose, NFC, Micro-fibrillated cellulose, MFC), 전기방사를 통한 나노셀룰로오스(Electrospinning nanocellulose), 마지막으로 박테리아 배양을 통해 생산된 박 테리아 셀룰로오스(Bacterial cellulose)가 있다(Bondeson et al., 2006;Chakraborty et al., 2005;Fotie et al., 2020;Oksman & Sain, 2006). Brown (1986a, 1986b)은 최초로 Acetobacter xylinum를 배양하는 가운데 배지의 윗부분에서 자라나는 하얀색의 균막 층을 발견하였고, 이를 박테리아 셀룰로오스라고 보고하였다. Acetobacter속, Rhizibium속, Agrobacterium속 등을 탄소와 질소가 포함된 배지 안에서 배양하면 배양액의 계면에 흰색의 피막이 형성되며(Barud et al., 2008;Wang et al., 2017), 이렇게 형성된 박테리아 셀룰로오스는 산 가수분해 방법, 기계적-물리적 처리 방법 을 통해 생성된 셀룰로오스보다 높은 기계적 강도와 극도 로 미세한 3차원 망상구조를 가진다(Suwannapinunt et al., 2007). 또한 일반적인 식물섬유는 셀룰로오스, 헤미셀룰로 오스(hemicellulose), 리그닌(lignin) 등으로 이루어져 있지 만 박테리아 셀룰로오스는 순수한 셀룰로오스 만으로 이 루어진 특징을 가진다(de Oliveira Barud et al., 2016). 산 가수분해 방법, 기계적-물리적 처리방법은 펄프화 과정 중 에서 리그닌 등의 성분을 제거하기 위한 유독성 화학물질 의 사용과 높은 에너지 사용으로 제조 과정이 친환경적이 지 않은 단점이 있는 반면 박테리아 셀룰로오스 제조 과정 은 순수한 셀룰로오스를 환경 친화적인 방법으로 생산할 수 있는 장점을 갖는다(Ross et al., 1991). 일본에서는 박 테리아 셀룰로오스의 산업적 활용과 대량 생산을 위한 체 계적인 연구를 진행해오고 있으며(Toyosaki et al., 1995), 실제로 박테리아 셀룰로오스는 식품의 증량제, 선도 유지 제, 조직감 개선제, 안정제 등 다양한 첨가물 소재로 이용 되고 있다(Esa et al., 2014;Sutherland, 1998). 현재 박테 리아 셀룰로오스 생산 수율이 가장 우수하다고 알려진 균 주는 Acetobacter속으로 농업 부산물, 과일 부산물, 채소 부산물 등 천연 자원으로부터 박테리아 셀룰로오스를 생산 하기 위한 다양한 응용 연구가 진행 되고 있다(Hussain et al., 2019). 식품 부산물 자원을 이용하여 고부가가치 박테리아 셀룰로오스를 생산하기 위한 다양한 연구는 곤 약(Hong & Qiu, 2008), 포도 껍질 추출물과 치즈 유청 (Carreira et al., 2011), 콜롬비아 농업 부산물(Castro et al., 2011), 커피체리 껍질(Rani & Appaiah, 2013), 파인애플 부산물(Algar et al., 2015), 파인애플 껍질과 수박 껍질과 같은 과일 부산물(Kumbhar et al., 2015), 두리안 껍질(Luo et al., 2017), 캐슈 나무 부산물(Pacheco et al., 2017), 감 귤 껍질(Güzel & Akpınar, 2019), 야자수 나무에서 얻어지 는 사고(sago)(Voon et al., 2019), 파인애플 부산물(Ch'ng et al., 2020) 등 다양한 소재에 대한 활용 사례가 보고되고 있다.
커피 찌꺼기(spent coffee grounds, SCG)는 원두에서 커 피를 추출한 성분을 제외한 나머지를 일컫는 커피 추출 폐 기물이다(Hong et al., 2018). 커피 찌꺼기는 재생 가능한 요소들을 많이 지니고 있기 때문에 다양한 분야에 재활용 가치가 높은 자원이지만 현재까지는 가치를 활용하지 못하 고 많은 양이 일반 생활 쓰레기로 버려지고 있다(Nam et al., 2017). 전세계적으로 커피 수요가 꾸준히 증가하고 있 는 실정이며 커피 찌꺼기의 발생량 또한 매년 증가하고 있 다(Dattatraya Saratale et al., 2020). 커피를 추출할 때 커 피원두의 0.2 %만을 사용하며 나머지 99.8 %의 원두는 커피 찌꺼기로서 버려지고 있다. 이는 2014년 기준 연간 약 27만톤에 해당하는 양이고, 이를 처리하기 위한 사회적 비용은 연간 7,642억 원에 달할 정도로 큰 처리 비용이 발 생하며, 처리과정에서 발생하는 이산화탄소로 인한 환경적 인 문제도 무시할 수 없는 시점이다(Nam et al., 2017). 현 재 커피 찌꺼기 재활용에 대하여 다양한 연구가 시도되고 있지만 대부분 원천기술개발 수준으로 실용화 및 활성화에 대한 문제가 남아 있다.
플라스틱 소재는 다양하고 우수한 기능 및 저렴한 가격 으로 현대인의 풍요로운 일상생활과 산업발달에 큰 공헌을 해왔다(You et al., 2015). 하지만 대량으로 발생되는 플라 스틱 폐기물의 소각이나 매립이 심각한 환경오염의 원인으 로 대두되고 있어 이를 해결하기 위한 바이오 매스 활용에 대한 관심이 커지고 있다(Lee et al., 2016;Lee & Sung, 2012).
본 연구에서는 버려지는 커피 부산물을 이용하여 커피박 배양액 배지를 제조하고, 이를 활용하여 박테리아 셀룰로 오스의 생성을 확인하고자 하였다. 생성된 박테리아 셀룰 로오스를 건조시켜 건조 방법에 따른 인장강도 및 신장률, 수분용해도, 두께, 색도 등 특성 조사를 통해 친환경 식품 포장재 소재 개발을 위한 기본 자료로 활용하고자 하였다.
재료 및 방법
커피박 배양액 배지를 만들기 위해 먼저 커피박 여과액 (spent coffee grounds filtrate, SCGF)을 제조하였다. 커피박 여과액은 커피박을 증류수에 일정 비율로 혼합하여 만든 커피박 혼합액을 고압 멸균기(AC-100, Hanyang Science Lab Co., Ltd, Seoul, Korea)로 90°C에서 60분간 추출 후 여과지(Whatman No. 2 f ilter p aper)로 여과하여 상온에서 냉각시켜 제조하였다. 제조한 커피박 여과액에 당(sugar)과 산(acetic acid)을 첨가하여 커피박 배양액 배지(spent coffee grounds filtrate medium)를 제조하였다(Table 1). 본 연구에서 사용한 미생물은 한국 종국 협회(KCCM, Korean Culture Center of Microorganisms)에서 Gluconacetobacter xylinus subsp. xylinus (KCCM 41431)를 분양 받아 사용하 였다.
균주 Gluconacetobacter xylinus subsp. xylinus (KCCM 41431)의 셀룰로오스 균막 생성에 대한 최적 배양 조건을 확인하기 위해서 배양 방법, 초기 pH, 배양 온도, 배양 기 간을 각각 다르게 설정하여 비교하였다.
배양 방법에 따른 셀룰로오스 균막의 두께를 측정하기 위해 각각 교반 배양과 정치 배양으로 박테리아 셀룰로오 스를 생성하였다. 교반 배양 방법은 고형배지에 보존 중인 Gluconacetobacter xylinus subsp. xylinus를 100 mL 배양액 에 백금이로 접종하여 30°C에서 5일 동안 125 rpm으로 진 탕 배양하였다. 정치 배양 방법은 고형배지에 보존 중인 Gluconacetobacter xylinus subsp. xylinus를 100 mL 배양액 에 백금이로 접종하여 30°C에서 7일 동안 정치 배양한 후 박테리아 셀룰로오스 균막의 두께를 측정하여 최적의 배양 방법을 설정하였다.
0.1 N NaOH와 0.1N HCl로 배양액의 초기 pH를 3-8로 조정하여 30°C에서 7일 동안 정치 배양한 후 박테리아 셀 룰로오스 균막의 두께를 측정하여 최적의 초기 pH를 설정 하였다.
선행 실험을 통해 설정한 최적 초기 pH 6으로 배지를 제조하고, 배양 온도를 22-34°C에서 각각 7일 동안 정치배 양한 후 박테리아 셀룰로오스 균막의 두께를 측정하여 최 적 배양 온도를 설정하였다.
선행 실험을 통해 설정한 최적 초기 pH6과 배양 온도 30°C의 조건에서 21일간 정치배양한 후 박테리아 셀룰로오 스 균막의 두께를 측정하여 최적 배양 기간을 설정하였다.
배지는 고압 멸균기(AC-100, Hanyang Science Lab Co.)로 121°C에서 15분간 멸균 처리하여 사용하였다. Gluconacetobacter xylinus subsp. xylinus는 호기성 미생물 로서 생장에 필요한 산소를 공급하기 위해 삼각 플라스크 입구를 실리스토퍼로 막아 호기성 조건을 유지시켜 주었다 . 고형배지에 보존 중인 Gluconacetobacter xylinus subsp. xylinus를 100 mL 배양액에 백금이로 접종하여 30°C에서 72시간 동안 정치 배양하여 전배양액을 제조하였다. 전배 양과 동일한 배지 조성으로 본배양액을 제조하였고, 배지 는 고압 멸균기로 121°C에서 15분간 멸균 처리하여 사용 하였다. 본배양액에 전배양액을 넣고 선행 실험을 통해 설 정한 최적 초기 pH와 배양 온도, 배양 시간의 조건에서 배양을 진행하여 공기와 배지가 만나는 표면에 박테리아 셀룰로오스 균막을 형성시켰다.
형성된 박테리아 셀룰로오스 균막을 정제하기 위해 0.1N NaOH 용액에 넣고 80°C에서 3시간 동안 중탕하여 남아있 는 배지 등 오염물을 제거하였다. pH 7이 될 때까지 증류 수로 반복 세척하여 중화한 후 열풍건조(hot air drying, 25°C, 3시간), 동결건조(freeze drying, -50°C, 24시간)하여 박테리아 셀룰로오스 필름을 제조하였다. 열풍건조에서 는 박테리아 셀룰로오스 균막을 식품용 믹서기로 분쇄 후 몰드(9×9cm)에 넣고 건조 하는 몰드건조(molding drying, 25°C, 6시간)를 추가로 진행하여 함께 비교하였다.
박테리아 셀룰로오스 필름의 인장강도 및 신장률은 ASTM Standard Method D882-91 방법에 따라 압축/굽힘 시험기(SDWS-2013-R3, IMADA SEISAKUSHO Co., Ltd, Toyohashi, Japan)를 사용하여 KS 규격에 준하여 제조한 필름(2×9 cm)을 시험기 하축과 상축에 고정시킨 후 측정하 였다. 측정 중 상하부 물림부에서 시편이 빠지거나 절단된 경우에는 재측정하여 측정 오차를 최소화 하였다. 측정 시 초기 grip간 거리는 5 cm, cross head의 속도는 500mm/ min로 조절하였다. 인장강도(A)및 신장률(B)은 각각 다음 식을 이용하여 구하였다.
(A)에서 F (maximum tensile force)는 필름을 늘려 절단 될 때까지 작용한 가장 큰 힘, A (cross sectional area)는 필름의 평균 단면적이다. (B)에서 ΔL은 필름이 절단될 때 까지 이동한 grip간 거리, L은 초기 grip간 거리이다.
박테리아 셀룰로오스 필름의 수분 용해도는 ASTM Standard Method E96-85 방법에 따라 제조된 필름(5×5 cm)을 105°C에서 24시간 건조한 후 초기 무게를 측정하였 다. 건조된 필름을 30 mL 증류수가 담긴 비커에 담아 입 구를 파라필름으로 밀봉한 후 shaking incubator에서 25°C, 120 rpm 조건으로 24시간 교반하였다. 24시간 후 용해되지 않고 남은 필름을 다시 105°C에서 24시간 건조하여 최종 무게를 측정하였다. 수분 용해도는 다음 식을 이용하여 구 하였다.
A는 건조한 후 초기 무게(initial dry weight), B는 건조 후 최종 무게(final dry weight)이다.
박테리아 셀룰로오스 필름의 두께는 제조한 필름(5×5 cm)의 왼쪽 위, 왼쪽 아래, 오른쪽 위, 오른쪽 아래 4부분 으로 나누어 디지털 캘리퍼스(CD-15APX, MITUTOYO, Kawasaki, Japan)를 이용하여 두께를 mm로 나타내었다.
결과 및 고찰
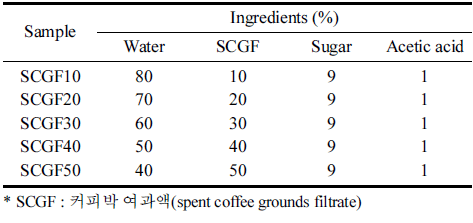
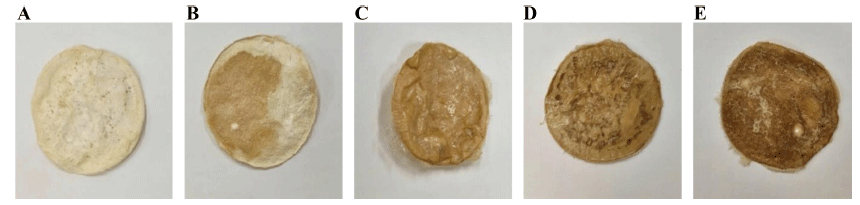
커피박 배양액 배지를 만들기 위한 커피박 여과액(spent coffee grounds filtrate, SCGF)의 첨가 비율을 달리 설정하 여 균막 생성 여부를 비교하고, 최적 첨가 비율을 선정하 였다. Fig. 1과 같이 SCGF10, 20, 30, 40, 50 모두 박테리 아 셀룰로오스 균막이 생성되었다. 하지만 SCGF10의 경우 균막의 두께가 너무 얇게 형성되었으며, SCGF30, 40, 50 은 배양액의 당 함량이 높아 표면이 끈적거리는 단점이 있 어 SCGF20을 최적 비율로 선정하였다. 배양 방법에 따른 박테리아 셀룰로오스 균막 형성 차이를 비교하였다(Fig. 2). 교반 배양으로 생산한 셀룰로오스 균막의 경우 균막의 형성 기간이 5일 이내로 정치배양에 비해 배양 시간을 단 축할 수 있다는 장점이 있으나 교반 속도에 의해 균막이 엉기는 형태로 생성되어 필름으로 적합하지 않았다. 또한 건조 후에도 불규칙하게 수축되는 단점을 보였다. 정치 배 양으로 생산한 셀룰로오스 균막은 균막 형성 기간이 7일로 교반 배양에 비해 오래 걸리지만 균막의 표면이 매끈하게 형성되었고, 건조 후에도 필름으로써의 형태를 유지하였다. 따라서 정치 배양이 보다 적합한 박테리아 셀룰로오스 균 막 생성 방법으로 판단하였다.
박테리아 셀룰로오스 균막 생성 조건을 확인하기 위하여 초기 pH, 당 함량, 배양 온도, 배양 기간을 각각 다르게 설정하여 균막을 생성한 후, 균막의 두께를 측정하여 최적 배양 조건을 확립하였다(Fig. 3). 박테리아 셀룰로오스 균 막의 생산을 위한 최적 초기 pH를 연구한 결과 pH 6에서 가장 높은 생산능이 나타났다. pH 3에서 6까지는 생산량 이 비례적으로 증가하였으나 pH 7과 8에서는 매우 낮았다. 박테리아 셀룰로오스 균막의 생산을 위한 최적 당 함량을 연구한 결과 당 함량 10 brix 배지에서 가장 높은 생산능 이 나타났다. 당 함량 1 brix 배지는 셀룰로오스 균막이 전혀 생성되지 않았다. 3 brix에서 10 brix까지는 생산량이 비례적으로 증가하였으나 12 brix에서는 매우 낮았다. 박테 리아 셀룰로오스 균막의 생산을 위한 최적 배양 온도를 연 구한 결과 배양 온도 30°C에서 배양하였을 때 가장 높은 생성능이 나타났다. 일반적으로 Gluconacetobacter xylinus subsp. xylinus는 26°C에서 가장 높은 생성능이 보인다고 알려져 있지만(Chawla et al., 2008;Gromet-Elhanan & Hestrin, 1963)
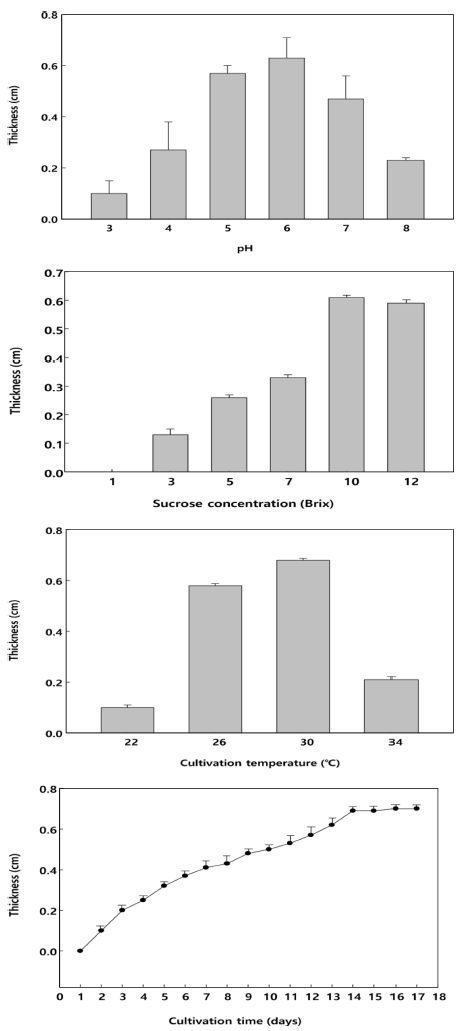
30°C에서 배양하였을 때 배양 시간이 단축되면서 셀룰로 오스 균막의 두께는 더 두꺼운 결과를 보였다. 박테리아 셀룰로오스 균막의 생산을 위한 최적 배양 온도를 연구한 결과 배양 시간 5일 후부터 배지 표면에 얇은 균막 형태 가 나타났으며 14일 배양하였을 때 가장 높은 생성능이 나타났다. 이후 배양 시간을 연장하여도 셀룰로오스 균막 의 두께 변화가 차이가 없었다. 상기에서 확립된 셀룰로오 스 균막의 생산을 위한 최적 조건은 전배양 후 본배양을 실시하고, 정치배양을 통해서 초기 pH 6, 당 함량 10 brix 배지, 배양 온도 30°C, 배양 시간 14일에서 셀룰로오스 균 막의 생산능이 최대임을 확인하였다.
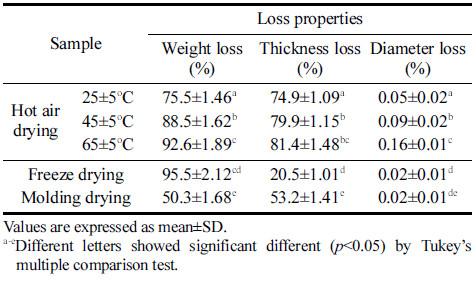
박테리아 셀룰로오스 균막의 건조 방법에 따른 건조 손 실과 열풍건조 온도에 따른 건조 손실을 측정한 결과를 Table 2에 나타냈다. 균막의 무게 손실은 동결건조, 열풍건 조, 성형 후 몰드건조 순으로 나타났으며, 두께 손실은 열 풍건조, 동결건조, 성형 후 몰드건조 순으로 나타났다. 지 름 손실은 모든 건조 방법에서 유의적인 차이가 없었다. 열풍건조 25°C, 45°C, 65°C에서 균막을 건조한 결과 무게 손실, 두께 손실, 지름 손실 모두 건조 온도가 높아짐에 따라 손실이 증가하였다. 이를 바탕으로 최적 열풍건조 온 도는 25°C로 선정하였다.
|
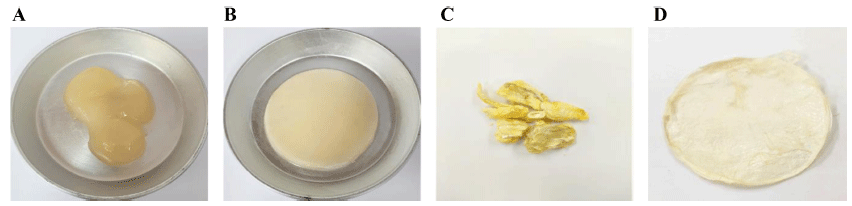
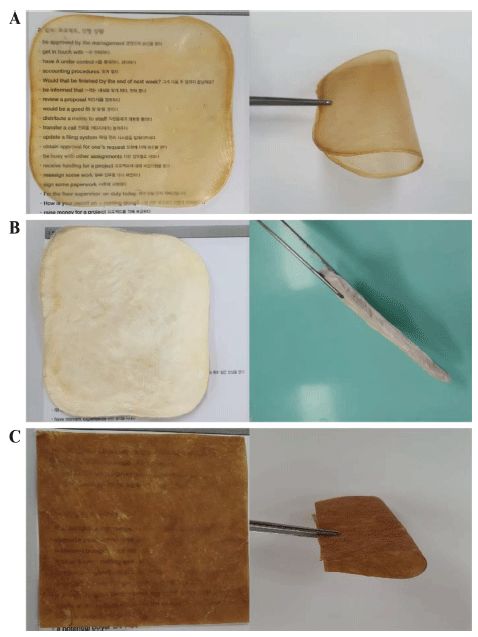
생성된 박테리아 셀룰로오스 균막의 건조 방법에 따른 외관 차이와 질감 차이를 보여주는 결과를 Fig. 4에 나타 내었다. 열풍건조로 건조한 셀룰로오스 균막의 경우 표면 이 부드럽고 일반적인 포장재 필름 질감을 보인 반면, 동 결건조로 건조한 셀룰로오스 균막의 경우 스티로폼과 같은 질감을 보였다. 셀룰로오스 균막을 분쇄하여 원하는 형태 로 성형하여 건조한 경우 가죽과 같은 질감을 보여 건조 방법에 따라 완성된 셀룰로오스 균막이 외관과 질감에 있 어 차이를 보였다. 하지만 박테리아 셀룰로오스 균막의 건 조 방법에 따른 표면 미세 구조는 차이가 없었다(Fig. 5).

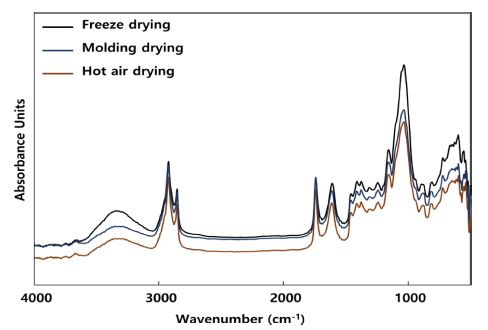
박테리아 셀룰로오스 필름의 건조 방법에 따른 작용기 변화를 측정하기 위해 FT-IR 분석을 수행하였다(Fig. 6). 일반적으로 식물성 셀룰로오스는 1,250 cm-1에서 1,450 cm-1 영역에서 5개의 피크 분리가 나타나며, 1,000 cm-1에 서 1,200 cm-1 영역에서 4개의 피크를 나타낸다. 또한 추가 적으로 893 cm-1, 1,430 cm-1, 2,900 cm-1, 3,400 cm-1 영 역에서 진동에 의한 피크를 나타낸다. 최적 배양 조건으로 배지에서 획득한 셀룰로오스 균막을 각각 열풍건조, 동결 건조, 몰드건조를 통해 건조한 결과 일반적으로 알려진 식 물성 셀룰로오스 피크와 동일한 결과를 보였다.
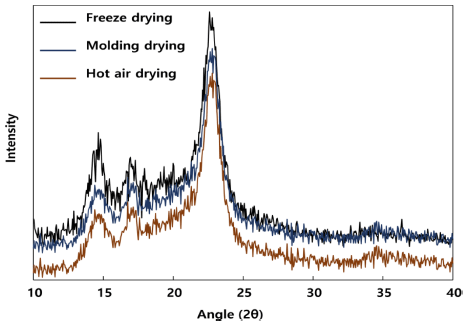
박테리아 셀룰로오스 필름의 건조 방법에 따른 작용기 변화를 측정하기 위해 XRD 분석을 수행하였다(Fig. 7). 일 반적으로 식물성 셀룰로오스의 결정 구조는 14.6°, 16.4°, 22.6°에서 주요 결정성 회절 피크가 나타난다. 최적 배양 조건으로 배지에서 획득한 셀룰로오스 균막을 각각 열풍건 조, 동결건조, 성형 후 몰드건조를 통해 건조한 결과 일반 적으로 알려진 식물성 셀룰로오스 피크와 동일한 결과를 보였다.
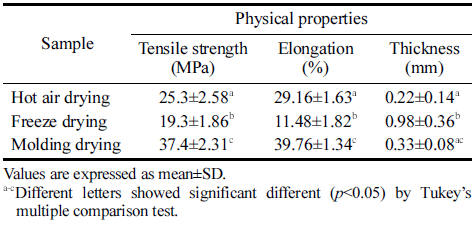
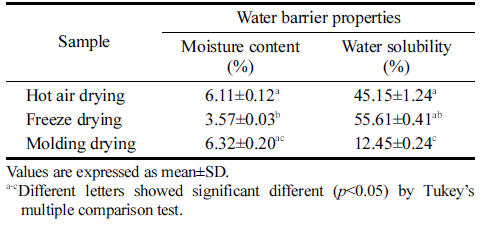
건조 방법에 따른 박테리아 셀룰로오스 균막으로 제조한 필름의 물리적 특성을 조사한 결과를 Table 3에 나타내었 다. 몰드건조를 하였을 때 가죽과 같은 질감으로 인장강도 37.4 MPa와 신장률 39.76%로 열풍건조와 동결건조보다 높았다. 또한 동결건조 시 스티로폼과 같은 질감으로 열풍 건조와 성형 후 몰드건조 보다 두께는 가장 두꺼운 것으로 나타났지만 인장강도가 낮았다. 건조 방법에 따른 셀룰로 오스 균막으로 제조한 필름의 수분함량과 수분용해도 결과 를 Table 4에 나타내었다. 필름의 수분용해도는 수분에 대 한 저항성을 나타내는 지표로서 수분용해도는 식품 포장재 에 요구되는 중요한 성질이다. 동결건조한 필름은 수분함 량이 3.57%로 열풍건조와 몰드건조한 필름보다 낮았으나 수분 용해도는 55.61%로 수분 흡수율이 가장 높게 나타났 다. 몰드건조한 필름은 가죽과 같은 질감과 촘촘한 구조로 인해 수분 용해도 12.45%로 수분 흡수율이 가장 낮음을 확인하였다.
|
|
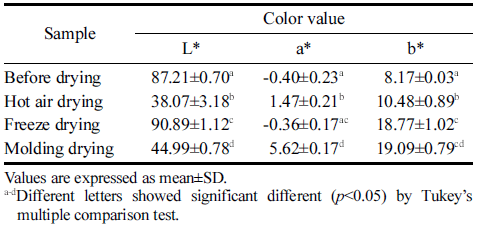
건조 방법에 따른 박테리아 셀룰로오스 균막으로 제조한 필름을 L*, a*, b* 값으로 색상을 정량 수치화한 결과를 Table 5에 나타내었다. 필름의 색도는 소비자의 선호도에 직접적으로 영향을 주는 중요한 특성이다. 건조 전 박테리 아 셀룰로오스의 L*는 87.21이고, 이를 동결건조로 건조한 경우 백색도가 90.89로 건조 전 셀룰로오스 균막 보다 백 색도가 높아졌으며, 열풍건조와 성형 후 몰드건조한 경우 각각 38.07과 44.99로 오히려 백색도가 낮아졌다. 열풍건조 와 성형 후 몰드건조는 열을 가하는 건조 방법으로 인해 상대적으로 동결건조한 필름보다 b*가 높았다.
|
요 약
박테리아 셀룰로오스는 우수한 물리화학적 특성을 가지 고 있어 다양한 분야에서 활용이 가능하다. 본 연구에서는 커피 부산물을 활용하여 박테리아 셀룰로오스 균막 생성을 위한 최적 배양 조건을 구명하고, 최종 건조 필름의 특성 을 확인하였다. 셀룰로오스 균막은 전배양 후 본배양을 실 시하고, 정치배양을 통해서 배양하여 초기 pH 6, 당 함량 10 brix 배지, 배양 온도 30°C, 배양 기간 14일 조건에서 최대 생산능을 나타내었다. 정치 배양으로 생산한 셀룰로 오스 균막의 경우 균막의 형성 기간이 교반 배양에 비해 오래 걸리지만 균막의 표면이 매끈하고 건조 후에도 필름 으로서의 형태를 유지하는 장점을 확인할 수 있었다. 생성 된 셀룰로오스 균막은 각각 열풍건조, 동결건조, 몰드건조 방법으로 건조하였다. 커피박 배양액으로 제조한 배지에서 생성된 박테리아 셀룰로오스 균막에 대한 SEM 분석, XRD 분석, FT-IR 분석 결과 일반적인 박테리아 셀룰로오 스와 물리화학적 특성이 유사하게 나타났다. 건조 방법에 따른 필름의 질감 차이를 확인하였다. 건조 조건에 따라 보다 다양한 물리적 특성 구현이 가능할 것으로 예상된다. 지속적인 친환경 소재 개발을 통해 커피 부산물 재활용 기 회를 확대되고, 식품 폐기물로 인한 환경문제 해결에 기여 할 것으로 기대된다.