서 론
현대인의 질병 예방에 대한 관심 및 항노화 산업의 발전 에 따라 만성질환을 예방하고 치료할 수 있는 천연 소재에 대한 요구가 증가하고 있다. 생체 대사과정에서 끊임없이 발생하는 활성산소종(reactive oxygen species, ROS)은 정 상적인 경우 생체 내의 항산화계에 의해 제거되어 항산화 방어계의 균형을 이루지만, 생체가 과도한 스트레스를 받 거나 과음, 흡연, 환경오염, 질병 상태에서는 활성산소의 과잉으로 건강한 세포에 산화적 손상을 유발하여 암, 심혈 관 질환, 당뇨 등과 같은 다양한 질병을 유발하고 노화를 촉진한다(Reuter et al., 2010;Alfadda & Sallam, 2012). 활성산소종을 제거하기 위해 사용되는 합성 항산화제의 경 우 세포 내 독성이 보고됨에 따라 안전하고 효과적인 천연 항산화제를 개발하기 위한 연구가 이루어지고 있다(Kim et al., 2008;Kim et al., 2015).
현대인의 만성질환 중 하나인 당뇨병은 전 세계적으로 유병율이 증가하는 추세로서, 우리나라도 식습관의 변화로 인해 당뇨병 환자의 수가 빠르게 증가하고 있다. 당뇨병 은 췌장에 있는 β-세포에서 분비되는 인슐린의 절대적 또 는 상대적 분비 부족으로 혈당의 농도가 급격하게 상승하 여 체내에 비정상적인 당질 대사를 초래하는 질병이다 (Beckman et al., 2002). 대부분의 당뇨병은 인슐린이 분 비되지 않아 발생하는 제1형보다는 비만이나 유전적인 문 제로 발생하는 제2형에 속한다(Salimifar et al., 2013). 당 뇨는 심혈관계 질환, 신장 질환, 망막 및 구강질환 등의 합병증을 유발하므로 적절한 치료와 예방이 필요하며, 특 히 식후 혈당을 조절하는 것이 매우 중요하다(Tai et al., 2000;Yoo et al., 2002). α-Glucosidase는 소장에 존재하는 소화 효소로서 다당류를 단당류로 가수분해시켜 혈당을 급 격히 상승시키므로, 혈당 조절을 위한 α-glucosidase 저해 제가 당뇨병 치료제로 이용되어 왔다(Lebovitz, 1998). 그 러나 α-glucosidase를 억제하는 약물의 장기 투여를 통해 복부팽만, 설사 등 부작용이 보고되면서 인체 내 부작용을 줄이고 항당뇨 효과를 나타내는 천연물 치료제 개발에 대 한 연구가 증가하고 있다(Dileep et al., 2018;Ji et al., 2020).
고추(Capsicum annuum L.)는 가지과(Solanaceae)에 속하 는 초본식물로 한국인의 식생활에서 매운맛을 내는 필수적 인 향신료로 자리 잡고 있다(Kim et al., 2020). 고추 열매 는 phenolic acid, flavonoids, 비타민 C, E가 풍부하며, 매 운맛 성분인 capsaicin은 당뇨병성 신경성증, 관절염, 대상 포진 후 신경통, 피부건선 등의 치료 효과와 항암 활성에 대한 연구가 보고되고 있다(Zhang & Po, 1994;Howard et al., 2000;Mori et al., 2006). 그러나 고추의 식용 및 생리활성에 관한 연구는 고추 열매에 집중되어 있으며, 식 용이 가능한 고춧잎에 대한 생리활성 연구는 소수에 불과하 다. Kim et al. (2003)은 고춧잎 용매 분획물의 항산화, 항 균 및 tyrosinase 저해활성을 보고하였으며, Jeon et al. (2008)은 고춧잎 추출물의 항산화 활성과 암세포 증식 억 제 효과를 보고하였다. Ku & Kang (2010)은 고추 기관별 항산화 활성과 quinone reductase 유도 활성을 비교한 결과 고춧잎이 다른 기관에 비해 더 높은 활성을 나타내었다. 또한 Kim et al. (2021)은 고춧잎 에탄올 추출물로부터 α- glucosidase 저해 활성을 나타내는 화합물을 탐색하여 luteolin과 apigenin 배당체를 확인하였다. 이들 연구를 통해 고춧잎은 기능성 천연 소재로서 개발 가능성이 높을 것으로 기대되며 산업화를 위해 다양한 연구가 필요한 실정이다.
본 연구에서는 산화 스트레스의 예방 및 혈당을 조절할 수 있는 천연 소재로서 고춧잎의 산업적 이용 증대를 위한 기초 자료를 제시하기 위해 고춧잎의 추출 조건에 따른 항 산화 및 α-glucosidase 저해 활성과 주요 플라보노이드 성 분으로 luteolin 함량을 분석하였다.
재료 및 방법
본 실험에 사용된 고춧잎은 살리초 품종으로 2021년 수 확하여 건조된 원료를 ㈜노블젠(Suwon, Korea)에서 구입하 여 –20°C에 보관하면서 실험에 사용하였다. 추출 용매에 따른 고춧잎의 추출은 고춧잎 50 g에 1,450mL의 물 또는 95% 에탄올을 가하여 열수 추출은 100°C에서 1시간, 에탄 올 추출은 실온(25°C)에서 24시간 동안 추출한 후 감압 농 축기를 이용하여 용매를 휘발시켰다. 추출 온도에 따른 고 춧잎의 열수 추출은 고춧잎을 80°C와 100°C에서 1시간 동 안 추출하였으며, 추출 시간에 따른 고춧잎의 열수 추출은 고춧잎을 100°C에서 각각 30분, 60분, 90분 동안 추출하였 다. 추출 조건에 따른 고춧잎 추출액은 55 μm bag filter로 여과한 후 동결건조(PVTFD 10R, IlShin Lab Co., Ltd., Dongducheon, Korea)하여 추출 수율을 측정하고 본 실험 의 평가 시료로 사용하였다. 추출 수율은 동결 건조된 분 말 중량을 추출에 사용한 고춧잎 원료의 중량으로 나누어 백분율(%)로 나타내었다.
고춧잎 추출물의 주요 플라보노이드 성분을 분석하기 위하여 열수 추출 분말 100mg에 2.5 N HCl과 70% methanol 혼합 용액 5mL를 가하여 75°C에서 2시간 동안 산 가수분해를 진행하였다. 가수분해한 시료를 10mL로 정용한 후 0.45 μm syringe filter (Advantec Toyo Kaisha Ltd., Tokyo, Japan)로 여과하여 high-performance liquid chromatography (HPLC) 분석에 사용하였다. HPLC 분석기 기는 Agilent 1100 series (Agilent Technologies, Waldbronn, Germany)를 사용하였으며, column은 Sunfire C18 (4.6×250 mm, 5 μ m, W aters Co., Milford , MA, USA)을 사용하 였고, 검출 파장은 350 nm에서 분석하였다. 이동상 A는 2% acetic acid를 함유한 deionized water, 이동상 B는 2% acetic acid를 함유한 50% acetonitrile을 사용하였다. 용매 B는 0%로 시작하여 40분에 100%로 증가시킨 후 50 분까지 유지하였으며, flow rate는 0.8 mL/min, injection volume은 20 μL로 분석하였다. 주요 플라보노이드 성분의 확인을 위한 luteolin과 apigenin 표준품은 Sigma-Aldrich Co. (St. Louis, MO, USA)에서 구입하여 사용하였다. 추출 조건에 따른 고춧잎 추출물의 luteolin 함량은 동일한 조건 으로 HPLC 분석을 수행한 후 표준 검량 곡선을 통해 계 산하였다.
고춧잎 추출물 10 μL에 0.1 mM DPPH (2,2-diphenyl- 1-picrylhydrazyl, Wako Pure Chemical Industries, Ltd., Osaka, Japan) 190 μL를 혼합하여 상온에서 30분간 반응시 킨 후 spectrophotometer를 이용하여 517 nm에서 흡광도를 측정하였다. 각 시료의 DPPH 라디칼 소거능은 아래의 식 으로 계산하여 백분율로 나타내었다.
7mM ABTS (2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid), Wako Pure Chemical Industries)와 2.45mM potassium persulfate를 암소에서 16시간 동안 반응시켜 ABTS 양이온 을 형성시킨 후 사용 직전 734 nm에서 흡광도가 0.80±0.02 가 되도록 조정하였다. 고춧잎 추출물 10 μL에 ABTS 용 액 190 μL를 혼합하여 실온에서 10분 동안 반응시킨 후 spectrophotometer를 이용하여 734 nm에서 흡광도를 측정하 였다. 각 시료의 ABTS 라디칼 소거능은 아래의 식으로 계산하여 백분율로 나타내었다.
고춧잎 추출물의 α-glucosidase 저해 활성은 α-Glucosidase Inhibitor Screening Kit (Biovision, Milpitas, CA, USA)를 이용하여 측정하였다. 고춧잎 추출물 10 μL에 α- glucosidase 10 μL와 α-glucosidase assay buffer 60 μL를 가 하여 실온에서 20분간 반응시킨 후 20 μL의 α-glucosidase 기질 혼합물을 각 well에 첨가하고, 410 nm에서 30분 동안 흡광도를 측정하였다. 시료 무처리구는 negative control로 사용하였고, acarbose (Sigma-Aldrich Co.)를 positive control 로 사용하였으며, 아래의 식으로 계산하여 저해율을 나타 내었다.
모든 실험은 3회 반복하여 수행하였으며, 실험의 결과는 평균(mean)±표준편차(standard deviation, SD)로 나타내었다 . 통계는 SPSS 프로그램(Statistical Package for Social Science, version 17, SPSS Inc., Chicago, IL, USA)을 이 용하여 분석하였으며, 고춧잎 추출 용매(물, 95% 에탄올) 와 추출 온도(80°C, 100°C) 간 유의적 차이는 p<0.05 수준 에서 Student’s t-test로 검증하였으며, 추출 시간별 유의적 차이는 일원배치 분산분석(one-way ANOVA)을 실시한 후 p<0.05 수준에서 Duncan’s multiple range test를 이용하여 검증하였다.
결과 및 고찰
식물성 유용성분 중 하나인 플라보노이드는 식물의 2차 대사산물로서 식물체 보호 기능뿐만 아니라 항산화, 항염 증, 항균, 항바이러스, 항암 활성 등 다양한 생리활성을 나 타내는 것으로 알려져 있다(Havsteen, 1983;Wang et al., 2018). 고춧잎의 주요 플라보노이드 성분은 apigenin과 luteolin이 보고되고 있으며(Kang et al., 2021;Kim et al., 2021), apigenin은 파슬리, 박하, 레몬, 들깨, 딸기 및 다양 한 과일에 함유되어 있고(Park et al., 2015), luteolin은 당 근, 브로콜리, 샐러리 등 녹황색 채소류와 과일에 풍부한 성분으로 알려져 있다(Tuorkey, 2016). Apigenin은 항산화 활성이 높은 성분으로 알려져 있으며, 그 외에도 항염증, 항고혈압, 항암 활성 등의 다양한 생리활성이 보고되고 있 다(Salehi et al., 2019). Luteolin은 항산화, 항암, 항염증, 항알레르기 활성 및 신경세포 보호 활성 등이 알려져 있다 (Woo et al., 2016;Woo et al., 2021). 고춧잎 추출물의 주 요 플라보노이드 성분의 함량을 비교하기 위하여 열수 추 출물에 대한 HPLC를 시행한 결과 luteolin (RT 31.7 min) 의 함량은 4.44 mg/g, apigenin (RT 35.5 min)의 함량은 0.35 mg/g으로 분석되어 apigenin에 비해 luteolin의 함량이 10배 이상 높은 것으로 확인되었다(Fig. 1).
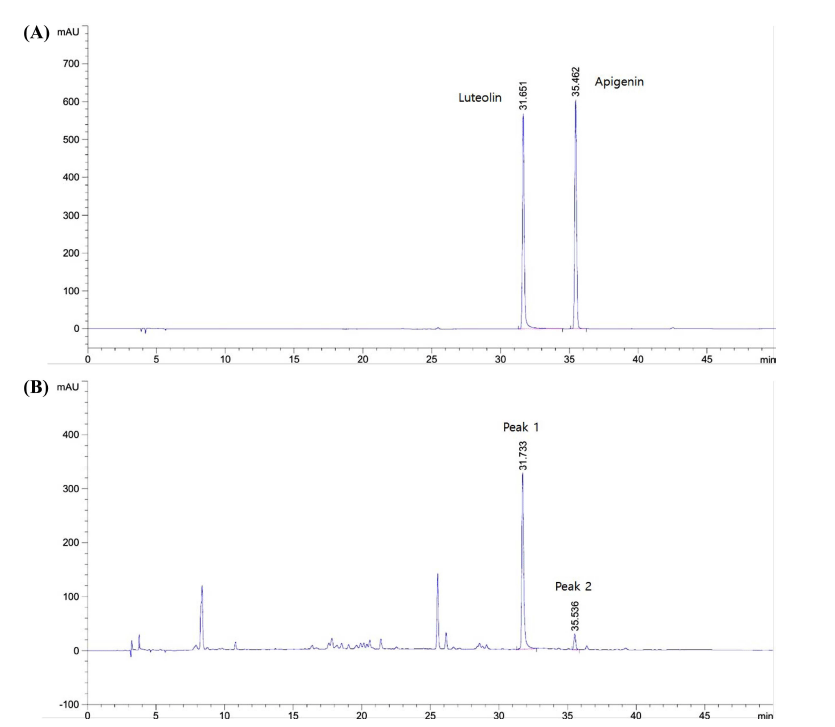
고춧잎에 물을 첨가하여 100°C에서 1시간 동안 추출한 열수 추출물과 95% 에탄올을 첨가하여 상온(25°C)에서 24 시간 동안 추출한 에탄올 추출물의 추출 수율 및 luteolin 함량을 측정한 결과는 Table 1과 같다. 추출 수율은 열수 추출 조건에서 23.08%로 측정된 반면, 에탄올 추출에서 1.64%로 낮은 수율을 나타내었으며, luteolin 함량은 열수 추출 분말의 4.44 mg/g과 에탄올 추출 분말의 2.61 mg/g으 로 큰 차이를 나타내었다.

|
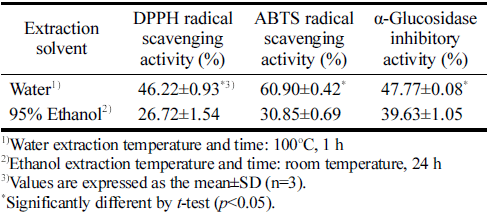
추출 용매에 따른 고춧잎 추출물의 항산화 활성과 α- glucosidase 저해 활성을 측정한 결과는 Table 2와 같다. 용매별 추출 시료의 DPPH 라디칼 소거능(100 μg/mL)과 ABTS 라디칼 소거능(100 μg/mL)을 비교한 결과 열수 추 출물은 각각 46.22%와 60.90%의 소거능을 나타내며 에탄 올 추출물(26.72%, 30.85%)에 비해 더 높은 항산화 활성 을 나타내었다. Jeon et al. (2008)은 고춧잎을 상온에서 물 과 메탄올로 추출한 시료의 DPPH와 ABTS 라디칼 소거 능을 비교한 결과 메탄올 추출물이 더 높은 항산화 활성을 나타내었으나, 본 연구와 달리 물 추출에서 열처리를 하지 않아 항산화 성분의 추출 효율이 낮았기 때문으로 생각된 다. 또한 Ku et al. (2009)의 연구에서 13개 품종의 고춧잎 을 메탄올로 추출하여 항산화 활성을 비교한 결과 DPPH 라디칼 소거능은 200 μg/mL 농도에서 품종에 따라 1.8- 40.7%의 범위로 큰 차이를 나타내었으며, 본 연구의 항산 화 활성(100 μg/mL, 46.22%)과 비교하였을 때 원료로 사 용한 살리초 품종은 항산화 활성이 우수한 품종으로 생각 된다. α-Glucosidase는 식이 중에 함유된 탄수화물을 포도 당으로 전환시키는 효소로서, α-glucosidase 저해제는 탄수 화물의 흡수를 지연시키는 역할을 하여 식후 혈당 상승을 완만하게 하므로 인슐린 비의존성 당뇨병 환자에게 효과적 이다(Park et al., 2020;Lee, 2021). 고춧잎의 용매별 추출 시료(0.5 mg/mL)에 대한 α-glucosidase 저해 활성을 비교한 결과 열수 추출물은 47.77%, 에탄올 추출물은 39.63%를 나타내어 열수 추출물의 저해 활성이 더 높은 결과를 보였 다. 고춧잎 에탄올 추출물로부터 α-glucosidase 저해 활성을 나타내는 화합물을 탐색하여 보고한 연구는 있으나(Kim et al., 2021), 고춧잎의 추출 조건에 따른 α-glucosidase 저해 활성을 비교한 연구는 전무하다. 본 연구에서 산업적으로 활용할 수 있는 식품 등급의 추출 용매로서 열수와 에탄올 추출물의 추출 수율, luteolin 함량, 항산화 활성 및 α- glucosidase 저해 활성을 비교한 결과 모든 평가 항목에서 열수 추출물이 유의적으로 우수한 결과를 나타내어 고춧잎 의 추출 용매를 물로 선정한 후 추출 온도에 따른 열수 추출물의 평가를 진행하였다.
|
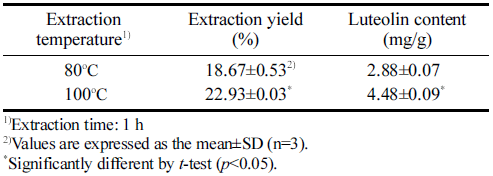
고춧잎의 열수 추출 온도를 선정하기 위해 80°C와 100°C에서 각각 1시간 동안 열수 추출한 고춧잎 추출물의 추출 수율 및 luteolin 함량을 측정한 결과는 Table 3과 같 다. 추출 수율은 80°C 추출에서 18.67%, 100°C 추출에서 22.93%로 측정되었으며, luteolin 함량은 80°C 추출에서 2.88 mg/g, 100°C 추출에서 4.48mg/g을 나타내어 추출 온 도에 따른 수율 및 luteolin 함량은 100°C 추출에서 유의적 으로 높은 결과를 확인하였다. 그러나 추출 온도에 따른 고춧잎 열수 추출물의 항산화 활성을 비교하기 위해 DPPH 및 ABTS 라디칼 소거능을 측정한 결과 추출 온도 에 따른 유의적인 차이는 나타나지 않았다(Table 4). Yun & Jeong (2012)의 연구에서 소리쟁이 뿌리를 온도별로 추 출하여 분석한 결과 추출 온도와 비례하여 추출 수율은 증 가하였으나 DPPH 라디칼 소거능은 50°C 추출에서 74.6%, 75°C 추출에서 76.8%로 근소한 차이를 나타내었다. 천연 소재의 온도에 따른 추출물에서 항산화 활성이 유사한 결과 는 높은 추출 온도에서 항산화 성분의 추출 수율은 증가하 는 반면 일부 항산화 성분이 고온에서 불안정한 특성을 나 타내어 항산화 성분의 총 함량이 유사하기 때문으로 추정된 다. 추출 온도에 따른 고춧잎 열수 추출물의 α-glucosidase 저해 활성을 비교한 결과 80°C 추출에서 42.51%, 100°C 추출에서 47.67%의 저해율을 보이며 100°C 추출물이 유의 적으로 더 높은 활성을 나타내었다(Table 4). 추출 온도에 따른 고춧잎 열수 추출물의 분석 결과 100°C 조건의 추출 수율이 80°C 추출에 비해 1.3배 높은 결과를 나타내며, α- glucosidase 저해능에서 좀 더 높은 활성을 나타내므로 고 춧잎의 열수 추출 온도를 100°C로 선정한 후 추출 시간에 따른 열수 추출물의 평가를 진행하였다.
|

|
고춧잎을 100°C에서 각각 30분, 60분, 90분 동안 열수 추출한 후 추출물의 추출 수율 및 luteolin 함량을 측정 한 결과는 Table 5와 같다. 추출 수율은 30분 추출에서 19.72%로 가장 낮은 결과를 보였으며, 60분 추출에서 22.84%로 증가하였으나 90분 추출(23.10%)과 유의적인 차 이는 보이지 않았다. 추출 시간에 따른 luteolin 함량은 30 분 추출의 3.77 mg/g의 함량에서 60분 추출 시 4.66mg/g 으로 증가하였으나 90분 추출에서 4.60mg/g의 함량을 나 타내며 60분 추출과 유사한 수준으로 확인되었다. 추출 시 간에 따른 고춧잎 열수 추출물의 추출 수율과 luteolin은 비례적으로 증가함을 알 수 있었다. 추출 시간에 따른 고 춧잎 열수 추출물의 항산화 활성을 비교하기 위해 DPPH 및 ABTS 라디칼 소거능을 측정한 결과 60분 추출물에 서 각각 47.81%와 61.35%의 소거능을 나타내며 30분과 90분 추출물에 비해 좀 더 높은 항산화 활성을 나타내었다 (Table 6). Kim et al. (2006)은 감초의 에탄올 추출물의 DPPH 라디칼 소거능을 추출 시간에 따라 비교한 결과 6 시간과 12시간 추출물에 비해 18시간 이상의 추출물에서 활성이 더 높았으나 24시간 추출물과 유의적 차이는 없는 결과를 보였다. 그러나 Chung et al. (2006)의 동백나무 잎 을 이용한 열수 추출 조건 연구에서 추출 시간에 따른 열 수 추출물의 DPPH 라디칼 소거능을 비교한 결과 10분과 30분 추출물에 비해 60분과 120분 추출물에서 뚜렷하게 낮은 활성을 보였으며, 30분 이상의 추출 시 동백잎의 항 산화 화합물이 급격히 감소 또는 분해되는 결과로 보고하 였다. 고춧잎의 열수 추출에서도 60분 이상의 추출에서 항 산화 성분의 안정성이 낮아지는 것으로 생각된다. 추출 시 간에 따른 고춧잎 열수 추출물의 α-glucosidase 저해 활성 을 비교한 결과 항산화 활성 평가 결과와 유사하게 60분 추출물의 활성이 가장 높았으며, 90분 추출물에서 근소하 게 낮아지는 결과를 보였다(Table 6). Shin et al. (2015)은 잣버섯 에탄올 추출물의 추출 시간에 따른 α-glucosidase 저해 활성을 비교한 결과 추출 시간에 따라 활성이 증가하 는 결과를 보였다. Park et al. (2009)은 반응표면분석법을 통해 추출 조건에 따른 메밀 새싹 추출물의 α-glucosidase 저해 활성을 분석한 결과 추출 시간에는 큰 영향을 받지 않는 것으로 나타났다. 이들 연구를 통해 천연 소재의 특 성 및 생리활성 성분의 화학적 특성에 따라 추출 조건이 검토되어야 할 것으로 판단된다. 본 연구에서 고춧잎의 추 출 조건에 따른 추출 수율, luteolin 함량, 항산화 활성 및 α-glucosidase 저해 활성을 평가한 결과 에탄올보다는 물을 추출 용매로 하여 100°C, 60분 추출 조건에서 가장 우수한 결과를 나타내었으며, 향후 고춧잎 열수 추출물은 다양한 후속 실험을 통해 산업적 경제성이 우수한 천연 항산화 및 항당뇨 소재로서 개발이 기대된다.

|

|
요 약
본 연구에서는 고춧잎의 기능성 식품 소재화를 위한 기 초 연구로 추출 조건에 따른 고춧잎 추출물의 추출 수율, luteolin 함량, 항산화 및 α-glucosidase 저해 활성을 조사하 였다. 고춧잎 열수 추출물의 주요 플라보노이드 성분을 HPLC 분석을 통해 비교한 결과 apigenin (0.35 mg/g)에 비 해 luteolin (4.44 mg/g)이 10배 이상 높은 함량을 나타내었 다. 고춧잎을 열수와 에탄올로 각각 추출한 후 추출물의 추출 수율, luteolin 함량, 항산화 및 α-glucosidase 저해 활 성을 비교한 결과 모든 항목에서 열수 추출물이 유의적으 로 높은 결과를 나타내었다. 추출 용매를 열수 조건으로 선정하여 80°C와 100°C의 온도에서 추출한 열수 추출물을 분석한 결과 항산화 활성은 유사하였으나, 추출 수율, luteolin 함량 및 α-glucosidase 저해 활성은 100°C 추출에 서 더 높은 결과를 나타내었다. 추출 온도를 100°C로 선정 한 다음 추출 시간을 선정하기 위해 고춧잎을 각각 30분, 60분, 90분 동안추출한 열수 추출물을 분석하였다. 추출 수 율은 30분 추출의 19.72%에 비해 60분과 90분 추출에서 22.84%와 23.10%로 증가하였으며, luteolin 함량도 30분 추출물의 3.77mg/g에서 60분과 90분 추출물은 각각 4.66 mg/g과 4.60 mg/g의 수준으로 증가하였다. 추출 시간에 따 른 고춧잎 열수 추출물의 DPPH 및 ABTS 라디칼 소거능 을 측정한 결과 60분 추출물에서 각각 47.81%와 61.35% 의 소거능을 나타내며 30분과 90분 추출물에 비해 좀 더 높은 항산화 활성을 나타내었다. 추출 시간에 따른 고춧잎 열수 추출물의 α-glucosidase 저해 활성을 비교한 결과 항 산화 활성 평가 결과와 유사하게 60분 추출물의 활성이 유의적으로 높은 결과를 나타내었다.


