서 론
체내의 염증은 외부로부터 침입한 병원성 물질과 손상된 세포와 같은 물질에 대한 방어 반응으로(de Cássia da Silveira e Sá et al., 2013), 염증 유발이 지속될 경우 조직 손상을 촉진하여 신경퇴행성질환 같은 만성질환과 암 등이 발병될 수 있는 요인이 된다(Lee et al., 2016). 대식세포 (macrophage)는 그람 음성 세균의 세포 외막에 존재하는 물질로 알려진 lipopolysaccharide (LPS) 등의 자극으로 활 성화되어 체내의 염증 반응에 관여하는 주요 세포 중 하나 로 중요한 기능을 하는 것으로 알려져 있다. 활성화된 대 식세포에서 방출되는 사이토카인인 종양괴사인자(tumor necrosis factor-alpha, TNF-α), interleukin-6 (IL-6)는 염증성 사이토카인으로 급성 면역반응 및 염증 반응을 유도한다 (Bae et al., 2018;Lee et al., 2018). 염증 반응으로 인해 산화 스트레스(oxidative stress)가 발생되고 그 부산물로 활 성산소종(reactive oxygen species, ROS) 및 nitric oxide (NO) 생성되는데(Jin et al., 2017), 이는 체세포에도 손상 을 입힐 수 있는 것으로 보고되었다(Bogdan, 2015). 산화 스트레스는 단백질, 핵산 및 세포막을 손상시킬 수 있는 초과산화물(O2-), 하이드록실 라디칼(HO), 과산화 수소 (H2O2)와 같은 활성산소종으로 인한 손상을 주어 우리 몸 의 불균형을 초래하게 된다(Storz & Imlayt, 1999). 이러한 활성 산소를 제거하거나 조절할 수 있는 천연 항산화 물질 은 비타민 C, 폴리페놀 등이 있으며, 항산화 효소로는 superoxide dismutase (SOD), catalase (CAT) 등이 효과가 있는 것으로 알려져 있다. 이와 같은 활성산소의 생성을 억제하기 위한 식품의 생리활성 물질에 관한 연구는 활발 히 진행되고 있다 (Youa & Moon, 2016).
한편 인공광을 이용한 식물공장은 외부와 차단된 시설 내에서 온·습도, 광원 및 이산화탄소 등의 환경요인을 인 공으로 제어하여 작물을 계절에 관계없이 재배할 수 있고, 농약 없이 안정적으로 작물을 생산할 수 있어 다양한 원예 작물을 대상으로 하는 연구가 진행되고 있다(Heo et al., 2010;Lee et al., 2015;Lee et al., 2016). 식물공장에서는 연중 안정적으로 작물을 생산하기 위하여 발광다이오드 (light-Emitting Diode, LED)나 형광등과 같은 새로운 기술 이 고려되고 있다(Kozai & Niu, 2020). 식물공장은 작물 생장에 필요한 광원의 종류에 따라 자연광 및 인공광 시설 로 구별되는데, 인공광을 이용한 식물공장은 시설 내의 온 도나 습도 같은 재배환경을 시간과 공간의 제약 없이 인위 적으로 제어할 수 있어 자연광을 광원으로 하는 온실과 같 은 시설에 비해 생육 예측이 용이하다(Cha et al., 2014;Lee et al., 2015). 인공광을 이용한 식물공장에서는 작물의 재배환경을 인위적으로 조절하는 것이 가능하므로, 외부 기후변화와 상관없이 단위면적당 생산량이 노지나 온실에 비해 증가하고 생장이 균일한 작물을 생산할 수 있어 부가 가치가 높은 작물 재배에 효과적인 생산시스템으로 주목받 고 있다(Lee et al., 2015).
갯방풍 또는 갯기름나물로 불리우는 방풍나물(Peucedanum japonicum)은 전남 여수 지방과 충남 보령, 태안, 경북 등 에서 노지와 하우스 재배로 생산되고 있다(Lee et al., 2015;Choi & Cho, 2018). 방풍나물은 어린잎과 줄기를 산채 또 는 나물로 식용되어, 현대인의 바쁜 일상에서 건강한 먹거 리를 찾는 사람들에게 새로운 건강기능성 작물로 부상하고 있다(Jung et al., 2014). 또한 뿌리에서 다수의 잎이 발생 하는 다년생 약용작물 중 하나로 두통, 현기증 및 전신 통 증에 대한 전통 의학으로 사용되었다(Lee et al., 2015). 방 풍나물에 관한 선행연구로는 방풍나물 추출물이 난소절제 흰쥐의 혈중 지질 변화에 미치는 영향 (Jeon & Kim, 2016), 식물공장 재배시스템에 따른 방풍나물의 생육, 비타 민 C와 아미노산 함량 및 수량에 미치는 영향(Lee et al., 2015), 방풍나물의 수확시기에 따른 부위별 향기성분 비교 분석(Jung at al., 2014) 등이 있다. 하지만 자연광을 이용 하는 노지 재배와 인공광형 식물공장 시스템에서 재배한 방풍나물에 대한 기능성 연구가 보고된 바 없는 실정이다. 따라서 본 연구에서는 인공광을 이용한 식물공장 내에서 광질이 다른 조건에서 재배한 방풍나물 추출물의 항산화 및 항염증 효과를 분석하고 비교하였다.
재료 및 방법
본 연구에서는 LED를 인공광원으로 사용하는 국립농업 과학원 농업공학부 식물공장 시스템에서 재배한 방풍나물 의 기능성을 평가하였다. 인공광원으로는 LED (SungJae, Co. Ltd., Sungnam, Korea)와 형광등을 주광원으로 하여 청색(B)+백색(W) 혼합 LED (혼합비율 1:1), 청색(B)+적색 (R)+백색(W) 혼합 LED (혼합비율 1:2:1), 형광등(FL, 24W, Phillips, Germany), 청색(B)+적색(R) LED+형광등(FL), 백 색(W) LED+형광등(FL) (혼합비율 1:1)으로 5개의 광조사 구를 설정하였다. 혼합광질 제어에 사용한 청색 및 적색 LED 최대파장은 450 nm와 660 nm였으며, 백색 LED의 경우 형광등과 유사 파장을 갖는 계열의 LED를 채택하였 다. 모든 광조사구에서 광강도는 재배 개시 2주차부터 150 μmol/m2/s로 제어하였다. 방풍나물은 실내 온도와 습도가 22±1ºC 및 60±5%로 제어된 재배시스템에서 담액식 재배 방식을 채택하고 Yamazaki 배양액을 이용하여 재배하였다. 또한 대조구로는 전라남도 여수 금오도의 방풍나물 작목반 에서 노지 재배한 방풍나물을 사용하였다.
본 연구에 사용된 시료는 건조 과정을 거친 후 분쇄 (FM909T, Hanil, Wonju, Korea)하고 10배수의 50% 발효 주정을 추가하여 상온에서 24시간 동안 2회 교반 추출하 였다. 추출이 끝난 시료는 감압농축기(Tokyo Rikakikai Co., Ltd., Tokyo, Japan)를 사용하여 농축 후, 동결건조 (IlshinBio-Base, Dongducheon, Korea)하여 분말 형태로서 본 실험에 사용하였다. 각 방풍나물 시료 증거 표본은 국 립농업과학원 농식품자원부에 보관하였다(NAS-2021- PJ1~6).
1,1-Diphenyl-2-picrylhydrazyl (DPPH) 라디칼 소거 활성 은 Brand-Williams et al. (1995)의 방법을 응용하여 측정 하였다. 각 시료와 표준품을 농도별로 plate에 분주한 후 DPPH (Sigma-Aldrich Co., St. Louis, MO, USA)을 95.5% 에탄올에 용해하여 제조한 mixture와 시료를 혼합하고 실 온의 암소에서 30분간 반응하였다. 흡광도는 microplate reader (Molecular Devices, San Jose, CA, USA)를 이용하 여 517 nm에서 측정하여, 추출물의 DPPH (%) 값과 추출 물의 D P PH 값을 50% 감소시키는 IC50 (50% Inhibitory concentration) 값으로 표현하였다.
2,2'-Azino-bis (3-ethylbenzothiazoline-6-sulfonic acid) (ABTS) 라디칼 소거 활성은 Re et al. (1999)의 방법을 응용하여 측정하였다. 7.4 mM ABTS (Sigma-Aldrich Co., St. Louis, MO, USA)와 2.6 mM potassium persulfate (Sigma-Aldrich Co., St. Louis, MO, USA)를 1:1 비율로 혼합하고 실온인 암소공간에 24시간 보관하였다. ABTS mixture는 732 nm에서 흡광도 값이 0.70±0.02이 되도록 증류수(pH 7.4)로 희석하여 사용하였다. 제조한 ABTS와 시료를 1:1 (100 μg:100 μg) 비율이 되도록하여 혼합한 후 실온에서 10분간 반응시킨 다음 microplate reader (Molecular Devices, San Jose, CA, USA)를 이용하여 760 nm에서 흡광도를 측정하여, 추출물의 ABTS (%) 값과 추 출물의 ABTS 값을 50% 감소시키는 IC50 (50% Inhibitory concentration) 값으로 표현하였다.
총 폴리페놀 함량은 Folin-Denis (1912) 방법을 응용하여 측정하였다. 방풍나물 추출물을 각 농도별로 희석한 후 시 료와 Folin-Denis’ reagent (Sigma-Aldrich Co., St. Louis, MO, USA)를 혼합하여 3분 동안 실온에 반응시켰다. 10% Na2CO3 (Samchun, Korea) 용액을 혼합하여 암실에서 2시 간 반응시키고, 725 nm에서 microplate reader (Molecular Devices, San Jose, CA, USA)를 이용하여 흡광도를 측정 하였다. 표준 물질 Galic acid (Sigma-Aldrich Co., St. Louis, MO, USA)를 사용하여 표준 검량선을 구하고 방풍나물 추 출물의 총 폴리페놀 함량을 구하였다.
방풍나물 추출물에 0.1M potassium phosphate buffer (pH 7.5) 0.6 mL을 넣고 xanthine 2 mM을 녹인 기질액 0.2 mL를 첨가하였다. 그 후 xanthine oxidase (0.2 U/mL) 0.1 mL를 가하여 37°C에서 10분 동안 반응시키고 1 N HCl 1 mL를 가하여 반응을 정지시킨 후, microplate reader (Molecular Devices, San Jose, CA, USA)를 이용하여 570 nm에서 흡광도를 측정하였다. 방풍나물 추출액에 대한 xanthine oxidase 저해 활성은 흡광도 감소율을 백분율(%) 로 나타내었다.
본 연구에 사용된 마우스 대식세포주 RAW 264.7은 한 국세포주은행(Korea Cell Line Bank, Seoul, Korea)에서 구 입하여 사용하였다. RAW 264.7 세포는 Dulbecco’s modified Eagle’s medium (DMEM, GIBCO BRL, Grand Island, NY)에 10% fetal bovine serum (FBS) 및 100 units/mL penicillin과 100 ug/mL streptomycin을 첨가한 세포 배양액을 사용하여 37°C, 5% CO2 조건에서 배양하 였다.
RAW 264.7 세포를 96 well plate에 1×105 cells/well로 분주하고 24시간 동안 배양한 후, 방풍나물 추출물을 농도 별(62.5, 125, 250 μg/mL)로 첨가하고 24시간 동안 37°C, 5% CO2 incubator에서 배양하였다. 추출물의 세포 안전성 및 독성 유무는 MTS (Promega Corporation, Fitchburg, WI, USA) 시약 10%를 첨가하고 빛을 차단하여 37°C에 2 시간 반응시킨 후, 490 nm에서 microplate reader (Molecular Devices, San Jose, CA, USA)를 이용하여 흡광도를 측정 하고, 추출물을 처리하지 않은 대조군과 비교하여 평가하 였다.
RAW 264.7 세포에서 생성되는 NO의 양은 Green et al. (1982)의 방법에 따라 측정하였다. RAW 264.7 세포를 96 well plate에 1×105 cells/well의 농도로 분주한 후 24시간 동안 37°C, 5% CO2 incubator에서 배양하였다. 24시간 후 배지를 제거하고 LPS (2 μg/mL) 농도로 처리된 배지에 방 풍나물 추출물을 농도별(62.5, 125, 250 μg/mL로 넣고 24 시간 동안 배양하였다. 새로운 96 well plate에 griess reagent 100 μL와 배양된 세포 배양 상등액 100 μL을 가하 여 상온에서 15분 동안 반응시키고 microplate reader (Molecular Devices, San Jose, CA, USA)를 이용하여 540 nm에서 흡광도를 측정하였다.
Superoxide dismutase (SOD) 활성은 superoxide dismutase colorimetric activity kit (Invitrogen Corporation, Carlsbad, CA, USA)를 이용하여 측정하였다. 대식세포에서 방풍나물 추출물의 SOD 활성도를 평가하기 위해 RAW 264.7 세포를 24 well에 1×104 cells/well로 분주하고 24시 간 배양한 후, 방풍나물 추출물을 농도별로 처리하였다. 24시간 배양한 후 상층액을 회수하여 원심분리(1,500 rmp, 10 min, 4°C)하고 SOD 활성도 측정에 사용하였다. 시료 용액 10 μL에 substrate용액 50 μL와 xanthine oxidase용액 25 μL를 가하여 실온에서 20분간 반응시킨 후 microplate reader (Molecular Devices, San Jose, CA, USA)를 이용하 여 450 nm에서 흡광도를 측정하였다. 표준물질 superoxide dismutase standard를 사용하여 표준 검량선을 구하고 정량 하였다.
Catalase (CAT) 활성은 catalase colorimetric activity kit (Invitrogen Corporation, Carlsbad, CA, USA)를 이용하여 측정하였다. 대식세포에서 방풍나물 추출물의 CAT 활성도 를 평가하기 위해 RAW 264.7 세포를 24 well에 1×104 cells/well로 분주하고 24시간 배양한 후, 방풍나물 추출물 을 농도별로 처리하였다. 24시간 배양한 후 상층액을 회수 하여 원심분리(1,500 rpm, 10min, 4°C)하고 CAT 활성도 측정에 사용하였다. 시료 용액 25 μL에 hydrogen peroxide reagent 25 μL 가하여 실온에서 30분간 반응시키고, 각각 25 μL의 substrate와 HRP (Horserasdish peroxidase concentrate + Assay buffer) 용액을 혼합하여 15분간 반응시킨 후 에 microplate reader (Molecular Devices, San Jose, CA, USA)를 이용하여 560 nm에서 흡광도를 측정하였다. 표준 물질 catalase standard를 사용하여 표준 검량선을 구하고 정량하였다.
대식세포에서 방풍나물 추출물의 항염증 효과를 평가하 기 위해 RAW 264.7 세포를 24 well에 1×104 cells/well 로 분주하고 24시간 배양한 후, LPS 2 μg/mL와 방풍나 물 추출물을 농도별로 처리하여 배양하였다. 24시간 배 양한 후 상층액을 수거하여 1,500 rpm에서 10분 동안 원 심분리하고 사이토카인 함량 분석에 사용하였다. TNF-α 와 interleukin (IL)-6의 함량은 각각의 enzyme-linked immunosorbent assay (ELISA) kits (Abcam, London, UK) 를 사용하여 다음과 같이 측정하였다. 각 항체가 부착되어 있는 96 well plate에 상층액 샘플 50 μL과 antibody cocktail 50 μL를 넣고 1시간 동안 상온에서 반응시키고, wash buffer를 사용하여 3회 세척하였다. 세척 후 TMB 용 액을 넣고 10분간 반응시켰으며 마지막으로 stop solution 을 넣어 반응을 정지하고, microplate reader (Molecular Devices, San Jose, CA, USA)를 이용하여 450 nm에서 흡 광도를 측정하였다.
결과 및 고찰
방풍나물 추출물의 D P PH 라디칼 소거 활성 측정 결과 는 Table 1에 나타내었다. 방풍나물 추출물은 모두 농도 의존적으로 활성이 증가하는 경향을 보였다. 대조군으로는 L-ascorbic acid을 사용하였으며, IC50 값이 3.96 μg/mL로 나타났다. 모든 방풍나물 중에서 IC50 값 기준으로 노지 (Outfield, 701 μg/mL) 추출물에서 가장 높은 항산화 활성 을 보였다. 인공광 시료 추출물 중 IC50 값 기준으로 BW, BRFL, FL, BRW, WFL 순으로 높은 항산화능을 나타내었 으며, BW 추출물이 850 μg/mL로 가장 높은 항산화 효과 를 보였다.
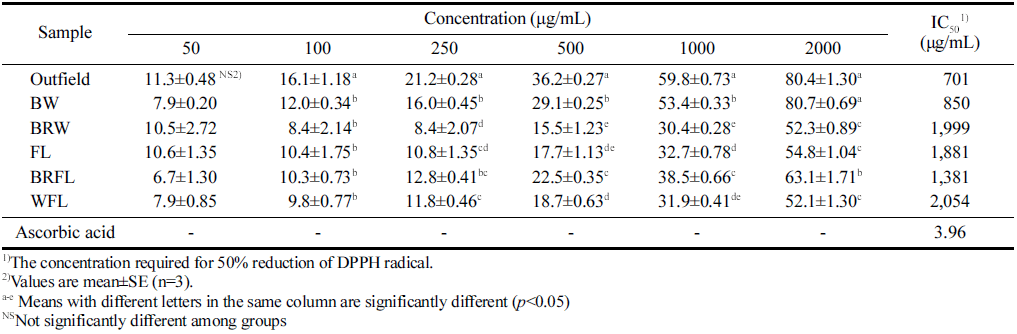
|
방풍나물 추출물의 ABTS 라디칼 소거 활성 측정 결과 는 Table 2에 나타내었다. ABTS 라디칼 소거 활성의 IC50 는 노지 추출물에서 267 μg/mL으로 가장 높은 활성을 보 였다. 인공광에서 재배된 방풍나물의 추출물은 낮은 농도 에서 비슷한 경향을 나타내었지만, 500 μg/mL 농도일 때 는 FL와 BW 시료가 노지 추출물 다음으로 높은 항산화 값을 나타내었고, 1,000 μg/mL 농도일 때는 BW 및 노지 추출물이 가장 높은 활성을 보였고 두 군 사이에 유의한 차이를 보이지 않았다(p<0.05). IC50 값 기준으로, 노지 추 출물 다음으로 FL (382 μg/mL) 및 BW (412 μg/mL) 추 출물이 높은 라디칼 소거 활성을 보였다. 결과적으로 DPPH와 ABTS에서 노지 추출물이 높은 항산화 활성을 보 였지만, 인공광 추출물 또한 고농도에서 우수한 항산화 활 성이 있는 것으로 나타났다. 선행연구(Jin et al., 2014)에서 방풍나물의 비타민 C 함량은 노지 재배시 하우스 재배보 다 더 높았는데, 비타민 C의 함량은 품종, 재배방식, 재배 장소, 생육시기, 인공광원 등에 차이가 있다고 보고되었다 (Jin et al., 2014, Lee et al., 2015;Lee et al., 2016). Lee at al. (2016)의 연구에 의하면 비타민 C의 함량이 BRW 시료가 높은 것으로 나타났다. 본 실험에서는 BRW와 BW 조건에서 재배된 방풍나물을 비교한 결과 BW 조건에서 더 높은 항산화능을 나타내었다. 광요구도와 항산화는 서 로 연관되어 있으며, 방풍나물은 노지에서 재배한 시료가 항산화능이 높았으므로 방풍나물은 노지에서 재배할 때 광 요구도가 알맞은 것으로 나타났다. 또한 인공광에서 BW 조건으로 재배한 시료가 노지에서 재배할 때의 광요구도와 제일 유사한 것으로 시사된다.
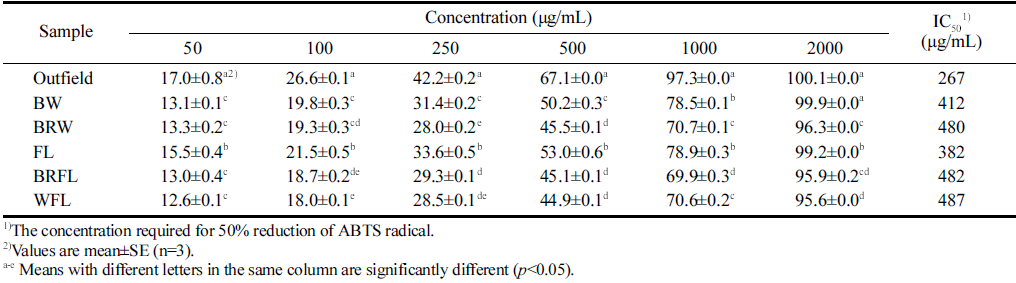
|
방풍나물에서 분석한 총 폴리페놀 함량은 Table 3에 나 타내었다. 방물나물의 총 폴리페놀은 추출물 62.5 μg/mL 기준으로 노지에서 재배한 추출물에 18.2 μg GAE/g로 가 장 많았고, 인공광 중에서는 WFL에서 재배된 방풍나물의 추출물에서 높은 함량(11.1 μg GAE/g)을 보였다. 그러나 추출물 최고 농도(2,000 μg/mL)에서도 인공광 재배 방풍 나물의 총 폴리페놀 함량은 노지 재배산에 미치지 못하였 다. Jin (2014)에 의하면 수확시기보다는 재배 조건에 의 해 영향을 받는 것으로 보고되었는데, 빛의 양과 밀접한 관계가 있으며 빛의 양이 증가되면 총 폴리페놀 함량도 증 가하는 것으로 나타났다(Jang et al., 2005). 총 폴리페놀 함량은 자연산 바위솔에서 인공적으로 재배된 바위솔보다 많은 것으로 조사되었는데(Eun et al., 2006), 본 연구에서 도 노지에서 재배된 방풍나물이 인공광에서 재배된 방풍나 물보다 총 폴리페놀 함량이 많은 것으로 나타났다. 따라서 총 폴리페놀과 같은 기능성분의 증진을 위해서는 노지 조 건을 좀 더 반영한 인공광 환경이 고려되어야 할 것이다.
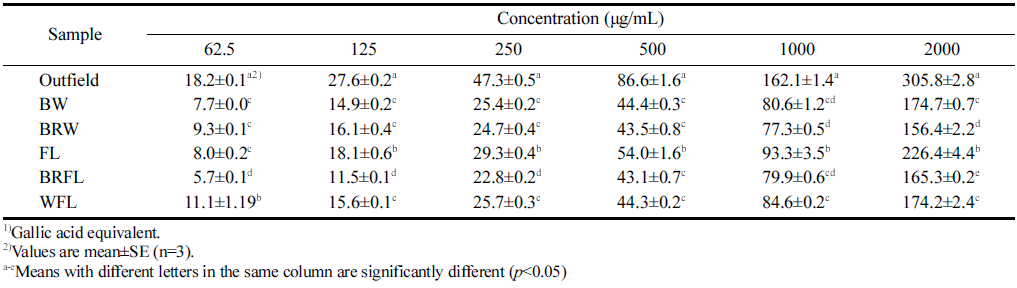
|
Xanthine oxidase (XO) 저해 활성을 조사한 결과를 Table 4에 나타내었다. 방물나물의 XO 저해활성은 방풍나물 추 출물의 농도 의존적으로 증가하는 경향을 나타내었고, 인 공광 FL 추출물의 경우 IC50 값이 0.75 μg/mL로 노지 추 출물(2.35 μg/mL)보다 우수한 효과를 보였다. 25 μg/mL 농도에서 노지 추출물과 인공광 중 FL, WFL 및 BW 조 건에서 재배된 추출물은 실험군에서 가장 많은 활성을 보 이면서 유의한 차이를 보이지 않았으나, 10 μg/mL 농도에 서는 오히려 FL과 WFL 추출물에서 노지 추출물(54.0 μg/ mL) 보다 우수한 XO 저해 활성을 나타내었다. Xanthine oxidase는 purine 대사에 관여하는 효소로 hypoxanthine을 xanthine으로 전환시키고, 산소를 전자수용체로 이용해 uric acid를 형성한다. 이 효소는 염증 및 심한 통증을 동반하는 통풍과 신장에 침착되어 신장질환을 유발하는 것으로 알려 져 있으며(Storch & Ferber, 1988), xanthine oxidase의 저 해는 활성산소의 생성을 억제하므로 항산화, 항노화 및 항암 등 생물학적으로 중요하다. 본 연구에서 XO 저해 활성에서 노지 재배와 인공광 재배 방풍나물을 비교하였을 때 IC50 값으로는 인공광에서 재배된 시료가 높은 저해 활 성을 보였다. 따라서 인공광 시설에서 재배한 방풍나물도 xanthine oxidase 저해 효과가 우수한 점을 고려할 때, 특 성 맞춤형 항산화 소재로서 활용 가능할 것이다.
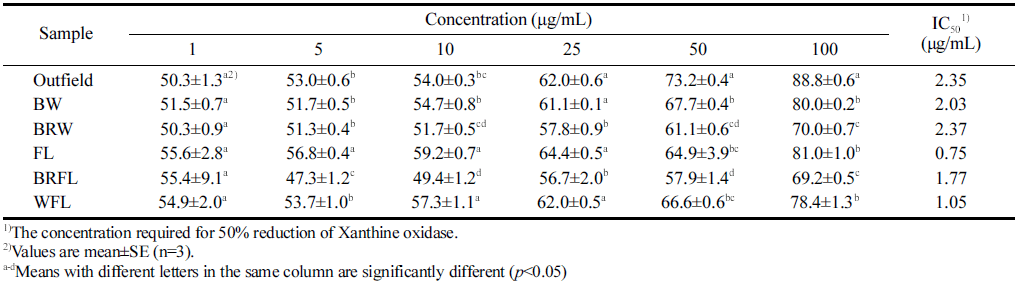
|
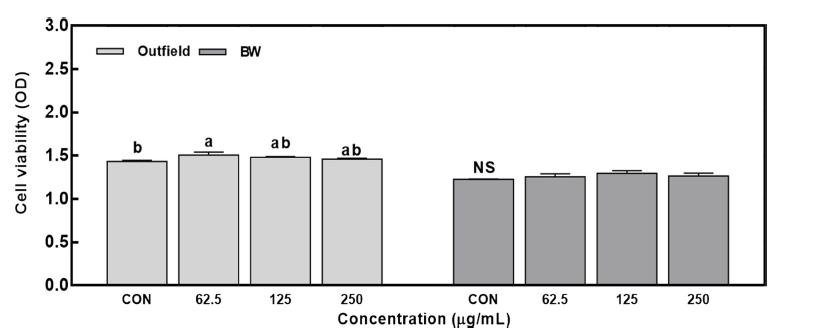
RAW 264.7 세포의 안전성에 미치는 영향을 알아보기 위하여 MTS assay를 수행하였다. 그 결과, 모든 시료가 대조군과 비교할 때, 250 μg/mL 농도범위까지 세포생존율 이 100% 이상으로 나타났으며 세포에 독성 및 안전성에 영향을 미치지 않은 것으로 확인되었다(Fig. 1). 노지 (Outfield) 추출물은 250 μg/mL 농도에서 대조군과 유의한 차이를 보이지 않았으나 62.5 μg/mL에서는 대조군보다 높 은 세포생존율을 나타내었다. BW 환경에서 재배된 방풍나 물 추출물은 방풍나물을 처리하지 않은 대조군과 비교하여 유의적으로 차이를 보이지 않았다. 따라서, 본 실험에서는 세포 안전성에 영향을 주지 않는 농도 범위를 250 μg/mL 까지로 설정하였고, 방풍나물 추출물의 기능성을 항염증 항목 중심으로 평가하였다.
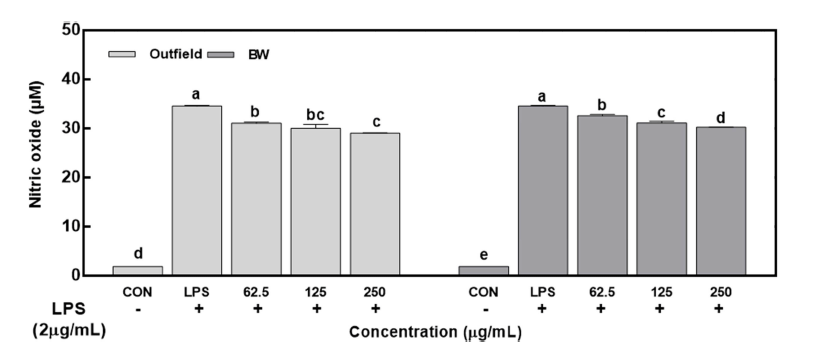
활성산소 중 하나이며 염증 유발에 중요한 역할을 하는 것으로 알려진 nitric oxide (NO) 생성에 방풍나물 추출물 이 미치는 영향을 확인하였다. 노지 및 BW 조건에서 재배 된 방풍나물 추출물은 250 μg/mL 농도에서 L P S 단독 처 리군 대비 각각 10.1%와 5.6% 수준에서 NO 생성을 억제 하였으며, 노지 추출물이 BW 추출물보다 높은 NO 생성 억제 활성이 있는 것으로 나타났다(Fig. 2).
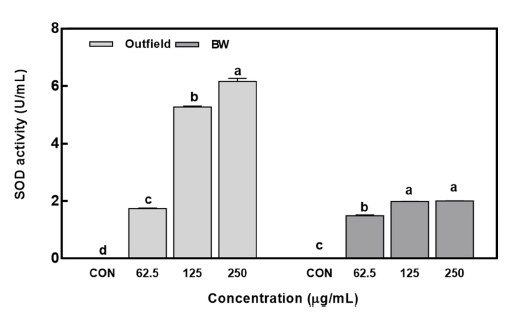
방풍나물 추추물의 SOD 활성도를 측정한 결과(Fig. 3), 노지와 BW 조건에서 재배된 방풍나물의 추출물을 처리하 지 않은 대조군에 비해 유의적인 superoxide radical 생성 억제 활성을 보였다. 노지와 BW 조건에서 재배된 방풍나 물 추출물은 62.5 μg/mL 농도에서 각 1.74 U/mL와 1.50 U/mL 값으로 대조군보다 높은 SOD 활성을 나타내었다. 또한 최고 농도(250 μg/mL)에서는 노지와 BW 추출물 각 6.16 U/mL와 2.00 U/mL 값으로 높은 활성을 나타내었다. SOD는 superoxide radical을 과산화수소와 정상 상태의 산 소로 환원시켜줌으로써 노화 억제 등의 항산화 역할을 하 는데, 상업적으로는 관절염이나 류머티즘 등과 같은 각 종 퇴행성 질병 치료를 위한 항염증제나 피부 노화방지를 위 한 화장품의 첨가제로도 이용되고 있다(Gupta et al., 1993). 노지 및 인공광 시설에서 재배된 방풍나물의 추출 물은 농도 의존적으로 SOD 활성을 보였고, 같은 농도에서 노지 재배된 방풍나물 추출물의 SOD 활성이 우수한 것으 로 나타났다. 따라서 노지에서 재배된 방풍나물(Outfield)뿐 아니라 인공광에서 재배된 방풍나물도 식품 및 체내에서 활성산소종 제거에 도움을 줄 수 있을 것이다.
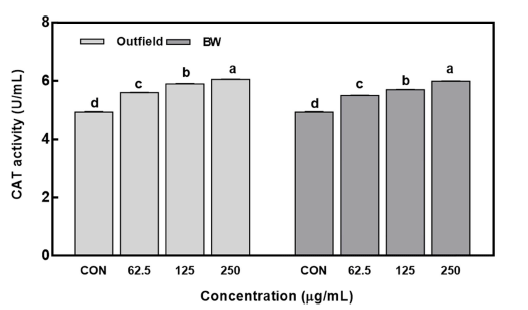
Catalase (CAT) 활성에 대한 효과는 Fig. 4에 나타내었 다. CAT는 생체내의 유해 산소들을 처리하여 세포를 보호 하는 항산화계 효소로 ascorbate peroxidase (APX)와 함께 H2O2를 분해 소거하는 대표적인 효소이다(Ryu & Kwon, 2008). 본 실험에서 노지 및 인공광으로 재배된 방풍나물 추출물은 농도 의존적으로 catalase 활성을 보였고, 노지 및 BW 추출물은 62.5 μg/mL 농도에서 각 5.6 U/mL와 5.5 U/mL 값으로 대조군보다 높은 활성을 나타내었고 최고농 도(250 μg/mL)에서는 각 6.05 U/mL와 5.99 U/mL 값으로 높은 활성을 보였다. 결과적으로 모든 농도에서 노지 추출 물이 상대적으로 높은 catalase 활성을 나타냈다. SOD는 세포 내 호흡 작용의 부산물로서 superoxide anion을 과산 화수소로 전환시키며(Fridovich, 1989), 이렇게 생성된 H2O2는 CAT와 peroxidase에 의해 물이 되고 독성을 잃어 버리게 된다(Yu et al., 2005). 따라서 인공광 재배된 방풍 나물의 catalase 활성도 우수한 것으로 나타나 앞으로 노화 의 예방 및 억제 측면에서 유용한 소재가 될 수 있을 것 이다.
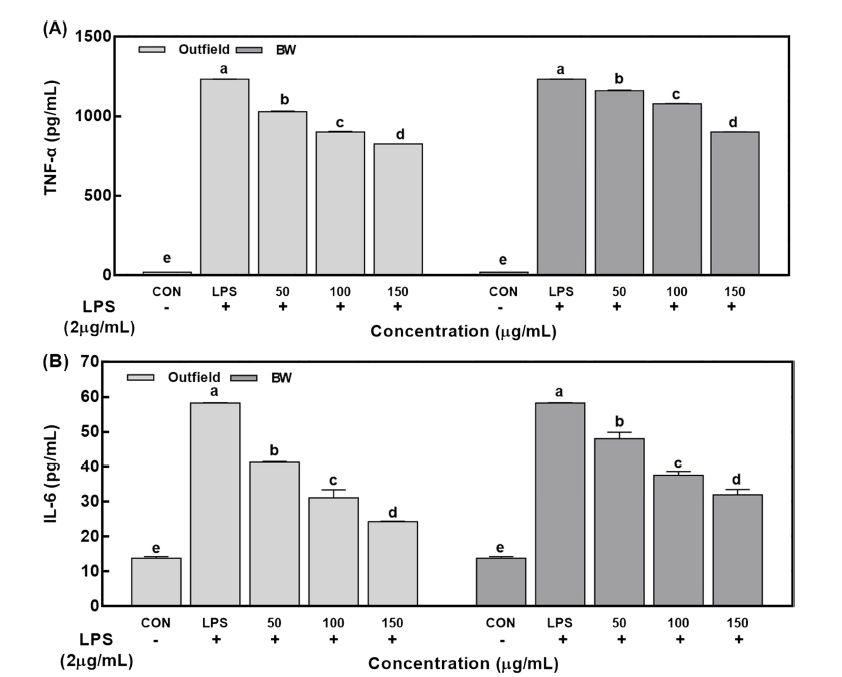
대식세포는 외부 자극에 의해 활성화되어 스스로 TNF-α 와 IL-6 등의 다양한 염증 사이토카인을 분비하고 면역계 의 다양한 세포를 활성화하며, 미생물 감염시 발현량이 증 가한다. 따라서 대식세포는 사이토카인 생성을 유도하여 미생물에 대한 숙주의 항상성을 유지하는 데 중요한 방어 역할을 한다(Agarwal et al., 1988;Noel et al., 1999). LPS 를 처리한 대조군은 유의적으로 높은 TNF-α를 생성하였 고, 방풍나물 추출물 처리에 의해서 생성 분비되는 TNF-α 함량이 유의적으로 감소하였다. 150 μg/mL 노지 추출물을 처리한 경우 음성대조군에 비해 33.0% 감소하였고, BW 추출물을 처리한 경우 26.9% 감소하였다(Fig. 5A). IL-6는 감염과 조직 손상에 따른 면역 초기 반응에서 생성되는 주 요 매개 물질로 TNF-α 등에 의해 유전자 발현이 자극되어 염증 반응을 조절한다(Tanaka et al., 2016). 또한 B세포 자극 인자로 면역글로불린의 합성을 증진하며, 다른 사이 토카인과 함께 상승작용을 나타낸다(Cha et al., 2010). 방 풍나물 추출물을 처리 시 농도 의존적으로 이들 사이토카 인의 함량을 감소시키는 경향을 보여주었고, 음성대조군에 서 증가된 IL-6 함량을 유의적으로 감소시켰다. 150 μg/ mL 노지 추추물을 처리한 경우 음성대조군에 비해 58.3% 감소하였고, BW 추출물을 처리한 경우 45.2% 감소하였다 (Fig. 5B). 이는 방풍나물 추출물이 염증 자극에 의해 분비 된 TNF-α와 IL-6를 억제시키고 이들 사이카인들의 상호작 용으로 T세포와 B세포를 자극하여 체내 염증 조절에 도움 을 주는 것으로 보인다.
요 약
본 연구에서는 인공광 시설에서 광원을 달리하여 생산된 방풍나물의 항산화 및 항염 효과를 평가하였고 노지 재배 된 방풍나물과 그 생리활성을 비교하였다. DPPH 및 ABTS 라디칼 소거 활성 및 총 폴리페놀은 노지에서 재배 된 방풍나물이 인공광 시설에서 재배된 방풍나물보다 높은 항산화 활성을 나타내었고, 인공광에서 재배된 방풍나물 중 에서는 BW 광원으로 재배된 방풍나물이 농도 의존적으로 높은 항산화 효과를 보였다. XO 저해 활성은 BW 재배된 방풍나물이 노지 재배 방풍나물보다 우수한 효과를 나타내 었다. SOD와 CAT 결과는 BW 및 노지 재배된 방풍나물 모두 무처리 대조군에 비해 농도 의존적인 활성을 보였다. BW 및 노지 재배된 방풍나물은 방풍나물을 처리하지 않 은 무처리 대조군에 비해 TNF-α 와 IL-6 사이토카인을 농 도 의존적으로 유의하게 감소시켰다. 따라서 인공광 재배 된 방풍나물은 대체적으로 노지보다 낮을 수 있지만 항산 화 및 항염 효과를 보였고. 앞으로 인공광에서 재배된 작 물의 다양한 기능성 소재로서의 연구에 도움이 될 것으로 기대된다.