서 론
비만(Obesity)은 체내 지방이 정상 범위보다 과도하게 축 적된 상태로 체질량지수(body mass index, kg/m2)가 25 이 상인 상태를 의미하고, 이 가운데 허리둘레가 남자 90 cm, 여자 85 cm 이상인 경우 복부비만(abdominal obesity)으로 진단한다. 2018년 기준, 국내 20세 이상 성인인구 중 35.7%가 비만이며, 23.8%가 복부비만으로 나타나 비만의 발병 위험이 지속적으로 증가하는 것으로 조사되었다 (Korean Society for the study of obesity, 2019). 이러한 비만 인구의 증가는 각종 질병을 유발해 개인과 가족의 삶의 질을 떨어뜨릴 뿐만 아니라, 치료비, 간병비, 미래소 득 손실, 생산성 저하 등 각종 사회경제적 비용을 11조 이상 발생시키고 있다(National Health Insurance Service, 2018). 현재 널리 사용되고 있는 비만 치료제는 펜터민 (phentermine), 로카세린(lorcaserin), 올리스타트(orlistat) 등 이 대표적인데, 상당한 효능에도 불구하고 두통, 불면증, 복 부팽만, 설사 등 다양한 부작용이 보고되고 있다. 이러한 약품의 부작용 최소화와 예방학적 비만 치료를 위한 식품업 계의 천연기능성소재 발굴 및 상용화 연구가 활발한 실정이 다. 실제 건강기능식품 국내 시장 규모 동향 분석 결과, 체 지방감소 원료가 개별인정형 원료 가운데 생산액 1위(30%) 로 조사되었다(Ministry of Food and Drug Safety, 2014).
최근 들어 프로바이오틱스 관련 논문, 특허 및 개별인정 사례가 꾸준히 증가하며 건강기능식품으로써의 시장성이 강화되고 있다. Pubmed에서 ‘probiotics’로 검색한 결과, 지 난 10년(2001-2021년)간 3만 건 이상, 2020년부터 현재까 지 7천 건 이상의 논문이 발표되는 등 보고 건수가 증가 하고 있는 추세이다. 프로바이오틱스의 인정된 기능성은 체지방 감소, 피부보습, 자외선에 의한 피부손상으로부터 피부건강 유지, 면역과민반응에 의한 피부상태 개선, 장면 역 조절 등으로, 프로바이오틱스 제품은 명백한 기능성식 품 소재로 자리잡았다. 건강기능식품협회에 따르면 프로바 이오틱스 판매액은 2018년 기준 5,424억원, 2019년 기준 6,444억원으로 약 18% 급성장하였다. 현재 식품의약품안전 처에 인정된 ‘체지방 감소에 도움’을 주는 프로바이오틱스 원료는 Lactobacillus gasseri BNR17과 Lactobacillus 복합 물 HY7601+KY1032 두 가지이다. Lactobacillus gasseri BNR17은 고탄수화물식이로 비만이 유도된 마우스 내 지방 산화와 지방산 생합성을 억제시켜 체지방량을 감소시켰다 (Kang et al., 2013). Lactobacillus 복합물 HY7601+KY1032 은 한국야쿠르트에서 개발 및 특허받은 원료로 고지방식이 로 비만이 유도된 마우스의 간 내 지방산화를 촉진시켜 체 지방 감소효과가 있었다(Park et al., 2013). 이처럼 유산균 원료를 통한 체지방 감소 효과는 계속적으로 보고되고 있 는 실정이며 프로바이오틱스 시장과 소비자의 관심이 증가 함에 따라 관련 연구는 더욱 활발해질 것으로 전망된다.
인간의 장 내에는 100조 이상의 장내세균이 존재하며, 이 들은 숙주와 공생하며 인체의 배변활동, 대사조절, 면역조절, 식욕조절 등에 영향을 줄 수 있다(Butel, 2014;Freedman et al., 2018). 장내세균은 유익균과 유해균으로 분류되며, 장 전체적으로 유해균이 우위인 경우 비만, 당뇨병 등 대사증 후군 발병 위험이 증가하며, 반대로 유익균이 서식하는 경 우 면역조절이 활성화되며 생체 순환에 긍정적으로 기여한 다(Kechagia et al., 2013). 유산균은 대표적인 장내 유익균 에 속하며 특히 Lactobacillus 및 Bifidobacterium 속(genus) 의 대사증후군 예방 효과가 다수 보고되었다. 예를 들어, Lactobacillus brevis SBC8803 사균체(heat-killed)인 hk- SBC8803을 랫드에게 급여한 결과, acyl-ghrelin 분비 조절 을 통해 식욕을 조절하였다(Saito et al., 2019). 또한 비만 마우스에게 Lactobacillus rhamnosus GG를 13주간 경구 투여한 결과, 지방연소를 촉진하는 아디포넥틴과 AMPK 이 활성화되고 지방축적 감소 및 인슐린 민감성이 개선되 었다(Kim et al., 2013). Lactobacillus rhamnosus Lb102와 Bifidobacterium animalis ssp. lactis Bf141를 비만이 유도 된 마우스에게 개별 급여한 결과, 두 실험군 모두에서 체 중 및 체지방이 감소하였다(Le Barz et al., 2019). 따라서 본 연구는 항비만 효과가 보고된 Lactobacillus rhamnosus Lb102 및 Bifidobacterium animalis ssp. lactis Bf141의 혼합유산균이 체지방 감소에 미치는 효과를 검증하고자 하였다.
재료 및 방법
혼합유산균은 티나바이오텍(Seoul, Korea)으로 부터 제 공받아 사용하였다. 혼합유산균은 동결건조하여 생산한 생균 Bifidobacterium animalis ssp. lactis Bf141 (50%), Lactobacillus rhamnosus Lb102 (35%)와 부형제 maltodextrin (15%)을 혼합하여 제조하였다. 혼합유산균의 일반성분은 탄수화물 34.2%, 단백질 39.1%, 총지방 3%와 기타 무기 질로 구성되어 있으며, 냉동 상태로 보관하였다. 경구투여 직전, 혼합유산균 1.0*109 cfu의 분말을 증류수 4mL에 섞어 고농도군(1.0*109 cfu)에 투여할 유산균 혼탁액을 제 조하였고, 이를 희석하여 저농도군(2.5´109 cfu)을 제조하 였다.
실험동물은 4주령 C57BL/6 수컷 마우스를 대한바이오링 크(Dae-han Bio Link, Eumseong, Korea)에서 구매하였다. 실험동물은 케이지 별로 21±2°C, 40-60% 상대습도와 12:12 낮-밤 주기의 환경에서 사육되었다. 1주간 순화기간 을 거친 후, 실험동물을 무작위로 그룹당 12마리씩 분리하 였으며, 이후 8주간 고지방식이(60% kcal from fat; Doo- Yeol Biotech, Seoul, Korea)와 함께 혼합유산균을 농도별로 매일 경구투여하였다. 실험군은 고지방식이 음성대조군, 혼 합유산균 저농도(2.5×109 cfu), 혼합유산균 고농도(10.0×109 cfu)로 설계하였다. 모든 실험은 한양대학교 실험동물운영 위원회(IACUC)에 의해 승인받았다(2021-0090A).
혼합유산균 급여에 따른 체중 및 사료 섭취량 변화를 분 석하기 위해 체중은 주당 1회, 사료 섭취량은 주당 2회 측 정하였다. 총열량섭취량은 혼합유산균 내 일반성분의 열량 을 고려하여 8주간 사료 섭취량과, 혼합유산균 섭취 열량 의 총합을 계산하였다.
이중에너지 방사선 흡수계측기(DEXA, Medikors, Seongnam- si, Gyeonggi-do, Korea)를 사용하여 체지방, 제지방, 골밀도, 체수분 등을 측정하였다. 이를 위해 6시간 공복 실시하고, Ketamine (Yuhan, Seoul, Korea, 100 mg/kg bw) 과 Xylazine (Bayer Korea, Seoul, Korea, 10 mg/kg bw)를 이용하여 전신마취한 후 체성분을 분석하였다.
혼합유산균의 혈당조절 효과를 평가하기 위해 제2형 당 뇨병의 주요지표인 공복 혈당량을 측정하였다. 혼합유산균 급여 8주차에 6시간의 공복 후 꼬리 정맥 채혈로 얻은 혈 액에서 ACCU-CHEK 혈당측정기(Roche Diabetes Care, Inc., Indianapolis, IN, USA)를 이용해 공복 혈당량을 분석 하였다.
혈청(Serum) 내 총중성지방(triglyceride)과 총콜레스테 롤(total cholesterol)을 상업용 키트(Asan Pharm, Seoul, Korea)를 이용하여 측정하였다. 중성지방 키트의 중성지 방 반응용 시약과 혈청을 반응시켜 분광광도계(BioTek, Winooski, VT, USA)로 흡광도 550 nm에서 측정하였다. 총 콜레스테롤도 위와 같은 효소적 반응 방식으로 콜레스테롤 측정용 시약을 혈청과 반응시켜 흡광도 500 nm에서 측정 하였다.
혼합유산균 급여가 실험동물 내 지방 소화 및 흡수에 미 치는 영향을 분석하기 위해 혼합유산균 경구 투여 0주와 8주에 채취한 분변에서 Folch법을 실시하여 변내 지방량을 측정하였다(Folch et al., 1957). 변 분말은 Homogenizer (IKA Works, Inc., Staufen, Germany)로 분쇄하고, 500 mg 을 chloroform: methanol (2:1, v/v) 용액 5mL에 넣고 상 온에서 30분간 반응시켰다. 이후 여과지를 이용해 얻은 여 과액에 0.74% (w/v) potassium chloride 8 mL를 혼합한 후 원심분리하였다. 극성(Polar) 상층액을 제거한 후 질소농축 기(N-EVAP, Organomation, Berlin, MA, USA)를 이용해 비극성(non-polar) 하층액의 chloroform을 휘발시키고 조지 방(crude lipid) 함량을 측정하였다.
결과 및 고찰
혼합유산균을 8주간 급여하는 동안 체중, 사료섭취량, 총 섭취열량 등 성장인자를 분석하였다(Table 1). 체중을 분석 한 결과 혼합유산균 급여에 따른 체중의 유의적인 변화는 관찰되지 않았다. 체중은 수분, 체지방, 근육, 골격 등을 합 한 몸 전체의 무게이기 때문에, 체중의 변화가 체지방의 변화로 바로 등치되지는 않는다(Flegal et al., 2009). 그럼 에도 체중의 감소는 질병 및 전문운동선수를 제외한 일반 적인 경우 체지방 감소에 대한 필요조건으로 인식되고 있 다(Gallagher et al., 2000). 본 연구에서 사용한 것과 동일 한 Lb102와 Bf141을 고지방-고과당식이로(65% kcal from fat, 17.9% kcal from carbohydrate)비만을 유도한 마우스에 게 8주간 개별 급여한 결과, 유산균 처리군 모두에서 체중 과 증체량이 유의적으로 감소하였으며,이는 에너지 소모량 (energy expenditure)증가에 의한 현상으로 고찰되었다(Le Barz et al., 2019). 사료섭취량은 식욕(appetite) 조절과 관 련하여 중요한 지표로 활용될 수 있는데(Ellacott et al., 2010), 본 연구에서는 실험 기간 동안 혼합유산균 급여에 의해 영향받지 않았다. 이러한 결과는 Lb102와 Bf141을 개별 급여한 선행 연구에서도 동일하게 보고된 바 있다 (Le Barz et al., 2019). 실험기간 총섭취열량을 합산한 결 과, 혼합유산균의 농도에 따라 총섭취열량이 증가한 경향 을 보였다. 특히, 혼합유산균 고농도 그룹의 경우 총섭취 열량이 12% 증가하였는데(p<0.01), 이는 혼합유산균 분말 에 포함된 유당(lactose) 등 당류의 열량이 추가되면서 발 생한 것으로 판단된다. 비만 환자의 경우 비알코올성지방간 (non-alcoholic fatty liver disease), 고지질혈증(dyslipidemia) 등 간 내 지질항상성(lipid homeostasis) 교란이 빈번히 발생함(McCullough, 2004;Diehl & Day, 2017)에 따라 간 조직의 무게를 측정하였다. 그 결과 혼합유산균 급여군 에 따른 간 조직의 무게 변화는 관찰되지 않았다(p=0.50). 종합하면, 성장 분석의 주요지표인 체중, 사료섭취량, 간 무게는 혼합유산균 급여에 영향받지 않았으나, 총섭취열 량은 혼합유산균 내 유당 유입에 따라 증가함을 확인하 였다.
구체적인 체성분의 변화를 분석하기 위하여 체성분 분석 기 DEXA를 이용해 체지방(fat in tissue, %), 제지방(lean mass, g), 골밀도(bone mineral density, g/cm2)를 측정하였 다. 체성분 분석 결과, 혼합유산균 급여에 따른 체지방 감 소는 관찰되지 않았다(Fig. 1A). 이러한 결과와 달리 일부 선행연구에서는 Lactobacillus 및 Bifidobacterium 속(genus) 의 체지방 감소 효과가 다수 보고된 바 있다. 예를 들어, 고지방식이로 비만을 유도한 마우스에게 Bifidobacterium longum PI10을 급여했을 때와, Bifidobacterium animalis subsp. lactis LA804와 Lactobacillus gasseri LA806을 혼 합 급여했을 때 모두 유의하게 부고환 지방(epididymal fat)이 감소했다(Alard et al., 2021). 또한, 비만 여성에게 Lactobacillus rhamnosus CGMCC1.3724를 급여한 결과 위 약군 대비 유의적인 체지방 감소 효과를 보였다(Sanchez et al., 2014). 그리고 고지방-고과당 식이로 비만을 유도한 마우스에게 8주간 Bifidobacterium animalis subsp.을 급여 한 결과 체지방이 감소하였다(Huo et al., 2020). 하지만, 본 연구에서 사용한 혼합유산균(Bf141 + Lb102)를 이용한 항비만 연구는 없었으며, 본 연구 결과 고지방식이유도 비 만 마우스에서 혼합유산균(Bf141 + Lb102)의한 체지방 감 소는 없는 것으로 나타났다. 동일한 프로바이오틱스를 개 별 급여했던 선행연구에서는 비만유도를 위해 고지방-고과 당식이(65% kcal from fat, 17.9% kcal from sucrose)를 이 용했다는 점에서, 고지방(60% kcal from fat)를 이용한 본 연구와 차이점이 있었다. 특히 고과당이 간 내 지방합성 (hepatic de novo lipogenesis)을 강력하게 유도한다는 점에 서, Bf141과 Lb102는 간의 지질합성을 억제함으로써 체지 방 감소 효과를 보인 것으로 유추됩니다. 추후 비알코올성 지방간(non-alcoholic fatty liver disease) 모델을 이용하여 혼합유산균의 효과를 검증한다면 보다 정확한 기전 구명이 가능할 것으로 판단된다.
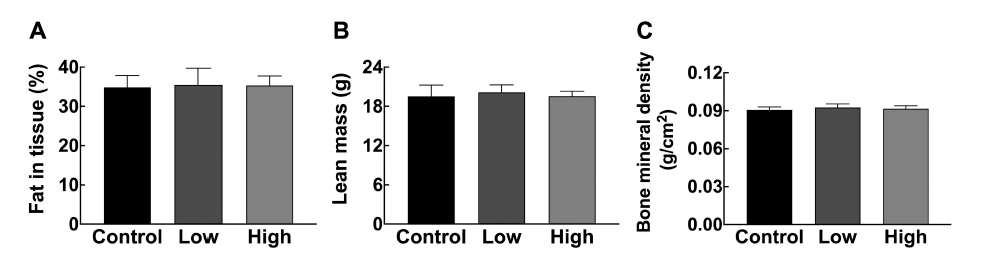
제지방와 골밀도 측정 결과에서도 혼합유산균 투여에 따 른 유의미한 차이는 관찰되지 않았다(Fig. 1B, 1C). 이와 유사하게 평균 BMI 33.5 kg/m2의 비만 대상자 20명을 모 집하여 3개월간 유산균 4종(Lactobacillus acidophilus, Bifidobacterium lactis, Bifidobacterium longum, and Bifidobacterium bifidum)을 급여한 결과, 제지방과 골밀도에서 유 의미한 차이가 나타나지 않았다(Sergeev et al., 2020). 또한, 고지방식이로 비만을 유도한 마우스에게 Bifidobacterium animalis ssp. lactis 420을 6주간 급여한 연구에서도 제지 방량에는 유의미한 변화가 관찰되지 않았다(Stenman et al., 2014). 결론적으로, 혼합유산균(Bf141 + Lb102)은 고지 방식이유도 비만 마우스의 제지방 및 골밀도에 영향을 미 치지 않았다.
공복 혈당량은 공복 시 진행되는 간 내 포도당신생합성 (gluconeogenesis)에 의해 결정되는 지표로써, 비만과 제2형 당뇨병의 공통인자인 인슐린저항성(insulin resistance)의 지표로 활용된다(Hatting et al., 2018). 6시간 공복 후 혈당 량을 측정한 결과, 대조군과 실험군 사이에 유의적인 차이 를 나타내지 않았다(Fig. 2A). 이러한 관찰과 달리, 유산균 이 제2형 당뇨병에 미치는 효과를 분석한 메타연구(metaanalysis) 에서는 유산균 급여 시 공복 혈당량이 11.27m g/dL 감소하는 것으로 나타났다(Hu et al., 2017). 또한, streptozotocin으로 당뇨가 유발된 랫에 Lactobacillus rhamnosus BSL과 Lactobacillus rhamnosus R23을 30일간 경구투여 해 준 결과, 포도당신생합성에 관여하는 glucose-6-phosphatase 의 발현이 낮아지고, 공복 혈당량이 개선되었다(Farida et al., 2020). 그리고 임신성 당뇨병(Gestational diabetes)을 가 진 여성에게 Bifidobacterium와 Lactobacillus를 급여한 연 구 결과, 공복 혈당량이 감소하였다(Kijmanawat et al., 2019). 이처럼 일부 선행연구에서는 유산균 급여에 의한 공 복기 혈당 효과가 보고되었지만, 본 실험에 사용된 것과 같 은 혼합유산균은 활용된 적이 없었다. 본 연구 결과, 고지 방식이유도 비만 마우스에서 혼합유산균(Bf141 + Lb102)에 의한 공복 혈당 개선은 관찰되지 않았다.
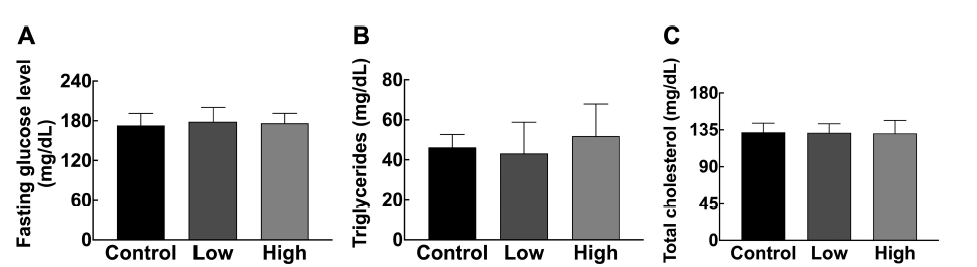
심혈관질환 및 대사질환과 연관성이 높은 이상지질혈증 의 주요 지표로 중성지질과 콜레스테롤 수치가 알려져 있 다. 혈중 중성지질과 총콜레스테롤을 측정한 결과, 음성 대조군과 혼합유산균 급여군 사이에 유의미한 차이는 나 타나지 않았다(Fig. 2B, 2C). 이와 동일하게, 고지방-고과당 식으로 비만을 유도한 마우스에게 Bf141와 Lb102을 개별 급여한 결과, 혈중 중성지질과 총콜레스테롤 모두 차이가 나타나지 않았다(Le Barz et al., 2019). 고지방식이로 비 만을 유도한 마우스에게 유산균 Bifidobacterium animalis subsp. lactis A6을 급여한 연구에서도 혈중 중성지방과 총콜레스테롤 수치는 변화하지 않았다(Huo et al., 2020). 반면, Lactobacillus plantarum K50를 고지방식이유도 비 만 마우스에게 급여한 결과, 혈중 중성지방과 HDL 콜레 스테롤 수치가 모두 개선되었다(Joung et al., 2021). 또한, 고지방식이로 비만을 유도한 마우스에게 Lactobacillus rhamnosus LRa05를 급여한 연구에서도, 혈중 중성지방 및 총콜레스테롤 수치가 유의적으로 개선되었다(Sun et al., 2020). 하지만, 본 연구에서 사용된 혼합유산균을 사 용한 선행 연구는 없었으며, 본 연구 결과 혼합유산균 (Bf141 + Lb102)에 의한 혈당 및 혈중 지질 지표 개선은 나타나지 않았다.
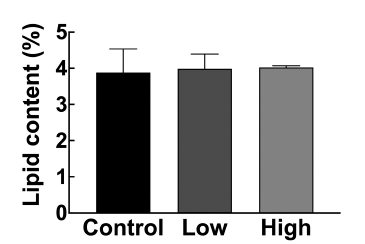
분변 내 지질 함량은 소화기관 내 지방의 소화 및 흡수 정도를 시사하며, 이는 장내균총에 의해 영향을 받는다. 지 질이 소장으로 흡수되지 않고 분변으로 배출되면 체내에 지질 흡수를 억제해 항비만 효과를 볼 수 있으며, 담즙산 의 배설을 촉진해 혈중 콜레스테롤 수치를 개선할 수 있다 (de la Cuesta-Zuluaga et al., 2018). 고지방식이유도 비만 마우스에서 혼합유산균의 투여가 체내 지방 소화 및 흡수 율에 미치는 영향을 분석하기 위해 8주차 분변을 수집하여 지방함량을 측정하였다(Fig. 3). 분석 결과, 대조군과 혼합 유산균 투여군 사이에 분변 내 지질 함량의 차이는 관찰되 지 않았다(Fig. 3). 일부 선행연구에 따르면, 고지방식이로 비만을 유도한 마우스에게 유산균 Lactobacillus plantarum K50을 급여한 실험군에서 대조군에 비해 분변 내 단쇄지 방산(short-chain fatty acid)의 함량이 높게 나왔으며, 이는 활성화된 장내세균총의 건전성을 반영한다(Joung et al., 2021). 또한 유전적으로 당뇨가 유도된 KK-A(y) 마우스에 게 유산균 Lactobacillus gasseri NT를 급여한 결과, 분변 내 중성지방 함량이 대조군 대비 유의적으로 높게 나타났 다(Yonejima et al., 2013). 하지만, 본 연구에서 사용한 혼 합유산균을 이용한 선행연구는 없었으며, 본 연구에서 최 초로 분석한 결과 혼합유산균(Bf141 + Lb102) 급여에 의 한 분변 내 지질 함량 변화는 관찰되지 않았다.
요 약
이상의 결과를 종합하면, 혼합유산균 2종(Bifidobacterium animalis ssp. Lactis Bf141와 Lactobacillus rhamnosus Lb102)의 섭취는 고지방식이 유도 비만 마우스에서 체중, 체지방, 제지방, 골밀도 등 주요 체성분에 영향을 주지 않 았다. 혼합유산균은 식욕 조절 효과를 위해 측정한 사료 섭취량에도 영향을 주지 않았으며, 간 조직 무게에도 영 향을 미치지 않았다. 인슐린저항성과 포도당신생합성의 주 요 지표인 공복혈당량 또한 혼합유산균 급여에 의해 변화 하지 않았다. 또한 혼합유산균은 심혈관질환의 지표로 사 용되는 혈중 중성지방 및 총 콜레스테롤에 영향을 주지 않았으며, 체내 지방의 소화 및 흡수율에서도 영향을 미 치지 않았다. 결론적으로, 고지방식이유도 비만 마우스를 이용하여 혼합유산균(Bf141 + Lb102)의 항비만 생리활성 을 검증한 결과, 유의미한 물리적, 대사적 표현형 개선은 검증되지 않았다. 따라서, 추후 개별 보다 다양한 혼합 조 건 및 농도로 연구를 설계하여 혼합유산균의 항비만 효과 를 검증할 필요성이 있다.
