서 론
커피는 세계에서 가장 많이 소비되는 비알코올성 음료 중 하나이다. 커피나무는 전 세계적으로 꼭두서니과 (Rubiaceae) 내의 3종이 대부분을 차지한다. 경제적으로 중 요한 것으로는 아라비카종(Coffea arabica)과 로부스타종 (Coffea robusta) 순서이고 리베리카종(Coffea liberica)은 그 중요도가 낮다. 아라비카 원두가 로부스타 원두에 비해 풍 미가 좋으므로 더 값어치가 있다. 커피나무는 브라질, 인도, 베트남, 케냐 등 동남아시아, 아프리카, 중남미 지역의 여 러 나라에서 재배되고 있다.
식물의 씨앗은 발아하는 동안 생화학적인 반응이 일어나 화학 성분들이 변화된다. 콩, 보리, 그리고 쌀 등의 발아산 물들이 콩나물이나 식혜음료, 그리고 감마-아미노뷰티르산 (GABA)을 함유한 발아미 밥 등의 다른 제품으로 많이 소 비되고 있다. 커피 생두도 발아를 하게 되면 영양성분의 변화가 일어나는데 카페인의 함량은 소폭 증가하지만 발아 기간에 따라 클로로겐산과 GABA 등의 함량이 1.7배까지 증가하여 기능성이 향상된다고 알려져 있다(Kim et al., 2018). 커피 발효의 1차적인 목적은 커피콩 생산과정에서 커피씨앗 주변 점액질의 편리한 제거에 있다(Lee et al., 2015). 자연적인 습식발효과정에는 젖산세균이 10,000 – 1,000,000 cfu/mL정도가 함유되어 있는 등(Evangelista et al., 2015;Elhalis et al., 2020) 각종 세균과 곰팡이(Silva et al., 2008), 효모가 관여하며 이 과정에서 커피 품질이 좋아지거나 나빠질 수 있다. 그렇지만 곰팡이나 효모를 이 용한 커피의 발효가 지속해서 시도되고 있으며(Kwak et al., 2018) 발효에 의한 커피 아로마의 증진을 위한 미생물 의 선발 및 발효 기술도 요구되고 있다(Lee et al., 2015).
동남아시아 지역은 사향고양이(Paradoxurus hermaphroditus) 가 서식하고 있으며 이들이 커피 열매를 섭취한 후 장내에서 소화 및 발효를 거쳐 배출한 커피 콩으로 만든 커피가 고가로 소비 되고 있다. 대표적인 것이 루악으로 알려진 Kopi Luwak이다(Marcone, 2004). 커피 열매가 장 내를 통과하는 동안 커피의 과육부분은 소화되어 이용되 고 씨앗부분은 대장을 거쳐 외부로 배출되게 되는 데 이 때 각종 미생물의 작용을 받게 되는 것이다. 고양이의 장내 에는 Gluconobacter 미생물이 우점종이며(Watanabe et al., 2020), Lactobacillus나 비피도박테리움(Bifidobacterium) 등 의 젖산균도 각각 소장과 대장에서 생육한다(Muzaifa et al., 2019). 그러나 이 사향고양이의 장관계를 이용한 발 효커피의 생산은 동물복지상의 문제점으로 지적되고도 있다(Lachenmeier & Schwarz, 2021). 한편, 커피콩의 arabinogalactan이 비피도박테리움을 선택적으로 생육시키 는 프리바이오틱스 작용이 있다는 보고도 있다(Hori et al., 2007).
따라서 본 연구에서는 기능성이 향상된 발아커피를 대상 으로 하여 인체에 유익한 프로바이오틱스인 비피도박테리 움(Bifidobacterium spp.)을 배양하여 독특한 발효 커피를 제조하고 이 과정에 있어서 카페인, 클로로겐산 및 항산화 활성 등 주요 기능성의 변화에 대하여 알아보고자 하였다.
재료 및 방법
사용된 균주는 Bifidobacterium animalis (B. animalis) DY-64 KCCM 10583, Bifidobacterium bifidum (B. bifidum) KCCM 12096 Bifidobacterium breve (B. breve) BV-B KCCM 43018로서 한국미생물보존센터(KFCC, Seoul, Korea)에서 구입하였다. HPLC 등급 메탄올 및 아세토니트 릴은 J. T. Baker (Phillipsburg, NJ, USA)에서 구입했다. 트리에틸아민(Hayashi Pure Chemical Industries, Ltd., Osaka, Japan) 및 주사기 필터(0.45 μm, Whatman, Clifton, NJ, USA)를 구입하였고, HPLC 등급 에탄올 및 물은 Merck (Darmstadt, Germany)회사의 제품이었다. 클로로 겐산, 카페인 및 Carrez 시약은 Sigma-Aldrich (St. Louis, MO, USA)에서 구입했다. 그 외 모든 시약은 기본적으로 HPLC용 또는 시약 특급을 사용하였다.
아라비카(Coffea arabica) 종의 커피 씨앗을 라오스(Club Green Coffee Co., Bolaven, Laos)에서 구입하였으며, 수작 업으로 껍질(parchment)을 제거한 후 발아에 사용하였다. 이 콩을 Kim et al. (2018)의 방법에 따라 1% 차아염소산 나트륨 용액을 이용하여 2분간 살균한 후 80% 상대습도의 조건으로 30°C에서 멸균수에 14시간 침지후 멸균수 적신 거즈 위에서 10일간 발아를 진행하였다. 그동안 하루 2회 멸균수를 교체하였다.
발효를 위한 스타터 비피도박테리움은 de Man, Rogosa & Sharpe (MRS) 액체배지(0.05% 시스테인 아미노산 함유) 에 배양하였다. 발효를 수행할 때 발아 종료 커피 콩시료 를 여과 멸균된 물과 동량으로 혼합한후 시료 무게의 5% 에 해당하는 Bifidobacterium 스타터 미생물을 접종하였다. 이 때 시스테인 아미노산 0.05%, 설탕과 식용의 효모추출 물을 1%씩 첨가하였다. 발효는 혐기성 용기에서 37°C, 4 일간 실시하였다. 이것을 60°C에서 18시간동안 풍건한 후 -20°C에 보관하였다.
로스팅은 로스터(Soo i-coffee N-905CR, icoffee, Seoul, Korea)를 이용하였으며, 건조된 커피 생두 50 g을 넣고 230°C에서 30분간 볶음으로써 진한 로스팅(dark roasting) 중 가운데 단계인 French 등급이 되게 하였다. 이것을 수 동식 분쇄기(kalita KH-3, coffee mill, Yokohama, Japan)로 분쇄하였다.
카페인과 클로로겐산의 함량은 Kim et al. (2018)의 방 법에 따라 carrez 청징키트를 사용한 후 LiChrospher 100 RP-18 칼럼과 diode array detection (DAD)를 장착한 HPLC (LC-20AD, Shimadzu, Kyoto, Japan)를 이용하여 정량하였 다. 전체 클로로겐산의 함량은 세 종류 주요 이성질체 화 합물들의 합으로 산출하였다(Kim et al., 2018).
Kim et al. (2018)의 방법대로 분석하였다. 즉, 커피콩을 분쇄한 후 속슬렛 방법으로 지방질을 제거한 후 이것을 아세톤/메탄올/물 용액으로 추출, 여과, 농축하였다. 이것 을 메탄올 수용액에 재용해하여 성분분석에 사용하였다. 커피생두나 원두의 항산화 활성도는 2,2-diphenyl-2-pycryl hydrazyl (DPPH) 라디칼 분석(Sharma and Bhat, 2009)과 ABTS•+ 분석(Sánchez-González et al., 2005)으로 측정하 였다(Kim et al., 2018).
결과 및 고찰
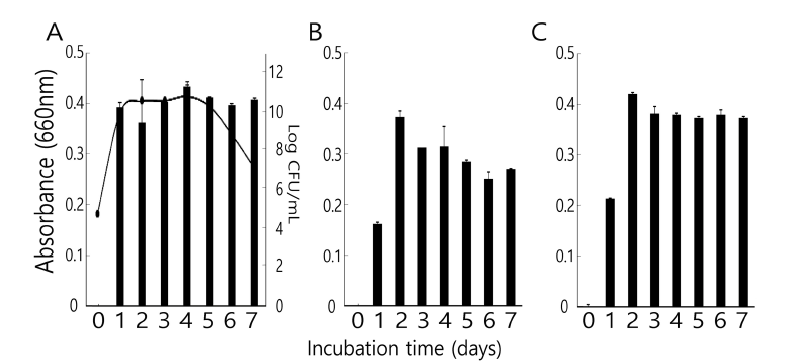
발효용 스타터 미생물인 Bifidobacterium spp. 3종(B. animalis, B. bifidum, B. breve)을 시스테인이 첨가된 MRS 배지에 배양하였다. 모든 미생물이 잘 생육하였지만(Fig. 1) 그 중에서도 B. animalis가 가장 빠르게 생육하였다. B. breve와 B. bifidum이 그 뒤를 이었다. 37°C에서 배양한 결 과 B. animalis의 경우 배양 1일이면 정상기에 도달하였으 며 생균수에 있어서도 최고치에 접어들었다. 그러나 다른 두개의 균주는 발효 2일째의 흡광도가 가장 높아 이 때가 생균수도 가장 많은 것으로 판단하였다. B. animalis의 경 우 발효 5일 이후에는 생균수가 점점 감소하고 있어 스타 터로는 기대할 수가 없었다. 따라서 위 3종의 비피도박테 리움 스타터 미생물은 배양 2일후의 것이 이후 발효 커피 의 생산에 사용되었다.
37°C에서 2일간 배양된 위 스타터 배양액을 멸균된 발아 커피 생두의 5% (w/w)가 되도록 하여 접종하였다. 접종 당시 혼합액의 pH는 모두 5.5정도였다. 발효를 진행하는 미생물의 상태를 확인하고자 발효미생물액의 pH를 측정한 결과 B. breve가 접종 1일 후에 급격한 감소를 나타내 커 피콩이 존재할 때도 잘 생육하고 있음을 보여주었다(Fig. 2). 그러나 B. animalis와 B. bifidum은 발효 3일 후부터 pH 감소가 진행되는 경향이었다. 발효액의 산도는 B. animalis의 경우 발효 5일 후 pH 4.5 이하가 되었으며 B. bifidum과 B. breve는 발효 5일 후까지도 pH 4.5 이하로 내려가지 않았다. 이 혼합물에 식용의 1% 설탕과 1% 효 모추출물을 추가하였을 때는 배양 1일 후부터 pH가 대폭 감소하였다. 특히 pH 4.5 이하에 이를 때는 B. animalis가 발효 3일 후였으며, B. bifidum은 발효 5일, B. breve는 발 효 4일이었다. 따라서 설탕과 효모추출물이 발아커피 생두 발효에 의한 산생성 기간을 2일 이상 단축할 수 있었다.
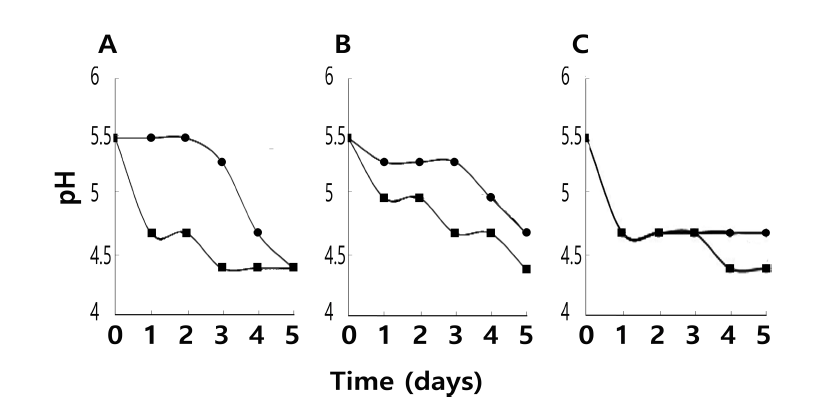
Fig. 3는 발효 발아커피 제조 단계별 커피 생두 사진이 다. Fig. 3(A)는 껍질이 제거 되었지만 여전히 은피(silver skin)에 둘러싸인 커피 생두의 모습이고 30°C 온도에서 10 일 동안 발아를 마친 커피 생두(Fig. 3B)를 습열멸균한 후 B. animalis로 4일간 발효시킨 것은 Fig. 3(C)에 나타냈다. 비피도박테리아에 의한 발효를 마친 커피 생두는 연초록에 서 황갈색으로 변색하였으나 그 형태는 변하지 않았다. B. bifidum이나 B. breve에 의한 발효 발아커피 생두도 육안으 로는 유사한 모습이었다. 건조된 커피콩 중의 수분 함량은 B. animalis, B. bifidum, 그리고 B. breve에 의한 발효발아 커피가 각각 2.12% (w/w), 1.98%, 그리고 1.75%를 나타냈 다. 이 때 커피원두와 autoclave처리만을 거친 커피원두는 각각 0.62%와 0.73%의 수분함량을 보였다.

커피 중의 주요 기능 성분과 항산화 활성의 변화를 발효 와 로스팅 과정을 거치는 동안 발효미생물의 종류에 따라 알아보았다(Fig. 4). 커피 중의 가장 잘 알려진 기능성분인 카페인은 커피 생두에는 1.18%(w/w)기 함유되어 있었다. 아라비카 커피 종에는 보통 0.84-1.4%(w/w) 함유된 것으로 알려져 있다(Yisak et al., 2018;Gichimu et al., 2014). 이 카페인은 발아에 의하여 약 22%가 증가되었는데 스타터를 사용한 발효를 위하여 이것을 121°C, 15분간 습열멸균 처 리하면 커피 원두중의 카페인에 비하여 약 35%가 증가하 였다. 그리고 이 함량은 발효 후에는 B. bifidum 발효에서 약간 감소할 뿐 큰 변화가 없었다. 따라서 비피도박테리움 을 이용한 발아커피의 발효과정은 카페인을 파괴하지 않고 오히려 소량 증가 시켜주는 것을 알 수 있다.
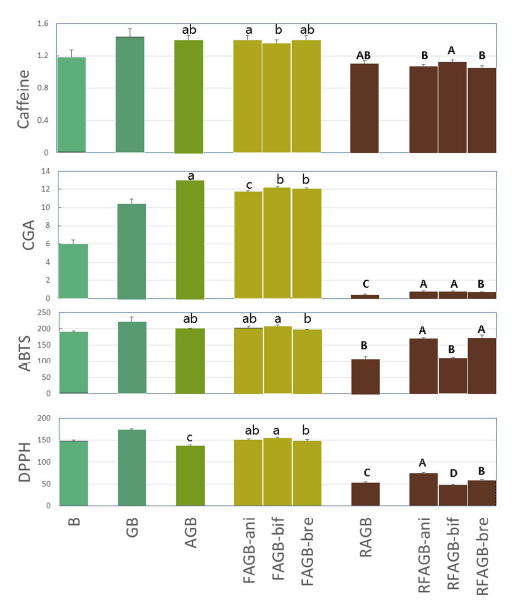
발효가 발아커피 생두의 로스팅에 미치는 영향을 알아보 기 위해서 발효 발아커피를 230°C에서 30분간 로스팅 하 였다. 이 온도가 진한 색깔의 커피를 만드는 상대적으로 강한 열처리임에도 습열멸균 처리한 발아커피와 비교할 때 약 30%가 줄어들 뿐 결과적으로는 원래 커피 생두중의 함 량과 유사한 수준이 되었다. 문헌에 의하면 커피 생두를 200°C에서 8분간 로스팅한 커피 원두의 경우 커피 생두 중 1.19%이던 카페인함량이 1.16%가 되어 거의 변화가 없다고도 하며(Sualeh et al., 2020), 색깔이 연한 커피용 원두(230°C, 12분)인 경우 오히려 1.4%이던 카페인의 함량 이 1.7%로 증가했다는 보고도 있다. 동시에 진하게 로스팅 한 원두의 경우에는 카페인 함량이 약 1.0%로 감소함을 보였다(de Souza et al., 2020). Fig. 4는 발효과정을 거친 모든 커피 생두간에도 별다른 차이가 없음을 보여준다. 따 라서 커피 생두중의 카페인 함량은 발아 및 발효 과정 중 소폭 증가하고 이것을 진하게 로스팅을 할 경우 그 상승폭 만큼 다시 감소하는 것을 알 수 있었다.
식물 씨앗의 발효 과정 중 폴리페놀의 함량이 증가하거 나 관련된 항산화 활성이 발효과정에 영향을 받는다 (Carciochi et al., 2016). 클로로겐산은 커피중의 가장 중요 한 폴리페놀성 항산화제이다. 보통 2.9-5.42%(w/w, db)가 함유되어 있다고 알려져 있지만(Farah et al., 2006) 라오스 아라비카 커피 생두에 약 15%의 클로로겐산이 들어 있다 는 보고도 있다(Jeszka-Skowron et al., 2016). 본 연구의 아라비카 종의 커피 생두중에는 클로로겐산 함량이 6.02% 이던 것이 발아에 의하여 70%가 증가되었다. 이는 autoclave처리에 의하여 더욱 증가하여 원래 커피 생두의 2 배 이상이 되었다. 이는 카페인의 경우보다 훨씬 큰 증가 폭이다. 그러나 이 값은 비피도박테리아에 의한 발효과정 중 약 10%정도가 감소되었다. 따라서 발효과정을 통해서 발아커피중의 미생물이 클로로겐산함량을 증가시키는 작용 은 없는 것으로 생각된다. 그런데 이러한 발효된 발아커피 생두로부터 커피를 내리기 위하여 커피 원두를 제조하면 약 95%이상이 파괴되어 검출되지 않았다. Sualeh 등(2020) 도 아라비카 커피를 진한 로스팅을 한 경우 약 2.7%이던 클로로겐산 함량이 거의 검출되지 않음을 보여 주었다. 따 라서 비피도박테리아에 의한 발아커피의 발효는 미생물에 의한 클로로겐산함량의 증가 등의 생화학 반응이 일어나지 않으며 열처리에 대한 클로로겐산 보호 물질도 생산하지 않는다고 할 수 있다. 따라서 발아 및 발효를 거친 클로로 겐산의 기능성을 이용하기 위해서는 생두추출물의 섭취 등 커피 생두 자체를 약하게 열처리하는 과정이 필수적이라고 생각된다.
ABTS와 DPPH는 모두 자유라디칼 소거능 시험법으로 생체중의 항산화능 측정에 많이 사용된다. 그러나 사용되 는 화학물질이 다르기 때문에 두 방법을 이용한 결과가 반 드시 정확한 비례 관계에 있지 않으므로 손쉬운 DPPH방 법과 함께 ABTS법을 사용하여 상호 보완할 수 있다. Fig. 4는 두 방법이 전체적으로 유사한 결과를 가짐을 보여준 다. ABTS 값은 커피 생두가 192 μmole Vit CE/g-db이었 는데 발아과정에서 약간 증가하였으나 발효에 의하여 원래 수준이 되었다. 이들 항산화 활성에 대한 다크 로스팅의 영향은 ABTS는 약 50%, DPPH는 약 73%가 감소하였다. 그런데 발효 과정이 이 감소를 저해하였다. 즉, ABTS활성 의 경우에는 B. bifidum을 제외한 2종의 발효는 커피 생두 활성의 약 85%를 나타냈다. 따라서 B. animalis와 B. breve에 의한 경우에는 약 50%의 감소폭 중에서 35%를 감소 저해하므로 약 70%의 감소 저해 효과를 보였다. 이 는 발효과정에서 생성된 산물들 중 열에 의한 항산화 활성 감소를 저지하는 물질이 생성되었을 수 있다는 추론을 가 능하게 한다. DPPH활성의 경우에는 ABTS와 같은 경향이 지만 그 저해 폭이 작았다. 따라서 커피콩에 대한 항산화 활성의 측정은 DPPH보다는 ABTS방법이 더 뚜렷한 차이 를 보여주었는데 이는 여러 다른 식품들에 대해 두가지 방 법을 실험하여 내린 결론과 같은 결과이다(Floegel et al., 2011).
요 약
발아 커피 생두의 기능성을 향상할 수 있는지 알기 위하 여 인체에 유익한 비피도박테리움 3종(B. animalis, B. bifidum, B. breve)을 이용하여 발효 연구를 한 결과 다음 과 같은 내용을 알 수 있었다. 발효는 MRS배지에 설탕과 효모추출물을 첨가하여 37°C에서 4일간 실시하였다. 발효 후에도 발아커피 생두중의 카페인의 함량에 변화가 없었다 . 발효과정은 발아 커피의 클로로겐산 함량을 약간 더 높 은 상태로 유지하였으며 이 과정에서 균주별 차이는 없었 다. 진한 로스팅(230°C, 30분) 조건으로 생산한 원두의 경 우 카페인의 함량이 3 0%(w/ w) 감소하였으나 클로로겐산 함량은 95%이상 감소하였다. B. animalis와 B. breve에 의 한 발효과정은 발아커피 원두의 항산화 활성의 감소를 저 해(70%) 하였다. 종합하면, 비피도박테리아를 이용한 발효 발아커피 생두와 원두가 커피의 우수한 기능성을 여전히 갖고 있음을 알 수 있었다.