Review
박테리오신 신속 추출을 위한 Aqueous Two Phase System 고찰
김종희, 이은선, 김부민, 함준상, 오미화*
Rapid Extraction of Bacteriocins using Aqueous Two-Phase System: A Literature Review
Jong-Hui Kim, Eun-Seon Lee, Bu-Min Kim, Jun-Sang Ham, Mi-Hwa Oh*
National Institute of Animal Science, Rural Development Administration
*Corresponding author: Mi-Hwa Oh, National Institute of Animal Science, Rural Development Administration, Wanju 55365, Republic of Korea Tel: +82-63-238-7379; Fax: +82-63-238-7397 E-mail:
moh@korea.kr
© Korean Society for Food Engineering. All rights reserved.
Received: Aug 10, 2021; Revised: Aug 23, 2021; Accepted: Sep 28, 2021
Abstract
Bacteriocins are ribosomally synthesized proteinaceous substances produced by bacteria. They exhibit antimicrobial activity against closely related species and food-borne pathogens. Those produced by lactic acid bacteria (LAB) suggest a new direction for food preservation as they are often employed in food processing and food fermentations as natural biopreservatives. However, this new market demands the development of new downstream strategies to maximize its efficiency and economics. Aqueous two-phase system (ATPS) is a liquid-liquid fractionation technique, which has emerged as a powerful tool for the efficient extraction and purification of peptides, enzymes, and proteins due to its versatility, lower cost, process integration capability, and ease to scale-up. In this review, we introduce polymer-salt ATPS and surfactant-assisted ATPS for bacteriocin separation and provide an overview of the effects of parameters such as tie line length, pH, and properties of polymers and salts.
Keywords: Bacteriocin; Rapid extraction; Aqueous two-phase system (ATPS)
서 론
박테리오신은 다양한 미생물이 생산하는 천연 항균성 단 백질로 리보솜에서 합성된다(Pingitore et al., 2007). 항생 제는 광범위한 박테리아에 작용하여 살균 또는 정균작용을 통해 제어하는 반면에 박테리오신은 생산 균주 또는 밀접 하게 관련된 박테리아에 대해서만 항균작용을 하는 특징을 가지고 있다(Pingitore et al., 2007).
유산균 유래 박테리오신은 천연 생물 방부제로 식품 가 공과 발효에 자주 사용되기때문에 식품 산업에서 특히 중 요하다(de Vuyst and Leroy, 2007). 식품의 유통기한을 연 장하기 위해 사용하는 아질산염과 이산화황 같은 화학 방 부제는 인체 건강과 식품 영양가에 부정적인 영향을 미칠 수 있다(Rai et al., 2016). 반면 박테리오신은 인체에 무독 하고 잔류성이 없으며, 열과 pH에 대해 비교적 안정성이 높다는 점에서 화학 방부제의 대체 물질로서 그 효용성이 증대되고 있다(de Vuyst and Leroy, 2007). 최근 소비자들 의 건강에 대한 관심 증가로 천연 식품 또는 화학 방부제 무 첨가 식품에 대한 수요가 증가하고 있으며, 동시에 유 통기한이 긴 최소 가공 식품에 대한 요구가 증가함에 따라 박테리오신은 천연 방부제로서 식품의 안전성을 확보할 수 있는 수단으로 인식되고 있다(Boye and Arcand, 2013).
그러나 상업적 박테리오신 생산의 주요 방해 요인은 생 산비용이 높다는 것이며, 여기에는 두가지 주요 원인이 있다(Özel et al., 2018). 첫째는 미생물에서 생합성 되는 박테리오신이 매우 소량이다. 이를 해결하기 위해 지난 수십년 동안 다양한 분자생물학적 및 대사 공학적 연구가 지속되었고, 유전자 재조합, 박테리오신 구조 변경, 대사 조절을 위한 발효시스템 개발 등을 통해 박테리오신의 대 량 생산 가능성을 확인하였다(Özel et al., 2018;Gor et al., 2020). 또한, 유청이나 당밀과 같은 성장 배지를 대체하 는 원료도 생산 수율이 높아졌다(Kotelnikova and Gelfand 2002;Guerra and Pastrana, 2003;Nadar et al., 2017). 둘 째는 박테리오신 정제를 위한 하부공정(downstream)이 고 가이기 때문이다. 미생물로부터 박테리오신 생산량을 늘리 기 위한 연구가 지속되고 있음에도 불구하고 여전히 가격 이 비싼 이유가 여기에 있다. 일반적으로 박테리오신의 회 수 및 정제에는 황산암모늄이나 유기용매를 이용한 침전, 여과 또는 원심분리, 투석, 이온교환 크로마토그래피와 같 은 수많은 공정 단계가 필요하다(Przybycien et al., 2004). 이러한 다단계 정제 공정은 높은 생산비용과 시간 소모, 대량 생산의 어려움 등 많은 단점을 가지고 있다(Nadar et al., 2017). 이외에도 유기용매 기반 추출은 단백질 분자의 상당한 변성을 유발할 수 있다는 문제도 있다(Banik et al, 2003). 따라서 생물학적 활성을 잃지 않는 범위에서 최소 한의 단계로 경제적이고 효율적인 분리 및 정제 기술의 개 발이 필요하다.
다양한 산업분야에서 요구되는 박테리오신의 정제 정도 는 각 응용 분야에 따라서 다르다. 식품 산업에서 활용하 기 위해서는 박테리오신을 부분 정제하는 것만으로도 충분 할 수 있다(Jamaluddin et al., 2018). 이와 관련해서 최근 에는 간편하고 신속한 부분 정제를 위해 고분자 수용액의 액체-액체 상분리 현상을 이용한 연구가 활발하게 진행되 고 있다(Nadar et al., 2017). 주로 물을 기반으로 구성된 수성-이상계 시스템(Aqueous two-phase system; ATPS)은 외부자극에 민감한 생물학적 물질에 온화한 환경을 제공하 기 때문에 다양한 생체 분자(단백질, 효소, 항체, DNA 등) 의 분리 분야에서 주목받고 있다(Iqbal et al., 2016). 또한 이 방법은 발효 배지에서 직접 박테리오신을 추출하기 때 문에 정제 공정을 단순화 할 수 있다(Dutra-Molino et al., 2014). 이에 본 리뷰에서는 수성-이상계 시스템 기술과 유 형, 박테리오신의 정제에서 수성-이상계 시스템 방법의 적 용, 그리고 수성-이상계 시스템 분할에 영향을 미치는 요 소 및 제한점에 대하여 검토하였다.
수성-이상계 시스템(ATPS)
수성-이상계 시스템(ATPS)은 혼합되지 않는 액체-액체 분별 기술이다. 즉, 두 종류의 고분자가 물에 잘 용해되지 만 친화성이 낮아 서로 섞이지 않으면서 두 층으로 분리되 는 원리를 이용한 것이다(Albertsson, 1971). 이 방법은 반 드시 고분자들만 이용되는 것이 아니라, 고분자(폴리머)-염, 알코올-염, 계면활성제-염 등을 활용할 수 있는 것으로 알 려져 있다(Nadar et al., 2017). 이 방법은 단백질, 효소, DNA, 바이러스, 세포, 항체 등 광범위한 생체 분자의 정 제 및 회수를 위해 사용되었고, 이에 따라 계속 발전되 었다(Iqbal et al., 2016). 또한 수성-이상계 시스템의 고 분자 수용액은 70-90%가 물로 구성되어 있고 상형성 (phase forming) 고분자가 극성이 전혀 없어 환경 친화적이 며 가격이 저렴한 고분자 물질을 사용함으로 경제적이다. ATPS 기술은 연속 작동이 가능하고, 대량 생산이 용이하 며, 생체 분자의 농축과 정제를 동시에 할 수 있으므로 처 리 시간을 단축할 수 있다(Iqbal et al., 2016).
수성-이상계 시스템의 성공여부는 시스템 매개 변수(수 성 상 구성)를 잘 조작하여 적절한 분배 계수(K, 상부층 과 하부층의 생체 분자 농도 비율)를 설정하고, 박테리오 신 분리를 위한 적절한 용매의 선택하는 것에 달려있다. 일반적으로 수성-이상계 시스템을 활용한 박테리오신 정 제를 위해서는 크게 4 단계의 유용한 전략 개발이 필요 하다. 첫번째 단계는 목표 단백질 및 기타 오염 물질의 물리 화학적 특성을 정확하게 분석하는 것이고, 두번째는 적절한 수성-이상계 시스템 유형(폴리머/폴리머, 폴리머/ 염)을 정하는 것이고, 세번째 단계는 수성-이상계 시스템 유형의 시스템 매개변수(tie-line length, volume ratio, pH)를 정확하게 측정하는 것이다. 마지막 단계는 대상 제품 회수율과 순도에 대한 공정 매개 변수의 영향을 평 가하는 것이다(Rosa et al., 2010).
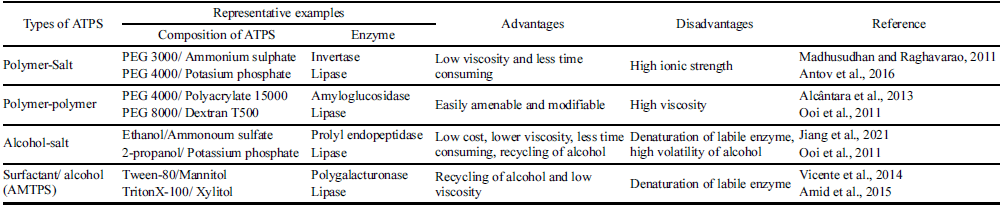
수성-이상계 시스템(ATPS)의 유형
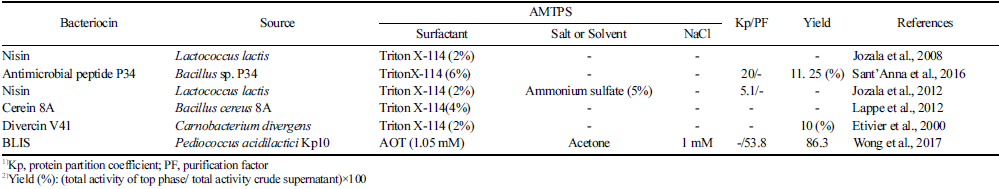
가장 일반적인 수성-이상계 시스템은 폴리머-폴리머(예: polyethylene glycol (PEG)-dextran) 또는 폴리머-염(예: PEG-Ammonium sulfate) 시스템이며, 가장 많이 활용되고 잘 확립되어 있는 조합이다(Table 1). 다른 유형으로는 알코올-염, 이온액체 기반(Louwrier, 1998;Sun et al., 2009;Asenjo and Andrews, 2012;Ruiz-Ruiz et al., 2012;Molino et al., 2013) ATPS와 계면활성제를 이용하는 수성 미셀-이상계 시스템(Aqueous Micellar Two-phase System, AMTPS) 등이 있다(Ruiz-Ruiz et al., 2012;Vicente et al., 2014;Amid et al., 2015). 폴리머-폴리머 시스템은 이온 강도가 낮기 때문에 이온 환경에 민감한 용질을 분리, 회수 및 정제하는데 사용하는 것이 좋다. 폴리머 중에서 PEG는 분자량이 다양하고, 독성이 낮고, 경제적이며, 휘발 성이 적기 때문에 수성-이상계 시스템에서 많이 사용한다. 친화성 리간드의 사용은 폴리머에 공유 결합함으로서 소수 성 특성을 조작할 수 있으며, 이는 생체 분자의 회수율 및 정제 수율을 높일 수 있다. 염은 수성-이상계 시스템에서 생체 분자 사이의 소수성 상호작용을 조절할 수 있으며, 단백질 주변 환경을 변화시켜 분할 작용을 유도한다. 알코 올-염 시스템은 폴리머-염 시스템에 비해서 저렴하며 점도 가 낮고 성분 회수가 쉽고 침전이 빠르다는 장점이 있지만 대부분의 단백질은 알코올이 풍부한 상과 호환되지 않는다 는 단점 때문에 다양하게 활용하기 어렵다(Cabezas 1986;Goja et al., 2013). AMTPS는 막단백질과 같이 이온 환경 에 민감한 단백질의 경우 비이온성 계면 활성제가 A TPS 형성에 사용될 수 있어 유용하다. 현재까지 박테리오신 정 제를 위해 활용한 A TPS 연구에서는 폴리머-염의 구성이 가장 많았으며(Lappe et al., 2012;Abbasiliasi et al., 2014;An et al., 2017;da Silva et al., 2018;Abdul et al., 2020), Triton X-114를 사용한 AMTPS 활용 연구가 일부 연구자들에 의해 수행되었다(Jozala et al., 2008;Jozala et al., 2013;Sant’Anna et al., 2016).
ATPS에서 분할(층 분리)에 미치는 요인
ATPS는 추출하고자 하는 물질의 종류에 따라 폴리머 의 분자량 및 농도, 그리고 염의 종류 및 농도 등이 분 할에 큰 영향을 준다(Porto et al., 2008;Rahimpour et al., 2016;Yücekan and Önal, 2011). 이러한 매개변수는 반데르발스, 소수성, 수소 결합 및 이온 상호 작용과 같은 화학적·물리적 상호 작용의 수를 변경함으로써 단백질 분 할에 직접적인 영향을 미친다. 일반적으로 박테리오신의 적절한 분할은 정제 인자(purification factor; PF), 분배계수 (K), 수율(yield, %), 비활성(specific activity) 측면에서 예 측된다.
폴리머의 종류과 분자량, 농도
ATPS에서 주로 사용되는 폴리머의 종류에는 폴리에틸렌 글리콜(polyethylene glycol; PEG)과 덱스트란(Dextran)이 있다. 친수성을 띈 이러한 고분자들은 인체에 무해하며 의약품, 식품 및 화장품 산업 등에 널리 사용되고 있다.
폴리머의 분자량은 크기에 따라 탄소수와 표면 소수성이 변화하기 때문에 단백질의 분할 거동(partitioning behavior) 에 큰 영향을 미친다(Mattiasson and Ling, 1986). 분자량 의 선택은 분할의 첫 단계에서 이루어지며, 박테리오신 분 할을 위해 다양한 범위의 PEG 분자량(600-20,000 Da)이 사용되었다. 일반적으로 PEG-염 시스템에서는 PEG 분자 량이 증가함에 따라 분배 계수(K)가 낮아진다. 즉, PEG가 풍부한 단계(top phase)에서 단백질에 대해 사용 가능한 자 유 부피(free volume)가 감소하여 생체 분자를 하부 단계 로 밀어낸다(Karkas and Önal, 2012). 그러나 PEG-폴리머 시스템에서는 PEG 분자량이 증가함에 따라 분할 효소의 소수성과 분배 계수(K)가 선형적으로 증가한다(Tubio et al., 2004;Andrews and Asenjo, 2010). 따라서 박테리오신 의 효율적인 분할을 위해서는 표적 단백질의 성질과 특성 에 맞는 적절한 폴리머를 선택해야한다.
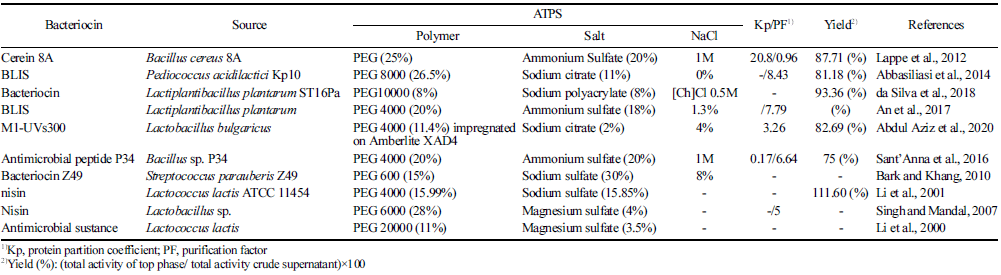
분자량 외에도 폴리머의 농도는 A TPS에서 생체분자의 분할에 중요한 역할을 한다. 폴리머의 분자량이 높을수록 상 분리에 필요한 고분자 농도는 낮아지며, 폴리머의 농도 가 증가함에 따라 상 간의 밀도, 점도 차이가 증가한다 (Tello, 1994). PEG-염을 활용한 시스템에서 PEG 농도가 높으면 생체 분자 분할에 관여하는 고분자 단위의 수도 증 가하므로 생체 분자와 PEG 사이의 더 많은 소수성 상호 작용으로 인해 더 많은 분자가 PEG 상으로 이동하게 된 다(Tello, 1994). 박테리오신 분할에 사용된 PEG의 농도는 8-28%(w/w)로 다양하며 대부분 PEG의 농도가 높아질수록 좋은 분리 및 정제도를 보였다(Table 2). 그러나 da Silva et al. (2018)은 저농도의 PEG 10000과 sodium polyacrylate으로 구성된 A TPS에 의해 상당히 높은 정제 수율로 Lactobacillus plantarum ST16Pa 배양액으로부터 박테리오신을 추출하는 데 성공했다. 따라서 박테리오신을 성공적으로 분할하기 위해서는 박테리오신의 표면 특성에 따라 적절한 PEG의 분자량과 농도를 선택해야 한다.
중성염(NaCl)의 첨가
일반적으로 폴리머-염시스템에서 NaCl을 첨가하면 두 상 사이의 전위차 및 단백질 소수성을 변화시켜 생체분자의 수율과 선택성을 개선하는 효과가 있다(Rosa et al., 2007). NaCl의 첨가로 인한 소수성의 증가는 단백질 표면에 결합 된 물분자를 제거하는 것으로 얻어진다. 결국 소수성 부분 이 노출되어 폴리머 상과의 소수성 상호작용을 촉진할 수 있다. 또한 NaCl의 첨가는 전하와 관련하여 단백질 주변의 환경을 조작하여 분할 거동을 변화시킨다(Rosa et al., 2010). 일반적으로 음전하를 가진 단백질은 PEG-염시스템 에서 상부 단계(PEG가 풍부한 층)로 분할되는 경향이 있 는 반면 양전하를 가진 단백질은 하부 단계(PEG가 거의 없는 층)로 이동한다(Karkas and Önal, 2012). 그러나 고농 도의 NaCl을 첨가하면 시스템에 존재하는 단백질의 변성 을 유발할 수 있으므로, 0.1-1.0 M 수준의 낮은 농도로 첨 가하는 것이 바람직하다. Abdul et al. (2020)은 PEG 4000- Na3C6H5O7 시스템에 4%의 NaCl을 첨가하여 Lactobacillus bulgaricus 배양액에서 박테리오신(M1-UVs3000)을 높은 수율 (82.69 %)로 얻을 수 있었다.
pH 조정
ATPS의 pH는 용질의 전하를 변경하거나 단백질 표면 특성을 변경할 수 있기 때문에 분할에 영향을 준다. 단백 질의 순 전하는 등전점(pI)보다 높은 pH의 경우엔 음으로, 낮은 pH의 경우에는 양으로 바뀐다. pH가 pI와 같으면 순 전하는 0이 된다(Hatti-kaul, 2001). 더 높은 pH 시스템에 서 음전하를 띠는 생체 분자는 상부 단계를 선호하고 분배 계수를 증가시킨다. 즉, 표적 단백질의 pI 보다 높은 pH 값은 “양의 쌍극자 모멘트(positive dipole moment)”로 인 해 PEG가 풍부한 상에 친화성을 갖도록 유도한다(Barbosa et al., 2011;Kianmehr et al., 2014). 중성(pH 7)인 조건은 대부분의 단백질과 효소에서 A TPS 분할을 수행하기에 안 정하다. 중성(pH 7) 이상의 값은 PEG-phosphate 시스템이 적합하며, pH 6.5 미만은 PEG-sulfate 시스템과 호환된다.
타이 라인 길이(Tie line length, TLL)
PEG-염 시스템에서 TLL은 두 상의 조성이 평형상태일 때 각 평형상이 임계점으로부터 떨어진 거리를 의미한다 (Cho and Kang, 2004). TLL이 짧을수록 분배계수(K)가 1 에 가까워지며 이는 목표 단백질의 분할이 덜 선택적으로 이루어진 것을 뜻한다. 반대로 TLL의 증가는 PEG층으로 의 분할을 위한 더 큰 소수성을 제공하여 분배계수(K)의 증가를 야기한다(de Souza et al., 2014). 따라서 하부 단계 의 단백질은 감소하고 상부 단계의 단백질 수율이 증가하 게 된다(Mehrnoush et al., 2012). 또한 PEG-염 시스템에서 TLL을 증가 시키면 더 효과적으로 염석(salting-out)이 가 능하여 단백질이 상부 단계로 이동하게 된다(de Silva and Franco, 2000). 한편 PEG 단계에서 단백질 용해도가 불충 분하면 단백질이 계면에서 침전된다. 용해도 및 염분 허용 한계는 단백질의 특성에 따라 다르며 이에 따른 분할 거동 도 다르다(Ferreira et al., 2007). Abbasiliasi et al. (2014) 은 Pediococcus acidilactici Kp10 배양액에서 bacteriocinlike inhibitory substance (BLIS) 분할 시 PEG 8000- Na3C6H5O7 시스템을 사용하였고, TLL이 증가함에 따라 상 부 단계로 더 많은 BLIS가 이동하였다.
박테리오신 추출을 위한 ATPS의 적용
대표적 박테리오신인 니신(nisin)은 1969년에 Food and Agriculture Organization (FAO)와 World Health Organization (WHO)에서 안전한 첨가제로 인정받았으나 복잡한 정제 공정, 낮은 수율에 따른 높은 단가 때문에 많이 활용되지 못하고 있다. ATPS는 이를 해결하기 위한 적합한 경제적 접근방식 중 하나이다. Table 2에서 미생물 배양액으로부 터 박테리오신을 추출하기 위해 ATPS를 이용한 연구에 대 해 소개하였다. Lappe et al. (2012)은 PEG-염을 활용한 ATPS의 다양한 조합으로 cerein 8A를 정제하였다. 가장 높은 분배 계수(K: 9.4±4.9)는 PEG (20%)-(NH4)2SO4 (20%) 의 조합에서 나온 반면, 가장 높은 수율(87.71%)은 PEG (20%)-(NH4)2SO4 (20%)에 1M NaCl을 첨가한 시스템을 통해 달성되었다. 정제도(0.96)는 낮아졌지만, 저자는 본 연구에서 ATPS의 조건 설정을 위해 무기염의 유형과 나 트륨 첨가와 같은 기본 변수만 다루었기 때문에 분리에 영향을 줄 수 있는 또 다른 중요한 매개 변수(예: 시스템 구성, PEG의 분자량 및 pH 등)를 최적화 하여 정제도를 높일 수 있을 것으로 보인다. 또한, Abbasiliasi et al. (2014)은 PEG와 sodium citrate로 구성된 ATPS를 사용하 여 P. acidilactici Kp10 배양액으로부터 BLIS를 정제하기 도 하였다. PEG 8000 (26.5%)-sodium citrate (11%) 그리 고 46.38%의 TTL에서 정제도 8.43, 수율 81.18%를 달성하 였다. L. plantarum ST16P의 박테리오신은 PEG 10000 (8%) 및 sodium polyacrylate (8%)로 구성된 ATPS을 사 용하여 배양 상등액에서 정제되었는데, 이들은 분할 촉진 첨가제로서 0.5M choline chloride을 사용하여 훨씬 더 높 은 분배 계수(Kbac: 32)와 함께 높은 수율(약 93%)을 달 성하였다(da Silva et al., 2018). 이와 같은 결과를 볼 때, 복잡한 발효액에서 박테리오신의 일차 추출 방법으로서 ATPS의 잠재력이 크다고 생각한다.
AMTPS는 비이온성 계면 활성제를 사용하여 원하는 생 체 분자를 분리하기 위한 ATPS 기반 기술을 변형한 것으 로, 특정 계면 활성제 농도 및 온도에서 상 분리(미셀이 풍부한 상 및 미셀이 부족한 상)가 일어난다(Rangel-Yagui et al., 2004). Table 3에서는 박테리오신 추출에 사용된 AMTPS를 정리하였다. Jozala et al. (2008)은 상업용 및 생합성 니신을 추출하기 위해 AMTPS 방법을 활용하였고, 그 구성으로서 Triton-X 114의 단일 사용 가능 여부를 조 사하였다. 다양한 농도의 Triton X-114 (0, 2, 4, 6 및 8%) 에서 L. sakei 성장 저해와 니신 활성도를 확인한 결과, 2%를 사용하는 것이 가장 적합하다는 결과를 얻었다. 상 업용 니신의 경우 2%의 Triton X-114가 있는 상태에서 총 활성도가 103 AU만큼 향상되었다(Jozala et al., 2008). 니 신은 미셀이 풍부한 상으로 분배되었고, 이러한 현상이 일 어나는 것은 니신의 소수성 특성과 작은 크기의 분자(3 kDa) 때문이라고 설명하였다. 그러나 분배계수(K) 외에 수 율 및 정제 정도에 대한 성능은 조사하지 않았다. Jozala et al. (2013)도 Triton X-114 (2%)와 염으로 구성된 AMTPS 를 사용하여 니신 추출을 시도하였다. MgSo4 및 (NH4)2SO4이 첨가되었을 때 항균활성은 5.0 log AU/mL로 염이 없는 단일 AMTPS보다 크다는 것을 확인하였다. Cerein 8A의 추출은 4% Triton X-114의 단일 사용으로 미 정제 상등액의 초기 활성(3,200 AU/mL)을 유지하였고, 분 배계수(Kcer)는 2.5로 2%, 6%의 Triton X-114보다 큰 값 을 나타냈다(Lappe et al., 2012). 이것은 Trition X-114의 농도가 높아질수록 “exclude-volume effects”로 인해 대부 분의 단백질이 미셀이 부족한 단계로 분할되기 때문이다. 실용적인 관점에서 Trition X-114를 이용한 분리방법은 cerein 8을 미셀이 풍부한 상에서 추출할 수 있는 동시에 미셀이 부족한 층을 통해 대부분의 불순물을 제거할 수 있 었다(Lappe et al. al., 2012). Etivier et al. (2000)은 Triton X-114를 이용한 상 분할 및 교환 크로마토그래피를 조합하 여 Carnobacterium divergens V41 배양액으로부터 divercin V41을 정제하였고, 높은 비활성(108 AU/mg)값을 얻었다. 이를 통해 Triton X-114를 이용한 상 분할이 원심분리를 이용한 세포 분리의 예비 단계를 대체할 수 있었다. 또 한 이 방법에서 사용한 계면활성제(Triton X-114)를 크로 마토그래피 단계의 첫 번째 용출로 쉽게 제거할 수 있음 을 강조하였다. 또 다른 예로 Wong et al. (2017)은 P. acidilactici Kp10의 발효액에서 BLIS를 정제하기 위해 계면 활성제(Bis 2-ethylhexal sulfosuccinate sodium salt: AOT)에 침전하는 방법을 사용하였으며, pH 4에서 1.05 mM의 AOT 및 아세톤 추출(1 mM NaCl 사용)로 86.3% 수율 및 53.8 정제 인자를 얻었다.
Table 3.
Extraction of bacteriocins from fermentation broth by using surfactant based AMTPS
Download Excel Table
추출 과정에서 관찰되는 박테리오신의 독특한 특징 중 하나는 정제 후 순도의 증가와 함께 비활성의 증가이다 (Jozala et al., 2008). Moreno et al. (2001)은 이것을 억제 화합물의 제거와 덜 활동적인 박테리오신 응집체의 해리에 기인했다고 보고하였다. 예를 들어, Zhang et al. (2009)의 연구에서 정제된 pentocin 31-1은 특이 활성이 1,381.9배 증가하였고, 정제 수율은 76.8% 였다. 또한 Jozala 등 (2015)은 유청에서 Lactococcus lactis 발효에 의해 생성 된 니신을 정제하기 위해 소수성 상호반응 크로마토그래 피(hydrophobic interaction chromatography, HIC)를 사용하 였고, 높은 정제도(PF, 물: 774, PBS: 284)를 달성하였다.
박테리오신의 정제 공정에서 고려하여야 할 또 다른 측 면은 활용 목적에 따라 필요한 제품의 순도이다. 필요한 순도 수준은 주로 박테리오신 적용 방향에 따라 다르다. 박테리오신 특성화 연구(구조 및 기능)의 경우는 높은 제품 순도가 요구되는 반면, 식품 및 생물 보존을 위해 활용하 는 경우에는 높은 순도의 박테리오신이 필요하지 않을 수 있다. 예를 들어 Zhang et al. (2014)은 나노여과 단계의 잔류물에 NaCl을 첨가한 후 최종 분무 건조 단계를 거쳐 박테리오신(pediocin PA-1)이 풍부한 보존제를 생산하였다.
산업 적용을 위한 제한점 및 전망
ATPS는 단일 단계의 정제 방법으로 높은 회수율과 순도 를 제공하며 경제적이고 환경 친화적 공정으로 인해 산업 계에서 선택할 수 있는 하부 공정 처리의 매력적인 대안이 다(Yau et al., 2015). 그러나 분할 메커니즘에 대한 제한 된 지식과 ATPS 실험 설계, 설치 및 작동에 대한 이해 부족은 여전히 산업적 활용을 방해하는 요소이다. 특히, 효소나 고분자 단백질과는 달리 박테리오신과 같은 저분 자 단백질 분할을 위한 ATPS 적용에 관한 연구는 매우 부족한 실정이다(Jamaluddin et al., 2018). 또한 상업적 규 모에서 ATPS의 성공적인 구축을 위한 전략이 필요하다. 이를 위해 정제 과정과 관련된 다양한 매개변수의 영향을 분석하고 매개변수 간의 상호작용을 평가하여 최적 조건을 예측할 수 있는 응용 프로그램이 개발되어야 한다. 이러한 도구는 실험 시간을 크게 단축하고 최상의 분할 조건을 제 공함으로서 생산 공정의 효율성과 경제성을 향상 시킬 수 있다(Iqbal et al., 2016).
앞으로 ATPS는 이론적, 실험적으로 빠르게 진화할 것으 로 예상되며, 이를 통해 더 새로운 유형의 ATPS가 개발될 수 있다(Yau et al., 2015). ATPS에 대한 더 많은 지식은 더 발전된 응용 프로그램의 개발로 이어질 것이며, ATPS 를 다른 유망한 도구와 통합하여 개발하면 박테리오신과 같은 고부가가치 제품에 적용할 수 있는 강력한 분리 기술 이 될 수 있을 것이다.
요 약
박테리오신은 다양한 식품에서 천연 보존제로 그리고 항 생제 대체제로 잠재력을 가지고 있다. 그러나 박테리오신 의 다단계 정제 공정은 높은 생산 비용을 야기하여 상업적 이용 등 소비자 접근성에 장애요인이 되고있다. 식품 등 일부 산업 분야에서 활용하기 위한 박테리오신의 순도는 그리 높지 않아도 되며, 이에 따라 정제 공정을 간소화하 여 생산 비용을 낮추고 공정 효율성을 강화할 수 있다. 이러한 관점에서 박테리오신 등에 적용할 수 있는 수성- 이상계 시스템(ATPS)은 높은 정제 수율과 빠른 처리 시 간으로 인해 산업분야에서 하부 공정 처리 기술로 적절한 대안이 될 수 있으며, 고분자 수용액이 70~90% 물로 이 루어진 친환경적 기술로서 환경보호에도 도움을 줄 것으 로 전망된다.
감사의 글
본 연구는 2021년도 농촌진흥청 국립축산과학원 전문연 구원 과정 지원사업 및 농촌진흥청 연구사업(세부과제번호 : PJ01423802)의 지원에 의해 이루어진 것임.
Author information
김종희: 농촌진흥청 국립축산과학원 박사후연구원
이은선: 농촌진흥청 국립축산과학원 농업연구사
김부민: 농촌진흥청 국립축산과학원 농업연구사
함준상: 농촌진흥청 국립축산과학원 농업연구관
오미화: 농촌진흥청 국립축산과학원 농업연구관
References
Abbasiliasi S, Tan JS, Ibrahim TAT, Kadkhodaei S, Ng HS, Vakhshiteh F, Ariff AB.2014. Primary recovery of a bacteriocin- like inhibitory substance derived from Pediococcus acidilactici Kp10 by an aqueous two-phase system. Food Chem. 151: 93-100.


Albertsson PA.1971. Partition of cell particles and macromolecules; Distribution and fractionation of cells, mitochondria, chloraplasts, viruses, proteins, nucleic acids, and antigen-antibody complexes in aqueous polymer two-phase systems. 2nd Ed. J. Wiley
Alcantara LAP, do Nascimento KS, Mourao CA, Minim VPR, Minim LA.2013. Aqueous two-phase poly (ethylene glycol)- sodium polyacrylate system for amyloglucosidase purification: equilibrium diagrams and partitioning studies. Sep. Purif. Technol. 118: 888-894.

An Y, Wang Y, Liang X, Yi H, Zuo Z, Xu X, Han X.2017. Purification and partial characterization of M1-UVs300, a novel bacteriocin produced by Lactobacillus plantarum isolated from fermented sausage. Food Control 81: 211-217.

Andrews BA, Asenjo JA.2010. Theoretical and experimental evaluation of hydrophobicity of proteins to predict their partitioning behavior in aqueous two phase systems: a review. Sep. Sci. Technol. 45: 2165-2170.

Antov MG, Ivetić DŽ, Knežević Jugović, ZD.2016. Single step recovery of lipase from Penicillium cyclopium by aqueous two phase extraction. Sep. Sci. Technol. 51: 622-628.

Asenjo JA, Andrews BA.2012. Aqueous two-phase systems for protein separation: phase separation and applications. J. Chromatogr. A 1238: 1-10.


Banik RM, Santhiagu A, Kanari B, Sabarinath C, Upadhyay SN.2003. Technological aspects of extractive fermentation using aqueous two-phase systems. World J. Microbiol. Biotechnol. 19: 337-348.
Barbosa JMP, Souza RL, Fricks AT, Zanin GM, Soares CMF, Lima AS.2011. Purification of lipase produced by a new source of Bacillus in submerged fermentation using an aqueous twophase system. J. Chromatogr. B 879: 3853-3858.


Boye JI, Arcand Y.2013. Current trends in green technologies in food production and processing. Food Eng. Rev. 5: 1-17.

Cabezas Jr H, Evans JD, Szlag DC.1989. A statistical mechanical model of aqueous two-phase systems. Fluid Ph. Equilibria 53: 453-462.

Cho JM, Kang CH.2004. Measurements of liquid-liquid equilibrium of aqueous polymer solutions containing polyethylene glycol and dextran. J. Ind. Eng. Chem. 15: 558-563.
da Silva Sabo S, Lopes AM, de Carvalho Santos-Ebinuma V, de Oliveira Rangel-Yagui C, de Souza Oliveira RP.2018. Bacteriocin partitioning from a clarified fermentation broth of Lactobacillus plantarum ST16Pa in aqueous two-phase systems with sodium sulfate and choline-based salts as additives. Process Biochem. 66: 212-221.

da Silva, ME. and Franco, TT.2000. Purification of soybean peroxidase (Glycine max) by metal affinity partitioning in aqueous two-phase systems. J. Chromatogr. B: Biome. Appl. 743: 287-294.

de Souza Jr, EC, dos Reis Coimbra, JS, de Oliveira, EB, Bonomo, RCF.2014. Recovery of casein-derived peptides with in vitro inhibitory activity of angiotensin converting enzyme (ACE) using aqueous two-phase systems. J. Chromatogr. B. 973: 84-88.


de Vuyst L, Leroy F.2007. Bacteriocins from lactic acid bacteria: production, purification, and food applications. J. Mol. Microbiol. Biotechnol. 13: 194-199.


Dutra Molino J, Feitosa VA, de Lencastre Novaes LC, Santos Ebinuma V, Lopes AM, Jozala AF, Pessoa Junior A.2014. Biomolecules extracted by ATPS: practical examples. Rev. Mex. Ing. Quim. 13:359-377
Etivier AM, Boyaval P, Duffes F, Dousset X, Compoint JP, Marion, D.2000. Triton X‐114 phase partitioning for the isolation of a pediocin‐like bacteriocin from Carnobacterium divergens. Lett. Appl. Microbiol. 30: 42-46.


Ferreira GB, Evangelista AF, Severo Junior JB, Souza RRD, Santana JCC, Tambourgi EB, Jordao E.2007. Partitioning optimization of proteins from Zea mays malt in ATPS PEG 6000/CaCl2. Braz. Arch. Biol. Technol. 50: 557-564.

Goja AM, Yang H, Cui M, Li C.2013. Aqueous two-phase extraction advances for bioseparation. J. Bioprocess. Biotechnol. 4: 1-8.
Guerra NP, Pastrana L.2003. Influence of pH drop on both nisin and pediocin production by Lactococcus lactis and Pediococcus acidilactici. Lett. Appl. Microbiol. 37: 51-55.


Hatti-Kaul R.2001. Aqueous two-phase systems. Mol. Biotechnol. 19: 269-277.

Jamaluddin N, Stuckey DC, Ariff AB, Faizal Wong FW.2018. Novel approaches to purifying bacteriocin: A review. Crit. Rev. Food Sci. Nutr. 58: 2453-2465.


Jozala AF, Lopes AM, de Lencastre Novaes LC, Mazzola PG, Penna TCV, Junior AP.2013. Aqueous two-phase micellar system for nisin extraction in the presence of electrolytes. Food Bioproc. Tech. 6: 3456-3461.

Jozala AF, Lopes AM, Mazzola PG, Magalhaes PO, Penna TV, Pessoa Jr A.2008. Liquid-liquid extraction of commercial and biosynthesized nisin by aqueous two-phase micellar systems. Enzyme Microb. Technol. 42: 107-112.


Jozala AF, de Lencastre Novaes LC, Mazzola PG, Oliveira-Nascimento L, Penna TCV, Teixeira JA, Junior AP.2015. Low-cost purification of nisin from milk whey to a highly active product. Food Bioprod. Process. 93: 115-121.

Karkaş T, Onal S.2012. Characteristics of invertase partitioned in poly (ethylene glycol)/magnesium sulfate aqueous two-phase system. Biochem. Eng. J. 60: 142-150.

Kianmehr A, Pooraskari M, Mousavikoodehi B, Mostafavi SS.2014. Recombinant D-galactose dehydrogenase partitioning in aqueous two-phase systems: effect of pH and concentration of PEG and ammonium sulfate. Bioresour. Bioprocess.1: 1-8.

Kotelnikova EA, Gelfand, MS.2002. Bacteriocin production by Gram-positive bacteria and the mechanisms of transcriptional regulation. Russ. J. Genet. 38: 628-641.

Lappe R, Sant’Anna V, Brandelli A.2012. Extraction of the antimicrobial peptide cerein 8A by aqueous two-phase systems and aqueous two-phase micellar systems. Nat. Prod. Res. 26: 2259- 2265.


Li C, Bai J, Li W, Cai Z, Ouyang F.2001. Optimization of conditions for bacteriocin extraction in PEG/salt aqueous two‐phase systems using statistical experimental designs. Biotechnol. Prog. 17: 366-368.


Louwrier A.1998. Model phase separations of proteins using aqueous/ethanol components. Biotechnol. Tech. 12: 363-365.

Mattiasson B, Ling TGI.1986. Efforts to integrate affinity interactions with conventional separation technologies: Affinity partition using biospecific chromatographic particles in aqueous twophase systems. J. Chromatogr. B Biomed. Appl. 376:235-243.

Mohammadi HS, Omidinia E.2013. Process integration for the recovery and purification of recombinant Pseudomonas fluorescens proline dehydrogenase using aqueous two-phase systems J. Chromatogr. B. 929: 11-17.


Molino JVD, Viana Marques DDA, Junior AP, Mazzola PG, Gatti MSV.2013. Different types of aqueous two‐phase systems for biomolecule and bioparticle extraction and purification. Biotechnol. Prog. 29: 1343-1353.


Moreno MRF, Callewaert R, de Vuyst L.2001. Isolation of bacte riocins through expanded bed adsorption using a hydrophobic interaction medium. Bioseparation 10: 45-50.


Nadar SS, Pawar RG, Rathod VK.2017. Recent advances in enzyme extraction strategies: a comprehensive review. Int. J. Biol. Macromol. 101: 931-957.


Narayan AV, Madhusudhan MC, Raghavarao KSMS.2011. Demixing kinetics of phase systems employed for liquid-liquid extraction and correlation with system properties. Food Bioprod. Process. 89: 251-256.

Ooi CW, Tan CP, Hii SL, Ariff A, Ibrahim S, Ling TC.2011. Primary recovery of lipase derived from Burkholderia sp. ST8 with aqueous micellar two-phase system. Process Biochem. 46: 1847-1852.

Ozel B, Şimşek O, Akcelik M, Saris PE.2018. Innovative approaches to nisin production. Appl. Microbiol. Biotechnol. 102: 6299-6307.


Park HJ, Khang YH.2010. Simple and rapid extraction of a bacteriocin produced by Streptococcus parauberis Z49 from fermented cultures. Korean J. Microbiol. 46: 291-295.
Pingitore EV, Salvucci E, Sesma F, Nader-Macias ME.2007. Different strategies for purification of antimicrobial peptides from lactic acid bacteria (LAB). In: Mendez-Vilas A (eds). Communicating current research and educational topics and trends in applied microbiology, Formatex, Badajoz, Spain 1: 557-568.
Porto TS, e Silva GM, Porto CS, Cavalcanti MTH, Neto BB, Lima-Filho JL, Pessoa Jr A.2008. Liquid-liquid extraction of proteases from fermented broth by PEG/citrate aqueous twophase system. Chem. Eng. Process. 47: 716-721.

Przybycien TM, Pujar NS, Steele LM.2004. Alternative bioseparation operations: life beyond packed-bed chromatography. Curr. Opin. Biotechnol. 15: 469-478.


Rahimpour F, Hatti-Kaul R, Mamo G.2016. Response surface methodology and artificial neural network modelling of an aqueous two-phase system for purification of a recombinant alkaline active xylanase. Process Biochem. 51: 452-462.

Rangel-Yagui C, Pessoa-Jr, A, Blankschtein D.2004. Two-phase aqueous micellar systems: an alternative method for protein purification. Braz. J. Chem. Eng. 21: 531-544.

Rosa PAJ, Ferreira IF, Azevedo AM, Aires-Barros MR.2010. Aqueous two-phase systems: a viable platform in the manufacturing of biopharmaceuticals. J. Chromatogr. A 1217: 2296- 2305.


Ruiz-Ruiz F, Benavides J, Aguilar O, Rito-Palomares M.2012. Aqueous two-phase affinity partitioning systems: current applications and trends. J. Chromatogr. A 1244: 1-13.


Sant’Anna V, Folmer Correa AP, de Souza da Motta A, Brandelli A.2016. Liquid-liquid extraction of antimicrobial peptide P34 by aqueous two-phase and micellar systems. Prep. Biochem. Biotechnol. 46: 838-843.


Singh N, Mandal SK.2007. Studies on nisin production by isolated Lactobacillus species in aqueous two-phase system. Mapana J. Sci. 6: 69-80.

Sun LH, Jiang B, Xiu ZL.2009. Aqueous two-phase extraction of 2, 3-butanediol from fermentation broths by isopropanol/ammonium sulfate system. Biotechnol. Lett. 31: 371-376.


Tello PG, Camacho F, Jurado E, Paez MP, Guadix EM.1994. Enzymatic hydrolysis of whey proteins. II. Molecular‐weight range. Biotechnol. Bioeng. 44: 529-532.


Tubio G, Nerli B, Pico G.2004. Relationship between the protein surface hydrophobicity and its partitioning behaviour in aqueous two-phase systems of polyethyleneglycol-dextran. J. Chromatogr. B 799: 293-301.


Vicente FA, Malpiedi LP, e Silva FA, Pessoa Jr A, Coutinho JA, Ventura SP.2014. Design of novel aqueous micellar two-phase systems using ionic liquids as co-surfactants for the selective extraction of (bio) molecules. Sep. Purif. Technol. 135: 259-267.

Wong FWF, Ariff AB, Abbasiliasi S, Stuckey DC.2017. Recovery of a bacteriocin-like inhibitory substance from Pediococcus acidilactici Kp10 using surfactant precipitation. Food Chem. 232: 245-252.


Yau YK, Ooi CW, Ng EP, Lan JCW, Ling TC, Show PL.2015. Current applications of different type of aqueous two-phase systems. Bioresour. Bioprocess. 2: 1-13.

Yucekan İ, Onal S.2011. Partitioning of invertase from tomato in poly (ethylene glycol)/sodium sulfate aqueous two-phase systems. Process Biochem. 46: 226-232.

Zhang J, Liu G, Shang N, Cheng W, Chen S, Li P.2009. Purification and partial amino acid sequence of pentocin 31-1, an anti- Listeria bacteriocin produced by Lactobacillus pentosus 31-1. J. Food Prot. 72:2524-2529.


Zhang J, Zhang Y, Wen Y, Gao Q, Wang D, Zhao M, Zhou Z.2014. A compatible membrane process for separation and concentration of pediocin PA-1 from fermentation broth. Sep Sci. Technol. 49: 1978-1984.