서 론
박테리오신(bacteriocin)은 리보솜에서 합성되는 단백질 또는 펩타이드 계통의 항균성 물질로서 구조에 따라 항균 활성이 다양하며 좁은 항균 스펙트럼 혹은 넓은 항균 스펙 트럼을 가진 박테리오신들이 존재한다. 이러한 항균성 펩 타이드의 생산은 박테리아 경쟁에서 중요한 역할을 하며 생산 균주에 생존 이점을 제공한다(Ruiz-Barba et al., 1994). 지난 몇 년 동안 박테리오신은 인간의 위장관에 의 해 쉽게 소화되기 때문에 식품 방부제로의 사용을 위해 많 은 관심을 끌었다(Mills et al., 2011). 천연 식품 방부제로 박테리오신을 사용하면 화학 방부제를 사용하지 않고도 고 품질의 안전한 식품에 대한 소비자의 요구를 충족시킬 수 있다. 그러나 식품 첨가제로서 박테리오신의 적용은 병원 체 제거 효과와 높은 가격과 같은 이유로 제한될 수 있다 (Chen & Hoover, 2003) 따라서 많은 연구자들은 생물학적 및 경제적 문제를 모두 해결할 수 있는 새롭고 더 효과적 인 박테리아 유래 박테리오신을 탐색하기 위한 연구를 진 행하였다.
Cotter 등(2005)에 따르면, 박테리오신은 2개의 주요 군 (Class)으로 분류된다. Class I은 lantibiotic으로 분자량이 5 kDa 미만의 작은 펩타이드로 구성되어있고, Class II는 lantibiotic을 가지고 있지 않으며 약 10 kDa 미만의 작은 크기를 가지고 있어 열에 대한 안정성이 높다. Class II는 Class IIa (pediocin-like), Class IIb (two-peptide), Class IIc (cyclic), Class IId (non-pediocin single linear) 등 4개의 하 위 그룹으로 나뉜다(Cotter et al., 2005;Pei et al., 2018).
박테리오신을 생산하는 다양한 세균들이 있지만, Lactobacillus에 의해 생산된 박테리오신은 식품산업에서 많은 관심을 받고 있다(Egan et al., 2016). 박테리오신은 위장관에서 쉽게 소화될 수 있기 때문에, 박테리오신 자 체보다는 박테리오신 생산 미생물의 투여가 보다 효과적 인 접근일 수 있다(Lagha et al., 2017). Lactobacillus는 유당을 젖산으로 전환하고 other organic acids, diacetyl, acetoin, hydrogen peroxide, antifungal peptides, bacteriocin 등과 같은 항균성 분자를 추가적으로 생성함으로써 다양한 식품 발효에 오랫동안 사용되어왔다(Egan et al., 2016). 그 결과 대부분의 Lactobacillus는 미국식품의약국(FDA)이 승 인한 ‘일반적으로 안전하다고 인정되는 물질’(generally recognized as safe, GRAS)로 간주된다. Lactobacillus속의 미생물은 정상 또는 건강한 장의 특징으로 잘 알려져 있으 며, 외래종 및 잠재적으로 유해한 미생물로부터 장 환경을 보호하는 데 중요한 역할을 한다(Giraffa et al., 2010). 현 재 상업적으로 이용되고 있는 박테리오신은 Lactococcus lactis 균주가 생산하는 니신(nisin), Pediococcus spp. 균주 가 생산하는 페디오신(pediocin)이 있으며, 많이 보고된 박 테리오신으로는 Enterococcus spp. 균주가 생산하는 엔테로 신(enterocins), Lactococcus lactis 균주가 생산하는 락티신 (lacticins)이 있다(Kamarajan et al., 2015;Garsa et al., 2014;Silva et al., 2018). 한편, 사람의 장내 토착 미생물 이면서 대표적인 프로바이오틱스 균주인 L. gasseri 균주로 부터 보고된 박테리오신은 4종류이다(Giraffa et al., 2010). 가장 잘 알려진 것은 L. gasseri LA39의 gassericin A이며, acidocin LF221A와 acidocin LF221B은 L. gasseri LF221 에서 분리되었고, gassericin T는 L. gasseri SBT 2055에서 분리되었다(Toba et al., 1991;Bogovič-Matijašić et al., 1998;Kawai et al., 2000). 그러나 L. gasseri 균주에 의해 생산되는 박테리오신에 관한 정보는 여전히 부족하며, 상 업적 용도로서 사용되기 위해선 새로운 L. gasseri 균주로 부터 생성된 다양한 박테리오신들에 대한 연구가 필요하다.
본 연구에서는 신생아 분변으로부터 식품 병원성 균주에 대하여 광범위한 항균활성을 가진 유산균을 분리 및 동정 하였다. 또한 항균활성이 가장 우수한 L. gasseri G2의 프 로바이오틱스 잠재성을 확인하고 이 균주가 생산하는 박테 리오신의 특성을 평가하였다.
재료 및 방법
건강한 신생아(생후 2주 이내) 10명의 분변 기저귀를 회 수한 후 각각 10회에 걸쳐 채취한 분변 1 g을 희석용 완충 용액으로 희석하여 0.4%(w/v) bromocresol purple이 함유 된 MRS 배지에 각각 도말하고 37°C에서 24시간동안 배양 한 후, 노란색을 띄는 집락의 colony를 선발하였다. 모양, 크기에 따라 상이한 균주를 임의적으로 선택한 뒤, MRS 액체 배지에서 37°C에서 48시간동안 배양하였다. 배양 후, 상등액을 원심분리(10,000×g, 10분, 4°C) 및 membrane filter (0.2 μm, Dismic, Advantec)로 여과 멸균하였다. 멸균 여과한 상등액을 이용하여, 25 mL TSB soft agar (0.8%, w/v)에 각각 배양한 5종 감수성 균주(B. cereus KCCM 40935, Staphylococcus aureus ATCC 40510, Salmonella Enteritidis KCCM12021, Listeria monocytogenes CCARM 0214, Escherichia coli O157:H7 ATCC43888)에 대해 저해 환(diameter) 형성을 조사하였다. 5종 모두에서 가장 높은 저해환을 형성하는 분리 균주를 선별하여 박테리오신 실험 에 사용하였다.
분리균주들의 박테리오신 생산 여부는 well diffusion assay 방법을 사용하여 판별하였다(Tagg & Mcgiven, 1971). 선별된 유산균을 18시간 이상 MRS 배지에서 배양한 다음 원심분리(15,000 rpm, 10분, 4°C) 및 membrane filter (0.2 μm, Dismic, Advantec)로 여과 멸균하여, 상등액을 회수하 였다. 100 mL의 TSB soft agar (0.8%, w/v)에 5종 감수성 균주를 각각 혼합하였다. 혼합한 배지용액을 25 mL씩 분주 하여 완전히 굳은 후, 살균된 cork borer을 이용하여 직경 5mm의 구멍을 내고, 분리 균주의 상등액 50 μL를 접종하 였다. 4°C에서 2-3시간 정도 방치하여 상등액이 확산되게 한 후 감수성 균주의 생육 최적 온도에서 18시간 이상 배 양하여 저해환 생성여부를 확인하였다. 박테리오신 활성은 생육저해환의 반경(mm)으로 나타내었다.
박테리오신 생산 균주의 동정은 16S rRNA gene을 증폭 하여 분리 균주를 동정하였다. Genomic DNA는 Walter 등 의 방법에 따라 분리하였으며(Walter et al., 2000), primers 로는 27F primer (5'-AGAGTTTGATCMTGGCTCAG-3')와 1492R primer (5'-TACGGYTACCTTGTTACGACTT-3')를 사용하였고, PCR 조건은 initial denaturation 5분, 그리고 94°C에서 45초간 denaturation, 55°C에서 60초간 annealing 및 72°C에서 60초간 extension의 cycle을 35회 하였다. 16S rRNA gene 염기서열 확인은 Solgent사(Daegeon, Korea)에 의뢰하여 확인하였다.
항균물질을 생산하는 분리균주 L. gasseri G2의 성장곡 선에 따른 항균활성을 조사하기 위해 37에서 24시간 전배 양한 G2를 100 mL의 MRS 액체배지 1% 접종한 후 48시 간 정치배양하면서 6시간 마다 배양액을 회수하여 620 nm 에서 흡광도를 측정하였다. 나머지 배양액을 원심분리하여 얻은 배양 상등액은 pH와 지시균인 L. monocytogenes CCARM 0214에 대한 항균활성을 well diffusion method로 측정하였다.
프로바이오틱스 특성으로서 내산성, 내담즙성, 항생제 감 수성을 확인하였으며, 대조구로 Lactobacillus rhamnosus GG (ATCC 53103)를 사용하였다. 내산성은 10N HCl를 이용하여 pH 2.5 및 pH 7.0으로 각각 조절된 완충액에 분 리 유산균 현탁액(1.0×108 CFU/mL)을 접종한 후 37°C에서 배양하면서 0, 0.5, 1, 2, 3시간 동안 잔존하는 생균수를 측정하였다. 내담즙성은 MRS broth에 0.3% (w/v) bile salts (Sigma-Aldrich Co., St. Louis, MO, USA)를 첨가하 여 인공 담즙액(10 mL)을 제조한 다음 인공 위액에서 잔 존하는 균수로 조정한 균 현탁액(1.0×108 CFU/mL)을 접 종하고 37°C에서 배양하면서 1시간 간격으로 잔존하는 생 균수를 측정하였다. 항생제 감수성은 디스크 확산법을 사 용하였다. 항생제가 포함된 11종의 Sensi-Disc (OXOID, Hanpshire, UK) 접종된 MRS 평판배지 위에 올려놓고 37°C에서 24시간 배양하였다. 배양이 종료된 후, 각 항생 제에 대한 저해환의 크기를 측정하고 제조사 가이드라인에 따라 감수성과 내성을 (R: resistant, I: intermediate, S: susceptible) 판정하였다.
분리균주 L. gasseri G2가 생산하는 박테리오신을 부분 정제하기 위하여 200 mL의 MRS 액체배지에서 37°C에서 12시간 전 배양한 후, MRS 배지 2 L에 1% (v/v)를 접종 하여 37°C에서 24시간 본 배양을 수행하였다. 배양액을 원 심분리(15,000 rpm, 30분, 4°C) 및 0.2 μm 여과막를 이용하 여 제균하였다. 제균한 상등액과 차가운 아세톤 용매를 1:3의 비율로 혼합하여 -80°C에서 10분간 방치한 후 원심 분리 및 감압 농축하였다(Jeong et al., 2011). 농축된 시료 를 동결 건조하여 -70°C에서 보관하면서 필요시 3차 증류 수에 용해하여 추후 실험의 시료로 사용하였다.
분리균주 L. gasseri G2가 생산하는 박테리오신의 특성 을 확인하기 위하여 pH, 열, 유기용매, 가수분해 효소처리 조건하에서 안정성을 확인하였다.
pH에 대한 안정성: pH에 대한 박테리오신의 안정성을 조사하기 위하여 동결건조된 항균물질 0.2 g에 1 mL의 각 각의 pH에 적합한 완충용액을 사용하여 잘 녹여주었다. pH 2-11까지 각각 완충용액 pH 2.0 (0.1 M glycine-HCl), pH 4.0 (0.1 M sodium acetate), pH 6.0 (0.1 M sodium citrate), pH 7.0 (0.1M sodium phosphate buffer), pH 9.5 (0.1M glycine-NaOH), pH 11.0 (0.1 M carbonate buffer)으 로 항균물질을 희석하여 7°C에서 2시간 방치 한 후 잔존 하는 박테리오신의 항균활성을 측정하였다.
열에 대한 안정성: 열에 대한 안정성의 조사는 동결건조 된 항균물질 0.2 g에 1 mL의 sodium phosphate buffer (pH 7.0) 용액을 사용하여 잘 녹여준 후 4°C, 25°C, 30°C, 37°C, 50°C, 70°C에서는 24시간동안 방치하였고, 100°C는 30분, 121°C에서 15분간 방치 한 후 잔존하는 항균활성을 측정 하였다.
유기용매에 대한 안정성: 유기용매에 대한 안정성 실험 은 acetone, methanol, ethanol, 및 butanol을 동결건조된 항 균물질과 같은 무게 비율로 혼합(1:1)하여 상온(25°C)에서 1시간 방치한 후, 잔존하는 박테리오신의 항균활성을 측정 함으로써 여러 유기용매에 대한 박테리오신의 안정성을 조 사하였다.
가수분해효소에 대한 영향: 효소에 대한 안정성 조사는 항균물질에 가수분해 효소 protease lipase, proteinase, trypsin, lysozyme, α-amylase를 최종농도 1 mg/mL로 각각 첨가한 후 37°C에서 1시간 반응시킨 뒤 잔존 항균활성을 측정하였다.
분리균주 L. gasseri G2가 생산하는 박테리오신의 항균 범위를 알아보기 위해 다양한 유산균 및 식품유래 병원성 균주 Lactobacillus plantarum ATCC 49445, L. acidophilus ATCC 4162, L. sakei ATCC 15521, Leuconostoc mesenteroides ATCC 9135, B. cereus KCCM 40935, L. monocytogenes CCARM 0214, S. aureus ATCC 40510, Clostridium perfringens KCCM 40946, E. coli O157:H7 ATCC 43888, Enterobacter sakazakii KCTC 2749, S. Enteritidis KCCM 12021, Shigella flexneri KCCM 40948, Shigella boydii KCCM 41649, Vibrio parahaemolyticus KCCM 11965, Vibrio vulnificus ATCC 29306에 대하여 항균력을 확인하 였다. 각 지시균주의 최적 생육온도에서 24시간 이상 배양 하여 저해환의 생성 여부를 well diffusion assay 방법을 사용하여 확인하였다(Tagg & Mcgiven, 1971).
항균물질의 분자량을 측정하기 위하여 아세톤 침전법으 로 부분 정제한 박테리오신 시료를 사용하여 tricine-SDSPAGE를 실시하였다(Wang et al., 2000). Gel 농도는 16.5%로 사용하였고, 표준 분자량 물질로 Precision Plus ProteinTM Dual Xtra Standards marker (Bio-Rad Laboratories, Hercules, CA, USA)를 사용하였다. 부분 정제한 시 료를 Tricine-SDS-PAGE sample buffer와 1:1의 비율로 혼 합하여 끓는 물에서 3분간 가열하여 전기영동하였다. 전기 영동 완충용액으로 TGS running buffer (Bio-Rad)를 사용 하였다. 전기영동이 끝난 gel은 EzWay Protein-silver staining kit (Komabiotech, Seoul, Korea)로 염색을 하였 고, 다른 gel은 멸균수로 4시간 동안 세척한 다음 이 gel 을 plate 위에 무균적으로 건조시키고 그 후 지시균(L. monocytogenes, 1.0×106 CFU/mL)이 포함된 TSA soft (0.8%) 5 mL을 중층하였다. 37°C에서 12시간 배양한 후 저해환을 관찰하여 박테리오신의 위치를 확인하였다.
결과 및 고찰
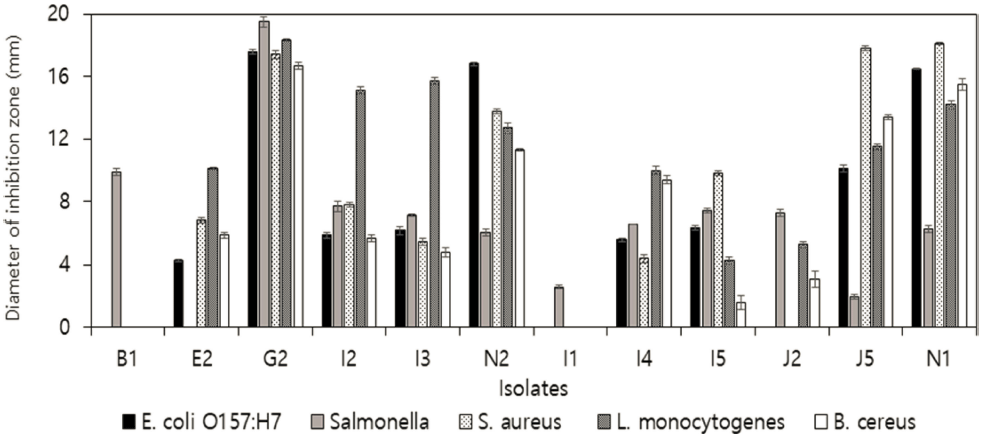
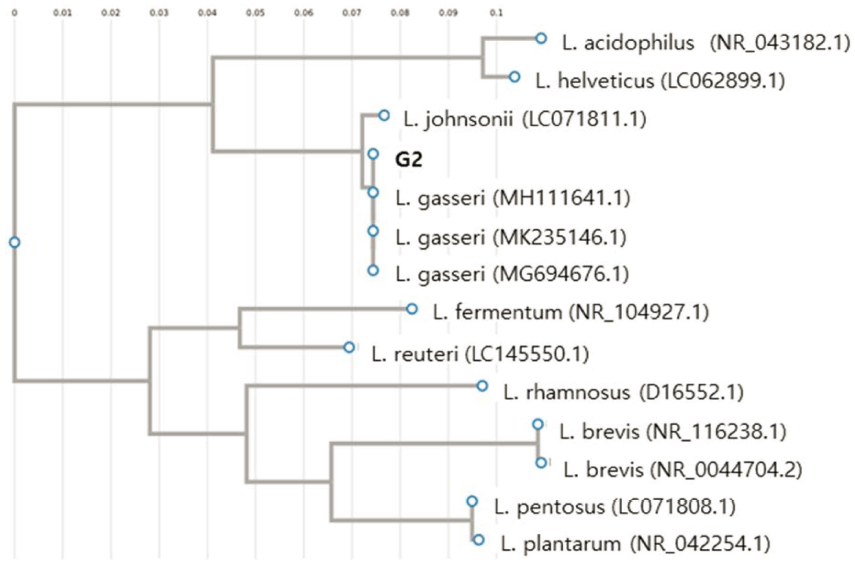
신생아 분변으로부터 형태학적 특성에 따라 상이한 219 균주의 유산균을 분리하였으며, 식품 부패미생물 B. cereus, S. aureus, S. Enteritidis, L. monocytogenes, E. coli O157:H7에 대한 항균활성을 측정하였다. 5균주 모두에서 생육저해활성이 가장 우수한 G2균주를 선발하였고(Fig. 1), 분자생물학적 동정을 실시하였다. 16S rRNA gene 염기서 열을 BLAST 프로그램을 이용한 GenBank의 데이터베이 스와 비교한 결과 99%의 신뢰도로 Lactobacillus gasseri 로 동정되었고(Fig. 2), G2 균주를 L. gasseri G2로 명명 하였다.
본 연구에서 선별된 L. gasseri G2의 내산성을 조사하기 위해 초기 접종균수와 비교한 결과, pH 2.5에서 3시간 배 양하였을 때 98.8% 생존율로 거의 영향을 받지 않은 것으 로 나타났다. 이어서 산성 처리된 균주는 회수되어 bile salt 0.3%를 첨가한 MRS 액체배지에서 4시간 배양하였다. 최종적으로 G2 균주는 85.4%의 생존율을 나타냈으며, 이 결과는 프로바이오틱스 균주로 잘 알려진 L. rhamnosus GG 표준 균주보다 6.2% 높은 생존율이었다. 또한 G2균주 는 pH 1.5로 보정한 MRS 액체 배지에서도 92.3%의 생존 율을 보임으로서 매우 우수한 내산성을 보여주었다(Table 1). 공복시 위내는 pH 2.0이하의 강산성이지만 음식물 섭 취 후 2-3시간 동안은 음식물에 희석되어 pH 2.0이상인 점을 감안할 때 L. gasseri G2는 산과 담즙산염에 대한 강 한 내성이 있어 위장관에서의 생존가능성이 높을 것으로 사료된다(Wang et al., 2000).
선발 미생물의 항생제 감수성을 조사하기 위해 11종의 항생제가 포함된 Sensi-Disc를 사용하였다. 그 결과, oxacillin, ciproflozacin, clindamycin, gentamicin, penicillin, streptomycin 등의 항생제에 대해 강한 저항성을 보였고, ampicillin, cephalothin, erythromycin, tetracycline에 대해 감수성을 나타냈다(Table 2). 예상치 못하게 vancomycin에 서 약간의 영향을 받았다. 일반적으로 대부분의 유산균은 vancomycin과 같은 핵산 합성 억제제에 대해 내성을 보이 며, chloramphenicol, macrolides, lincosamides, tetracycline 과 같은 단백질 합성 억제제에 대해 저농도에서 영향을 받 기 쉽다(Delcour et al., 1999). 그 밖에 erythromycin과 tetracycline에 대한 저항성은 균주에 따라 다양하다 (Gueimonde et al., 2013). 한편, 항생제 저항성이 있는 프 로바이오틱스는 항생제 치료 후 장내 microflora를 복원하 는데 유용할 수 있다(Gueimonde et al., 2013). 그러나 tetracycline 내성 유전자와 같은 이동 가능한 유전 요소를 지니는 특정 항생제 내성 프로바이오틱스는 장내 병원균에 대한 잠재적 저장소를 구성하여 심각한 안전 문제를 야기 하기도 한다(Gueimonde et al., 2013). 본 연구에서 분리한 L. gasseri G2는 비교적 우수한 항생제 내성을 보유하고 있으며 특히, tetracycline에 대해 매우 민감하여 인체에 안 전하게 사용가능 할 것으로 사료된다.
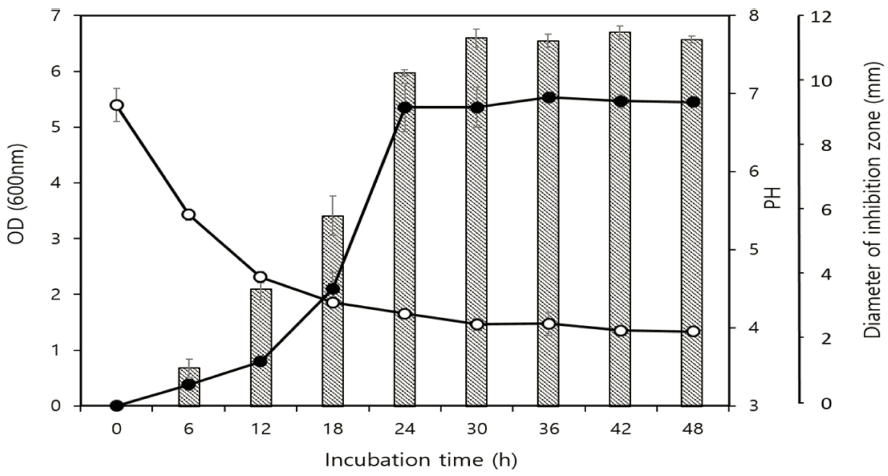
선발미생물의 생장에 따른 박테리오신 생산 수준 및 pH 변화는 G2균주의 배양 시간에 따라 단계별로 모니터링하 였다(Fig. 3). L. gasseri G2의 생육은 37°C에서 배양 9시 간에 유도기 단계에 도달하고, 18시간까지 대수 증식기였 으며, 그 후 정체기에 들어갔다. L. monocytogenes에 대한 항균활성은 배양 6시간부터 생성되기 시작하여 30시간에 최대 높은 활성에 도달하였고(저해환 크기 18.6 mm), 48시 간 때까지 일정한 활성을 유지하였다. 균주가 성장하는 동 안 pH는 배양 초기 pH 6.8에서 48시간 배양 후 pH 4.1로 감소하였다. 박테리오신 활성은 대수 증식기에 검출되기 시작하여 12-24시간에 최대에 이르렀고, 이는 균의 성장과 비례적으로 박테리오신이 생산되어 생산균주의 1차 대사산 물임을 확인하였다. 유사한 결과는 Lactococcus lactis ET45 균주, Lactobacillus curvatus LB65 균주, L. rhamnosus 1K 균주에서도 보고되었다(Jeong et al., 2011;Marie et al., 2011;Abdelbasset et al., 2014).
선발균주 L. gasseri G2의 부분 정제 박테리오신에 대한 pH, 열, 효소, 유기용매에 대한 안정성 조사는 Table 3에 나타내었다. pH 안정성을 시험한 결과, pH 2.0-10.0까지 어떠한 활성의 소실 없이 안정하였고, pH 11.0에서는 약간 활성이 감소하는 경향을 보였으나 우수한 잔존 활성(70% 이상)을 확인하였다. 유산균이 생산하는 박테리오신의 pH 안정성은 L. gasseri KT7, Lactobacillus brevis CM22, Lactococcus lactis subsp. lactis 등에서 많이 보고되었다 (Zhu et al., 2000;Rahmeh et al., 2019;Aslam et al., 2012). 본 연구에서 선발된 균주의 박테리오신 또한 pH 안 정성이 매우 우수한 것으로 나타났다. 열안정성 조사 결과 에서 L. gasseri G2균주의 박테리오신은 모든 열처리 조건 에서 안정성을 보였으며, 특히 120°C, 15분에서도 항균 활 성 소실이 전혀 없어 열에 대한 안정성도 아주 우수한 것 으로 확인되었다. 일반적으로 각종 유산균이 생산하는 박 테리오신의 열 안정성은 균주에 따라 상이한 것으로 알려 져 있는데, L. gasseri KT7의 gassericin KT7의 경우 100°C 에서 30분 반응시켰을 때 100% 활성을 보였지만 120°C에 서 15분 반응시켰을 때에는 항균활성이 완전히 소실되었다 (Zhu et al., 2000).
L. gasseri G2균주의 부분 정제 박테리오신에 대한 가수 분해효소 안정성을 보기 위해 여러 종류의 가수분해 효소 를 1 mg/mL의 농도로 첨가하여 반응시킨 후 항균물질의 잔존활성을 측정한 결과, α-amylase, lipase, lysozyme에 의 해서는 항균활성에 전혀 영향을 받지 않았으나, 단백질 가 수 분해 효소인 proteinase K, protease, trypsin에 대해서는 항균활성이 감소함을 확인하였고, 2 mg/mL 처리시에는 활 성을 완전히 상실하였다. 따라서 균주 L. gasseri G2가 생산하는 G2가 생산하는 항균물질은 단백질성 물질임을 확인하였다. 마지막으로 유기용매에 대한 안정성 시험을 위해 acetone, methanol, ethanol, buthanol을 사용하였으며 사용한 모든 유기용매에 대해서 높은 안정성을 나타내었다.
분리 균주 L. gasseri G2가 생산하는 박테리오신의 항균 범위를 알아보기 위해 11종의 식품유래 병원성균주 및 4종 의 유산균을 사용하여 항균활성을 확인하였다 (Table 4). G2균주의 부분 정제 박테리오신은 그람 양성균 8종, B. cereus KCCM 40935와 L. monocytogenes CCARM 0214, S. aureus ATCC 40510, C. perfringens KCCM 40946, Lactobacillus plantarum ATCC 49445, L. acidophilus ATCC 4162, L. sakei ATCC 15521, Leuconostoc mesenteroides ATCC 9135에 대해 항균활성을 확인하였고, V. vulnificus ATCC 29306을 제외한 6종의 그람 음성균 E. coli O157:H7 ATCC 43888, E. sakazakii KCTC 2749, S. Enteritidis KCCM 12021, S. flexneri KCCM 40948, S. boydii KCCM 41649, V. parahaemolyticus KCCM 11965에 대해 항균활 성을 나타냈다. 특히, L. monocytogenes CCARM 0214, E. coli O157:H7 ATCC 43888, S. Enteritidis KCCM 12021, S. boydii KCCM 41649에 대하여 강력한 항균활성을 나 타내었다. 결과적으로 신생아 분변에서 분리한 G2균주는 그람 양성균 뿐만 아니라 음성균에서도 광범위한 항균활 성을 나타내었다. 본 연구 결과와 마찬가지로 광범위한 항균활성을 가진 박테리오신은 L. gasseri K7과 L. gasseri LF221균주에서도 보고되었는데 이들은 B. cereus, C. tyrobutyricum, C. perfrigens, E. faecalis, S. aureus, Streptococcus thermophilus에 대하여 넓은 억제 스펙트럼을 가진 박테리오신을 생산했다(Matijašić & Rogelj, 1999;Matijašic & Rogelj, 2000). 반면에 L. casei, L. sakei, L. viridescens, L. plantarum에 의해 생산되는 plantaricin A의 항균 스펙트 럼은 비교적 좁다고 보고되었다(da Silva Sabo et al., 2014).
부분 정제된 박테리오신의 분자량을 추정하기 위하여 농 축된 박테리오신으로 tricine-SDS-PAGE를 실시하였다. 해 당 단백질이 잘 분리되어 나타나지는 않았지만 박테리오신 으로 유추할 수 있는 억제 구역은 Fig. 4에서 보는 바와 같이 지시균으로 L. monocytogenes를 사용하여 항균활성을 확인하였을 때 대략 2 kDa에 위치하고 있는 band에서 나 타났다.
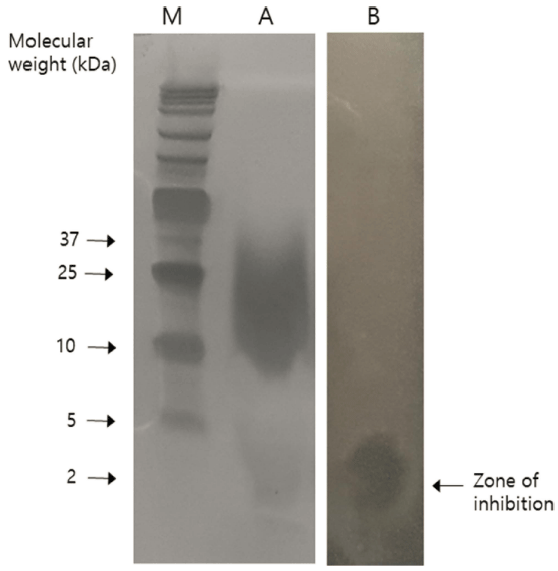
본 연구에서 L. gasseri G2균주가 생산하는 박테리오신 의 특성은 class II에 속하는 것으로 예상되며, 특히 subclass IIc속의 원형 박테리오신에 가깝다고 사료된다. 이들 은 분자량이 10 kDa 이하이며, 일반적으로 Clostridium spp., Listeria spp.와 같은 일반적인 식품 매개 병원균에 대 해 광범위한 항균활성을 나타내고, 높은 열 및 pH에 안정 할 뿐만 아니라 많은 단백질 분해 효소에 대한 내성이 있 다고 알려져 있다(Chung et al., 2011). 이러한 특징은 다 른 그람 양성 박테리오신과 명확하게 구별되며, 별도의 그 룹으로 간주될 만큼 높은 동질성(homogenous)을 가지고 있다고 보고되었다(Chung et al., 2011;Gabrielsen et al., 2014;Maqueda et al., 2008;Kemperman et al., 2003) L. gasseri G2가 생산하는 박테리오신은 이러한 특징과 매우 유사한 특성을 보임으로서 산업적 용도로서 잠재성이 매우 높다고 판단된다.
요 약
유산균으로부터 생산되는 박테리오신은 천연 보존제로서 식품산업에서 합성보존제의 대안으로 많은 관심을 끌고 있 다. 본 연구에서는 신생아분변에서 분리한 Lactobacillus gasseri G2의 프로바이오틱스 특성과 이 균주로부터 생산 되는 박테리오신에 대한 일부 특성을 규명하였다. G2 균주 는 내담즙성, 내산성, 항생제 내성 및 광범위한 항균활성과 같은 프로바이오틱스로서 잠재성을 확인하였다. 아세톤 침 전에 의한 부분 정제된 박테리오신은 높은 온도(100°C 30 분, 121°C 15분)와 광범위한 pH (pH 2.0-10.0) 뿐만 아니 라 다양한 유기용매(아세톤, 메탄올, 에탄올, 부탄올)에 대 해 항균 활성 소실이 전혀 없이 매우 우수한 안정성을 보 여주었고, 가수분해 효소처리의 경우 α-amylase, lipase, lysozyme에 대해서는 안정하였으나 proteinase K, protease, trypsin처리에서 활성이 감소하여 L. gasseri G2가 생산하 는 항균물질이 단백질성 물질임이 확인되었다. 부분 정제 된 박테리오신은 시험한 그람양성 4종 및 그람 음성 6종 균주에 대하여 항균활성을 나타냈다. Tricine-SDS-PAGE를 이용한 박테리오신의 분자량은 대략 2 kDa으로 확인되었 다. L. gasseri G2가 생산하는 박테리오신의 높은 열안정성 과 산·알칼리 안정성은 효소의 잠재적 산업화 가능성을 시사한다.