서 론
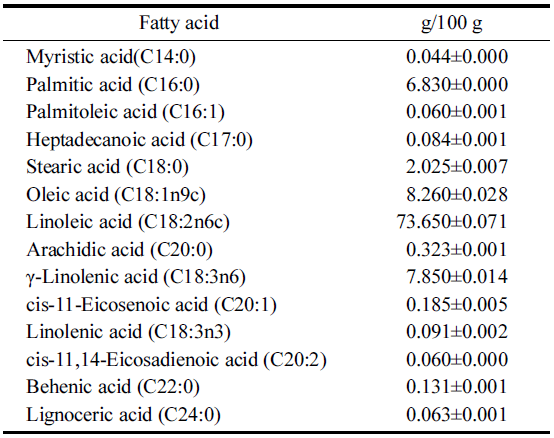
달맞이꽃 종자유가 건강식품으로 주목을 받고 있는데 이 는 달맞이꽃 종자유에 7-14% 함유 되어있는 불포화지방산 인 감마리놀렌산(gamma-linolenic acid, GLA) 때문이다. 감 마리놀렌산은 프로스타글란딘(prostaglandin, PG)이라는 생 리적 활성물질의 모체가 된다. 감마리놀렌산은 콜레스테롤 저하(Michihiro et al., 1986) 및 혈압강하(Hassall & Kirtland, 1984), 성인병예방 등의 효과가 있는 것으로 알려지면서 세계적으로 건강보조식품과 의약품 소재로서 많이 사용되 고 있는 유지 중 하나이다. 그러나 달맞이꽃 종자유의 지 방산은 cis형의 불포화지방산을 함유하고 있어 빛이나 열 에 의하여 자동 산화작용 일으켜 지방산의 성분변화, 산화, 과산화지질 생성 등이 쉽게 일어난다(Chan, 1987; Pyo et al., 1989).
에멀젼(emulsion)이란 두 액체를 혼합할 때 한쪽 액체가 미세한 입자로 되어 다른 액체속에 분산되어 있는 분산시 스템을 말한다. 에멀젼을 안정한 상태로 분산시키기 위해 두 액체의 계면장력을 낮춰야 하는데 이때 유화역할을 하 는 계면활성제(유화제)가 필요하다. 에멀젼은 유화제 조건 또는 균질방법에 의해 물리적성질 및 안정성이 달라진다. 유화제의 경우 hydrophilic lipophilic balance (HLB), 유화 제의 양, 유화제의 용해조건 등에 따라 다양한 에멀젼을 나타낸다(Yeon et al., 2014). 유화제의 기능과 효과를 극대 화하기 위해 기계적인 에너지를 이용하여 분산상의 입자를 작게 하는 조작이 필요하다. 기계적인 균질방법으로는 low-energy emulsification(자발적유화, 전상온도법), medium energy emulsification(초고속균질), high energy emulsification (초고압균질, 초음파균질)이 있다(Kim et al., 2012). 특히 분산상을 나노수준의 입자로 작게 하기 위해서는 high energy emulsification이 효과적이다. 초고압균질기(microfluidizer) 를 이용하여 에멀젼을 제조하게 되면 초고압이 가 해진 유체는 좁은 틈(slot)을 통과하면서 높은 전단, 충돌 및 캐비테이션을 발생시키며 미립화 및 분산, 유화 등의 현상이 일어나게 된다(Lim et al., 2010).
달맞이꽃 종자유는 건강기능적 및 영양적으로 장점이 있 음에도 물에 대한 용해도가 낮고, 지방산화에 대한 안정성 이 낮기 때문에 친수성 식품에 직접 적용하기 어려우며 생 물학적 이용도가 낮다. 본 연구에서는 유화안정성이 높은 달맞이꽃 종자유 에멀젼 제조공정을 찾기 위해 유화제 HLB (8.6, 12, 16.7) 및 유화제농도, 균질법을 달리하여 제 조 후 4주간 저장하면서 특성을 관찰하였다.
재료 및 방법
본 실험에 사용된 달맞이꽃 종자유(evening primrose oil, EPO; Bomnawon, Gangwon, Korea)는 달맞이꽃종자에서 저온 압착하여 볶지 않은 기름으로 사용하였으며, 원재료의 지방산 조성은 Table 1과 같다. 모든 계면활성제는 Sigma aldrich Co. (St, Louis, MO, USA)에서 구입하여 사용하였 으며 유화제 HLB 8.6과 16.7은 Span 20 (HLB 8.6, 1,000- 2,000 mPa·s)과 Tween 20 (HLB 16.7, 250-450 mPa·s)을 각각 단독으로 사용하였으며, HLB 12는 Tween 80 (HLB 15, 375-480 mPa.s)과 propylen glycol (HLB 2.5, 42 mPa·s) 을 76:24 질량비율로 혼합하여 제조하였다. 기타 모든 시 약은 분석용을 사용하였다.
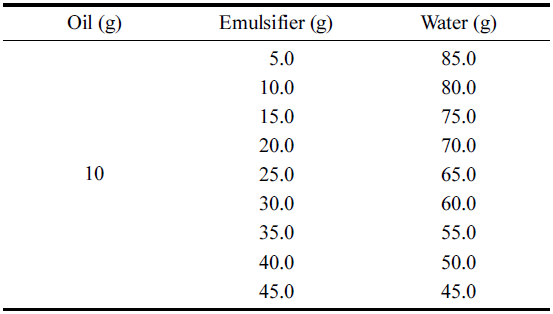
달맞이꽃 종자유 수중유적형(EPO/W) 에멀젼을 제조하기 위해 Table 2와 같이 다양한 농도의 유화제를 증류수에 용 해시켜 연속상을 준비하였다. 분산상인 10%의 달맞이꽃 종자유를 연속상에 첨가하여 초고속균질기(T25D, Ika, Königswnter, Germany)를 이용하여 7,000 rpm으로 2분 동 안 균질하였다. 이 때 일정한 시간동안 에멀젼의 유상과 수상이 분리되는 정도를 확인하였으며, 분리되지 않은 샘 플을 초고속균질기를 이용한 최적의 EPO/W 에멀젼으로 선택하였다.
초고속균질을 통해 제조된 EPO/W에멀젼 중 초고압 균 질기의 나노셀에 통과하기 적합한 수준의 점성을 지닌 샘 플만 초고압균질기(Picomax MN400, Micronox, Sungnam, Korea)를 사용하여 10,000 psi에서 1회 균질하였다. 초고속 및 초고압균질에 의해 각각 제조된 최적의 EPO/W 에멀 젼 중 유상과 수상분리가 없고, 입자크기가 가장 작고, 제 타전위차가 가장 높은 에멀젼을 28일 동안 상온(room temperature, RT)와 40°C (high temperature, HT)의 컨테이 너에서 입자특성, 포집효율, 지방산패 등을 관찰하였다.
에멀젼의 평균 입자크기 및 입자분포도는 dynamic light scattering (DLS) 원리에 의하여 DelsaMax Pro (Beckman Coulter, Brea, CA, USA)으로 분석하였다. 제타전위차(zetapotential) 측정은 electrophoretic light scattering (ELS) 원리 에 의하여 DelsaMax Pro (Beckman Coulter)으로 분석하였 다. 모든 에멀젼을 100배 희석하여 사용하여 3회 반복하여 측정하였으며, 입자크기는 diameter (nm), 제타전위차는 zeta-potential (mV), 입자분포도는 polydispersity index (PD Index)로 나타내었다.
포집되지 않은 free oil을 추출분리하기 위해 15 mL 튜 브에 에멀젼 1 mL과 n-hexane (Daejung chemicals & Metals, Co., Ltd., Siheung, Korea) 1 mL을 넣어 균질 후 1,000 rpm에서 3분 동안 25°C에서 원심분리기(LaboGene 1248R, GYROZEN, Daejeon, Korea)를 이용하여 분리하였 다. 원심분리 후 free oil이 분산된 상등액을 microplate reader (BioTek, Winooski, VT, USA)를 이용하여 284 nm 에서 흡광도를 측정하고 달맞이꽃 종자유 표준곡선에 의해 free oil양을 계산하였다. EPO 포집효율은 아래의 식을 이 용하여 계산하였다.
McDonald & Hultin (1987) 방법에 따라 측정하였다. 에멀 젼 1 mL를 취한 후 TBA reagent (15% (w/v) trichloroacetic acid (TCA), 0.375% (w/v) thobarbituric acid (TBA))를 0.25 M HCl에 넣어 혼합한다. 에탄올에 용해된 2% butylated hydroxytoluene (BHT)을 혼합하여 균질화하였다. 혼합한 샘 플을 항온수조 90°C에 넣어 15분 동안 가열한 후 상온에서 10분간 냉각 후 원심분리기(LaboGene 1248R, GYROZEN) 4,000 rpm, 10분, 25°C를 하여 microplate reader (BioTek) 532 nm에서 흡광도를 측정하였다.
결과 및 고찰
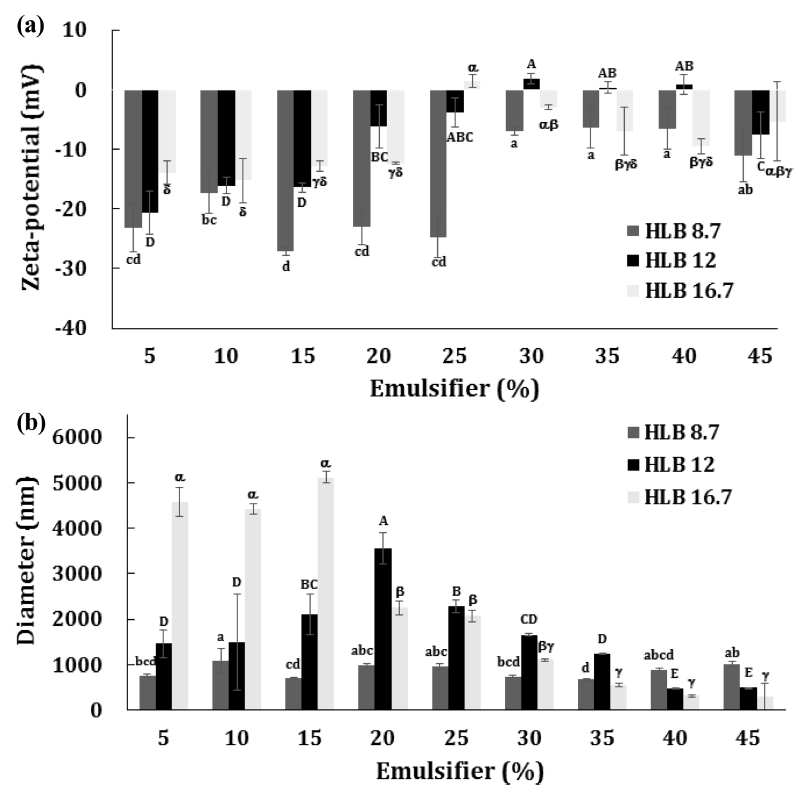
유화제 HLB (8.6, 12, 16.7)와 첨가비율(5-45%)을 달리 하고, 초고속균질을 통해 제조된 EPO/W 에멀젼들의 분리 되는 정도를 관찰하고 제조 직후 제타전위, 입도, 입자분산 도를 측정하였다. 대부분 제조 후 수 시간 내에 creaming 현상을 보이며 유상과 수상이 분리되었으며(Table 3), 유 화제 특유의 점성은 에멀젼 점성에 영향을 주었다. 유화 제 첨가량이 증가할수록 유상과 수상이 분리되는 시간이 증가하는 경향을 보였으며, 유화제 HLB에 따라 분리 되 는 시점이 다르게 나타났다. HLB 8.7의 경우 모든 에멀 젼이 2-3시간 안에 분리되었으며, HLB 16.7의 경우 30% 이상 유화제 첨가 에멀젼들이 유화제 농도 순으로 분리되 었고 6일 후에 모두 분리 되었다. HLB 12의 경우 HLB 16.7과 마찬가지로 30%이상 유화제 첨가 에멀젼들이 유 화제 농도 순으로 분리되었고, 45% 유화제 첨가 에멀젼 은 실험기간 28일까지 유상과 수상이 분리 되지 않는 안 정성을 보였다.

|
EPO/W 에멀젼의 제조 직후 제타전위, 입도, 입자분산 도는 Fig. 1과 같다. EPO/W 에멀젼의 제타전위 범위는 -27.09-1.81 mV로 측정되었으며, 유화제 HLB에 관계없이 절대값이 유의적으로 감소하는 경향을 보였으며(p<0.05), 유화제 첨가농도 25% 이후부터 급격히 낮아진 후 유지되 는 것으로 관찰되었다. EPO/W에멀젼의 입도는 HLB 8.6 의 경우 유화제 첨가농도와 관계없이 평균 865 nm 수준을 나타냈고, HLB 12의 경우 유화제 첨가농도에 따라 유의적 으로 증가하다가 20% 부터 유의적으로 감소하여 45% 첨가 에멀젼은 491 nm를 나타내어 최소크기를 보였다(p<0.05). HLB 16.7의 경우 유화제 첨가농도 20%부터 감소하여 40%와 45% 첨가 에멀젼은 모든 샘플 중 유의적으로 가장 작은 입도로 측정되었다(p<0.05). EPO/W에멀젼의 입자분 산도는 유화제 첨가 농도에 따라 감소하는 경향을 보였지 만, 평균 0.325로 다분산상에 가까운 값을 나타냈으며, 측 정 결과 값의 표준편차가 크게 나타나 유화제 HLB값 및 농도에 따른 유의적 차이는 없었다(p>0.05).
초고속 균질을 이용하여 제조된 EPO/W 에멀젼은 대부 분 유상과 수상이 분리되었고, 제타전위 절댓값이 낮아 분 산상들의 응집력이 크며, 입도의 표준편차가 크게 측정되 어 유화안정성이 낮았다. 또한 분리를 방지하기 위해서는 다량의 유화제를 첨가해야 하기 때문에 제조 효율성이 떨 어진다. 즉, 초고속균질법은 EPO/W 에멀젼 제조를 위한 최적의 균질법이 아님을 확인하였다. 에멀젼의 안정성을 향상시키기 위해 초고속균질로 제조된 다양한 EPO/W 에 멀젼 중에서 유화제 점성 및 에멀젼 점성, 에멀젼 입자특 성 등을 고려하여 초고압균질을 실행하였다.
초고압균질이란 유체에 초고압을 가하여 좁은 틈(slot)을 통과할 때 높은 전단, 충돌 및 캐비테이션을 발생시켜 콜 로이드입자를 미립화 및 분산시키는 공정이다(Lim et al., 2010). 초고압이 가해진 유체의 흐름성이 충분하지 않으면 높은 전단력이나 케비테이션이 발생하지 않아 입자크기 감 소 및 분산도 향상 등의 효과를 기대하기 어렵다(Bisten & Schuchmann, 2016). 그러므로 초고압균질기를 통과하는 유체의 점성 혹은 레이놀드수는 매우 중요하다(Bisten & Schuchmann, 2016). 유화제 중 가장 높은 점도를 가진 Span 20 (1,000-2,000 mPa·s)이 첨가된 에멀젼은 모두 초고 압균질이 불가능하였고, Tween 20 (250-450 mPa·s)이 첨가 된 에멀젼과 Tween 80 (375-480 mPa.s)과 propylen glycol (42 mPa·s)을 혼합한 유화제가 첨가된 에멀젼은 5-25% 첨 가 에멀젼은 초고압균질이 가능하였다.
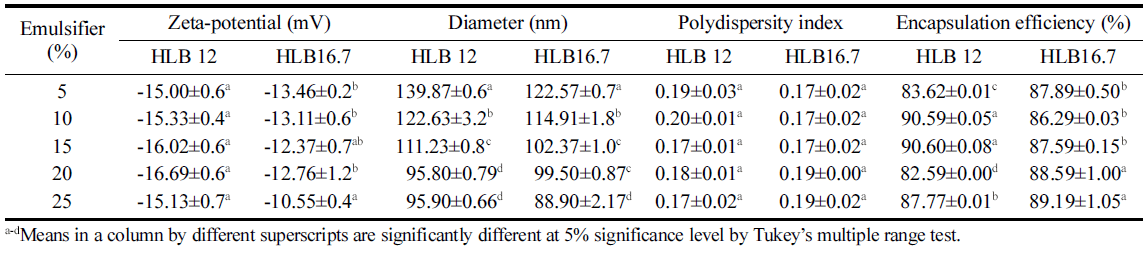
초고압균질 된 EPO/W 에멀젼의 입자특성은 Table 4와 같다. 제타전위는 HLB 12와 HLB 16.7 첨가 에멀젼 모두 절댓값 30 이하로 입자 안정성은 낮은 것으로 측정되었으 나, HLB 16.7 첨가 에멀젼이 다소 낮은 절댓값을 보였으 며, 25% 첨가 시 가장 낮은 제타전위차를 나타냈다. 초고 속균질 에멀젼은 유화제 첨가 농도증가에 따라 제타전위차 가 감소하였으나, 초고압균질의 경우 유화제 첨가농도에 따른 유의적인 제타전위차를 보이지 않았지만(p>0.05), 초 고속균질시 제타전위가 낮았던 에멀젼(20%와 25% 첨가) 의 제타전위차를 상승시키는 효과를 보였다. 콜로이드 입 자는 전하를 띠며 용액 안에서 전기적 이중층을 가지며, 콜로이드 입자와 접한 고정층의 전위와 분산매 전위의 차 이를 제타전위차라고 한다. 제타전위차는 입자사이의 반발 력이나 인력(응집력)의 크기에 대한 단위로 절댓값이 클수 록 반발력이 커서 안정성이 증진되며 작으면 분산상끼리 응집력이 커져서 안정성이 떨어지는 경향을 보인다(Jo et al., 2014).
입자크기는 초고압균질 된 에멀젼은 모두 150 nm 이하 로 나노수준으로 감소되었으며, 유화제 HLB 값에 관계없 이 첨가농도가 높아질수록 유의적으로 감소하는 경향을 보 였다(p<0.05). 유화제 HLB값과 상관없이 20%와 25% 유 화제 첨가 에멀젼의 경우 100 nm 이하로 측정되었다. 입자 분산도의 경우 모든 에멀젼이 0.2 이하로 측정되어 단분산 상에 가까운 분산상태로 관찰되었으며 유의적인 차이가 없 었다(p>0.05). 콜로이드 용액의 입자분산도가 0.3 이상이면 높은 heterogeneity를 보여 다분산상 상태라 할 수 있다 (Verma et al., 2003). 초고압균질 된 EPO/W 에멀젼에서 EPO 포집효율은 모두 80% 이상으로 높게 측정되었으며, 유화제 첨가농도 및 HLB값의 변화와 유의적인 관계가 보 이진 않았다.
초고속균질만 했을 경우에는 EPO/W 에멀젼의 입자특성 이 유화제의 첨가농도 및 HLB값에 대한 영향을 받았지만, 초고압균질을 했을 경우 입자의 제타전위 및 분산도는 유 화제 HLB값에 대한 영향은 거의 없었고, 유화제 첨가농 도가 증가할수록 입자크기가 감소하는 경향을 보였다. 여 러 연구논문에서 관찰되었듯이 초고압균질은 에멀젼 입자 의 분산도 향상과 나노수준으로 감소시키기에 효과적임이 관찰되었다(Jafari et al., 2006; Jafari et al., 2007; Pinnamaneni et al., 2003).
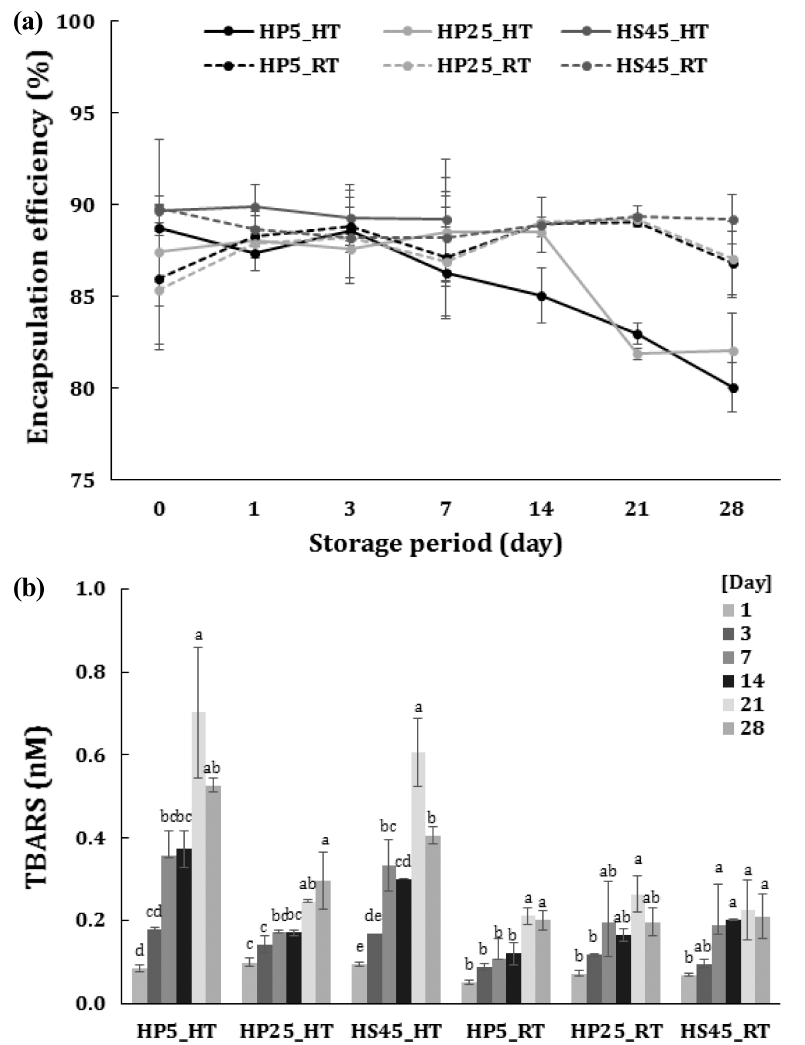
온도에 대한 EPO/W 에멀젼의 안정성을 관찰하기 위해 초고속균질 혹은 초고압균질로 제조 시 유상과 수상이 가 장 오랜 시간 동안 분리되지 않은 처리군을 선택하였다. 유화제 HLB는 12이며, 초고속균질로 제조한 경우는 45% 첨가 에멀젼(HS45), 초고압균질로 제조한 경우는 최저농도 5% (HP5)와 최고농도 25% (HP25) 첨가 에멀젼이었다. 세 가지 EPO/W 에멀젼(HS45, HP5, HP25)을 상온(RT)과 40°C (HT)에서 보관하면서 입자특성(Fig. 2) 및 포집효율(Fig. 3a)과 지방산패정도(Fig. 3b)를 28일 동안 관찰하였다.
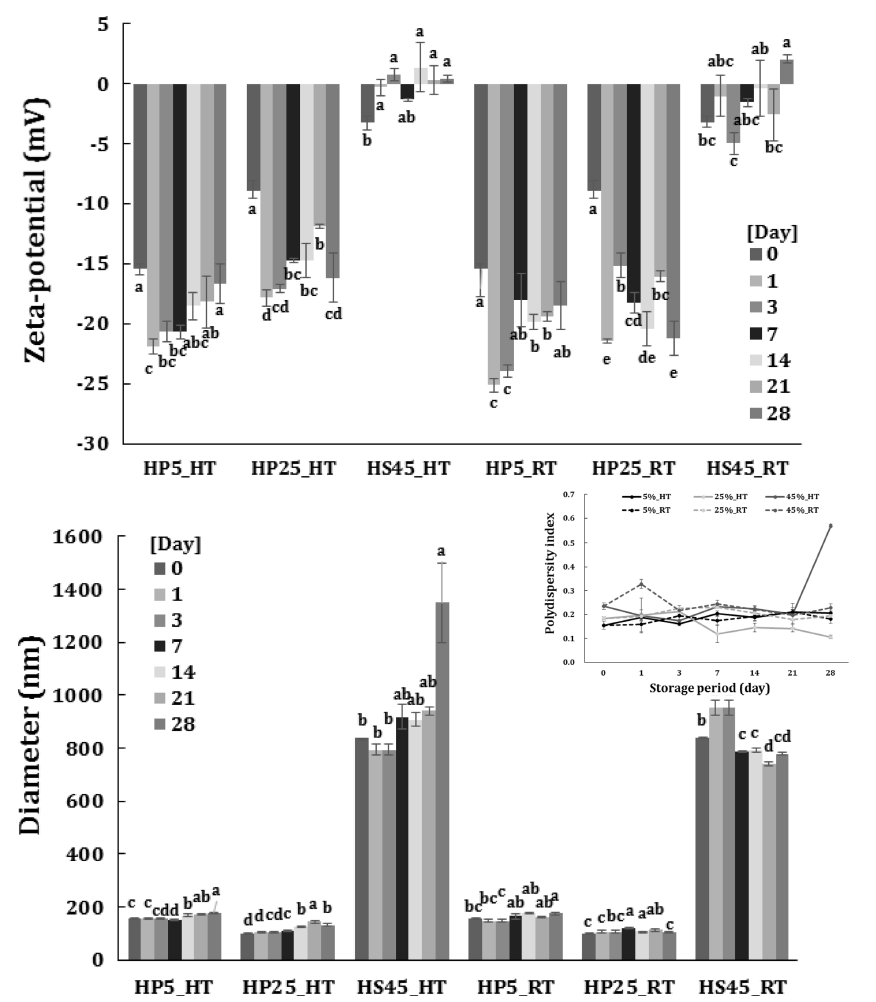
초고압균질법으로 제조된 에멀젼(HP5, HP25)이 초고속 균질법으로 제조된 에멀젼(HS45)보다 제타전위차 절댓값이 높았다. 40°C와 상온에서 저장한 HP5와 HP25는 모두 제 조 24시간 후 일시적으로 제타전위차 절댓값이 유의적으로 증가(p<0.05) 한 후 저장시간에 따라 감소하는 경향을 보 였다. HS45의 경우 HP5와 HP25에 비해 유의적으로 제타 전위차가 낮았으며, 40°C에서 저장한 경우 저장기간 동안 음의 전하에서 양의 전하로 변화하였다. 세가지 EPO/W 에멀젼(HS45, HP5, HP25) 입자크기는 저장기간 동안 모 든 에멀젼에서 저장초기보다 유의적으로 증가하였으나 (p<0.05), 초고압균질로 제조된 경우 평균 200 nm 수준을 유지하였으며, HS45는 40°C에서 저장했을 때 초기보다 500 nm 이상 증가하였다. 다른 에멀젼과 다르게 HS45를 상온에서 저장했을 때 유의적으로 입자크기가 감소하는 경 향을 보였다(p<0.05). 입자분산도를 살펴보면 저장 7일 이 후 25°C 저장한 HS45의 경우 다소 감소하는 경향을 보이 나 40°C에서 저장한 HS45는 지속적으로 증가하였다. 이러 한 입자분산도의 변화는 입자크기 증가에 영향을 준 것으 로 판단된다.
에멀젼은 열역학적으로 불안정하며 외부환경에 의해 파 괴될 수 있다. 대부분 기계적인 충격, 온도, 첨가물, 저장시 간 등에 의해 에멀젼은 creaming, flocculation, coalescence 등의 불안정화 단계를 거쳐 파괴된다(Lee & Yoo, 2014). 에멀젼을 완전히 파괴하여 물과 기름을 분리하지 않는 경 우 특정 온도에서 O/W형에서 W/O형으로 또는 W/O형에 서 O/W형으로 바꿀 수도 있다. 주로 유화제로 사용되는 비이온계면활성제는 친수성, 소수성을 여러 가지로 변화를 줄 수 있으며, 온도가 증가됨에 따라 친수성이 약해지고 소수성이 강해지는 성향을 보이며 계면에 접한 각도가 변 화한다(Gupta et al., 2016). 비이온계면활성제의 이러한 특 성은 보관온도에 따라 에멀젼의 입자크기 및 입자분산도를 증가시켜 저장기간에 따라 유화안정성을 감소시키며, 특히 초기 입자크기 및 입자분산도는 에멀젼 파괴속도를 가속화 시킨다.
40°C와 상온에서 저장하면서 EPO/W 에멀젼 포집효율 및 TBARS값을 측정한 결과는 Fig. 3과 같다. 포집효율은 저장기간 동안 모두 80% 이상을 나타내면 높은 포집율을 유지하였다. 그러나 HS45를 40°C에 저장한 경우 저장 7일 이후 유상과 수상이 분리되었다. 초고속균질로만 제조된 HS45는 Fig. 2에 나타났듯이 낮은 제타전위차 절댓값과 1 μm 이상의 큰 입자크기는 분산상의 응집의 유도하여 에 멀젼 안정성을 떨어뜨리는 요인으로 판단된다(Jo et al., 2014). 또한 40°C에서 저장한 HP5와 HP25의 경우 상온저 장에 비해 유의적으로 감소하는 경향을 보였다(p<0.05).
저장온도에 따른 지방산화 정도를 알기 위해 TBARS를 측정한 결과 저장기간에 따라 모든 에멀젼에서 유의적으로 증가했으며(p<0.05), 높은 저장온도에서 더 큰 폭으로 증가 하였다. 에멀젼의 지방산화는 유상과 수상의 계면에서 발 생하고, 유화공정조건, 입자의 평균크기, 입자분산도, 온도 등에 의해 다양한 지방산패도를 보인다. 예를 들면, 유화공 정 중에 산소와 접촉하거나, 전단력에 의해 발생하는 과열 에 의해 일어나는데 에멀젼 제조 시 이용된 에너지에 의해 발생하는 과열정도가 다를 수 있다(Carabin et al., 2014). 본 연구에서 이용된 초고압 균질의 경우 더 큰 전단력이 발생하여 에멀젼의 온도는 높일 수 있으나 균질 중 냉각장 치로 온도변화를 통제하였기 때문에 유화조건에 의한 차이 는 없지만, 25°C와 40°C의 저장온도 차이에 의해 영향을 받은 것으로 판단한다. 또한 일부 연구에서는 입자크기가 작을수록 계면이 넓어지고 산소 및 수상과 접촉할 기회가 증가하기 때문에 지방산화가 더 일어난다고 발표하였으며 (Gohtani et al., 2007; Lethuaut et al., 2002; Azuma et al., 2009; Lee et al., 2011) 이와는 반대로 입자크기가 작을수록 지방산화로부터 안정하다고 발표한 연구도 있 다(Nakaya et al., 2005; Imai et al., 2008; Atares et al., 2012). 본 연구에서 제조한 HS45의 경우 입자크기가 800 nm 이상의 큰 입자크기지만 25°C의 저장온도에서는 평균 200 nm 수준의 HP5, HP25와 차이를 보이지 않았다. 즉 입 자크기차이 만으로는 지방산화 정도에 직접적인 영향을 주 지 않는 것으로 판단된다(Osborn & Akoh, 2004;Dimakou & Kioas, 2007).