서 론
우리나라의 전통 식품 중 하나인 콩은 된장, 간장 등의 발효식품 및 두부, 콩나물, 콩가루 등의 비발효 식품까지 그 용도가 다양하게 사용되고 있으며, 최근에 암을 비롯 한 성인병을 예방할 수 있는 기능성 식품으로 각광 받기 시작하였다. 콩에는 독특한 기능성을 갖는 많은 생리활성 물질이 존재하는데, 이 중 이소플라본(isoflavone)이 대표적 이다. 이소플라본은 식품에서 발견되는 식물성 에스트로겐 (phytoestrogen)으로 에스트로겐과 유사한 생리활성을 나타 내며 장내균총에 의해 생리활성을 나타내는 피토케미컬 (phytochemical)이다(Kim et al., 2010). 콩의 이소플라본은 다이드제인, 제니스테인, 글리시테인 3종류의 비배당체 (aglycone)와 각각의 배당체(glycoside)인 다이드진(daidzin), 제니스틴(genistin), 글리시틴(glycitin) 그리고 말로닐배당체 (malonylglucoside), 아세틸배당체(acetylglucoside)를 포함하 여 12종류의 존재가 확인되었다(Shigemitsu et al., 1991). Xu et al. (1994)과 Adlercreutz (1995)의 연구에 따르면 이소플라본의 화학구조의 차이에 따라 다양한 생리기능성 을 나타내며, 유방암, 대장암, 자궁암 등의 억제효과가 탁 월하고 동맥경화 및 LDL콜레스테롤 감소, 순환기질환 및 골다공증 등 만성 질환의 예방효과가 높다고 보고된 바 있다(Peterson & Barnes, 1991;Clarkson et al., 1995;Anthony et al., 1998). 이소플라본은 식품 중에서 대부분 이 배당체 형태로 존재하며, 비배당체 형태의 이소플라본 이 체내에서 배당체 형태보다 빠르게 흡수된다고 보고되 어 있다(Setchell et al., 1999;Izumi et al., 2000). 그러므 로 체내흡수율을 높일 수 있는 비배당체 형태로 전환하는 생물전환(bioconversion) 기술이 필요하며, Lactobacillus plantarum와 Bifidobacterium longum 등 미생물을 이용한 이소플라본 비배당체 전환 연구가 이루어지고 있다(Cho et al., 2009;Kim et al. 2010).
콩 종실은 형태학적으로 종피(seed coat), 자엽(cotyledon), 배(embryo)로 구성되어 있는데 각 부분의 비율은 자엽이 90-92%, 종피가 6-8%, 배는 2% 정도에 달한다(Berhow et al., 2006). 각종 생리활성 물질은 콩 종실의 부위에 따라 많은 함량 변이를 나타내며, 특히, 콩의 이소플라본은 종피 나 자엽에 비해 배아에 함량이 훨씬 높은 것으로 알려져 있다. 미국의 Berhow et al. (2006)의 연구결과에 따르면, 이소플라본은 자엽에 0.13-0.35%, 배아에는 0.97-2.07%가 함유되어 있다고 하였다. 그러나 콩의 배아는 콩 관련 가공 제품을 생산하는데 불리하여 콩의 종피와 배아를 제거하고 콩 제품을 생산하고 있는 실정이다. 한편, 최근 콩에 함유 된 소야사포닌의 혈중 콜레스테롤 감소효과, 항산화활성, 항 바이러스, 간독성 물질제거, 항종양활성, 면역증진 효과 등 여러 생리활성 기능이 밝혀지면서 기능성 소재로 주목을 받 고 있다(Yang et al., 2015). 콩에 함유되어 있는 소야사포닌 (soyasaponin)은 비배당체인 soyasapogenol A, B, E 및 2,3- dihydro-2,5-dihydroxy-6-methyl-4H-pyran-4-one (DDMPA) 와 이들에 부착되는 당에 의하여 다양하게 분류된다. A계 열을 Aa, Ab, Ad, Ae, Af로, B계열은 DDMP가 부착된 αg, βg, βa, γg, γa와 DDMP가 부착되지않은 Ba, Bb, Bb', Bc로, E계열은 Bd와 Be로 구분한다. A계열 소야사포닌은 종실의 배 부분에만 존재하고 콩가공식품의 쓴맛, 떫은맛 등의 불쾌한 맛을 나타내고, B계열 소야사포닌은 배와 자 엽에 존재하고, 콩이 나타내는 대부분의 생리활성에 중요 한 역할을 하는 것으로 알려져 있다(Yang et al., 2015).
본 연구에서는 대두 가공시 부산물로 발생하는 콩배아를 미생물을 이용한 발효방법을 통해 생체내 흡수능이 우수한 형태인 비배당체 형태로 변화시키고자 대표적인 유산균인 Lactobacillus를 이용하여 발효시킨 후, 이소플라본이 비배 당체 형태로 변환 하는 정도를 확인함으로써 콩배아 발효 의 적합 조건을 선정하고, 이 조건에서 소야사포닌의 변화 도 분석 하였다.
재료 및 방법
콩배아 이소플라본의 비배당체화를 위해 본 실험에서 사용한 콩배아는 ㈜정식품(Cheongju, Korea)에서 구입하 여 사용하였다. 이소플라본 표준품인 다이드제인, 글리시 테인, 제니스테인, 다이드진, 글리시틴, 제니스틴은 Sigma Chemicals Co. (St. Louis, MO, USA)에서 구입하였으며, 아세틸배당체와 말로닐배당체들은 Nacalai tesque (Nijo Karasuma, Nakagyo, Kyoto, Japan)에서 구입하여 사용하였 다. 소야사포닌표준품은 ChemFaces (Wuhan, China)에서 구입하여 사용하였으며, 이소플라본과 소야사포닌 분석을 위한 이동상 용매는 HPLC grade를 사용하였고, 기타 실험 에 사용한 시약은 1급 이상 시약을 사용하였다.
발효에 사용한 균주는 Lactobacillus acidophilus KCCM 32820 (LA), Lactobacillus delbrueckii subsp. bulgaricus KCCM 35463 (LB)와 Lactobacillus plantarum KCCM 11322 (LP)의 3종의 균주를 한국미생물 보존센터에서 분양 받아 실험에 사용하였다. 보존용 배지로는 MRS broth 배지 (Oxoid, Hampshire, England)를 사용하였으며, 균주 배양은 MRS broth 배지에서 38°C에서 24시간 동안 배양하였다.
콩배아 발효를 위하여 사용할 유산균의 1차 균주 배양은 증류수 100 mL에 5.2 g의 MRS broth를 넣어 5.2%(w/v) MRS broth 배지를 만들고 살균한 후 균주를 0.2% 접종하 여 38°C에서 24시간 배양하였으며 같은 조건에서 2차 계 대배양 하였다(Lee et al., 2013). 이렇게 배양한 LA, LB, LP 균주는 증류수 38 mL에 콩배아 분말 4 g을 넣고 5% 접종하여 38°C에서 일정 시간 발효하였다. 또한 발효액의 초기 pH의 영향을 알아보기 위하여 pH를 3, 4, 5, 6으로 조정하여 발효하였다. 발효가 끝난 후 동결 건조(EYELA FD1; Rikakikai Co. Ltd., Tokyo, Japan)하고 냉동고에 보 관하여 분석실험에 이용하였다. 이소플라본의 비배당체 전 환율은 다음 식을 이용하여 구하였다.
발효 콩배아 추출분말에 함유된 이소플라본 함량 분석은 Tsangalis et al. (2002)의 방법을 변형하여 분석하였다. 동 결건조한 발효 콩배아 분말로부터 이소플라본을 추출하기 위하여 시료무게 20배의 헥산으로 상온에서 2시간 교반하 고 7,800 rpm으로 10분간 원심분리하여 상등액을 제거하고 후드에서 건조시킨 후 헥산과 동량의 메탄올를 넣고 1시간 동안 초음파 추출 후 7,800 rpm으로 10분간 원심분리하여 상등액을 회수하였다. 회수된 상등액을 0.2 um PTEE syringe filter (Thermo Scientific, Rockwood, Germany) 로 여과하여 UHPLC 분석 시스템(Waters, Milford, MA, USA)으로 분석하였다. 컬럼은 HALO C18컬럼(Advanced Materials Technology, Inc. Wilmington, DE, USA, 2.1×100 mm, 2.7 μm)을 사용하였으며, 이동상으로는 0.1% acetic acid를 함유한 증류수(HPLC grade, 용매 A)와 0.1% acetic acid를 함유한 acetonitrile (HPLC grade, 용매 B)를 사용하 였다. 유속은 0.3 mL/min이었고, 이동상 조건은 0 min, 10% B; 2 min, 30% B; 27-27.5 min, 50% B이었으며, UV검출기(254 nm)에서 정량하였다. 이때 컬럼 온도는 35°C였으며 주입량은 2 μL이었고, 크로마토그램 데이터는 Empower personal software (Waters)를 사용하여 분석하였다.
소야사포닌을 분석하기 위하여 동결건조한 발효 콩배아 분말 시료를 이소플라본 분석 시료 전처리 방법과 동일한 방법으로 추출하고, 0.2 um PTEE syringe filter로 여과하여 UHPLC-CAD 분석 시스템(Dionex Ultimate 3000, Thermo Scientific)으로 분석하였다. 컬럼은 an AcclaimTM RSLC Polar AdvantageII (2.7 μm, 120 Å, 2.1×150 mm) column 을 사용하였으며, 이동상으로는 0.1% acetic acid를 함유한 증류수(HPLC grade, 용매 A)와 0.1% acetic acid를 함유한 acetonitrile(HPLC grade, 용매 B)를 사용하였다. 유속은 0.5 mL/min이었고, 이동상 조건은: 0 min 20% B, 1-3 min, 30% B; 5 min, 45% B; 35-40 min, 90% B이었으며, 컬럼 온도는 40°C였으며 주입량은 1.3 μL이었고 시료 주입전에 9.9분간 초기 조건을 유지하였다.
결과 및 고찰
유산균 LA, LB, LP균과 LB, LP(1:1) 혼합균주 5%를 콩배아 분말에 접종하여 24시간 발효시키고 동결건조한 콩 배아 분말의 이소플라본 분석 결과를 Table 1에 나타내었 다. 균주의 종류에 관계 없이 총이소플라본 함량은 13.26- 14.04 mg/g로 비슷한 경향을 보였으며 유산균을 접종하지 않은 대조군은 글리시틴 >다이드진 >제니스틴 순으로 가 장 높은 함량을 나타내었고 다음으로 말로닐배당체가 높았 으며, 아세틸베당체와 비배당체가 가장 낮은 함량을 나타 내었다. 유산균을 접종하여 발효시켰을 때 배당체함량은 감소하였고, 비배당체 함량이 증가하였으며, 12%의 비배당 체 전환율을 나타낸 LA를 제외한 나머지 유산균들의 경우 에는 약 45%의 비배당체 전환율을 나타내었으며 각각의 함량은 다이드제인 >글리시테인 >제니스테인 순이었다. 특 히, 대조군과 비교하여 유산균으로 발효시켰을 때 다이드 진의 함량이 가장 크게 감소하였으며, 다이드제인 함량이 가장 크게 증가하였다. LB와 LP(1:1) 혼합균의 경우 비배 당체 전환율은 대조군과 LA균 보다는 높았지만 LB, LP 단독균을 이용하여 발효한 것보다는 낮았다.
|
Kim et al. (2013)은 대풍콩 종실의 총이소플라본 함량은 1.38 mg/g이었으며, 제니스테인 >다이드제인 >글리시테인 순으로 함량은 0.60, 0.14, 0.64 mg/g이었으나 콩 배아의 총이소플라본 함량은 10.39 mg/g이었다고 보고하였다. 본 연구에서는 LP균을 이용한 발효에서 총이소플라본 함량은 13.85 mg/g이었으며, 다이드제인은 3.46 mg/g, 글리시테인은 1.98 mg/g, 제니스테인은 0.85 mg/g이었다. 대두 종자에는 약 0.3%의 이소플라본 성분이 대부분 배당체 또는 말로닐 배당체의 형태로 존재하며, 아세틸배당체 및 비배당체는 매 우 적게 함유되어 있다고 보고되어 있다(Wang & Patricia, 1994). 콩배아의 경우에도 대부분이 배당체로 존재하였으며 아세틸배당체가 매우 적게 함유되어 있었다.
LP균주의 접종량을 달리하여 발효시켰을 때 이소플라본 함량변화를 Table 2에 나타내었다. 대조군의 비배당체함량 은 총이소플라본 함량대비 9.1%이었지만 LP균을 2.5% 접 종하였을 때 전환율은 41.6%로 급격하게 증가하였으며 접 종량 5% 에서 45.5%로 최대 전환율을 보였고 그 이상에 서는 다시 감소하였다. LP균주가 5% 접종에서 가장 높은 전환율을 나타내었으므로 이후 실험에서는 5% LP균을 사 용하여 실험을 진행하였다.
|
LP균을 이용하여 콩배아의 이소플라본을 비배당체화하기 위한 발효 시험에서 발효시간에 따른 비배당체 전환율을 조 사하였으며 그 결과를 Table 3에 나타내었다. LP균의 비배 당체 전환율은 24시간일 때 45.4%이었으며, 48시간과 72 시간에서는 다소 감소하였고 96시간에는 47.7%로 소량 증 가하였다. 총이소플라본 함량을 고려하지 않은 비배당체만 의 총함량은 24시간에서 가장 높았다. 24시간에 비배당체 중 다이드제인이 가장 높았고, 다음으로 글리시테인이 높 았으며 제니스테인이 가장 낮은 함량을 나타내었다. Kim et al. (2010)은 대두 추출분말을 Lactobacillus plantarum KCTC 3108로 발효시켰을 때 배당체 형태의 이소플라본이 서서히 감소하여 12시간 이후에 급격히 감소하였고, 비배 당체는 24시간까지 급격하게 증가하였고 이후 48시간까지 서서히 증가하였다고 보고하였다. Cho et al. (2009)은 17 가지 유산균을 이용한 soymilk에 대한 발효 시험 결과에 따르면 유산균 종류에 따라 비배당체화는 달랐으며 다이드 제인 함량은 0.057-1.089 mg/g이었고, 제니스테인 함량은 0.004-0.917 mg/g이었다. 특히, 본 연구에서 사용한 균주와 비슷한 L. plantarum ATCC 8014, L. plantarum L155, L. acidophilus KCNU을 이용한 발효 시험 결과 다이드제인 함량은 균주별로 각각 0.638, 1.033, 1.053 mg/g이었으며, 제니스테인 함량은 0.327, 0.881, 0.899 mg/g으로 다이드제 인 함량이 높았다. 본 실험에서는 LB와 LP균을 이용한 24 시간 발효 후 비배당체인 다이드제인 함량은 3.51, 3.46 mg/g으로 가장 높았으며, 글리시테인 함량은 1.88, 1.98 mg/g, 제니스테인 함량은 0.87, 0.85 mg/g으로 Cho et al. (2009)의 시험 결과와 비슷한 경향을 보였다.
|
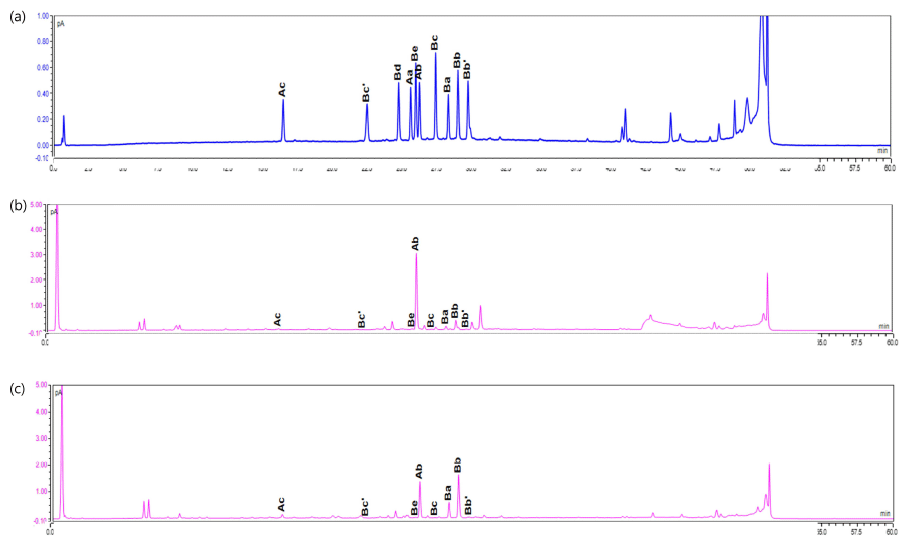
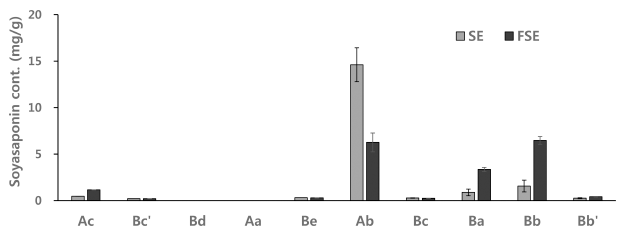
이소플라본 비배당체화의 최적 조건으로 발효한 콩배아 의 소야사포닌을 HPLC를 이용하여 분석하였다. 12개의 A 계열과 B계열 E계열 소야사포닌 표준물질에 대한 크로마 토그램(a), 콩배아(SE)의 소야사포닌 크로마토그램(b)과 LP 균을 이용하여 발효한 콩배아(FSE)의 크로마토그램은 Fig. 1과 같으며, 소야사포닌 함량 분석 결과를 Fig. 2에 나타내 었다. 콩배아는 소야사포닌 Ab가 가장 많았으며 다음으로 Bb, Ba, Ac순이었다. LP균을 이용하여 발효한 콩배아의 경 우 Ab함량은 SE에 비하여 2배 정도 감소하였고, 생리활성 이 높은 B계열이 증가하였으며, 특히, Bb와 Ba가 각각 4 배, 3.7배가 증가하였다. 이와 같이 발효시 소야사포닌 Ba 와 Bb가 증가하는 것은 소야사포닌 A계열의 deglycosylation 에 의한 것으로 Aa와 Ab가 구조적으로 소야사포닌 Ba와 Bb와 비슷하여 이들 함량이 증가한다고 보고되었다(Rickert et al., 2004, Hubert et al., 2008). Fig. 3
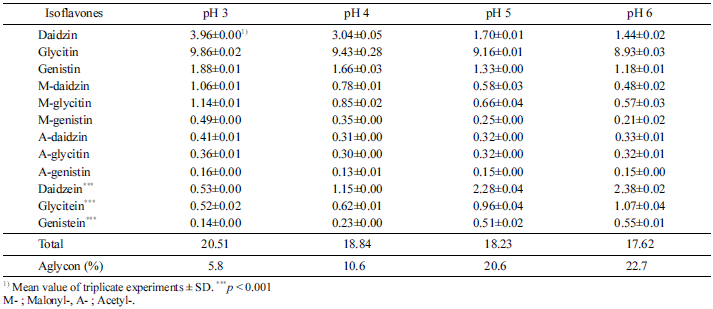
LP균주를 이용한 콩배아의 이소플라본 비배당체화 발효 시험에서 발효액의 pH가 이소플라본 비배당체화에 미치는 영향을 조사하였으며 그 결과를 Table 4에 나타내었다. 시 험결과 발효액의 pH가 3에서 5까지 증가할수록 비배당체 화 효율은 급격하게 증가하였으며, 이후 pH 6에서는 pH 5 에 비하여 소량 증가하여 발효액의 pH가 콩배아 이소플라 본 비배당체화에 많은 영향을 미침을 알 수 있었다. pH 3 에서 비배당체 함량은 전체 이소플라본 함량 대비 5.8%이 었으나 pH 6에서는 4배 정도가 증가한 22.7%였다. 발효액 의 pH가 증가할수록 다이드진 함량이 가장 크게 감소하였 으며 아세틸제니스틴은 거의 변하지 않았다. 비배당체 중 에서는 다이드제인이 가장 많이 증가하였으며 다음으로 글 리시테인, 제니스테인순 이었고 아세틸배당체는 거의 전환 되지 않았다.
|
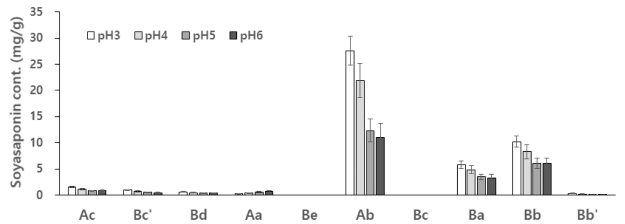
소야사포닌은 pH가 증가할수록 모든 계열의 소야사포닌 은 감소하였으며, 특히 A계열의 함량이 급격히 감소하였고, pH 6에서는 B계열의 총함량이 10.06 mg/g으로 A계열의 8.0 mg/g보다 높았다. pH가 증가할수록 Ab는 급격하게 감 소하였으며 Ba, Bb 함량도 발효액의 pH가 증가할수록 감 소하였으며 pH 5의 경우 pH 3보다 1.8배 감소하는 등 소 야사포닌 함량도 발효액의 pH 변화에 많은 영향을 받음을 알 수 있었다. 여러가지 유산균을 이용한 두유의 발효실험 결과 LP균의 경우 처음에는 pH 6.3 정도이었지만 3시간에 는 pH 6.0이었고 이때 균수가 가장 많았으며 그 이후 pH 는 급격하게 감소하여 6시간에는 pH 4.8 정도였으며 균수 도 크게 감소하는 등(Chun et al., 2008) pH 6에서 LP균이 가장 잘 성장하는 것으로 보고하였다. 본 실험 결과 pH 6에 서 가장 우수한 전환율을 나타낸 것은 Chun et al. (2008)의 보고와 같이 pH 6에서 LP균이 잘 성장하여 전환율이 높았 던 것으로 판단된다.
요 약
콩 가공 부산물인 콩 배아 이소플라본의 생체내 활성을 증가시키기 위하여 LA, LB, LP 등 3가지 유산균을 단독 또는 혼합하여 비배당체화 전환 효율을 증가시키고자 균주 의 종류와 접종량, 발효시간에 따른 이소플라본 함량을 분 석하였다. 그 결과 균주를 이용한 모든 발효에서 균주를 사용하지 않은 대조군에 비하여 높은 이소플라본 비배당체 전환을 보였고, 발효시간에 따른 비배당체 전환율은 24시 간에서 급격히 증가하였고 이후에는 큰 변화는 보이지 않 았다. 비배당체화 발효의 최적 균주는 LP균, 접종량은 5%, 발효시간은 24시간 이었다. 대조군의 이소플라본 배당체의 구성은 글리시틴>다이드진>제니스틴 순으로 가장 높은 함 량을 나타내었고, 유산균을 접종하여 발효시켰을 때 배당 체들은 감소하였고, 비배당체 함량이 증가하였으며, 다이드 제인>글리시테인>제니스테인 순으로 45% 이상의 비배당체 전환율을 나타내었다. 특히, 대조군과 비교하여 유산균으로 발효시켰을 때 다이드진의 함량이 가장 크게 감소하였고, 다이드제인 함량이 가장 크게 증가하였다. 소야사포닌의 경우 발효에 의하여 Ab가 급격하게 감소하였고 Ba와 Bb 가 증가하였다. 발효액은 pH 3에서 pH 6으로 증가함에 따 라 이소플라본 비배당체 함량이 증가하였으며 특히, 다이 드제인 함량이 많이 증가하였고, 소야사포닌 함량은 Ab 함 량이 급격하게 감소하였고, Ba와 Bb 함량도 소량감소하는 등 발효액의 pH가 발효에 의한 이소플라본과 소야사포닌 함량 변화에 많은 영향을 미치는 중요한 요인중의 하나임 을 알 수 있었고, LP균을 이용한 발효로 가공부산물인 콩 배아의 생리활성 증가 및 기능성소재화를 꾀할 수 있을 것 으로 생각된다.