서 론
생명공학(biotechnology)의 발전과 함께 생물체에 의해서 생산되는 생물고분자, 특히 탄수화물 고분자와 이의 유도 체들인 다당류는 일반적으로 10개 이상의 단당 그리고 여 기에 우론산(uronic acid) 등의 유기산이나 아미노당 등으 로 수식된 생체 고분자 화합물이다. 분자량, 구성당의 종류 , 결합순서, 결합양식, 결합위치 및 분지(branching) 유무 등에 따라 많은 종류가 존재하며 그 기원에 따라 식물, 동 물 및 미생물 다당류로 구분한다(Sinskey et al., 1986). 이 들 생물고분자는 주로 식물 및 미생물에 의해서 생합성 되 는데 미생물이 생산하는 다당류 또는 이의 유도체는 이미 알려진 식물 또는 해조류 유래의 천연다당류나 기타 합성 고분자와는 달리 독특한 기능성과 생리활성을 나타내며 적 당한 생산균주의 선택 및 배양방법의 개발로 대량생산이 가능하여 산업적으로 많은 관심을 받고 있다(Sandford & John, 1982;Wang et al., 2016). Streptococcus 속을 이용한 hyaluronic acid는 안과 수술용 viscosurgery 및 류마티스 치료의 lubricant로 이용될 수 있으며(Brunt, 1986;Hong et al., 2016), Pseudemonas elodea로 부터 생산되는 gellan gum은 신규 hetero 다당으로서 agar 대용의 겔화제로서 사 용될 수 있다(Moorhouse, 1987). 그리고 gellan gum과 유 사한 구조인 wellan 및 rhamsan도 각각 안정제 및 비료 현탁제로의 용도가 개발되었고, Leuconostoc mesenteroids 의 유전자 조작에 의한 변이주로부터 생산한 dextran (R4) 도 식품, 화장품, 의약품 등에서 우수한 성능의 신소재로서 사용될 수 있음이 밝혀졌다(Yalpani & Sandford, 1987). 또 한 곰팡이 및 담자균류의 다당류에서는 면역 증강 작용 및 항염증 작용 등을 나타내어 운지버섯인 Corioles vesicolar 로 부터의 다당유도체인 당단백질은 Krestin이라는 상품명 의 면역증강제로(Saleh et al., 2017), 유일한 양이온 다당 류인 chitosan에 대하여는 의약 및 식품에 대한 각종 용도 가 밝혀져 곰팡이류인 Mucorales를 이용한 산업적 용도 개발에 관한 각종 연구도 널리 수행되고 있다(Ramos Berger et al., 2018).
생물고분자의 다양한 기능성과 생리활성의 특이점에 관 한 연구는 물질특허 시대에 즈음한 유용물질생산의 국산화 측면에서는 물론, 신물질 개발의 균형있는 발전을 위해서 도 그 필요성은 매우 높다고 할 수 있다. Bacillus 속 균주 가 생산하는 생물고분자들은 오래 전부터 널리 연구되었으 며 동일 균종에서도 구조 및 특성이 다른 다당이 생산되는 흥미로운 현상들이 보고되어왔다(Shioda et al., 1971;Lee et al., 1991). 본 연구는 토양에서 유래한 Bacillus polymyxa YU-101 균주로부터 생합성된 생물고분자의 기능탐색에 있 어서 확인해야할 생물고분자의 이화학적인 특성을 조사하 였다.
재료 및 방법
본 실험에 사용한 전배양 및 생산용 배지는 가용성 전분 2%, soybean meal 1%, KH2PO4 0.2%, MgSO4 0.1%, NaCl 0.2%, CaCO3 0.2%로 조성한 배지를 121°C에서 15 분간 가압 살균하여 사용하였다. 접종균의 전배양은 균주 를 배지 20 mL를 함유한 100 mL 삼각플라스크에 1백금이 접종하고 30°C에서 12시간 진탕배양 하였다. 본 배양은 배 지 50 mL를 함유한 250 mL 삼각플라스크에 전배양액을 3%(v/v) 접종한 후 30°C에서 120 rpm으로 2일간 진탕배양 하면서 수행하였다.
배양액을 3배 희석하고 9000 g의 원심력으로 60분간 원 심분리 하여 균체를 제거하였다. 상층액에 3배 부피의 isopropyl alcohol (IPA)를 첨가하여 교반하면서 고점성의 섬유상 집합체를 얻은 후 진공건조하고 반복과정을 한 번 더 거친 후 crude biopolymer로 하였다(Minakami et al., 1984).
Crude biopolymer가 수용액 상태에서 음이온을 띠는 산 성당인 지, 전하를 띠지 않는 중성당인 지, 단백질이 결합 된 단백다당류 상태인 지를 확인하기 위하여 음이온교환수 지인 DEAE-cellulose에 0.5M HCl 용액을 가하여 천천히 유리봉으로 교반시키면서 계속 수세하였다. 여기에 0.5M NaOH 용액을 가하여 천천히 교반시켰고 이 과정을 반복 하여 행한 후 탈이온수로 중성이 될 때까지 수세하였다. 위와 같이 전 처리한 DEAE-cellulose를 column (2×50 cm) 에 충진하고 0.01 M phosphate buffer (pH 6)로 수세하였 다(Zweig & Sherma, 1982). 여기에 crude biopolymer를 0.01 M phosphate buffer (pH 6)에 녹여 충진하고 0.01 M phosphate buffer (pH 6)로 용출시킨 후 다시 2 M의 NaCl 용액을 사용하여 16 mL/h의 속도로 peristaltic pump (Pharmacia fine chemicals model P-1 peristaltic pump, Uppsala, Sweden)를 사용하여 단계 용출하였으며, fraction collector (HR 8046 Pharmacia Frac-100 fraction collector, Uppsala, Sweden)로 5 mL씩 분획하였다. 각 분획(fraction) 의 당은 phenol-sulufric acid법(Dubois et al., 1956)으로, 단백질은 UV 측정법(Zweig & Sherma, 1982)으로 UV detector (Pharmacia UV-1 FPLC detector, Uppsala, Sweden) 를 사용하여 280 nm에서 측정하였다.
끓는 물에 2-3시간 팽윤시킨 Sepharose CL-4B를 column (2.5×80 cm)에 충진하고 탈이온수 용액으로 평형시켰다. 별 도로 crude biopolymer를 탈이온수에 녹인 후 column에 충진시켰다. 탈 이온수의 용출속도는 21 mL/h로 용출하였 으며 fraction collector로 5 mL씩 분획하였다. 각 분획에서 얻은 당은 phenol-sulfuric acid법으로, 단백질은 UV detector (280 nm)로 측정하였다.
Crude biopolymer를 0.2%(w/v)가 되도록 증류수에 녹여 9000 g에서 30분간 원심분리하여 불용성 물질을 제거시켰 다. 이 용액에 최종농도가 0.4%(w/v)가 되도록 CPC를 첨 가하고 충분히 complex가 일어날 수 있도록 30°C에서 30 분간 방치시킨 다음 원심분리하여 침전물과 상층액으로 분 리하였다. 침전물(산성당)은 여러 번 증류수로 수세하여 1M의 NaCl로 용해하고 IPA로 재 침전시켰다. 이를 다시 증류수에 녹여 dialysis를 행한 후 동결건조하였다. 한편 상 층액(중성당)은 3배량의 IPA로 24시간 방치하여 침전시켜 시료로 하였다(Coura et al., 2012).
임계 염 농도는 Scott et al. (1955)의 방법에 따라 구하 였다. 농도 (0.1-0.5 M)를 달리한 2종의 염(NaCl, CaCl2) 용액 5 mL에 CPC 1.0 mg과 시료 0.5 mg을 넣고 혼합한 후 30°C에서 30분간 방치하여 CPC complex가 충분히 일어나 게 하였다. 원심분리한 후 상층액에 남아 있는 CPC 농도를 spectrophotometer (UV/VIS Scanning Spectrophotometer Du 530, Beckman Instruments Inc., Temecula, CA, USA) 로 260 nm에서의 흡광도를 측정하였으며 용액 중의 생물 고분자의 농도가 70%를 유지하는데 요하는 염용액의 농도 를 임계 염농도로 하였다. 임계 염농도의 측정을 위한 흡 광도 값은 3회 반복 측정하였다.
가수분해 및 가수분해를 행하지 않은 crude biopolymer 시료를 0.1%(w/v) 농도의 시료용액으로 한 후 아미노산, 펩티드, 단백질 등의 존재 유무를 판단하기 위하여 중성으 로 pH를 조절한 1 mL의 시료용액과 1%의 ninhydrin 용액 을 가하여 끓는 물에서 2-3분간 가열하여 색의 변화를 관 찰하는 Ninhydrin 반응, 트리펩티드 이상의 펩티드에 대한 존재유무를 판단하기 위하여 1 mL의 시료용액에 biuret 시 약 4 mL를 가하여 20-25°C의 온도범위에서 30분간 방치한 색의 변화를 관찰하는 Biuret 반응, 당류의 유무를 판단하 기 위하여 1 mL의 시료용액에 Anthrone 시약 2 mL를 가 하여 발색반응을 관찰하는 Anthron 반응, 환원당의 존재유 무를 알기위하여 1 mL의 시료용액에 Fehling 시약 8 mL를 가하고 10분간 가열하여 색의 변화를 여러 당과 대조해 보는 Fehling 반응의 정색반응을 수행하였다(Lee et al., 1991).
총당은 phenol-sulfuric acid 법으로 비색정량 하였다. 즉, 시험관에 시료 1 mL와 5% phenol 용액 1 mL를 취하고 pipette으로 진한 황산(conc-H2SO4) 5 mL를 가한 후 잘 교 반하였다. 반응물을 20-30분 방치한 후에 490 nm에서의 흡 광도를 측정하여 glucose 용액의 표준곡선으로부터 정량하 였다.
Glucosamine은 Elson-Morgan 방법(Gornal et al., 1949) 에 의하여 비색 정량하였다. 즉 시험관에 시료 0.5 mL 를 취하고 증류수 1 mL와 acetylacetone 시약을 가하여 혼합 한 후 끓는 물에서 10분간 가열하였다. Ehrich's 시약 0.5 mL를 가하여 75°C에서 30분간 가열한 후 실온에서 냉각 시키고 95% ethanol 용액 2.5 mL를 가하였다. 30분간 방 치한 후 520 nm에서 흡광도를 측정하고 glucosamine의 표 준곡선으로부터 정량하였다.
Acyl group은 시험관에 시료 1 mL를 취하고 알칼리성 hydroxylamine 시약(2M hydroxylamine HCl과 3.5 N NaOH의 1 : 1 혼합용액) 2 mL를 가하였다. 1분 후 진한염 산을 증류수로 2배 희석한 용액 1 mL를 가하여 pH가 약 1.2가 되도록 하였고 FeCl3· 6H2O 10 g을 0.1 N HCl에 녹 여 100 mL로한 용액을 1 mL 가하여 200 rpm에서 원심분 리 하였다. 상층액을 취하여 540 nm에서 흡광도를 측정하 여 acyl group을 정량하였다(Matheson et al., 1980).
여기서 At는 시료의 흡광도, As는 acetyl choline chloride 의 흡광도, Cs는 표준시료의 농도, Ma는 acetyl의 분자량, Ws는 시료의 무게, Vs는 시료의 부피이다.
Pyruvic acid는 Duckworth & Yaphe (1970)의 방법으로 다음과 같이 정량하였다. 시료 생물고분자(2mg/mL)에 0.2 N HCl 용액 1 mL를 가하여 100°C에서 4시간 동안 가수분해 한 후 가수분해물 0.5 mL를 취하여 0.4 μm triethanolamine (6 N HCl로 pH 8로 조정한 것) 2.4 mL와 NaOH 용액 (2.5 mg/mL) 0.1 mL를 가하여 잘 혼합하고 증류수를 blank 로 하여 340 nm에서 흡광도를 측정하였다(Absi). 별도로 위 혼합용액에 lactate dehydrogenase 용액(2,000 U/mL) 20 μL를 가하여 10분간 방치한 후 340 nm에서의 흡광도를 측정하여(Absf) pyruvic acid를 정량하였다.
여기서, W는 생물고분자의 농도(mg/mL)이다.
Uronic acid는 carbazole-sulfuric acid 분석방법으로 측정 하였으며 galacturonic acid의 표준곡선으로부터 정량하였다 (McCoMb & McCready, 1952). 즉 진한 황산 6 mL에 시 료용액 1 mL를 가하여 100°C로 유지한 항온수조에서 20분 간 가열냉각하고 0.1% carbazole-alcohol 용액 0.2 mL를 가 하고 동일한 조건의 증류수를 blank로 하여 525 nm의 흡 광도에서 측정하였다.
Protein은 Lowry법(Lowry & Rosebrough, 1951)과 Kjeldahl법(Magomya et al., 2014)에 의해 정량했으며 Lowry법은 BSA (bovine serum albumin)의 표준곡선으로 부터 정량하였다.
정제시료를 2 N H2SO4로 100°C에서 8시간 가수분해하고, 가수분해물을 Ba(OH)2로 중화시켰다. 원심분리하여 상층 액을 얻은 다음 진공회전증발기에서 농축하였고, 농축액 은 Sep-Pak C18 (C18 cartridge, Waters Co. Taunton, MA, USA)과 membrane (0.45 μm pore)으로 여과하여 시료로 한 후 HPLC (Waters 486, Waters Co., Milford, MA, USA)로 구성당을 분석하였다. HPLC 분석은 column은 aminex carbohydrate column HPX-87P (7.8 mm×30 cm, Bio-Rad Laboratories Inc., Hercules, CA, USA)를 사용하 였고 용매는 degassed DDL H2O를 사용하였으며 유속은 분당 0.6 mL, detector는 RI (R401), column temperature는 85°C, injection volumn은 20 μL로 하여 표준당류와 용출시 간을 비교하여 분석하였다(Matsuhiro et al., 2006).
시료 0.1 g을 0.01M sodium metaperiodate 용액 100 mL 에 녹여 4°C의 암실에서 4일간 산화를 행하였다. Ethylene glycol 10 mL를 가하고 8시간 방치하여 과잉의 과요오드산 을 분해한 다음 dialysis bag (Spectra/Por 2, Spectrum Inc., Phoenix, AZ, USA)으로 dialysis를 행하였고, 산화물의 환 원은 0.1 g의 sodium-borohydride를 첨가하여 12시간 반응 시켜 행하였다. 환원반응의 정지는 acetic acid를 가하여 행 하였고, 다시 dialysis를 행한 후 동결건조하여 각각 산화 및 환원물로 하였다. 산화 및 환원물의 분석은 2 N H2SO4 로 100°C에서 8시간 가수분해한 후 BaOH2로 중화하고 Sep-Pak을 통과시킨 후 HPLC로 분석하였다. HPLC 분석 은 column은 Sugar pak Ι을 사용하였고 용매는 0.0001 M Ca-EDTA 용액을 사용하였으며 유속은 분당 0.5 mL, detector는 RI (R401), column temperature는 75°C, injection volumn은 20 μL로 하여 표준물질과 비교하여 분석하였다 (Lavavitch & Ray, 1974;Lee et al., 1998).
중화당량은 Scott (1960)의 spectrophotometry법에 따라 서 구하였다. 0.1% CPC (cetyl pyridinium chloride) 용액 1mL를 0.5 mg/mL의 시료 용액에 넣고 여기에 0.01M Na2SO4용액을 넣어 총부피를 3 mL로 하여 혼합하였다. 30°C의 항온수조에서 30분간 방치하여 CPC complex를 형성시킨 다음 3,000 rpm에서 10분간 원심분리하였다. 상 등액을 취하여 260 nm에서 흡광도를 측정(O.D. sample) 하였으며 시료 대신 증류수를 넣어 같은 방법으로 흡광도 를 측정(O.D. control) 한 다음 시료 1 mg과 결합하는 cetylpyridinium의 양(mg), x를 계산하였다.
여기서, C는 1 mL에 존재하는 시료의 양(mg)이며 시료의 중화당량은 cetylpyridinium의 당량(304)을 위의 식에서 구 한 x 값으로 나누어 구하였다.
Carboxyl group의 제거는 Taylor & Conrad (1972)의 방법 에 의하여 행하였다. 0.05%(w/v)의 시료를 0.1 N HCl로 pH 4.7이 되도록 조정하고 1-ethyl-3-(3-dimet-hylaminopropyl) carbodiimide 500 mg을 첨가하였다. 이를 0.02 N HCl로 다시 pH 4.7이 되도록 조정하고 3시간 동안 magnetic bar 로 저어주었다. 3시간 후 sodiumborohydrade (500 mg)와 n-octanol (one drop)을 첨가하여 overnight을 행하였으 며, dialysis를 행한 후 동결건조하여 carboxyl-reduced polysaccharide는 2 N H2SO4로 100°C에서 8시간 가수분해 하고 Ba(OH)2로 중화한 후 HPLC로 구성당의 분석조건과 동일한 조건으로 분석하였다.
결과 및 고찰
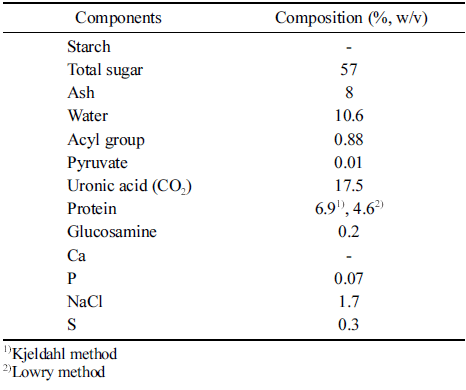
배양액으로부터 IPA로 침전하여 얻은 crude biopolymer (조생물고분자)의 성분조성은 Table 1과 같다. 총 당의 함 량은 57%이었으며, acyl group은 0.88%로 분석되었으며 uronic acid (CO2)는 17.5%로 분석되어 산성당이 존재함을 알 수 있었다. NaCl이 1.7%이었으며, glucosamine과 pyruvic acid는 극히 소량만이 존재하였고, 단백질은 Kjeldahl법에 의하면 6.9%, Lowry법에 의해서는 4.58%로 분석 되었다. 단백질 함량이 분석방법에서 차이가 있는 것에 대하여 Magomya et al. (2014)은 식물단백질의 단백질 함량을 두 가지 관점에서 분석하였다. Kjeldahl 질소 함량에 대하여 전환 계수 6.25를 사용하는(% N×6.25) 전통적인 Kjeldahl 법과 아미노산 잔기들(amino acid residues)을 총합한 단백 질 함량 분석결과를 비교하여 보았을 때, 6.25의 전통적인 전환 계수를 사용하는 Kjeldahl법은 시료의 실제 단백질 함량이 과대평가되었다고 보고하였다. 이에 근거하여 본 연구의 생물고분자의 단백질 함량은 Kjeldahl법보다는 단 백질을 염색하여 분석하는 Lowry법의 단백질 함량 분석결 과가 보다 정확할 것으로 판단되었다.
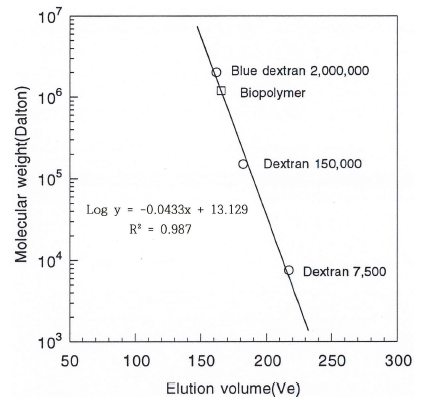
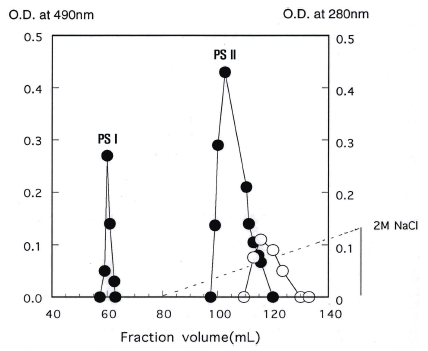
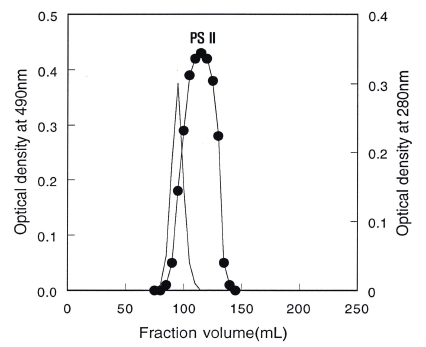
정제한 crude biopolymer를 DEAE-cellulose 음이온교환 수지를 이용하여 chromatography를 행한 결과는 Fig. 1과 같다. 용출구 분획에서 나타난 crude biopolymer 전체 양 의 5% (w/w) 정도의 PSI (polysaccharide I)은 중성당으로 판단되었고 95% 정도의 PSII는 흡착구 분획에서 나타나 음 이온 작용기를 갖는 산성의 고분자임을 알 수 있었다. 또한 crude biopolymer를 분석하였을 때(Table 1), 단백질이 4.6- 6.9%로 함유된 것으로 분석되어 crude biopolymer의 구조 에서 당과 단백질의 결착 여부를 확인하기 위해 흡착된 것 들을 2 M의 염으로 용출시켰을 때 산성 당은 0.5-0.8 M의 salt 농도에서, 단백질은 0.8-1.2 M의 염 농도에서 각각 용 출되어 단백질이 결합되어 있지 않은 생물고분자임을 알 수 있었다. 한편 sepharose CL-4B 수지를 분리용 column 으로 하여 gel chromatography를 행한 결과는 Fig. 2와 같 으며, 분자량을 추정하기 위해 분자량을 알고 있는 덱스트 란과 crude biopolymer의 gel chromatography를 행한 결과 를 Fig. 3에 나타내었다. Fig. 2에서 보는 바와 같이 crude biopolymer는 한 종류(PSII)의 당만 검출되었다. 앞선 ion chromatography에서의 중성당(PSI)은 전체 biopolymer 양의 5% 정도의 소량이어서 용출구에서 검출 되지 않은 것으로 생각되며 단백질도 수지자체가 소량의 charge를 갖고 있어 수지에 흡착되어 검출되지 않은 것으 로 판단되었다. 이러한 결과들로 부터 단백질이 결합되지 않은 biopolymer임을 재차 확인할 수 있었다. 본 연구의 biopolymer의 분자량은 Fig. 3에서 알 수 있는 바와 같이 분자량이 대략 9.65×105 Da의 biopolymer인 것으로 판단할 수 있었다.
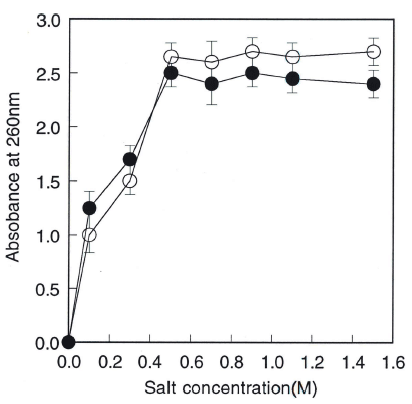
일반적으로 다가 음이온 특성을 갖는 산성 고분자는 여러 가지 4가 암모늄염 특히 양이온의 CPC (cetyl pyridinium chloride)와 물에 불용성인 착물(complex)을 형성하는 성 질을 보인다(Scott, 1960). 본 연구의 crude biopolymer의 구조가 당에 uronic acid가 결합되어 있는 다당류인지를 판단하고자 CO2 함량을 분석한 결과 17.5%가 함유되어 있는 것으로 확인되어(Table 1) uronic acid를 갖는 산성 당으로 판단되었다. 이를 재차 확인하기 위하여 crude biopolymer에 양이온인 CPC를 첨가한 결과에서도 biopolymer 수용액이 CPC와 착물형성을 보이면서 침전물과 상층액으로 분리되는 양상을 보여 이 고분자는 다가 음이 온적 특성을 갖는 산성 고분자임을 확신할 수 있었다. 일 반적으로 CPC-산성 고분자의 착물은 높은 무기염 농도에 서는 분해되어 다시 용해되는데 용해에 필요한 염의 임계 농도는 산성 고분자의 전하밀도가 클수록 높은 것으로 알 려져 있다. 이 임계농도는 산성 고분자의 CPC에 의한 분 리나 정제의 최초조건을 결정하는 중요인자이며 또 음이온 전하의 작용기를 판단하는 중요 기준이 된다(Scott, 1965). 따라서 분리정제 조건의 결정 및 음이온 작용기를 판단하 기 위해서 NaCl과 CaCl2의 염을 사용하여 염의 임계농도 를 검토한 결과를 Fig. 4에 나타내었다. 임계농도는 1가나 2가의 염 모두 0.4-0.5M의 농도범위로 나타나 carboxyl기 의 결합세기와 비슷하였다. 보통 많은 거대 음이온들의 CPC와의 결합세기는 의 순이며 sulfate 기를 갖는 해조류의 산성 다당류와 같은 경우는 2-3M의 높은 염의 임계농도를 갖는다(Constantopoluos et al., 1969). Fig. 4의 결과는 uronic acid가 검출된 Table 1의 결 과와도 일맥상통한 결과이다. 결과들로부터 산성 고분자를 정제할 때의 염농도는 임계농도보다 높은 1M (molarity) 의 농도로 하였다.
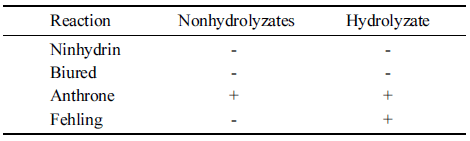
Crude biopolymer의 가수분해 전후 정색반응을 살펴본 결과를 Table 2에 나타내었다. Crude biopolymer는 가수분 해 전후 모두 당의 일반 정색반응인 Anthrone 반응에서 양성을 나타내어 당이 존재하였으며 가수분해 후 Fehling 반응에서 양성을 나타내어 환원성 당류임을 나타내었다. 또한 아미노산, 펩티드, 단백질의 유무를 확인하는 Ninhydrin 반응이나 트리펩티드 이상의 펩티드의 존재를 확인하는 Biuret 반응에 대한 정색반응에서는 음성을 나타 내었다.
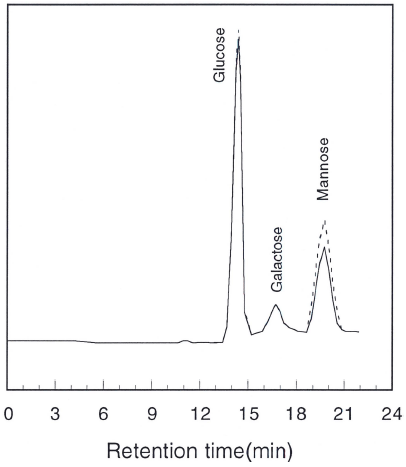
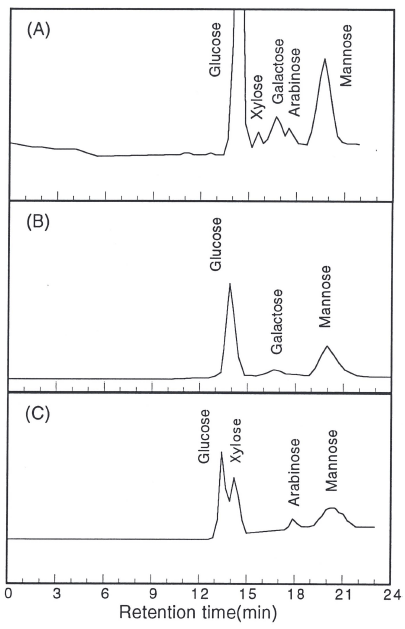
한편 조 생물고분자의 구성당을 확인하기 위해서 CPC 로 침전시켜 산성당(PSII)과 중성당(PSI)을 분리하여 투석 및 동결건조한 후 각각 가수분해하고 중화하여 HPLC로 분석한 결과는 Fig. 5와 같다. 전체 당의 약 5%를 차지하 고 있는 중성당(Fig. 5A)은 glucose, galactose, mannose로 구성되어 있었으며 95%를 차지하고 있는 산성당(Fig. 5B) 은 glucose, xylose, galactose, arabinose, mannose로 구성되 어 있었다. Crude biopolymer의 95%를 차지하고 있는 산 성당(PSII)의 molarity 비율은 glucose:xylose:galactose : arabinose :mannose = 32.8 : 0.48 : 8.91 : 1 : 24.98의 비율로 계 산되어 glucose, mannose와 galactose가 주요 구성당이라고 할 수 있었다.
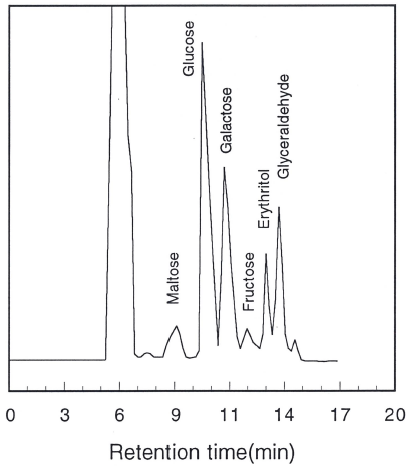
생물고분자의 당성분에 대한 당의 결합 양상을 보기 위 해서 Smith degradation법으로 처리하고 HPLC로 분석한 결과는 Fig. 6과 같다. Smith degradation에서는 당의 결합 양상이 1, 6 또는 1, 4 결합으로 이루어져 있을 때, 최종 산화환원물로 glycerol 및 erythritol이 생성되고, 1, 2 결합 및 1, 3 결합으로 이루어져 있을 때에는 glyceraldehyde와 glucose가 생성된다. 또한 1, 6 및 1, 4 결합의 chain에 2 번이나 3번 탄소 위치에 side chain이 존재하게 되면 side chain 연결 결합부위인 glucose는 산화되지 않고, 최종 산 화환원물로 glycerol이나 erythritol이 함께 생성된다(Breu, 1981). Fig. 6에서 볼 수 있는 바와 같이 crude biopolymer 의 최종 산화환원물로 glucose, glycerol, erythritol이 생성되 는 것으로 보아 1, 6 및 1, 4 결합으로 구성되어 있으며 2 번이나 3번 탄소 위치에 side chain이 존재하는 biopolymer 로 판단하였다.
Table 1의 결과에서 crude biopolymer의 uronic acid 함 량이 17.5%로 많은 부분을 차지하여 Taylor & Conrad (1972)의 방법에 따라 어느 당에 uronic acid가 결합되어 있는 지를 판단하기 위하여 carboxyl group을 제거하지 않 은 당과 carboxyl group을 제거하여 얻은 당을 각각 가수 분해하여 HPLC로 분석한 결과를 Fig. 7에 나타내었다. 가 수분해 하지 않은 당의 molarity 비율은 glucose :galactose : mannose = 1.78:1: 0.84이고 carboxyl group을 제거한 biopolymer의 구성 당의 molarity 비율은 glucose :galactose : mannose = 1.826:1:1.003으로 mannose가 약 0.16의 molarity 가 증가하여 mannouronic acid가 존재하는 것으로 추정하 였다.
Scott (1960)의 spectrophotometry법에 의하여 잔기 당 음 이온의 수를 측정하고자 시료와 증류수를 대조군으로 한 흡광도를 측정하여 중화당량을 구하였으며 그 값이 약 372로 나왔다. 이는 본 시료의 구성당이 6탄당이므로 평균 분자량을 162로 할 때 약 2.3 잔기 당 음이온이 한개 존 재하는 것을 알 수 있었다.
요 약
배양액으로부터 isopropyl alcohol로 침전하여 얻은 crude biopolymer를 gel chromatography와 음이온교환수지인 DEAE-cellulose로 ion exchange chromatography를 행한 결과 분자량은 대략 9.65×105 Da였으며 5%(w/w)의 중성당 (PSI)과 95%(w/w)의 산성 당(PSII)을 함유하고 있었다. Crude biopolymer의 총 당 함량은 57%, acyl group 0.88%, uronic acid인 CO2의 함량은 17.5%임을 알 수 있었다. CPC와 crude biopolymer와의 착물형성에 따라 NaCl과 CaCl2의 염을 사용하는 분리정제를 위한 임계농도는 두 가지 염 모두 0.4에서 0.5 M의 농도범위를 나타내었다. CPC를 사용하여 산성당과 중성당을 각각 분리하여 분석 한 결과 중성당은 glucose, arabinose, mannose를 함유하였 고 산성당은 glucose, xylose, galactose, arabinose, mannose 의 구성당을 함유하고 있었다. Crude biopolymer의 95%를 차지하고 있는 산성당(PSII)의 molarity 비율은 glucose: xylose:galactose : arabinose :mannose = 32.8 : 0.48 : 8.91 : 1 : 2 4.98의 비율로 계산되어 glucose와 mannose와 galactose 가 주요 구성당이라고 할 수 있었다. 당 결합 양상은 smith degradation 결과, product로 glucose glycerol, erythritol이 생성되어 1, 6 및 1, 4 결합으로 구성되어진 다당으로 추 정하였다. 중화당량은 372로 분석되어 2.3 잔기당 음이온 이 한 개 존재하는 biopolymer임을 알 수 있었다.