Article
효소처리에 따른 밀 배아 추출물의 2,6-dimethoxy-1,4-benzoquinone과 수용성 아라비노자일란 함량 변화
이재강, 이정훈, 최용현, 최용석, 류기형1,*
Changes in 2,6-dimethoxy-1,4-benzoquinone and Water Extractable Arabinoxylan Content of Wheat Germ Extract by Enzyme Treatment
Jae-Kang Lee, Jung-Hun Lee, Yong-Hyun Choi, Yong-Seok Choi, Gi-Hyung Ryu1,*
R&D Center, Sajodongaone Co., Ltd.
1Department of Food Science and Technology, Kongju National University
*Corresponding author: Gi-Hyung Ryu Department of Food Science and Technology, Kongju National University, Yesan, Chungnam 340-800, Korea Tel: +82-41-330-1484; Fax: +82-41-335-5944 E-mail:
ghryu@kongju.ac.kr
© Korean Society for Food Engineering. All rights reserved.
Received: Oct 16, 2018; Revised: Dec 24, 2018; Accepted: Jan 11, 2019
Abstract
This study was carried out using Celluclast 1.5L to increase the content of 2,6-DMBQ and water extractable arabinoxylan in wheat germ extract. Extraction temperatures were 30°C, 45°C and 60°C. The extraction times were 0, 6, 12, 18, 24 and 30 h. The pH of the extract decreased rapidly from 18 h at 30°C in both water- and enzyme-treated extracts. 2,6-DMBQ of water- and enzyme-treated extracts increased with the extraction time. At 30-hour extraction time, enzyme-treated extract increased 27.60% at 30°C extraction temperature than water extraction. Extraction temperatures of 45°C and 60°C were increased by 65.03% and 151.05%, respectively. The highest content of waterextractable arabinoxylan was 15.23±0.08 mg/g when the enzyme was treated at an extraction temperature of 60°C for 30 h. At 30=hour extraction time, enzyme-treated extract increased 7.92% at 30°C extraction temperature compared to water extraction. Extraction temperatures of 45°C and 60°C were increased by 31.20% and 54.38%, respectively.
Keywords: wheat germ; 2,6-dimethoxy-1,4-benzoquinone; water-extractable arabinoxylan
서 론
밀 배아는 밀의 제분을 통하여 밀가루를 생산하는 과정 에서 부산물로 생산되며, 순수한 배아만을 분리하여 생산 된다. 밀 배아는 밀 전체 중량의 2-3%에 해당하며 밀가루 의 저장 수명과 가공 품질에 좋지 않은 영향을 미치기 때 문에 제분 시 제거된다(Rizzello et al., 2010). 배아는 25% 단백질과 8-13%의 지방을 함유하여 비타민E의 중요한 공 급원이며 무기질 함량이 4-5%으로 영양상 우수한 식품소 재이다(Zuzana et al., 2009). 밀 배아의 항염 기능성과 관 련하여 밀 배아 유가 LPS로 자극된 대식세포에서 염증과 관련된 인자들에 가해지는 영향을 살펴본 결과 NF-B 및 MAPKs의 신호 경로 조절을 통한 염증성 인자들의 발현 감소로 항염 효과를 나타낸다고 하였다(Kang et al., 2016a). 그러나 밀 배아는 높은 지방 함량으로 산패가 발생하여, 밀 배아의 안정성을 증가시키기 위하여 열, 마이크로웨이 브, 압출성형 처리 등이 제시되었으나(Paradiso et al., 2008) 가공비용 증가로 인하여 대부분 사료로 이용되고 있 으므로 부가가치 향상을 위한 가공방법의 개발이 필요한 실정이다.
Celluclast 1.5L은 Trichoderma reesei 곰팡이에서 유래된 셀룰레이스로, 셀룰로스를 포도당과 셀로비오스로 분해하 고, β-glucosidase 등 글리코시드 가수분해에 관여하는 효 소를 생산하는 것으로 졌다(Rosgaard et al., 2006;Seong et al., 2008;Claassen et al., 2000). Choi et al. (2018)은 밀 배아에 Celluclast 1.5L을 처리하여 30시간 추출 시 총 페놀함량과 총 플라보노이드 함량이 증가하였고, DPPH 라 디칼 소거능과 ABTS 라디칼 소거능이 증가하여 항산화 활성을 나타냈다고 보고하였으며, Celluclast 1.5L은 주로 유기물을 가수분해 전처리 하여 발효 공정의 효율을 증가 시키기 위한 전처리에 주로 사용되고 있다(Ausiello et al., 2015).
2,6-Dimethoxy-1,4-benzoquinone (2,6-DMBQ)은 산화된 형태의 메톡시 하이드로퀴논으로, 올리고당에 연결되어 존 재한다(Hidvegi et al., 1999). 2,6-DMBQ는 밀 배아에 0.1 mg/g, 보리 배아에는 0.07 mg/g 들어 있는 것으로 보고되 었다(Tömösközi-farkas & Daood, 2004). 최근 밀 배아에서 퀴논화합물을 증가시키기 위하여 배당체로 존재하는 벤조 퀴논을 다양한 미생물로부터 기인되는 β-glucosidase로 분 리하여 생산하는 연구가 수행되었다(Yoo & Kim, 2010;Rizzllo et al., 2013). 이 퀴논 화합물은 항 증식성, 항 전 이성 및 면역학적 효과를 가지고 있는 것으로 알려졌으며 (Mueller et al., 2011), 밀 배아를 구연산 처리를 하여 2,6- DMBQ함량을 증가시킨 추출물로 항 염증 활성을 나타내 어(Kang et al., 2016b) 밀 배아의 2,6-DMBQ를 기능성 소 재로의 가능성을 제시하였다.
아라비노자일란은 밀의 세포벽을 구성하는 중요한 중합 체로 세포벽을 지지하는 역할을 하고 있다(Saulnier et al., 2007). 밀의 아라비노자일란의 기능성으로는 항염, 항암 및 알레르기 억제 효과가 있으며(Bae et al., 2004;Choi et al., 2017), 밀 배아에서 분리된 아라비노자일란의 면역세포 활성화 효과는 대식세포에서 분비되는 lysosomal enzyme 및 반응성 산소종의 생성과 연관이 있었다고 하였다(Choi et al., 2002). 최근 연구에 따르면 Celluclast 1.5L 효소 처 리 한 밀기울의 수용성 아라비노자일란의 함량이 0.32%에 서 7.14%로 크게 증가하였고, 대식세포의 활동을 증가시켜 항 염증 효과를 나타냈다고 보고하였다(Kang et al., 2016a). 밀 배아의 총 식이섬유 함량은 16.47 g/100g으로 알려져 있으나(Bansal & Sudha, 2011), 대부분의 연구가 비타민E에 집중되어 있으며 아라비노자일란 관련 연구는 미비한 실정이다.
본 연구는 밀 배아에 β-1,4 glucosidic linkage를 가수분 해하는 Celluclast 1.5L를 처리하여 추출 시간과 추출 온도 에 따르는 추출액의 pH 변화를 조사하고, 추출 건조물의 기능성 물질인 2,6-DMBQ및 수용성 아라비노자일란 함량 의 변화를 확인 하여 추출 공정의 효율성 확립을 목적으로 하였다.
재료 및 방법
실험재료
밀 배아 물 추출 건조물(water extract wheat germ, WEWG)과 Celluclast 1.5L 효소 처리 밀 배아 추출 건조물 (enzyme treated wheat germ, ETWG) 제조에 사용된 시료 는 밀 원맥을 제분하는 과정에서 부산물로 생산되는 밀 배 아(wheat germ, Sajo Dongaone Flour Mills Co., Dangjin, Korea)를 사용하였다. 추출에 사용된 효소는 Celluclast 1.5L (Celluclast 1.5L, Novozymes, Bagsvaerd, Denmark)를 사용하였다.
시료의 준비
밀 배아 50 g를 500 mL의 원심분리 튜브에 넣어준 다음 증류수 250 mL를 가하였다. 밀 배아 중량 대비 0.5%의 농 도로 Celluclast 1.5L 투입한 다음, 효소 활성 온도를 확인하 기 위하여 30°C, 45°C, 60°C로 설정된 항온수조(Maxturdy- 18, Daihan Scientific Co., Wonju, Korea)에서 각각의 추출 시간 동안 진탕 추출하였다. 추출이 종료된 직후 1,000×g 에서 15분간 원심분리(Union 5KR, Hanil Co., Incheon, Korea) 하였다. 원심 분리된 상등액을 여과지(Whatman 2, GE Healthcare, Little Chalfont, UK)를 사용하여 고형물을 제거하였다. 고형물이 제거된 상등액을 -70°C에서 6시간 동안 1차 동결 시킨 후 동결건조기(FD55, Ilshin Lab Co., Dongducheon, Korea)에서 -50°C까지 2차 감압 건조하여 분석용 동결건조 추출물을 제조하였다.
시료의 pH 측정
원심분리 후 여과된 추출액을 균질기(HG-15D, Daihan Scientific Co., Wonju, Korea)를 이용하여 3분간 균질화하였 으며, 균질화된 시료는 미리 보정된 pH 측정기(Model420, Thermo orion Co., Waltham, MA, USA)를 사용하여 측정 하였다.
시료의 2,6-DMBQ 정량
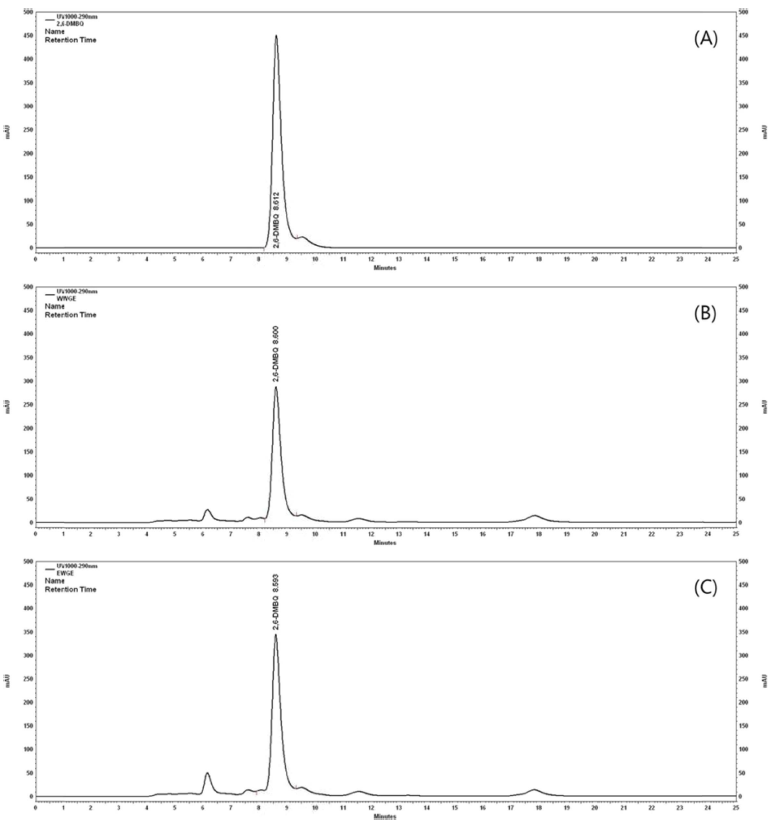
WEWG와 ETWG의 2-MBQ와 2,6-DMBQ 정량 분석은 Yoo & Kim (2010)의 방법에 따라 측정하였다. 추출 건조 물 1 g을 증류수 50 mL에 용해시킨 후, 클로로포름(Merck Millipore Co., Darmstadt, Germany) 100 mL으로 3회 분획 하였다. 분획된 클로로포름을 감압 농축기(N-1000, Eyela Co., Tokyo, Japan)를 사용하여 40°C에서 농축한 다음 20 mL의 HPLC 이동상 25 mM KH2PO4/acetonitrile (9:1, v/v, pH 4.8)으로 용해시켰다. 용해된 시료는 0.22 μm PTFE (Millex Simplicity, Merck Millipore Co., Carrigtwohill, Ireland)로 여과한 후 HPLC (Spectra System, Thermo electron Co., Waltham, MA, USA)로 분석하였다(Table 1). 분석용 컬럼은 Discovery Rp-amide C16 5 μm 250×4.6 mm (Supelco, Bellefonte, PA, USA)였다. 이동상의 유속은 0.7 mL/min으로 설정하였고, 컬럼의 온도는 70°C로 유지되 었다. 검출기는 자외선 검출기를 사용하였으며 290 nm로 분 석하였다. 정성 및 정량 분석 시 2,6-DMBQ (TCI Chemicals Co., Tokyo, Japan)를 표준물질로 사용하였다(Fig. 1).
Fig. 1.
HPLC Chromatogram of 2,6-DMBQ in wheat germ extract at water extract and enzyme-treated process.
(A) 2,6-DMBQ (standard); (B) Water extract wheat germ; (C) Enzyme treated wheat germ.
Download Original Figure
수용성 아라비노자일란
수용성 아라비노자일란(water extractable arabinoxylan, WEAX) 정량은 Douglas (1981)의 방법에 따라 측정하였 다. 50 mL 튜브에 시료를 125 mg 담고, 증류수 25 mL을 첨가 후 1분간 교반 시킨 다음 시료 1 mL을 취하여 튜브 에 옮겼다. 현탁액 1 mL은 시료 5 mg에 해당한다. 시료를 30분간 교반 후 1,000×g에서 10분간 원심분리(Mega 17R, Hanil Co., Inchon, Korea) 하고 상등액 1 mL을 취하여 튜 브에 옮겨 시료를 준비하였다. 각 튜브에 1 mL의 증류수를 첨가 후 10 mL의 반응 용액(glacial acetic acid (110 mL) hydrochloric acid (2 mL), 20% phloroglucino in absolute ethanol (5 mL), 1.75% glucose (1 mL))을 넣고 혼합하였다. 25분간 끓는 물에 담가 두면서 10분 간격으로 격렬히 혼 합하여 주었다. 반응을 종결시키기 위하여 0°C의 물에 담 근 후 분광광도계(Libra S22, Biochrom Co., UK)를 이용 하여 552 nm에서 510 nm의 측정된 흡광 값을 빼준 뒤 자 일로스 표준곡선과 비교하여 수용성 아라비노자일란 함량 을 계산하였다. 자일로스 표준곡선은 10 mg D(+)xylose를 100 mL 증류수에 녹인 후 튜브에 0, 0.5, 1.0, 1.5, 2.0 mL 를 분주한 후 각 튜브에 증류수를 첨가하여 최종 2 mL로 맞추었다. 반응 용액을 10 mL씩 첨가하고, 끓는 물에 25분 간 담근 후 552 nm와 510 nm에서 흡광도를 측정하여 표준 곡선을 작성하였다. 수용성 아라비노자일란 함량은 3회 반 복 측정 후 평균값과 표준편차를 구하였다.
통계분석
WEWG와 ETWG의 분석 결과는 미니탭(Minitab17, Minitab Inc., University Park, PA, USA)을 이용하여 분산 분석(ANOVA)을 실시한 후 p<0.05 수준에서 평균 간 차이 에 대한 Tukey 동시 검정을 실시하였다.
결과 및 고찰
시료의 pH 변화
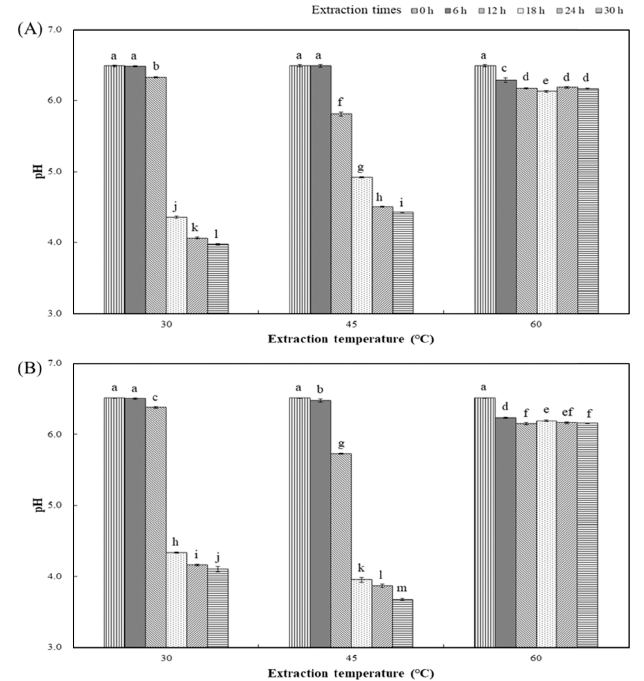
WEWG와 ETWG의 pH는 추출 온도 30°C와 45°C에서 추출 시간에 따라 감소하였으며, 추출 온도 60°C는 추출 시간이 경과해도 pH의 변화가 거의 없는 것으로 조사되었 다(Fig. 2). 밀 배아는 Lactobacillus rossiae와 같은 혼합 발효성의 젖산 생성균을 가지고 있다고 알려졌고, 이는 Lactobacillus plantarum과 함께 다양한 식품을 발효하기 위하여 사용되며, 밀 배아의 발효에 관여하여 항산화 활성 을 증가시킨다고 보고하였다(De Angelis et al., 2014;Scheirlinck et al., 2009;Rizzello et al., 2013). Shin et al. (2017)에 따르면 보리와 혼합한 밀의 발효 시 발효 온도 20-30°C에서 시간이 경과할수록 pH는 감소하였으며, 발효 시 생성되는 유기산은 대부분 citric acid와 lactic acid가 차지한다고 하였다. 일반적으로 구연산은 포도당이나 과당 을 Aspergillus niger의 수중 발효를 통하여 생산되며 (Crolla & Kennedy, 2001), 젖산은 Lactobacillus를 이용하 여 발효를 통해 생산된다(Leroy & Vuyst, 2004). 김치 발 효의 주요 젖산균을 가열 처리한 연구(Byun et al., 1989) 에 따르면 가열 온도 50°C에서는 가열시간에 비례하여 젖 산균의 감소가 확인되었고, 추출 온도 60°C에서는 가열 10 분 이내에 급격한 감소 후 시간에 비례하여 감소하였다고 보고하였다. 그러나 당 전이 반응을 위하여 55°C로 효소 처리를 한 연구 결과(Yong et al., 2012)에서 Celluclast 1.5L 은 50°C 이상에서 효소 안정성이 높다고 보고하여 Celluclast 1.5L의 활성도는 유지가 되었을 것으로 판단되 고, 추출물의 pH 변화는 밀 배아에 존재하는 유기산 생성 균의 영향을 받는 것으로 생각된다. 본 연구에서는 유기산 을 생산하는 젖산 생성 미생물이 추출 온도가 높아질수록 활성이 감소한 것으로 생각되며, 추출 시 생성되는 유기산 의 종류와 함량에 관하여 추가적인 연구가 필요하다.
Fig. 2.
Changes in pH of wheat germ extract at extraction time and extraction temperature.
(A) Water extract wheat germ; (B) Enzyme treated wheat germ. Values represent the mean±SD of three independent experiments. a-mMeans with the same letter in each sample are not significantly different at p<0.05.
Download Original Figure
2,6-DMBQ 함량 변화
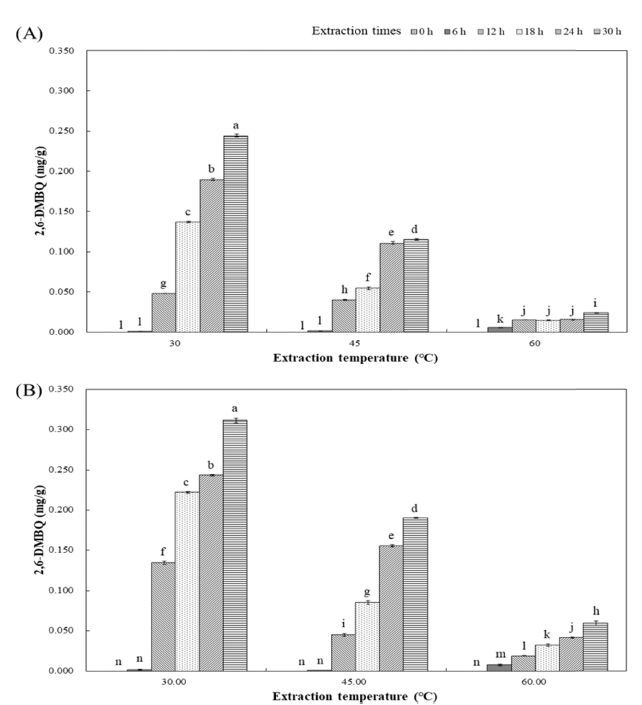
시료의 2,6-DMBQ함량을 HPLC로 분석한 결과 Fig. 1 과 같이 순수 분리되었으며, 그 피크의 면적으로부터 구한 함량은 Fig. 3과 같다. WEWG와 ETWG 모두 추출 시작 후 6시간까지 2,6-DMBQ가 거의 생성되지 않았으며, 12시 간 경과 후부터 증가하기 시작하였다. 추출 온도는 30°C 에서 가장 높은 함량의 2,6-DMBQ가 생산되었으며, 추출 온도가 올라갈수록 감소하는 경향을 나타냈다. 밀 배아에 는 젖산균이 존재하며(Rizzello et al., 2010) 젖산균은 β- glucosidase를 생산하는 것으로 알려졌다(Shim et al., 2014). 젖산균은 균주에 따라 다른 최적 온도와 pH를 가지고 있 으며(Jang & Kim, 2010), Zheng et al. (2016)은 밀 배아 내 배당체로 존재하는 2,6-DMBQ는 배아 세포 내 β- glucosidase에 의하여 하이드로퀴논 글루코시드가 아글리콘 으로 가수분해되고, peroxidase에 의하여 벤조퀴논으로 산 화되었다고 보고하였다. 본 연구에서는 30°C의 추출 온도 에서 젖산균이 생산하는 β-glucosidase의 효소 활성이 가장 활발하여 밀 배아에 배당체로 존재하는 2,6-DMBQ의 글리 코시드 결합이 절단되고 수용화되어, 건조물 내 함량이 높 게 측정되었으며, 온도가 증가할수록 효소 활성이 감소하 여 감소한 것으로 생각된다. Rizzello et al. (2013)은 β- glucosidase의 활성을 기준으로 Lactobacillus plantarum LB1과 Lactobacillus rossiae LB5를 선별하여 밀 배아 48 시간 동안 추출물을 제조한 결과 2,6-DMBQ의 함량이 0.252±0.013 mg/g의 으로 증가하였다고 하였다. 추출 온도 를 달리하였을 때 ETWG는 WEWG와 비교하여 추출 온 도가 30°C로 추출 시 2,6-DMBQ의 함량이 0.311±0.003 mg/g으로 약 27.60% 증가하였으며, 45°C 추출 시 0.190± 0.001 mg/g으로 65.03% 증가하였고, 60°C 추출 시 0.060± 0.003 mg/g으로 151.05% 증가하여 Celluclast 1.5L 처리가 2,6-DMBQ 수용화의 효율을 높여주는 것으로 나타났다 (Fig. 3). Lee et al. (2006) 등은 Celluclast 1.5L의 효소 활성을 위한 최적 pH는 4.5이고, 온도는 50°C 였다고 보 고하였다. 본 연구에서 추출온도 30°C와 45°C에서 추출시 간 18시간 후의 pH가 약 4.5였으며, 이때 WEWG 보다 ETWG의 2,6-DMBQ 함량이 증가하였으며, 젖산균의 활 성이 낮은 60°C에서도 WEWG 보다 높은 수율의 2,6- DMBQ 함량을 나타냈다. Celluclast 1.5L은 내부 β-1,4 결 합을 무작위로 절단하는 endo-1,4-β-D-glucanase, 말단의 셀룰로스에 작용하는 exo-1,4-β-D-glucanase, 셀로비오스를 가수분해하여 포도당을 유리시키는 β-glucosidase 등 셀룰 로스의 글리코시드 가수분해에 관여하는 효소를 생산한다 (Vinzant et al., 2001). 그리고 Lee et al. (2006)은 감태 줄 기 및 잎을 Celluclast 1.5L 처리하여 추출 시 50°C가 최적 온도였다고 보고하였다. 그러므로 Celluclast 1.5L 처리는 셀룰로스를 가수분해하고, 젖산균이 생산하는 β-glucosidase 가 밀 배아의 2,6-DMBQ 수용화를 용이하게 하는 형태로 만들어 주는 것으로 생각된다.
Fig. 3.
Changes in 2,6-DMBQ of wheat germ extract at extraction time and extraction temperature.
(A) Water extract wheat germ; (B) Enzyme treated wheat germ. Values represent the mean±SD of three independent experiments.Not detected atextraction time 0 h.
a-nMeans with the same letter in each sample are not significantly different at p<0.05.
Download Original Figure
수용성 아라비노자일란 함량 변화
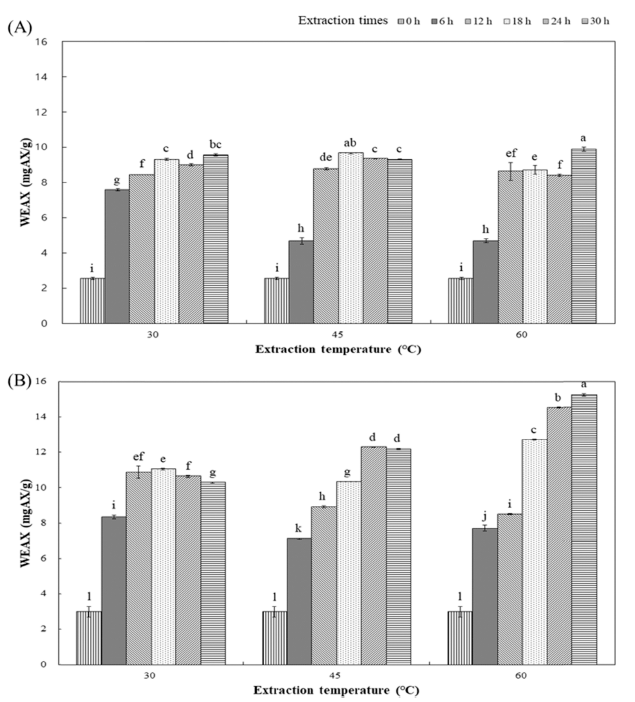
수용성 아라비노자일란 함량은 ETWG가 WEWG보다 증가하였다(Fig. 4). 특히 온도가 증가할수록 ETWG의 수 용성 아라비노자일란이 WEWG보다 최대 약 54.38% 증가 하는 경향을 나타내었다. 아라비노자일란은 밀 부산물로 얻을 수 있는 식이섬유의 한 종류로(Lu et al., 2000), 밀의 세포벽에 존재하는 헤미셀룰로스의 일종이다(Autio, 1996). Escarnot et al. (2011)은 밀기울의 아라비노자일란은 일부 수용화될 수 있다고 하였으며, Wang et al. (2014)에 의하 면 endo-1,4-β-xylanase를 밀기울에 처리하였을 때, 추출 온 도 50°C에서 가장 높은 수율의 아라비노자일란이 추출되었 고, 추출 시간이 증가함에 따라 수율이 증가하는 것으로 조사되었다. Kang et al. (2016b)이 보고한 압출성형된 밀 기울에 Celluclast 1.5L 처리를 한 경우 수용성 아라비노자 일란이 증가한 결과와 유사하였다. Celluclast 1.5L은 셀룰 로스를 포도당으로 가수분해 반응에 적용되는 효소이며 (Merino & Cherry., 2007), Sørensen et al. (2003)은 endo-1,4- β-xylanase와 Celluclast 1.5L과의 상호 작용으로 xylobiose와 xylotriose를 xylose로 가수분해한다고 하였으며, Liu et al. (2018)의 최근 연구에 따르면 Celluclast 1.5L이 셀룰로스 의 당화 과정 중 xylanase의 상승작용에 도움을 주었다고 보고하였다. 따라서 Celluclast 1.5L은 xylanase와 복합적 으로 밀 배아의 아라비노자일란 수용화에 작용한 것으로 생각된다.
Fig. 4.
Changes in WEAX of wheat germ extract at extraction time and extraction temperature.
(A) Water extract wheat germ; (B) Enzyme treated wheat germ. Values represent the mean±SD of three independent experiments. a-lMeans with the same letter in each sample are not significantly different at p<0.05.
Download Original Figure
요 약
본 연구는 밀 배아의 기능성 물질인 2,6-DMBQ와 아라 비노자일란 추출 효율을 증가시키기 위하여 상업용 효소인 Celluclast 1.5L을 사용하여 추출하였다. 추출 시 온도는 30, 45, 60°C였고, 추출 시간은 0, 6, 12, 18, 24, 30시간 추출 후 상등액 pH 변화와 건조물을 분석하였다. 추출물의 pH는 WEWG와 ETWG 모두 추출 온도 30°C에서는 18시 간 추출 시부터 급격하게 감소하였으며, 45°C는 12시간부 터 감소하였고, 60°C는 다른 추출 온도와 비교하여 큰 변 화는 없었다. 2,6-DMBQ는 WEWG와 ETWG 모두 추출 시간이 경과함에 따라 증가하였다. 추출 온도 30°C에서 가 장 높은 함량으로 추출되었으며, 30시간 추출할 때 2,6- DMBQ 함량은 ETWG에서 WEWG 보다 추출 온도 30°C 에서 27.60%, 45°C에서 65.03%, 60°C에서 151.05% 증가 하였다. 수용성 아라비노자일란 함량은 WEWG와 비교하여 ETWG가 높게 측정되었으며, 효소 처리 후 60°C에서 15.23 ±0.08 mg/g으로 가장 높은 함량으로 나타났다. 30시간 추출 시 ETWG와 WEWG에서의 수용성 아라비노자일란 함량을 비교했을 때 30°C에서 7.92%, 45°C에서 31.20%, 60°C에서 54.38% 증가하였다. 본 연구 결과는 제분 부산물인 밀 배 아에 항염 활성을 보유하는 기능성 소재로서의 활용을 위 한 기초자료로 이용될 수 있을 것으로 판단된다.
감사의 글
본 연구는 농림축산식품부의 재원으로 농림식품기술기획 평가원의 고부가가치 식품기술개발사업(과제번호: 116005- 3)의 지원에 의한 연구결과의 일부로 이에 감사 드립니다.
References
AusielloA, MicoliL, PirozziD, ToscanoG, TurocoM. 2015. Biohydrogen production by dark fermentation of Arundo donax for feeding fuel cells. Chem. Eng. Trans.43: 385-390.1974-9791
AutioK.1996. Functional aspects of cereal cell wall polysaccharides. In: Carbohydrate in food. EliassonAC (eds). Marcel Dekker, Inc., New York, NY, USA, pp. 227-266.
BaeMJ, YeeST, ChaeSY, ShinSH, KweonSH, ParkMH, SongMK, HwangSJ. 2004. The effects of the arabinoxylane and the polysaccharide peptide (PSP) on the antiallergy, anticancer. J. Korean Soc. Food Sci. Nutr.33: 469-474.

BansalS, SudhaML. 2011. Nutritional, microstructural, rheological and quality characteristics of biscuits using processed wheat germ. Int. J. Food. Sci. Nutr.62: 474-479.

 0963-7486
0963-7486
ByunMW, ChaBS, KwonJH, ChoHO, KimWJ. 1989. The combined effect of heat treatment and irradiation on the inactivationof major lactic acid bacteria associated with kimchi fermentation. Korean J. Food Sci. Technol.21: 185-191.0367-6293
ChoiEM, LimTS, LeeHL, HwangJK. 2002. Immune cell stimulating activity of wheat arabinoxylan. Korean J. Food Sci. Technol.34: 510-517.0367-6293
ChoiYS, LeeJK, LeeJH, KumHI, ChoiYH, ShinMS. 2018. Effects of enzyme treatment on antioxidant activity of wheat germ. Korean J. Food Cook Sci.34:512-518.
ChoiYS, LeeJK, LeeMG, LeeSG, JeongHY, KangH. 2017. Splenic T cell and intestinal IgA responses after supplementation of soluble arabinoxylan-enriched wheat bran in mice. J. Funct. Foods.28: 246-253.
 1756-4646
1756-4646
ClassenPAM, BuddeMAW, Lopez-contreasAM. 2000. Acetone, butanol and ethanol production from domestic organic waste by solventogenic clostridia. J. Mol. Micorbiol. Biotechnol.2: 39-44.
 1464-1801
1464-1801
CrollaA, KennedyKJ. 2001. Optimization of citric acid production from Candida lipolytica Y-1095 using n-paraffin. J. Biotechnol.89: 27-40.

 0168-1656
0168-1656
De AngelisM, BottaciniF, FossoB, KelleherP, CalassoM, Di CagnoR, VenturaM, PicardiE, SinderenDV, GobbettiM.2014. Lactobacillus rossiae, a vitamin B12 producer, represents a metabolically versatile species within the genus Lactobacillus. PLOS ONE.9: e107232.

 1932-6203
1932-6203
DouglasSG. 1981. A rapid method for the determination of arabinoxylans in wheat flour. Food Chem.7: 139-145.
 0308-8146
0308-8146
EscarnotE, AguedoM, AgneessensR, WatheletB, PaquotM. 2011. Extraction and characterization of water-extractable and water-unextractable arabinoxylans from spelt bran: Study of thehydrolysis conditions for monosaccharides analysis. J. Cereal Sci.53: 45-52.
 0733-5210
0733-5210
HidvegiM, RasoE, Tomoskozi-farkasR, SzendeB, PakuS, PronaiL, BocsiJ, LapisK. 1999. MSC, a new benzoquinonecontainingnatural product with antimetastatic effect. Cancer Bioter. Radiopharm.14: 277-289.

 1084-9785
1084-9785
JangMH, KimMD. 2010. Exploration of β-glucosidase activity of lactic acid bacteria isolated from kimchi. Food Eng. Prog.14: 243-248.
KangBK, KimMJ, JeongDH, KimKBWR, BaeNY, ParkJH, ParkSH, AhnDH. 2016a. Anti-inflammatory effect of wheat germ oil on lipopolysaccharide-stimulated RAW 264.7 cells and mouse ear edema. Microbiol. Biotechnol. Lett.44: 236-245.

KangH, LeeMG, LeeJK, ChoiYH, ChoiYS. 2016b. Enzymatically- processed wheat bran enhances macrophage activity and has in vivo anti-inflammatory effects in mice. Nutrients.8: 188- 200.

 2072-6643
2072-6643
LeeSH, KimKN, ChaSH, AhnGN, JeonYJ. 2006. Comparison of antioxidant activities of enzymatic and methanolic extracts from ecklonia cava stem and leave. J. Korean Soc. Food Sci. Nutr.35: 1139-1145.

LeroyF, VuystLD. 2004. Lactic acid bacteria as functional starter cultures for the food fermentation industry. Trends Food Sci. Technol.15: 67-78.
 0924-2244
0924-2244
LiuJ, MiaoT, ZhengF, RahimK, LouH, JiangW. 2018. Characterization of two endo-β-1,4-xylanases from Myceliophthora thermophila and their saccharification efficiences, synergistic with commercial cellulase. Front. Microbiol.9: 233-243.

 1664-302X
1664-302X
LuZX, GibsonPR, MuirJG, FieldingM, O’DeaK. 2000. Arabinoxylan fiber from a by-product of wheat flour processing behaves physiologically like a soluble, fermentable fiber in the large bowel of rats. J. Nutr.130: 1984-1990.

 0022-3166
0022-3166
MerinoST, CherryJ. 2007. Progress and challenges in enzyme development for biomass utilization. Adv. Biochem. Eng. Biotechnol.108: 95-120.

 0724-6145
0724-6145
MuellerT, JordanK, VoigtW. 2011. Promising cytotoxic activity profile of fermented wheat germ extract (Avemar) in human cancer lines. J. Exp. Clin. Canc. Res.30: 42-53.

 0392-9078
0392-9078
ParadisoVM, SummoC, TraniA, CaponioF. 2008. An effort to improve the shelf life of breakfast cereals using natural mixedtocopherols. J. Cereal Sci.47: 322-330.
 0733-5210
0733-5210
RizzelloCG, MuellerT, CodaR, ReipschF, NionelliL, Curiel JA, GobbettiM. 2013. Synthesis of 2-methoxy benzoquinoneand 2,6-dimethoxybenzoquinone by selected lactic acid bacteria during sourdough fermentation of wheat germ. Microb. Cell Fact.12: 105-113.

 1475-2859
1475-2859
RizzelloCG, NionelliL, CodaR, De AngelisM, GobbettiM. 2010. Effect of sourdough fermentation on stabilization, and chemical and nutritional characteristics of wheat germ. Food Chem.119: 1079-1089.
 0308-8146
0308-8146
RosgaardL, PedersenS, CherryJR, HarrisP, MeyerAS. 2006. Efficiency of new fungal cellulose systems in boosting enzymatic degradation of barley straw lignocellulose. Biotechnol. Prog.22: 493-498.

 8756-7938
8756-7938
SaulnierL, SadoPE, BranlardG, CharmetG, GuillonF. 2007. Wheat arabinoxylans: Exploiting variation in amount and compositionto develop enhanced varieties. J. Cereal Sci.46: 261-281.
 0733-5210
0733-5210
ScheirlinckI, Van der MeulenR, VranckenG, De VuystL, SettanniL. 2009. Polyphasic taxonomic characterization of Lactobacillus rossiae isolates from Belgian and Italian sourdoughs reveals intraspecific heterogeneity. Syst. Appl. Microbiol.32: 151-156.

 0723-2020
0723-2020
SeongKT, HassanMA, AriffAB. 2008. Enzymatic saccharification of pretreated solid palm oil mill effluent and oil palm fruit fiber. Pertanika J. Sci. Technol.16: 157-169.0128-7680
ShimKS, ParkGG, ParkYS. 2014. Bioconversion of puffed red ginseng extract using β-glucosidase-producing lactic acid bacteria.Food Eng. Prog.18: 332-340.

ShinDS, JeongST, SimEY, LeeSK, KimHJ, WooKS, OhSK, KimSJ, ParkHY. 2017. Quality characteristics of mixed Makgeolliwith barley and wheat by fermentation temperature. Korean J. Food Nutr.30: 305-311.

SorensenHR, MeyerAS, PedersenS. 2003. Enzymatic hydrolysis of water-soluble wheat arabinoxylan. 1. Synergy between alpha- L-arabinofuranosidases, endo-1,4-beta-xylanases, and beta-xylosidase activities. Bioeng.81: 726-731.


Tomoskozi-farkasR, DaoodHG. 2004. Modification of chromatographic method for the determination of benzoquinones in cereal products. Chromatographia.60: 227-230.
 0009-5893
0009-5893
VinzantTB, AdneyWS, DeckerSR, BakerJO, KinterMT, ShermanNE, FoxJW, HimmelME. 2001. Fingerprinting Trichoderma reesei hydrolases in a commercial cellulose preparation. Appl. Biochem. Biotechnol.91-93: 99-107.

 0273-2289
0273-2289
WangJ, SunB, LiuYL, ZhangH. 2014. Optimisation of ultrasound-assisted enzymatic extraction of arabinoxylan from wheat bran. Food Chem.150: 482-488.

 0308-8146
0308-8146
YongHU, KimSM, ShimJH. 2012. Enzymatic production of alkyl β-glucoside based on transglycosylation activity of celluclast. J. Korean Soc. Food Sci. Nutr.41: 1417-1422.

YooJG, KimMD. 2010. Production of 2-methoxy-1,4-benzoquinone (2-MBQ) and 2,6-dimethoxy-1,4-benzoquinone (2,6- DMBQ) from wheat germ using lactic acid bacteria and yeast. Food Eng. Prog.14: 292-298.
ZhengZ, GuoX, ZhuK, PengW, ZhouH. 2016. The optimization of the fermentation process of wheat germ for flavonoids and two benzoquinones using EKF-ANN and NSGA-II. RSC Advances.59: 53821-53829.
 2046-2069
2046-2069
ZuzanaS, EditaG, ErnestS. 2009. Chemical composition and nutritional quality of wheat grain. Acta Chimica. Slovaca.2:115-138.1318-0207