서 론
농산물은 수확 후에도 호흡을 포함한 대사활동을 하는데, 이러한 대사활동을 지연시켜야 품질을 유지하며 저장기간을 연장할 수 있다. 대사활동을 지연시키는 방법으로 저장온도 를 동결점 인근까지 낮추어 저장하는 방법과 Controlled Atmosphere (CA), Modified Atmosphere (MA) 등과 같이 호흡에 필요한 산소의 양을 낮추는 저장 방법이 있다(Park et al., 2016; Kim et al., 2018). 하지만 이러한 저장방법들 이 사용됨에도 UN FAO 자료에 따르면 과채류의 손실비 율(food loss and waste)은 45%로 높은 편이다. 따라서 과 채류의 저장기간을 연장하여 손실비율을 낮추는 기술의 개 발이 요구되어지고 있다.
생물체 내의 대사속도는 온도가 10°C 증가할 경우 2-3배 증가하며(Kim et al., 1996), 반대로 온도를 낮출 경우 감소 한다. 기존에는 냉해나 동해를 입지 않도록 어는점 이상의 온도에서 저장하였으나, 최근에는 어는점 이하에서도 얼지 않는 과냉각 현상을 활용하여 농산물을 저장하려는 연구가 수행되고 있다(Martins & Lopes, 2007; James et al., 2009).
과냉각 상태의 물은 준안정상태로 특정 크기 이하의 얼 음결정은 다시 액체 상태가 되나 특정 크기 이상의 얼음 결정은 전체적인 상변화를 일으키는 불균일 핵형성 (heterogeneous nucleation)을 유발한다. 반지름 r인 얼음이 형성 되었을때의 Gibbs free energy ΔGn은 얼음의 표면에 서 액체상태의 물 분자가 고체상태의 물 분자를 당기는 힘 에 의한 에너지 γ (interfacial energy)와 액체 상태와 고체 상태의 화학 퍼텐셜(chemical potential) 차이 Δμ = μliquid− mice, 얼음의 분자밀도(concentration of molecules) nice와 (1)의 관계를 갖는다(Kittel & Kroemer, 1980; DeVoe, 2014; Dalvi-Isfahan et al., 2017).
어는점 이하에서 얼음과 물이 공존할 때 얼음의 화학 퍼 텐셜이 물보다 작기 때문에(μliquid> μice) 더 작은 화학 퍼텐 셜을 갖는 얼음이 안정된 상태가 된다. ΔGn의 미분이 0이 되는 특정 반지름을 rc라고 할 때, 얼음의 지름이 rc보다 작으면 얼음 결정이 줄어드는 쪽으로, rc보다 크면 얼음 결 정이 성장하는 쪽으로 반응이 진행된다.
온도가 낮아질수록 물과 얼음의 화학퍼텐셜 차이 Δμ는 커지며, rc는 줄어들어서 물 분자가 rc 이상의 결정 형태가 될 확률이 높아지기 때문에 불균일 핵형성이 진행될 가능 성이 높아진다. 미생물이나 중금속 같은 불순물들이 rc보다 클 경우 빙결핵으로 작용하기도 하는데(Attard et al., 2012; Kobayashi et al., 2018), 특히 Pseudomonas 속 미생 물은 핵형성 단백질을 생성한다고 알려져 있다. Seeley et al. (1999)은 1 μL의 물을 500-600번의 냉해동을 반복실험을 한 결과 핵형성 발생 10%에서 90%의 확률 범위에 해당하 는 온도 폭은 0.75°C 정도라고 보고하였다. 이러한 확률 분 포의 미분은 정규분포 형태이며, 과냉각 온도가 낮아질수록 정규분포의 FWHM (Full Width at the Half Maximum) 값 은 커진다. 이러한 정규분포의 평균값을 빙핵 형성 온도 (nucleation temperature)라 하며, 물에 포함되어 있는 불순 물의 양에 영향을 받는다. 농산물에서의 빙핵 형성은 농산 물 자체의 성분이나 수분, 세포벽 구조의 영향을 받기도 하는데(Arias et al., 2015), sucrose나 glycerol 등의 성분은 유전자원 저장에서 동결보호제로 쓰이는 대표적인 물질로 빙핵 형성 온도에 영향을 준다고 알려져 있다(Farshad & Akhondzadeh, 2008).
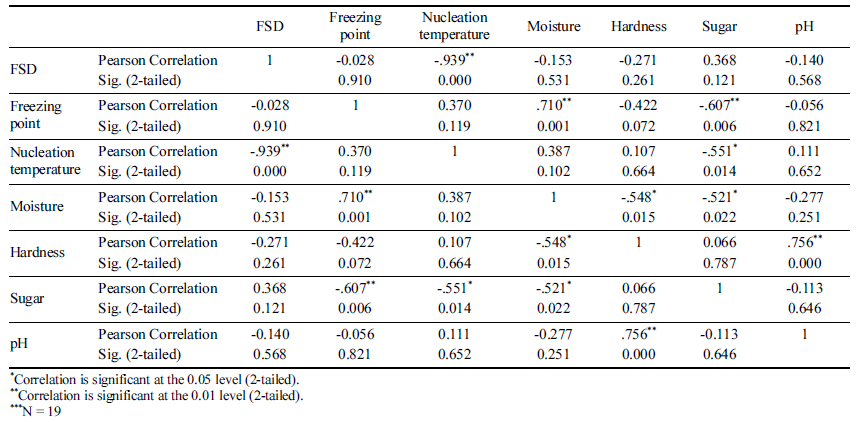
James et al. (2011)은 농산물의 종류별 빙핵 형성 온도 를 측정하였는데, 브로콜리의 경우 빙핵 형성 온도가 - 2.3°C부터 -9.8°C까지 큰 편차로 나타났고 일부 다른 농산 물도 2°C 이상의 편차로 나타났다. 일반적인 용액의 핵형 성 확률이 2°C 편차 이내인 것을 감안할 때(Wilson et al., 2003) 정규분포 범위를 벗어나는 큰 편차가 나타나는 원인 에 대한 분석이 필요하다. 농산물의 동결점(freezing point) 에 대한 이전 연구에서 당도와 함수율에 따라 어는점 내림 현상이 발생하여 동결점에 영향을 준다고 분석하였지만 (Park et al., 2016), 과냉각 현상에 영향을 주는 요인에 대 한 분석이 부족하였다.
농산물의 과냉각 저장을 위해서는, 핵형성에 영향을 주는 요인에 대해 분석하여 이러한 요인을 약화시키는 방법을 찾아야 한다. 본 연구에서는 농산물의 핵형성에 영향을 주 는 요인을 찾기 위해 농산물의 빙핵 형성 온도와 동결점의 차이인 과냉각 격차(FSD, freezing supercooling difference)와 이화학적 및 미생물학적 품질과의 상관분석을 통해 농산물 과냉각에 영향을 주는 주요 요인을 규명하여 농산물의 과냉각 저장 가능성을 높이고자 하였다.
재료 및 방법
다양한 국내산 농산물의 이화학적 품질 특성과 과냉각 특 성의 상관관계를 분석하고자 저장기간 연장이 필요한 농산 물 19종을 선정하여 사용하였다. 농산물은 국립농업과학원이 위치한 전주의 유통회사를 통해 2015년 유통되는 농산물을 구입하여 실험하였으며 산지를 특별하게 한정하지 않고 구 매하여 사용하였다. 5-6월의 의성 마늘, 7월의 김포 대파, 홍 천 백오이, 진주 풋고추, 김제 백구 포도, 성주 참외, 곡성 머스크 메론, 9월의 곡성 유명 복숭아, 부여 방울토마토, 이 천 장호원 황도, 의성 추희 자두, 진안 호박고구마, 해남 밤 고구마, 10월의 평창 무, 이서 배, 11월의 광주 부유 단감, 충주 후지 사과, 서귀포 감귤, 12월의 곡성 설향 딸기에 대 해 외관이 양호한 것을 선별하여 세척하지 않은 원물을 기 준으로 하되 일부 농산물은 세척한 뒤 분석을 수행하였다.
백오이와 같은 일부 농산물은 세척 전과 후의 과냉각 특 성이 현저히 차이가 나타났다. 미생물학적인 품질과 과냉각 특성의 상관관계를 분석하고자 2018년 3월 구입한 해남 배 추, 절임배추, 포기김치, 백김치에 대한 분석을 수행하였다.
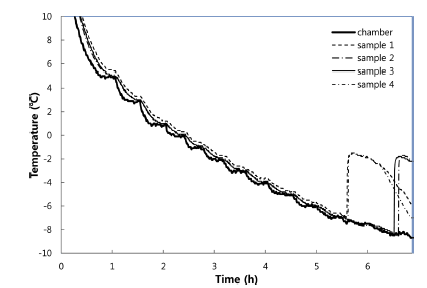
냉매의 액화 및 기화를 통해 냉동을 하는 일반적인 냉동 기로는 온도를 천천히낮추며 과냉각 특성을 분석하기 어렵 기 때문에 열교환기를 사용하여 열매체유를 냉각하고 냉각 된 열매체유를 순환시켜 챔버의 온도를 낮추는 방식의 과 냉각 실험장치(customized model, Sinhan plant, Chungju, Korea)를 제작하여 사용하였다(Kim et al., 2014). 온도센서 를 통한 열전도 영향을 줄이기 위해 테프론 코팅된 지름 0.12 mm의 K타입 열전대(K-12-TE, Delta Ohm, Sungnam, Korea)를 사용하여 온도 측정을 하였다. 측정된 온도는 자동 기록장치(ALMEMO 5690-2, Ahlborn, Holzkirchen, Germany) 를 통해 30초 간격으로 저장하였다. 빙핵 형성 온도와 동 결점을 측정하기 위해 4°C에서 -15°C까지 1°C씩 감소시켰 으며 농산물의 폼온이 장치온도에 도달한 뒤 온도를 낮추 도록 각각의 온도에서 20-60분 유지하도록 하였다. 핵형성 이 되면 잠열이 방출되며 상변화 과정을 갖는데, Wilson et al. (2003)의 연구와 같이 핵형성 직전의 온도를 과냉각 점, 상변화 구간의 초기 온도를 동결점으로 판단하였다.
19종의 과채류에 대해 당도 및 pH, 경도, 수분함량을 조사 하였다. 농산물 별 착즙액을 기준으로 당도를 디지털 굴절당 도계(RX-5000a, Atago Co., Tokyo, Japan)로 측정하였다. 정 확한 산도의 측정을 위해서는 적정산도를 측정해야 하지만, 과채류의 종류에 따라 주요산과 완충제 역할을 하는 염의 함량이 다르기 때문에, 상관분석을 위해서 수소 이온 농도 를 기반으로 하는 pH만을 측정하였다. pH는 착즙액을 5분 간 3,000 rpm으로 원심 분리한 뒤 상등액 1 mL에 증류수 19 mL을 첨가 희석하여 pH측정기(Orion Star A221, Thermo scientific, Beverly, MA, USA)로 측정하였다. 경도는 표피를 기준으로 10 mm 두께로 절단한 뒤 표피의 경도를 기준으로 하되 껍질이 두꺼운 경우 과육의 경도도 경도계(TA-XT2, Stable Micro System Ltd., Godalming, UK)로 지름 5mm probe를 이용하여 0.3mm/sec 의 속도로 5mm까지의 최대 압축강도로 측정하여 N 단위로 나타내었다. 수분함량은 AOAC (1990) 방법을 기준으로 표피를 제거한 시료 2-4 g을 105°C 건조기(CT-DO 72, Coretech, Anyang, Korea)와 전 자저울(CPA64, Sartorius weighing technology, Goettingen, Germany)을 이용하여 상압가열건조법으로 측정하였다.
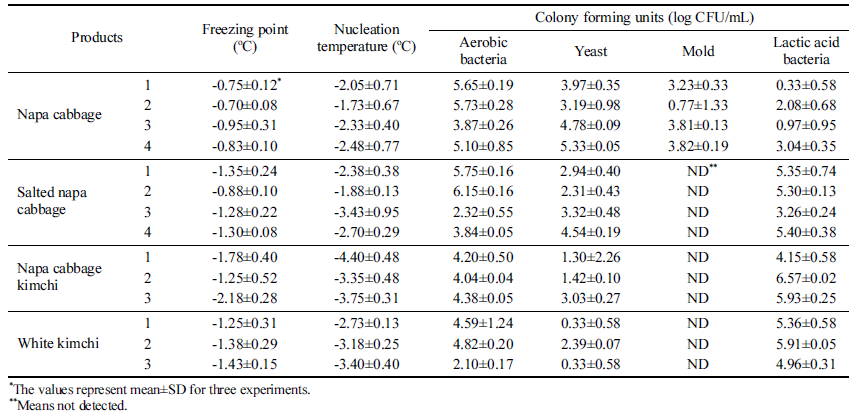
배추, 절임배추, 백김치, 포기김치에 대해 건조배지 (Petrifilm AC/LAB/YM/CC, 3M, Paul, MN, USA)를 사용 하여 분석하였으며, 호기성 세균은 aerobic count (AC) 배 지, 유산균은 lactic acid bacteria count (LAB) 배지, 효모 및 곰팡이는 yeast and mold count (YM) 배지를 이용하여 분석하였다. 시료는 배추를 대칭적으로 1/4로 절단하여 마 쇄한 뒤 20 g을 채취하여 180 mL의 멸균식염수(HAPS, Huko FS Co., Seoul, Korea)로 희석한 것을 기준으로 사 용하였다. AC 배지와 LAB 배지는 37°C에서 24-48시간, YM 배지는 25°C에서 72-96시간 배양하여 콜로니의 개수 를 분석하였다.
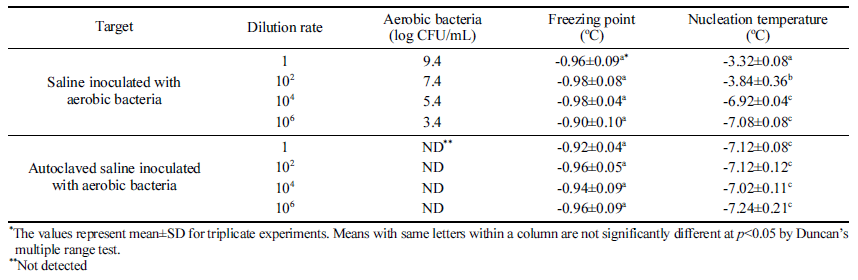
AC 배지로 배양한 호기성 세균을 멸균식염수에 접종하 여 균질기(WH4000 2751-9, 3M Korea, Seoul, Korea)로 균 질화한 용액에 대한 과냉각 분석을 하였다. 호기성 세균이 접종된 용액을 절반은 고압멸균기(FTAC-702, SCI Finetech Co., Seoul, Korea)로 멸균한 뒤 각각 미생물 농도가 9.4 log CFU/mL와 검출되지 않음을 확인하였다. 호기성 세균 원액과 멸균된 원액을 각각 102, 104, 106배로 희석하여 20 mL씩을 원뿔형 관(Falcon Conical Centrifuge tube 50mL, Corning Science Mexico, Tamaulipas, Mexico)에 담아서 동결점과 과냉각점을 5반복으로 측정하였다.
결과 및 고찰
마늘 등 19종의 과채류에 대한 동결점 및 빙핵 형성 온 도, 함수율, 경도, 당도, pH를 측정하였다(Table 1). 마늘의 경우 Fig. 1과 같이 장치의 온도를 20분 간격으로 1°C 낮 추며 온도를 측정하였으며, 각각의 동결실험은 4반복으로 수행하여 평균값을 기준으로 상관관계를 분석하였다. 동결 점은 함수율과 당도에 p<0.01의 유의적인 상관관계를 나타 내었고, 빙핵 형성 온도는 당도와 p<0.05의 유의적인 상관 관계를 보였다(Table 2). 이러한 결과는 세포벽의 수분과 용질이 올리브 잎의 동결에 영향을 준다는 결과(Arias et al., 2015) 및 trehalose, sucrose 등의 당이 동결점과 빙핵 형성 온도를 낮춘다는 연구결과와 일치한다(Wang and Haymet, 1998). 건조와 sucrose 처리는 유전자원의 액체질 소 동결저장(cryopreservation)을 위한 전처리로 이용되지만 (Farshad & Akhondzadeh, 2008), 건조에 의한 중량감소 문제와 첨가물 처리에 대한 소비자의 부정적 인식 때문에 신선농산물에 적용하기는 어려운 방법이다. 동결점을 그대 로 유지하며 빙핵 형성 온도에 영향을 주는 요인을 분석하 기 위해 FSD와 함수율, 경도, 당도, pH를 비교하였는데 (Table 2), 함수율 및 당도와 FSD의 상관관계가 나타나지 않았다. 비교적 낮은 함수율과 높은 당도에 의해 마늘은 별도의 처리 없이도 높은 FSD값을 갖는 것으로 생각될 수 있으나, 과채류에 대한 상관분석에서 FSD와 함수율 및 당 도는 상관관계가 나타나지 않았기 때문에 다른 원인이 있 을 것으로 생각된다.
|
|
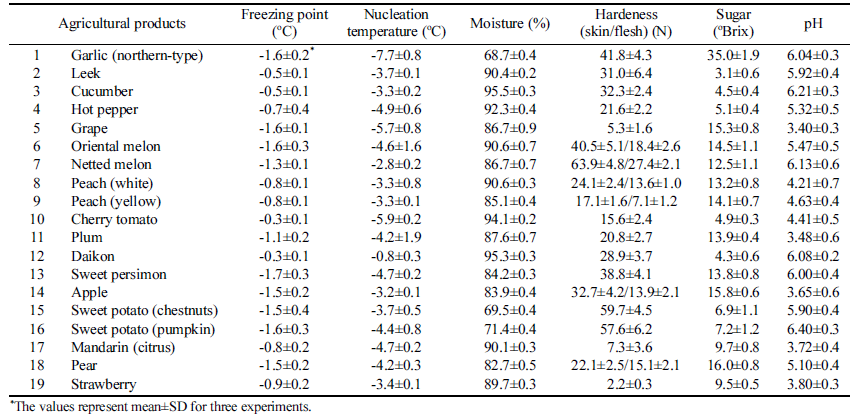
백오이와 같은 일부 농산물은 세척 전과 후의 과냉각 특 성 차이가 크게 나타났는데(Fig. 2), 농산물 표면의 불순물 이 세척에 의해 제거되어 빙핵 형성 온도가 낮아진 것으로 판단되었다. 이러한 불순물이 미생물의 영향인지 다른 화 합물의 영향인지 확인하고자 오이의 세척수와 고압멸균기 로 멸균한 세척수에 대한 과냉각 실험을 하였는데, 멸균한 세척수의 FSD가 증가하는 결과를 얻었다(Table 5와 유사 결과로 생략). 따라서 고압멸균으로 성분이 바뀌지 않는 화합물이나 중금속 등의 영향이 아나라 고온에 변성이 되 는 유기물이나 미생물의 영향으로 추정할 수 있다. 과채류 의 과냉각에 미생물의 영향이 크다고 가정한다면, 마늘의 항미생물성(Shin & Lee, 2002)이 높은 FSD값을 갖는 원 인이 될 수 있다.
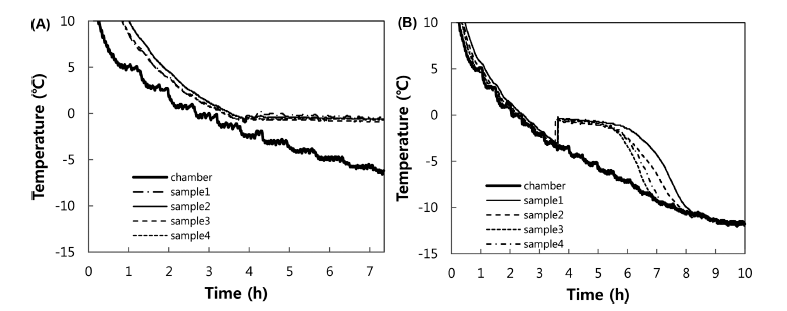
이러한 이유로 다양한 미생물이 분포하는 배추와 배추 가공식품에 대한 미생물학적 품질과 과냉각의 상관관계를 분석하였다.
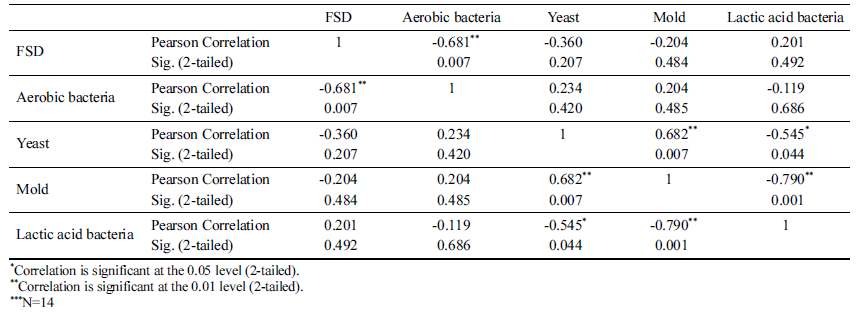
배추, 절임배추, 포기김치, 백김치에 대해 동결점 및 빙핵 형성 온도, 호기성세균, 효모, 곰팡이, 유산균을 분석하였다 (Table 3). 측정된 평균값을 이용하여 FSD와 미생물 중 호기 성 세균과 p<0.01의 상관관계 있는 것으로 분석되었다(Table 4). 호기성 세균의 일종인 Pseudomonas syringae 는 핵형성 단백질을 생성하여 과냉각을 억제한다고 보고되어 있는데 (Schmid et al., 1997), 이러한 핵형성 단백질을 생성하는 호 기성 세균의 영향으로 판단된다. 다만, 상관도가 0.681로 1 에 가깝게 측정되지 않은 것은 세균이 콜로니 형태로 자라 고, 핵형성은 특정 반지름 이상의 핵형성 단백질이 있을 때 발생할 확률이 높아지므로 호기성 세균의 총량이 아닌 콜로 니의 크기와 더 관련이 있기 때문으로 판단된다.
|
|
Attard et al. (2012)은 비구름에서 채취한 Pseudomonas 속 균들이 핵형성과 연관이 있으며, 균의 농도와 FSD가 상관관계가 있다고 보고하였다. 비구름에 핵형성 단백질을 생성하는 균들이 있으므로 농산물은 Pseudomonas 속 균들 을 포함한 호기성세균에 노출될 수 밖에 없으며, 농산물의 과냉각 저장을 위해서는 호기성 세균을 세척, 살균하는 것 이 중요할 것으로 판단된다.
호기성 세균과 과냉각의 상관관계를 검증하고자 배양한 호기성 세균을 9.4 log CFU/mL의 농도로 접종한 식염수와 이를 멸균한 시료를 각각 102, 104, 106 배로 희석하여 동 결점과 빙핵 형성 온도를 분석하였다(Table 5). 희석에 따 라 빙핵 형성 온도가 낮아졌으며, 104배 이상으로 희석한 약 5 log CFU/mL 수준 이하에서는 빙핵 형성 온도의 통 계적 차이가 없는 것으로 나타났다. 고압멸균기로 멸균한 시료는 통계적인 차이없이 과냉각 현상이 나타났으므로, 호기성 세균의 사체는 과냉각에 영향을 주지 않는 것으로 판단된다. Table 5에서는 5 log CFU/mL 이하의 호기성 세 균 농도를 갖는 식염수에서는 FSD가 멸균식염수와 비슷한 수준인 6도 정도로 나타났는데, Table 3의 배추 실험에서 는 5 log CFU/mL의 호기성 세균 농도에서 FSD가 2도 정 도로 작게 나타났다. 미생물은 과채류의 상처 부위나 면역 체계가 무너진 식물 세포에서 군집하여 자라는 특성이 있 기 때문에(Sapers et al., 2005; Sperber & Doyle, 2009), 배추 전체에서 5 log CFU/mL의 호기성 세균이 나타났다는 것은 실제로 배추 일부분에 더 높은 농도로 호기성 세균이 있다고 볼 수 있다. 호기성 세균이 군집한 배추 일부에서 시작된 핵형성은 세포간 동결(Pham, 2008)에 의해 배추 전체를 얼게 하여 FSD 값이 작게 나온것으로 판단된다.
|
요 약
19종의 과채류에 대한 동결점 및 빙핵 형성 온도, 함수율 , 경도, 당도, pH를 측정하여 Pearson 상관분석을 하였다. 동결점은 함수율과 당도에 p<0.01의 유의적인 상관관계를 나타냈으나, 빙핵 형성 온도는 당도에만 p<0.05의 상관관계 를 보였다. 특히 동결점과 빙핵 형성 온도의 차이값인 과냉 각 격차 FSD와는 함수율과 당도 등이 모두 상관관계를 보 이지 않았다. 호기성세균, 유산균, 효모, 곰팡이의 다양한 미생물이 분포하는 배추에 대한 미생물 분석과 FSD와의 상관분석을 수행하였는데, 호기성 세균과 p<0.01의 상관관 계가 나타났다. 호기성 세균을 9.4 log CFU/mL의 농도로 접종한 식염수와 이를 멸균한 시료를 각각 102, 104, 106 배 로 희석하여 동결점과 빙핵 형성 온도 분석에서도 높은 농 도의 호기성 세균이 빙핵 형성 온도를 높이는 결과가 나왔 다. 하지만, 약 5 log CFU/mL 수준 이하에서는 멸균식염수 와 빙핵 형성 온도의 통계적 차이가 없는 것으로 나타났다.