서 론
면역반응은 외부 병원성 항원으로부터 우리 몸을 보호하 기 위한 생체 방어체계로서 선천성 면역반응과 후천성 면 역반응으로 구분된다. 선천성 면역반응에 관여하는 면역세 포로는 호중구, 단핵구, 수지상세포, 대식세포와 같은 탐식 세포들이 있으며, 이중 대식세포와 수지상세포는 면역반응 의 개시자로서 외부로부터 들어오는 항원에 가장 빠르게 대응하여 포식하는 작용을 하며, 사이토카인을 분비해 선 천면역세포의 활성을 높이거나 외부로부터 유입된 항원을 면역 T세포에 전달하여 후천면역계의 활성 유도한다고 보 고되고 있다(Byun, 2017; Cho et al., 2017; Kim et al., 2017). 후천성면역계에 관여하는 면역세포로는 T 세포 및 B 세포 가 있으며, 선천성 면역반응 후 대식세포 및 수지상세포와 같은 탐식포식세포들이 제시한 특이 항원을 T세포가 인식 하면서 T세포 및 B세포의 활성이 일어나고, 활성화된 T세 포에 의해 발현되는 사이토카인의 작용으로 후천면역반응이 증폭된다(Klimp et al., 2002; Schepetkin & Quinn 2006; Sung et al., 2016).
면역조절 물질로서 합성 의약품 및 생물제제 등이 연구 되고 있지만 이러한 물질들은 대부분 부작용 또는 독성으 로 인하여 생체에 적용하기에는 한계점이 있다. 이러한 문 제점을 해결하기 위하여 식품소재 또는 천연물로부터 추출 한 물질을 면역조절물질로서 분리하여 개발하는 연구가 활 발히 수행되고 있으며(Byrd et al., 2000; Byun, 2015), 이 러한 천연물은 비특이적으로 면역세포들을 자극하여 생체 의 면역기능을 활성화시킴으로써 질병요인으로부터 생체의 방어력을 증강시킨다.
천연물을 통한 건강법 중 일상생활에서 쉽게 섭취 가능 한 당근, 무, 무청, 우엉, 표고버섯과 같은 채소들로 이루어 진 야채스프가 국내에서 암 환자 및 자가 면역성 질환의 환자들에게 많은 관심을 받아 다양한 많은 제품들이 판매 가 되고 있다. 당근은 비타민A의 전구체인 β-carotene을 다 량 함유하고 있어, 활성산소를 억제해 암, 노화, 및 각종 성 인병을 예방한다(Heinonen, 1990; Simon, 1990; Weisburger, 1991; Bendich et al., 1994). 무는 대표적인 항산화 성분인 phenolic compound, flavonoid와 각종 무기질과 소화효소인 amylase 등이 있으며, 소화불량, 숙취해소 및 항산화 등의 효과가 있다고 보고되어진다(Shimotoyodome et al., 2001). 무청은 35% 이상의 식이섬유와 20% 내외의 단백질과 철 분, 칼슘 등을 함유하고 있으며, 에탄올 추출물이 항암효과, 위장내 자극 및 자궁 수축 활성능, 장내 자극활성 등에 대 한 효과가 있다고 알려져 있다(Gilani & Ghayur, 2004; Yim et al., 2004; Ghayur & Gilani, 2005; Ku et al., 2006). 우엉은 폴리페놀 화합물인 caffeic acid 및 chlorogenic acid 등을 함유하고 항균작용, 항염증 등에 대한 연구가 보고되 고 있다(Takeda & Kiriyama, 1991a; Takeda & Kiriyama, 1991b). 표고버섯은 면역기능을 높여 항암 효과를 나타내 는 lentinan, 혈액 중 콜레스테롤을 제거하여 고혈압 및 동 맥경화와 같은 성인병 예방 효과를 나타내는 eritadenine, 체 내에서 비타민 D로 생성되어 칼슘의 흡수를 높여 주는 ergosterin 등을 포함하고 있다고 보고되었다(Lee et al., 1997; Hatvani 2001; Enman et al., 2007; Kim et al., 2013).
일반적으로 식물의 세포벽은 셀룰로오스, 헤미셀룰로오 스, 펙틴 및 리그닌 등과 같은 고분자물질로 구성되어 있 다. 이러한 식물 세포벽 구성성분들은 상호 간에 이온, 공 유 및 수소결합 등을 통해 단단한 결합조직을 이루고 있어 식물 내부 유효성분을 추출하는데 제한적이다(Sung et al., 2016). 따라서 식물 세포벽의 강한 결합을 물리적 및 화학 적인 방법으로 수용성화 함으로써 식물 함유 유효성분을 다량으로 용출시키기 위한 연구들이 다양하게 시도되고 있 다(Hwang et al., 1994). 압출성형은 혼합, 분쇄, 가열, 성 형 및 건조와 같은 연속적인 물리적인 조작을 통해서 전분 의 수화, 팽윤, 호화, 단백질의 변성, 미생물의 사멸, 독성 물질 파괴 및 이취물질 제거 반응 등이 연속적으로 일어나 는 공정이다. 스크류 회전속도, 수분 함량 및 배럴 온도 등의 공정변수 조절에 의해 다양한 특성의 압출성형물을 제조할 수 있다(Hwang et al., 1994; Shin et al., 2003). 국 내에서 압출성형공정을 이용하여 무청분말의 폴리페놀 추 출함량 증가 및 이취감소(Sung et al., 2016), 사과주스의 착즙 부산물인 사과박의 압출성형공정에 따른 수용성 식이 섬유 및 펙틴의 함량 증가(Hwang et al., 1994) 등과 같은 다양한 식품 분야에서 적용되고 있으며, 식품의 물리적 및 화학적 특성 뿐만 아니라 유용성분등의 추출효율을 개선하 고 자 하는 다양한 연구들이 진행되고 있다.
본 연구는 압출성형 무청을 사용하여 제조한 야채스프 (EVS)와 일반 무청을 사용하여 제조한 야채스프(NEVS)의 면역활성능에 관하여 알아보기 위하여 마우스 골수세포로 부터 분화된 다양한 면역세포(대식세포, 수지상세포) 및 비 장으로부터 적출한 비장세포에 NEVS와 EVS를 처리하여 세포생존율, 면역조절 물질인 사이토카인의 분비능, 세포표 면 활성인자(CD80/86, MHC class I/II)들의 발현 등에 미 치는 영향에 관하여 알아보았으며, NEVS와 EVS를 투여 가 BALB/c 마우스의 비장세포에서 후천성 면역반응에 미 치는 영향을 관찰하였다.
재료 및 방법
압출성형 야채스프의 제조에 사용된 압출성형기는 자체 제 작 한 실험용 쌍축 압출성형기(THK 31T, Inchon Machinery Co., Incheon, Korea)이며 압출성형기의 스크류 직경은 29.0 mm, 직경과 길이의 비(L/D ratio)는 25:1이다. 압출성형 공 정변수(배럴온도, 수분함량, 스크류 회전속도)는 Sung et al. (2016)의 연구에서 무청의 압출성형 최적조건으로 제시 한 130°C, 20%, 250 rpm으로 설정하였고, 그 밖의 원료사 입량 및 사출구직경은 100 g/min, 3.0 mm로 고정하였다.
본 실험에서 사용한 야채스프(제품명: 하늘빛 유기야채스 프) 및 압출성형 무청을 사용하여 제조한 야채스프는 ㈜하 늘빛(Gongju, Korea)에서 제공받아 동결건조하여 사용하였 고, 야채스프의 구성성분과 함량은 Table 1과 같다. 실험동 물은 6주령(18-20 g)의 C57BL/6 웅성 마우스를 오리엔트바 이오(Seoul, Korea)로부터 구입하여 사용하였다. 분양받은 마우스는 동물사육실 내부 환경에 1주간 순화시킨 후 미 분화 골수세포 및 비장세포를 채취하기 위하여 사용하였다. 야채스프의 섭취가 면역계에 미치는 영향에 관하여 관찰하 기 위하여 암컷 BALB/c 마우스(6주령, 체중 15-18 g)를 오 리엔트바이오로부터 구입하여 7일간 순화시켰다. 사육실의 온도는 23±2°C, 상대습도 50±5%, 명암주기는 12시간으로 일정하게 유지하였다. 동물실험을 위하여 마우스는 총 3군 (n=10)으로 분류하였으며, 첫 번째 그룹은 정상군(PBS 투여 군), 두 번째 그룹은 NEVS (100mg/kg body weight)투여군, 세 번째 그룹은 EVS (100 mg/kg body weight)투여군으로, 1일 1회 7일동안 경구투여 하였다.
골수세포로부터 대식세포 및 수지상세포로의 분화를 유도 하기 위하여 C57BL/6 마우스로부터 골수 채취용 주사기 (BD Biosciences, San Diego, CA, USA)를 이용해 대퇴부 골 수를 채취하였다. 채취한 골수를 차가운 phosphate buffered saline (PBS, Invitrogen Co., Carlsbad, CA, USA)으로 3회 세척한 후 적혈구를 제거하기 위하여 red blood cell (RBC) lysis buffer (Invitrogen Co.)를 5 mL 처리하여 10분간 방 치하였다. PBS로 3번 세척하여 적혈구 찌꺼기를 완전히 제거하였다. 분리한 미분화 골수세포를 수지상세포로 분화 시키기 위하여 10% fetal bovine serum (FBS)이 포함되어 있는 Roswell Park Memorial Institute (RPMI) 1640 배지 (Invitrogen Co.)에 2 mM L-glutamin, 100 unit/mL penicillin/ streptomycin, 50 μM mercaptoethanol, 0.1 mM non-essential amino acid, 1 mM sodium pyruvate, 20 ng/mL granulocytemacrophage colony stimulating factor (GM-CSF, R&D Systems, Minneapolis, MN, USA), 20 ng/mL IL-4 (R&D Systems)를 첨가하여 8일 동안 배양하였다. 또한 대식세포 로의 분화를 유도하기 위해 10% FBS가 포함된 Dulbecco's modified Eagle's medium (DMEM, WelGene, Daegu, Korea) 에 2 mM L-glutamin, 100 unit/mL penicillin/streptomycin, 50 μM mercaptoethanol, 0.1 mM non-essential amino acid, 1 mM sodium pyruvate, 25 ng/mL macrophage colony stimulating factor (MC-SF, R&D Systems)를 첨가하여 4일 동안 배양하였다.
NEVS와 EVS의 처리가 대식세포 및 수지상세포의 세포 증식능에 미치는 영향을 측정하기 위하여 마우스 골수세포 로부터 분화 된 대식세포 및 수지상세포를 각각 96 well plate (BD Biosciences)에 well당 3×105개로 분주한 후, NEVS와 EVS을 각각 500 μg/mL 및 1000 μg/mL의 농도 처리하여 37°C로 유지되는 5% CO2 세포 배양기에서 24시 간 배양한 후, 대식세포 및 수지상세포의 세포 증식능을 MTT 방법 및 WST-1 방법에 의하여 측정하였다. 3-(4,5- dimethylthiazol-2-yl)-2,5-diphenyl-tetrazolium bromide (MTT, Sigma-Aldrich Co., St. Louis, MO, USA) 방법은 시약을 PBS에 5 mg/mL의 농도로 용해하여 well당 30 μL씩 첨가하 고 2시간 동안 반응시킨 후, 배양 상등액를 제거하고 세포 내 생성된 formazan crystal을 dimethyl sulfoxide (DMSO)에 녹여 517 nm에서 흡광도를 측정하였다. WST-1 방법은 각 well에 WST-1 용액(Daeillab service, Seoul, Korea) 10 μL를 첨가하여 30분 동안 반응시킨 다음 multi-mode microplate reader를 이용하여 450 nm에서 흡광도를 측정하였다.
세포사의 분석을 위하여 FITC Annexin V Apoptosis Detection Kit I (556547, BD Biosciences)를 이용하여 Flow Cytometer (FACS, Cytomics FC 500, Beckman Coulter, Pasadena, California, USA) 분석을 실시하였다. 세포자살이 진행되는 과정 중 세포막 내측에 위치하는 Phosphatidyl serine (PS)이 전위되며, PS는 Annexin V와 강한 친화력을 지닌다. 또한 Propidium iodide (PI)는 분해된 DNA의 절편 과 친화력이 크므로 사멸된 세포를 분석하는 데 이용되고 있다(Vermes et al., 1995). 먼저, 세포를 1× PBS로 두 번 세척한 후 1× Binding Buffer를 이용하여 1×106 cells/mL 농도로 현탁시킨다. 이 용액으로부터 100 μL (1×105 cells)의 세포를 채취하여 5 mL culture tube에 분주하고, Annexin V-FITC (5 μL)와 PI (5 μL)를 첨가하여 15분 동안 실온에 서 염색을 실시한다. 염색된 혼합액에 1× Binding Buffer (400 μL)를 첨가한 후 FACS를 이용하여 분석하였다.
NEVS와 EVS의 처리가 대식세포 및 수지상세포의 사이 토카인 분비능에 미치는 영향을 측정하기 위하여 마우스 골수 세포로부터 분화된 대식세포 및 수지상세포를 각각 48 well plate에 well당 7×105개로 분주한 후, NEVS와 EVS을 각각 500 μg/mL 및 1000 μg/mL의 농도로 처리하 여 37°C로 유지되는 5% CO2 세포 배양기에서 24시간 배 양한 후, 배양 상등액에 포함되어 있는 TNF-α, IL-6 및 IL-1β의 함량을 측정하였다. 사이토카인의 측정은 enzyme linked immunosorbent assay (ELISA) kit (BD Biosciences) 를 사용하여 측정하였다.
NEVS와 EVS의 처리가 대식세포 및 수지상세포의 세포 표면 활성 인자의 발현에 미치는 영향 을 측정하기 위하여 마우스 골수세포로부터 분화된 대식세포 및 수지상세포를 각각 6 well plate에 well당 1×106개로 분주한 후, NEVS 와 EVS을 각각 500 μg/mL 및 1000 g/mL의 농도로 처리 한 후 24시간 동안 반응시키고 각각의 세포를 회수하였다. 항체의 비 특이적인 결합을 방지하기 위하여 회수된 각각 의 세포에 1 μg/mL의 Fcγ I/III (BD Biosciences)을 처리하 여 4°C에서 20분간 반응시킨 후, 대식세포와 수지상 세포 표면 활성 인자 분석을 위하여 anti-CD80-PE, anti-CD86- PE, anti-MHC I 및 II-PE (BD Biosciences)와 같은 세포 표 면 항체를 각각 1000배 희석하여 각각의 세포에 처리하고 30분 동안 반응시키고 FACS를 이용하여 NEVS와 EVS의 처리가 대식세포 및 수지상세포의 세포 표면 활성 인자의 발현에 미치는 영향에 관하여 분석하였다.
1주간의 순화를 마친 마우스를 경추 탈골법으로 희생시 킨 후 비장을 무균적으로 적출하여 10% FBS, 100 unit/mL penicillin, 100 μg/mL streptomycin 함유한 RPMI1640 배지로 3회 세척한 후 조직균질기(tissue grinder, Corning Costar, Corning, NY, USA)로 균질화하여 비장세포를 유리시켰다. 세포현탁액에 적혈구를 제거하기 위하여 RBC lysis buffer (BD Biosciences)를 첨가하여 적혈구를 제거하였고, 혈구계 수기를 이용하여 세포수를 측정하였다.
96 well plate에 well당 1×106개의 비장세포를 분주한 후, NEVS와 EVS를 500 및 1000 μg/mL과 양성 대조구인 ConA를 1 μg/mL의 농도로 처리하였고, 37°C로 유지되는 5% CO2세포 배양기에서 24시간 배양한 후, WST-1 (Daeillap service) 용액을 각 각의 well에 10 μL씩 첨가하 고 2시간 동안 반응시킨 후 450 nm에서 흡광도를 측정하 여 세포증식능을 평가하였다.
비장 조직으로부터 분리된 비장세포를 48 well plate에 well당 2×106개씩 분주한 후 NEVS와 EVS를 500 및 1000 μg/mL의 농도로 처리하였고, 또한 양성 대조구인 ConA를 1 μg/mL의 농도로 처리하였다. 24시간 배양 후, 배양 상등액에 존재하는 사이토카인(IFN-γ, IL-2, 4)의 함 량에 관하여 측정하였다. 사이토카인의 함량측정은 ELISA kit (eBioscience, San Diego, CA, USA)를 사용하여 측정 하였다.
실험동물에서 비장을 적출하여 mesh를 이용하여 단일 세포 부유액으로 만들었다. 원심분리(1,800 rpm, 3 min, 4°C)하여 상등액을 제거하고 RBC lysis buffer (Sigma- Aldrich)에 5분간 현탁시켜 적혈구를 제거하였다. 위의 세 포를 RPMI 1640 용액으로 원심 세척한 후, 10% FBS와 1% streptomycin이 함유된 RPMI 1640 용액으로 세포를 희 석한 후 CD4+ T 세포와 CD8+ T 세포를 측정하기 위해 PerCP-Cy5.5-conjugated anti-mouse CD4, PE-Cy7-conjugated anti-CD8a (BD Bioscience)를 tube당 1 μg의 농도로 상온 에서 15분간 염색하였다. 1 mL의 PBS를 넣어 3회 세척한 후, flow cytometry (Cytomics FC500, Beckman, Miami, FL, USA)로 측정하였다. NEVS와 EVS를 경구투여한 마우 스의 비장에서 분리한 T 세포의 cytokine 생성변화를 알아 보기 위하여, 비장에서 분리한 세포를 48 well plate에 well 당 0.5×106개씩 분주한 후, purified anti-mouse CD3e 및 CD28를 0.5 μg/mL의 농도로 처리하여 세포를 자극하였다. 24시간 배양 후 세포의 상층액을 이용하여 ELISA를 실시 하였다. IFN-γ, IL-2, IL-4 및 TNF-α 각각의 ELISA kit (eBioscience)를 이용하여 제조사의 지침대로 측정하였다.
결과 및 고찰
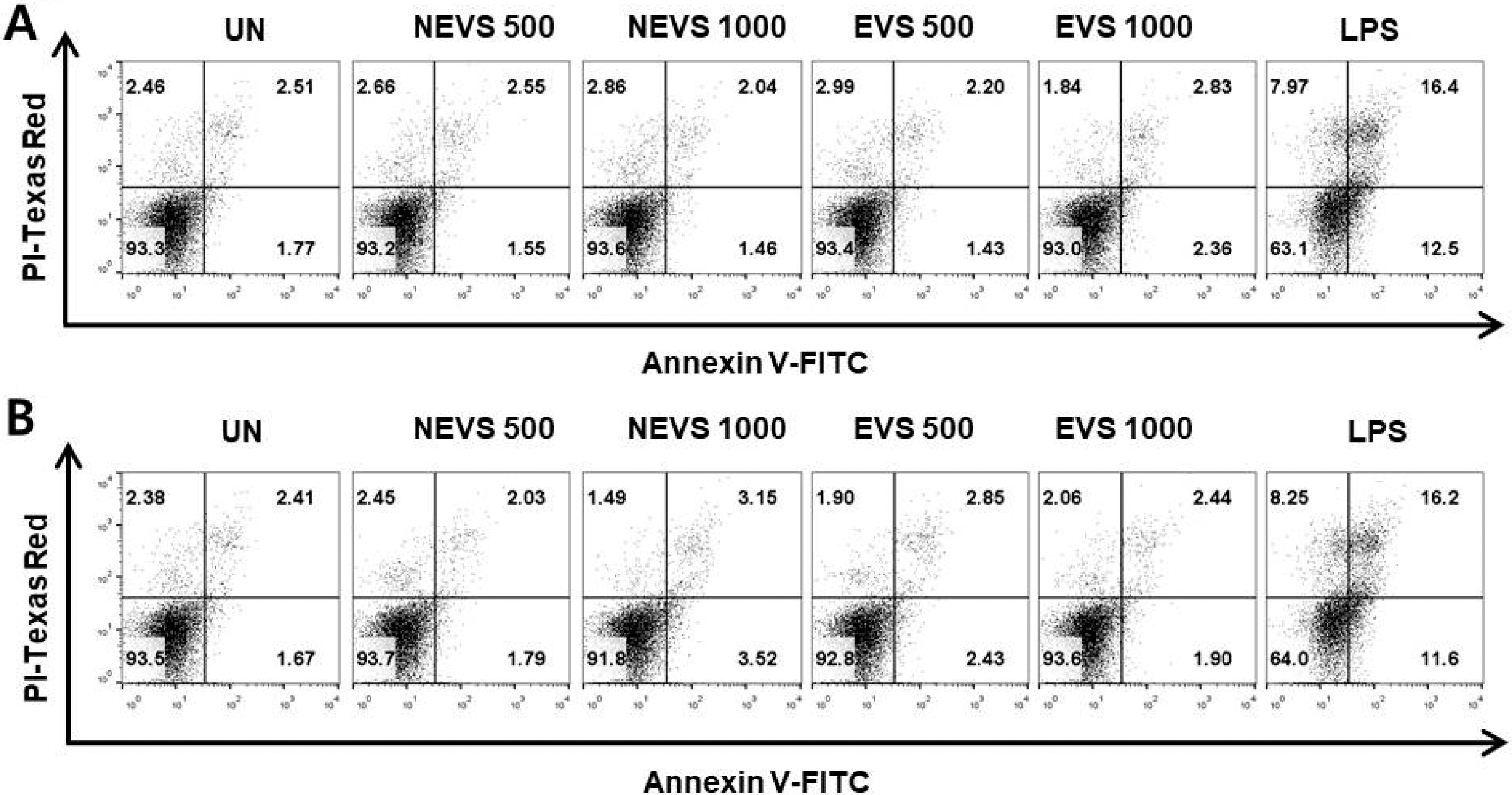
NEVS와 EVS의 처리가 대식세포 및 수지상세포의 세포 생존율에 미치는 영향에 관하여 평가하기 위하여 대식세포 및 수지상 세포에 NEVS와 EVS를 처리하여 MTT 및 WST-1 방법으로 세포 생존율을 관찰하였다(Fig. 1). 그 결 과, NEVS와 EVS의 모든 처리군에서 500 μg/mL, 1000 μg/ mL 처리시 세포독성이 나타나지 않는 것으로 관찰되었다. 또한 NEVS와 EVS의 대식세포 및 수지상세포에 세포자살 (apoptosis)을 유발 시키는지에 관하여 알아보기 위하여 NEVS와 EVS를 500 μg/mL, 1000 μg/mL로 각각 24시간 동 안 처리하고 Annexin V 및 PI로 염색한 후 FACS분석을 통해 세포자살 유무를 관찰 하였다(Fig. 2). 대식세포에 NEVS와 EVS를 처리한 결과, 대조군(Con) (1.77%)과 큰 차이가 나타나지 않았으며, LPS 처리군(12.5%)의 경우 대 조군와 비교하여 일부 세포자살을 유도하는 것으로 관찰되 었다(Fig. 2A). 수지상세포에 NEVS와 EVS를 처리한 결과, 대식세포 실험결과와 유사하게 샘플처리구에서는 큰 차이 가 나타나지 않았으며, LPS 처리군(11.6%)의 경우 대조군 (1.67%)와 비교하여 일부 세포자살을 유도하는 것으로 관찰 되었다(Fig. 2B). 세포내 세포자살이 유발되면 세포막의 유 동성 증가로 인하여, 막 인지질의 비대칭성이 소실되어 내 부에 존재하는 phosphatidyl serine이 세포표면으로 노출이 된다(Kim et al., 2016). Annexin V는 phosphatidyl serine과 특이적으로 결합하여, 세포자살의 표본으로 사용되고 있다. PI는 핵에 결합하는 물질로, 세포자살이 진행되면 세포의 세포막에 생긴 구멍을 통해 세포막으로 들어가 핵을 염색 한다. 따라서 이러한 결과로 미루어 보아 NEVS 및 EVS의 처리는 대식세포 및 수지상세포에서 세포독성에 영향을 미 치지 않았으며, 추후 NEVS 및 EVS의 처리가 면역활성능 에 어떠한 영향을 미치는지 알아보기 위하여 NEVS 및 EVS의 농도를 1000 μg/mL 이하로 고정하여 실험하였다.

대식세포 및 수지상세포는 선천면역에 관여하는 대표적 인 탐식세포로서, 외부로부터 생체로 유입된 바이러스 및 세균과 같은 병원체를 직접적으로 탐식하거나, 사이토카인 과 같은 면역 매개물질을 분비함으로서 면역반응을 유도한 다(Byun & Byun, 2015). 사이토카인은 면역세포 간 신호 전달을 위한 중요한 면역조절인자이며, 대식세포 및 수지 상세포가 생산하는 대표적인 사이토카인으로 TNF-α, IL-6 및 IL-1β 등이 있다(Kim et al., 2017). TNF-α는 종양괴사 인자로서 병원체에 의해 오염된 세포에 대한 세포독성을 일으켜 숙주 방어작용을 유도하며, 감염범위를 극소화 시 켜 초기 면역반응의 중요한 역할 매개한다(Sung et al., 2016). IL-6는 B 세포와 T 세포를 자극시켜 체액성 면역반 응을 조절하고 조혈작용을 증가시키며, IL-1β는 TNF-α와 유사하게 병원성 항원의 확산을 감소시키며, B세포와 T세 포의 세포활성에 관여하여 후천성 면역반응을 촉진시킨다 (Byun, 2017).
NEVS와 EVS의 처리가 대식세포 및 수지상세포의 사이 토카인 분비능에 미치는 영향 을 평가하기 위하여 대식세 포 및 수지상세포에 NEVS와 EVS를 처리하여 배양 상등 액에 존재하는 사이토카인의 함량을 ELISA법으로 측정 하 였다(Fig. 3). 양성대조구인 LPS 처리시, 대식세포의 사이 토카인(TNF-α; 1331.34±74.2 pg/mL, IL-6; 1061.91±56.3 pg/mL, IL-1β; 1056.41±53.2 pg/mL)이 유의적으로 증가하 였고, 수지상세포의 사이토카인(TNF-α; 1444.85±55.5 pg/ mL, IL-6; 1245.19±43.9 pg/mL, IL-1β; 956.77±52.8 pg/ mL)도 증가되는 것으로 관찰되었다. 농도별(500 및 1000 μg/mL) 대식세포의 NEVS 처리구에서 TNF-α의 분비량은, 481.83±76.1 및 635.54±54.7 pg/mL로 나타났으며, IL-6의 분비량은, 390.02±18.8 및 514.20±73.3 pg/mL로 나타났으 며, IL-1β의 분비량은 416.21±49.2 및 522.82±19.7 pg/mL 로 나타났다. 한편 EVS 처리구에서 TNF-α의 분비량은, 829.46±20.8 및 954.40±46.2 pg/mL로 나타났으며, IL-6의 분비량은, 625.53±.25.5 및 835.25±45.5 pg/mL로 나타났으 며, IL-1β의 분비량은, 708.22±42.8 및 919.85±37.1 pg/mL (n=3)로 나타났다. 두 그룹간의 수치를 비교하여 보면 EVS 처리구에서 사이토카인의 분비량이 유의적으로 증가 된 것으로 관찰되었다.
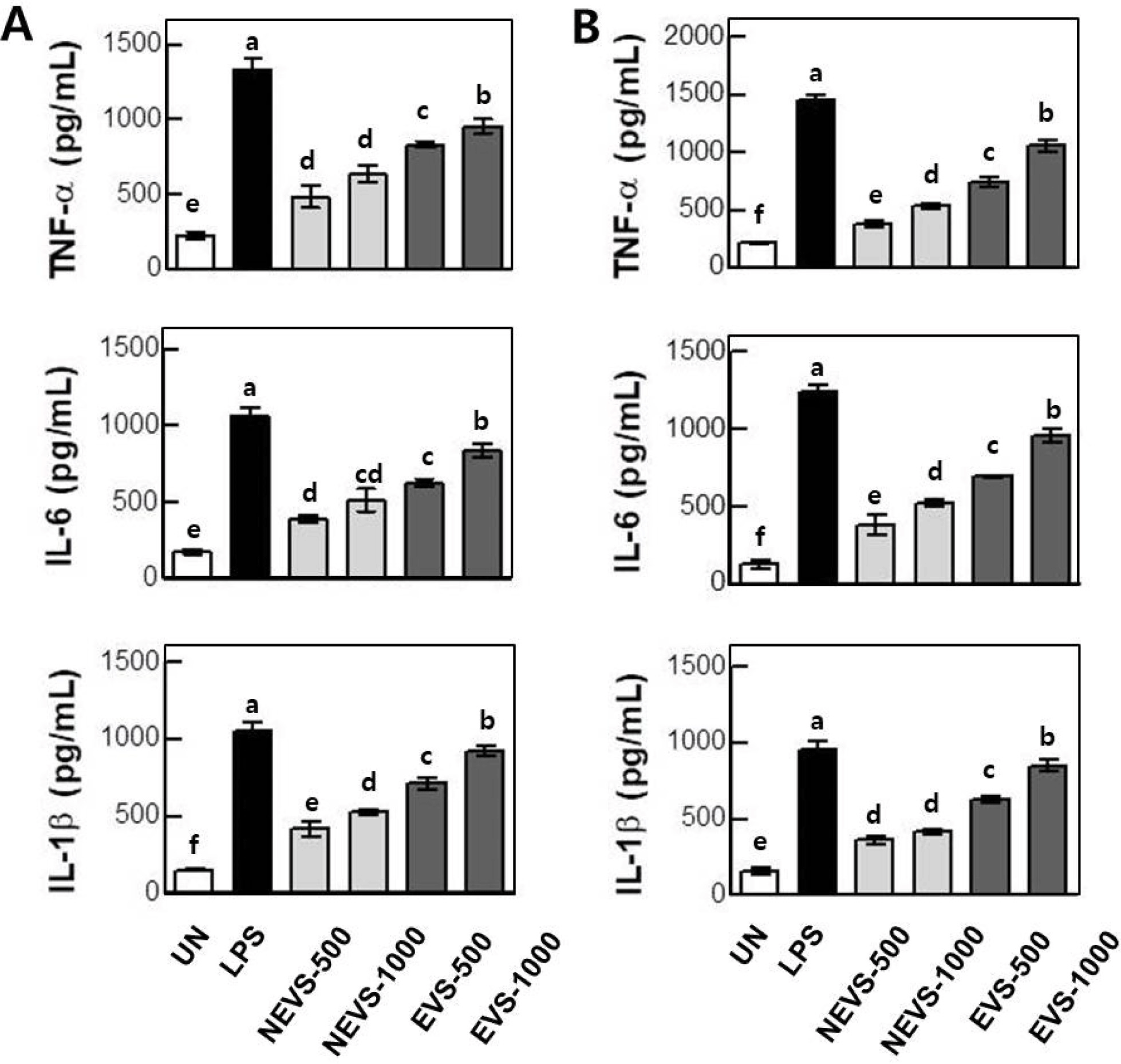
수지상세포에서 NEVS 처리시 TNF-α의 분비량은, 375.36±25.0 및 530.33±20.0 pg/mL로 나타났으며, IL-6의 분비량은, 385.41±65.0 및 520.79±19.9 pg/mL로 나타났으 며, IL-1β의 분비량은, 361.05±25.1 및 415.33±14.8 pg/ mL로 NEVS 처리 농도가 증가할수록 사이토카인의 분비 량 또한 증가하는 것으로 관찰되었다. 한편, EVS 처리구에 서 TNF-α의 분비량은, 744.87±44.4 및 1054.19±45.8 pg/ mL로 나타났으며, IL-6의 분비량은, 694.85±5.3 및 955.15 ±45.8 pg/mL로 나타났으며, IL-1β의 분비량은, 628.82±21.7 및 847.53±41.6 pg/mL로 관찰되었으며, 대식세포의 결과와 유사하게 EVS 처리구에서 사이토카인의 분비능이 유의적 으로 증가되는 것으로 관찰되었다. 따라서, 이러한 결과로 미루어 보아 압출성형 무청을 첨가하여 제조한 야채스프의 경우, 압출성형 처리하지 않은 무청을 첨가하여 제조한 야 채스프보다 면역활성이 더욱더 증가한다고 사료된다.
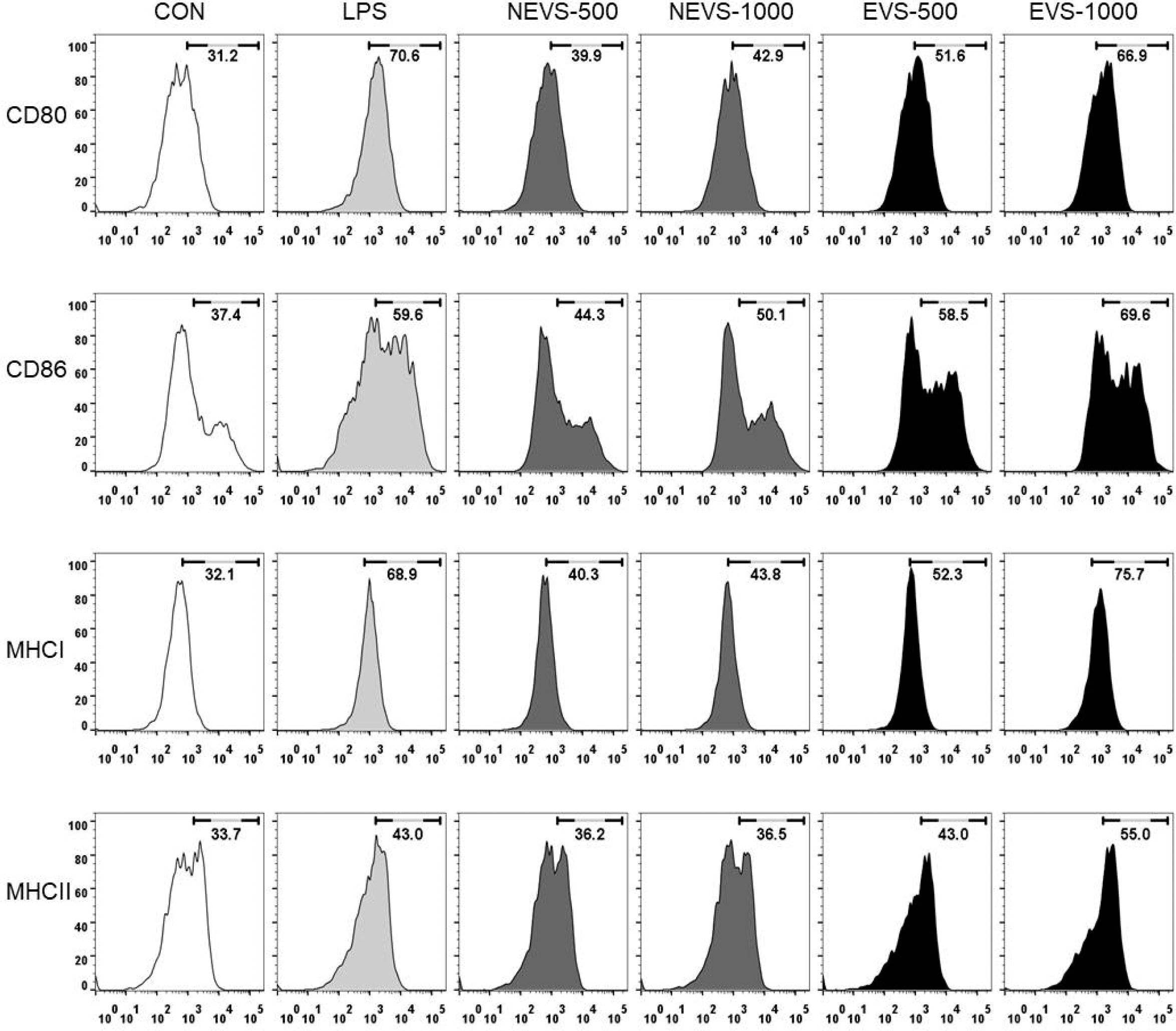
NEVS와 EVS의 처리가 대식세포 및 수지상세포의 세포 표면활성 인자 CD80과 86 및 MHC class I과 II의 발현량 에 미치는 영향을 유세포 분석기를 통하여 관찰하였다(Fig. 4, 5). 대식세포에서 NEVS (500 및 1000 μg/mL) 처리시 세포표면활성 인자의 발현량은, CD80; 39.9, 42.9% CD86; 44.3, 50.1%, MHC class I; 40.3, 43.8%, MHC classII; 36.2, 36.5%로 나타났으며, EVS (500 및 1000 μg/mL) 처 리시 CD80; 51.6, 66.9% CD86; 58.5, 69.6%, MHC class I; 52.3, 75.7%, MHC classII; 43.0, 55.0%로 처리농도가 증가할수록 발현량이 증가되는 것으로 나타났다.
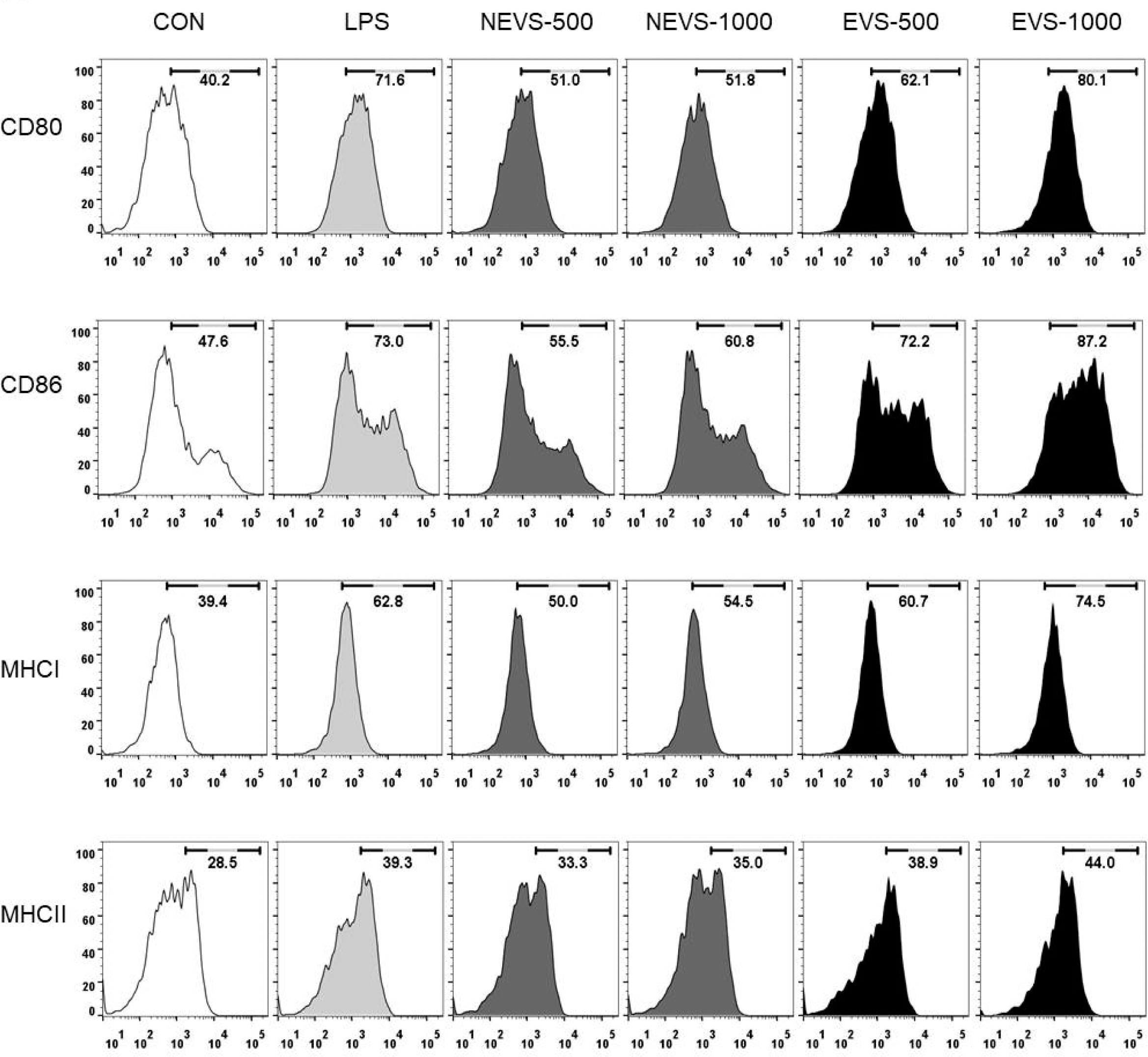
수지상세포에서 NEVS (500 및 1000 μg/mL) 처리시 세 포표면활성 인자의 발현량은, CD80; 51.0, 51.8% CD86; 55.5, 60.8%, MHC class I; 50.0, 54.5%, MHC classII; 33.3, 35.0%로 나타났으며, EVS (500 및 1000 μg/mL) 처 리시 CD80; 62.1, 80.1% CD86; 72.2, 87.2%, MHC class I; 60.7, 74.5%, MHC classII; 38.9, 44.0%로 나타났다. 대 식세포 및 수지상세포에서 NEVS와 EVS 처리군의 CD80 과 86 및 MHC class I과 II의 발현량을 비교하였을 때 동 일 농도에서 EVS 처리군에서 발현량이 크게 증가하는 것 으로 확인되었다.
다양한 면역세포구들은 세포 표면에 가지고 있는 표면 분자구조에 따라 서로를 구분하며, 이러한 구분은 분화집 단(CD)이라는 표현형을 사용한다(Lee et al., 2001). CD는 활성화된 T세포의 분열을 촉진시키는 항원제시 세포로서의 역할시 필수적으로 요구되는 세포막 단백질로 세포의 활성 화와 관련하여 중요한 지표로 이용된다(Cho et al., 2007). 주조직적합성 복합체(major histocompatibility complex; MHC)는 선천성면역 세포들이 후천성 면역세포인 T세포에 외부로부터 유입된 병원체의 항원을 제시할 때 사용하는 막 단백질로 면역반응을 전개한다(Piani et al., 2000). 탐식 세포가 포함하고 있는 주조직적합성 복합체로는 MHC class I과 II가 존재하며 대식세포 및 수지상세포와 같은 탐 식세포가 활성화 되지 않았을 때는 적은 양의 발현이지만, 면역세포들이 활성화가 되면 많은 양이 발현이 된다. MHC class I는 모든 세포에 발현이 되어 있으며, 세포독 성 T세포에 항원을 제시하여 항원을 제시한 세포가 세포 독성 T세포에 의해 제거되며, MHC class II는 특정 면역 세포에만 존재하며 탐식세포가 B세포나 보조T세포에 항원 을 제시하면 그 항원에 대한 면역작용을 활발하게 진행시 킨다. 따라서 CD80, 86, MHC class I 및 II의 발현 증가 는 대식세포와 수지상세포와 같은 탐식세포의 활성화에 매 우 밀접한 관련이 있다(Mo et al., 2017). 이러한 결과로 미루어 보아 EVS의 처리는 대식세포 및 수지상세포의 세 포 표면활성 인자들의 발현을 직접적으로 증가시켜 면역세 포를 활성화시키는 것으로 사료된다.
NEVS 및 EVS의 처리가 후천면역체계를 담당하는 대표 적인 면역세포인 비장세포의 세포증식능 및 사이토카인 분 비능에 미치는 영향에 관하여 평가하기 위하여 마우스 비 장조직으로부터 비장세포 유리시켜 NEVS와 EVS를 처리 하였다.
NEVS와 EVS를 농도별(500 및 1000 μg/mL)로 처리한 결과, NEVS 처리구에서는 101.54±5.0 및 105.78±1.9 pg/ mL로 유의적인 변화가 나타나지 않았지만, EVS 처리구 에서는 109.12±1.4 및 119.65±3.5 pg/mL로 비장세포의 생 존율이 유의적으로 증가하는 것으로 나타났다(Fig. 6). 비 장은 혈액으로부터 항원을 수집하여, T 및 B세포의 성숙 과 분열 및 분화가 이루어지는 주요 림프기관으로 주로 T 세포, B세포 및 대식세포로 구성이 되어있다(Ahn et al., 2014). 따라서 비장세포의 증식은 면역 시스템 활성화에 매우 중요한 의미를 가져 면역활성 물질을 확인시 면역 T 세포의 활성화 정도를 알아보기 위하여 주로 비장세포를 사용한다(Shan et al., 1999). 이러한 결과로 미루어 보아 NEVS 및 EVS의 처리는 상기 제시 된 농도에서 비장세포 에 독성을 미치지 않는 것으로 사료되며, EVS의 처리는 대식세포 및 수지상세포와 같은 선천면역계를 담당하는 탐 식세포뿐만 아니라 후천면역을 담당하는 T 및 B 세포가 다량 존재하는 비장세포에서도 유의적으로 세포 증식능을 증가시켜 면역활성을 유도하는 것으로 판단된다.
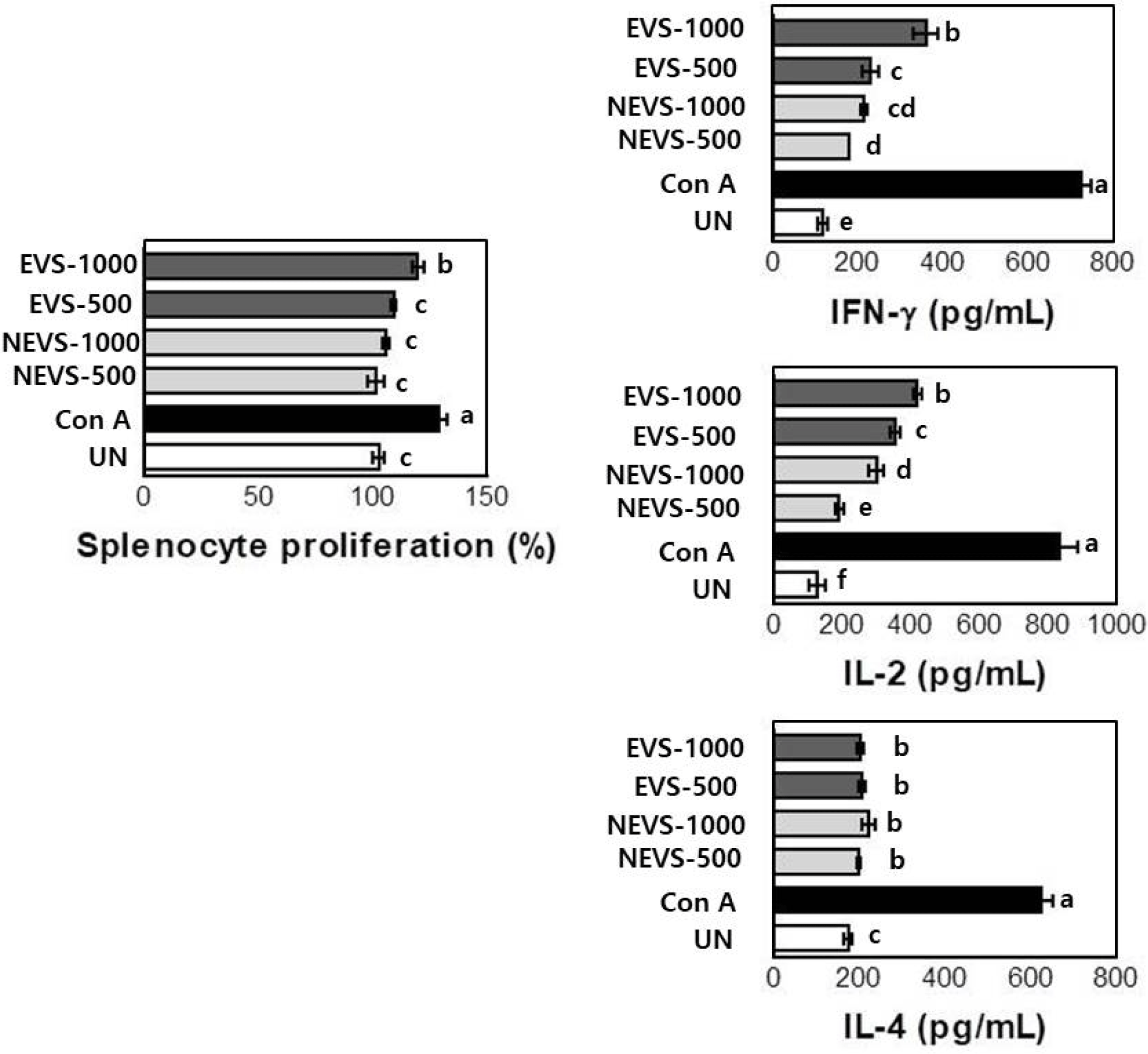
NEVS와 EVS 500 및 1000 μg/mL의 농도로 처리하여, 비장 세포의 사이토카인 분비 특성에 미치는 영향에 관하 여 알아보기 위하여 Th1 세포가 분비하는 대표적인 사이 토카인인 IFN-γ, IL-2와 Th2 세포가 분비하는 대표적인 사 이토카인인 IL-4의 분비능을 측정하였다(Fig. 6). 면역 T 세포는 Th1 세포와 Th2 세포로 분화하며, Th1 세포에서 분비되는 사이토카인의 경우 세포간 신호전달을 수행하여 면역반응에 중요한 역할을 하여 면역활성능을 나타내는 지 표로서 이용되고 있으며, Th2 세포에서 분비되는 사이토카 인은 알레르기 및 아토피와 같은 염증성 반응을 유도한다 고 보고되어 있다(Medzhitov, 2001).
Th1세포가 분비하는 사이토카인인 IFN-γ와 IL-2중 IFN- γ는 대부분의 세포를 표적기관으로 하여 분비되며, 대식세 포에 대해 강력한 활성화 기능을 가지며 항원제시세포에서 MHC class I과 II의 발현을 유도하고 T세포의 분화를 촉 진시켜 호중구와 혈관내피세포의 활성화를 시킨다(Pisa et al., 1992; Sypek et al., 1993; Lee et al., 2013). IL-2는 주 로 활성화된 T세포에서 분비되는 사이토카인으로 T림프구 의 증강효과를 확인할 수 있는 지표로서 사용된다(Grabstein et al., 1994; Howard et al., 1994; Ryu, 2010).
NEVS를 농도(500 및 1000 μg/mL)로 처리한 결과, IFN-γ 의 분비량은, 179.97±1.3 및 214.20±6.7 pg/mL로 나타났으며 IL-2의 분비량은, 193.69±11.3 및 300.38±20.1 pg/mL로 NEVS 처리 농도가 증가할수록 사이토카인의 분비량이 증가하는 것으로 관찰되었지만, 대조적으로 IL-4의 분비량에 대한 변 화는 관찰되지 않았다. 또한 EVS (500 및 1000 μg/mL) 처 리한 결과, IFN-γ의 분비량은, 230.65±20.4 및 359.97±29.8 pg/mL로 나타났으며 IL-2의 분비량은, 354.74±13.9 및 419.45±10.6 pg/mL로 EVS의 처리 농도가 증가할수록 사이 토카인의 분비량이 증가하는 것으로 관찰되었지만, 앞선 결과와 같이 IL-4의 분비량에 대한 변화는 관찰되지 않았 다. 이러한 결과로 미루어 보아 EVS의 처리는 Th2 세포 의 활성화에는 영향을 주지 않는 것으로 사료되며, 면역활 성과 직접적으로 관련이 있는 Th1 세포의 활성화를 통하 여 비장세포의 활성을 유도하는 것으로 판단된다.
NEVS와 EVS의 투여가 마우스의 면역활성에 미치는 영 향에 관하여 관찰하기 위하여 NEVS와 EVS를 7일동안 100 mg/kg의 농도로 경구투여 후 마우스의 비장조직을 적 출하여 비장세포를 유리시켜 T세포의 분포(Fig. 7A) 및 비 장세포 사이토카인 분비능(Fig. 7B)에 관하여 관찰하였다. 후천성면역은 B 세포 및 T세포에 의해 이루어지며, 면역 반응의 전환은 T림프구의 활성화에 따른 매개반응으로 이 루어진다(Clerici et al., 1994; Cannon, 2000). T세포는 수 용체 유전자가 활성화되어 분화단계에서 CD4+와 CD8+로 분류되며, CD4+ T림프구는 사이토카인의 생산에 밀접한 관련이 있으며, CD8+ T림프구는 종양세포와 같은 표적세 포를 직접적으로 파괴하는 역할을 수행한다.
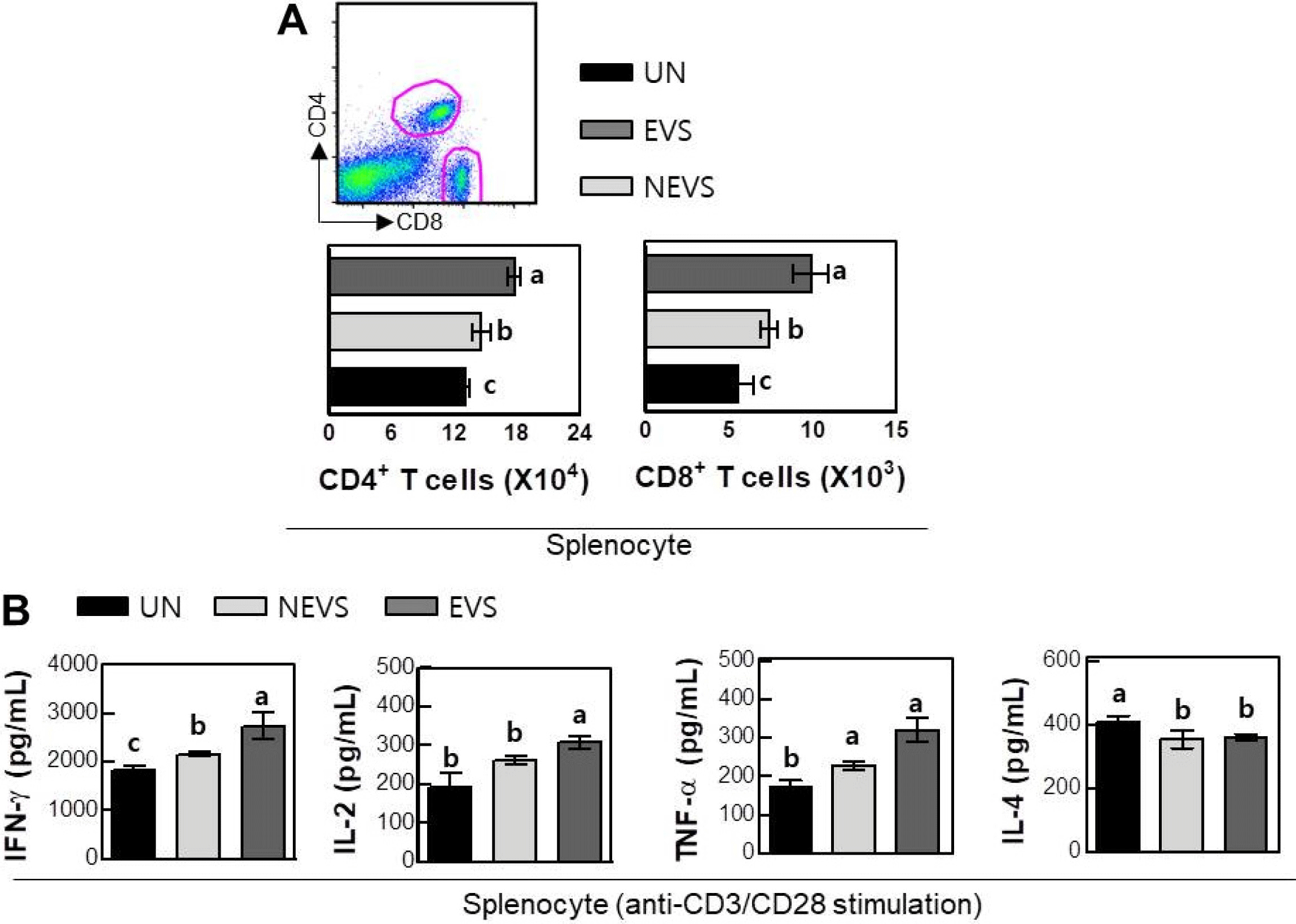
NEVS와 EVS의 투여 후 CD4+ 및 CD8+ T세포 수의 변 화에 관하여 관찰한 결과 두 그룹 모두에서 CD4+ 및 CD8+의 분포가 증가된 것을 확인 할 수 있었으며, 두 그 룹간의 차이를 비교하였을 때 EVS 투여군에서 CD4+ 및 CD8+의 분포가 유의적으로 증가된 것을 관찰할 수 있었다. 따라서 EVS의 투여는 후천성 면역반응의 대표적인 T세포 를 활성화시켜 면역반응을 조절하는 것으로 사료된다.
T세포 활성화에 의해 생성되는 사이토카인들 중 IFN-γ는 면역시스템을 자극하여 Th1 면역반응을 유도한다고 알려 져 있으며, IL-2는 세포매개성 면역반응에 중요한 역할을 하며, TNF-α는 면역세포들을 염증 부위로 보이게 하며 T 세포의 분화와 증식에 관여한다(Knutson & Disis, 2005; Weiss et al., 2007). IL-4는 알레르기와 같은 과민성 면역 반응에 관련된 Th2 세포의 활성화에 의해 생성되는 대표 적인 사이토카인이다. NEVS와 EVS의 투여에 따른 후천 성면역반응의 활성을 관찰하고자 비장세포를 통해 대표적 인 사이토카인인 IFN-γ, IL-2, TNF-α 및 IL-4의 분비량을 측정하였다(Fig. 7B). 그 결과 NEVS 투여군에서 사이토카 인의 분비량은 IFN-γ; 2275.6±147.86 pg/mL, IL-2; 261.03± 11.04 pg/mL, TNF-α; 259.85±38.73 pg/mL으로 대조구와 비 교하였을때 유의적으로 증가하였다. EVS 투여군의 사이토 카인 분비량은 IFN-γ; 2738.80±256.05 pg/mL, IL-2; 307.63± 14.79 pg/mL, TNF-α; 307.60±36.03 pg/mL으로 NEVS 투여 군과 비교하였을 때 유의적으로 사이토카인의 함량이 증 가된 것으로 관찰되었다. 또한 NEVS 및 EVS 투여군에 서의 IL-4의 분비량은 358.80±24.73 및 360.25±8.75 pg/ mL로 대조구와 비교하였을 때 두 그룹 모두 유의적인 감 소가 나타났으나, 두 그룹간의 차이는 나타나지 않았다. 따 라서 NEVS 및 EVS 투여는 Th2 세포의 활성화에는 별다 른 영향을 주지 않고, Th1 세포의 활성에 직접적으로 영향 을 주어 면역활성에 기여한다고 판단된다.
요 약
본 연구는 기존의 야채스프(NEVS)와 압출성형 무청을 첨 가하여 제조한 야채스프(EVS)의 면역활성 차이에 관하여 알아보기 위하여, 마우스의 골수에서 분리한 미분화 골수세 포를 대식세포 및 수지상세포로 각각 분화 시킨 후 EVS와 NEVS를 500 및 1000 μg/mL의 농도로 처리하였을 때, 대식 세포 및 수지상세포의 세포 증식능 및 사이토카인(TNF-α, IL-6 및 IL-1β)의 분비능이 EVS처리구에서 더욱더 증가되 는 것으로 관찰되었다. 또한 활성화된 탐식 세포의 세포 표 면에서 발현되는 CD80과 CD86의 발현과 탐식세포의 항원 제시에 밀접한 관련이 있는 주 조직적합성 복합체(MHC class I 및 II)의 발현이 EVS 처리구에서 유의적으로 증가되 는 것으로 관찰되었다. 또한 후천면역에서 중요한 역할을 수행 하는 면역 T 세포가 다량으로 분포하는 비장 조직으 로부터 유리한 비장세포에 NEVS와 EVS를 처리하여 세포 증식능 및 Th1 세포가 분비하는 사이토카인(IFN-γ 및IL-2) 의 함량을 비교하였을 때 EVS 처리구에서 사이토카인의 함량이 더욱더 증가되는 것을 확인하였다. 또한 NEVS와 EVS를 투여된 마우스의 비장세포로부터 사이토카인(IFN-γ, IL-2 및 TNF-α) 분비능을 측정한 결과 EVS 처리구에서 사 이토카인의 분비가 NEVS와 비교하여 유의적으로 증가되는 것으로 나타났다. 따라서 압출성형 처리된 무청을 첨가하여 제조한 야채스프의 경우 기존의 야채스프에 비교하여 면역 활성이 월등히 증가하는 것으로 판단된다.