Article
어피 펩타이드 리포좀 대량생산 최적 조건 및 저장 안정성
이중규1, 이윤정1, 백정정1, 김수진2, 조영재1,3, 최미정1,*
Optimization and Scale-up of Fish Skin Peptide Loaded Liposome Preparation and Its Storage Stability
JungGyu Lee1, YunJung Lee1, JingJing Bai1, Soojin Kim2, Youngjae Cho1,3, Mi-Jung Choi1,*
1Department of Food Science and Biotechnology of Animal Resources, Konkuk University
2Materials Science laboratory R&D Center, Dyne soze additives and ingredients
3Animal Resources Research Center, Konkuk University
* Corresponding author: Mi-Jung Choi, Department of Food Science and Biotechnology of Animal Resources, Konkuk University, 120 Neungdong-ro, Gwangjin-gu, Seoul 05029, Korea Tel: +82-2-450-3048; Fax: +82-2-450-1044 E-mail
choimj@konkuk.ac.kr
© Korean Society for Food Engineering. All rights reserved.
Received: Oct 16, 2017; Accepted: Nov 4, 2017
Abstract
Fish skin peptide-loaded liposomes were prepared in 100 mL and 1 L solution as lab scales, and 10 L solution as a prototype scale. The particle size and zeta potential were measured to determine the optimal conditions for the production of fish skin peptide-loaded liposome. The liposome was manufactured by the following conditions: (1) primary homogenization at 4,000 rpm, 8,000 rpm, and 12,000 rpm for 3 minutes; (2) secondary homogenization at 40 watt (W), 60 W, and 80 W for 3 minutes. From this experimental design, the optimal conditions of homogenization were selected as 4,000 rpm and 60 W. For the next step, fish peptides were prepared as the concentrations of 3, 6, and 12% at the optimum manufacturing conditions of liposome and stored at 4ºC. Particle size, polydispersion index (pdI), and zeta potential of peptide-loaded liposome were measured for its stability. Particle size increased significantly as manufacture scale and peptide concentration increased, and decreased over storage time. The zeta potential results increased as storage time increased at 10 L scale. In addition, 12% peptide showed the formation of a sediment layer after 3 weeks, and 6% peptide was considered to be the most suitable for industrial application.
Keywords: fish skin peptide; liposome; scale up production
서 론
리포좀은 인지질을 주성분으로 하여 이중층으로 한 층 이 상의 막으로 둘러싸인 인공적으로 제조한 구상형태의 미셀 (micelle)을 말한다(Yoo et al., 2002;Akbarzadeh et al., 2013). 리포좀은 pH, 온도와 같은 외부 환경으로부터 기능성 성분 보호를 위해 코팅 목적으로 사용되어 진다. 코팅 막 주재료 인 인지질은 독성이 없고(Oh et al., 2006), 체내에서 생분 해가 가능하며, 이중층으로 형성되어 수용성, 지용성 성분 모두 포집 가능(Jin & Yoo, 2001)한 장점을 가지고 있다. 리포좀은 제조 방법이 쉽고, 높은 생체적합성 등의 이유로 식품 산업에서 사용하기에 적합하다(Xia & Xu, 2005). 식 품분야에서의 리포좀에 관한 연구로는 효소(Kim et al., 2015;Wilkinson & Kilcawley, 2005), 에센셜 오일(Cox et al., 2000), 이취 저감, 미생물(Park et al., 1994), 영양 및 기 능성 성분 등 포집할 때 주로 사용되어졌다. 기술적인 방법 으로는 초음파 및 압력(Lee et al., 2008), 초임계 증발법 (Lee et a.l, 2010), ethanol 주입법(Sebally et al., 2016)이 사용되어졌으며, 그에 따른 크기 및 형태가 또한 다양하게 나타난다(Kim et al., 1983;Zawada et al., 2004). 하지만, 리포좀은 수용액 내에서 보관 시 응집, 인지질의 가수분해, 산화, 저장 시 이화학적 불안정함 등의 단점이 있으며(Kim et al., 2005), 이를 해결하기 위해서 미세 분말화하여 저장 하거나(Kim et al., 2004;Kang, 2014) cholesterol 등을 혼합 (Sułkowski et al., 2005;Cui et al., 2015)하여 제조 하는 등 안정성을 증진시키려는 여러 연구가 진행되고 있다.
리포좀의 산업적 적용가능성을 확인한 연구로는 Wagner & Vorauer-Uhl (2010), Carugo et al. (2016) 등이 있다. Wagner & Vorauer-Uhl (2010)은 lab scale에 한정적으로 개 발된 첨단 기술을 산업적 규모로 적용하기 위해서는 대량생 산을 가능케 할 적절한 방법이 존재하여야 하며, 상품의 개발, 구현, 품질관리에는 추가적인 시간과 노력이 필요하 다고 보고하였다. Carugo et al. (2016)은 microfluidic 방법 과 같은 새로운 기술을 사용하여 개발한 리포좀 제조방법 은 기존의 제조 방법들보다 개선된 리포좀 제조방법 일 수 있으나, 대량 생산 가능성 및 체계적 생산방법, 임상적 적 용을 위한 적절성, 생체활성 효율 등을 우려 사항으로 제 기하였다. 또한 리포좀의 산업적 규모로 구현하였을 때 리 포좀 생산 공장의 투자 및 공급 원료의 가격이나 생산을 통한 경제적 이득을 고려하여야한다(Charcosset et al., 2015). 현재 리포좀이 상용화된 제품에는 홍삼 함유 천연 리포좀(M&C Life Science, 2015) 등이 존재한다.
어피는 수산가공 중에 버려지는 수산부산물이지만 콜라 겐(Jung et al., 2014) 및 여러 단백질, 지방 등의 다양한 기능성 영양성분들이 포함되어있다(Park et al., 2011). 또 한 광우병 및 구제역으로 인해 동물성 콜라겐 안전성 확보 가 어려워짐에 따라서 해양자원으로부터 추출한 콜라겐의 수요가 증가하고 있다(Jung et al., 2014). 어류 유래 펩타 이드는 특유의 향으로 인해서 다른 향이 가려지게되어 식 품에 사용하는 것이 제한된다(Cho et al., 2015). 따라서 리 포좀으로 코팅함에 따라서 이취 저감 효과를 기대할 수 있 다. 또한 Kim & Lee (2015)는 수산부산물을 산업화하기 위해서 체계적인 시스템 구축과 동시에 대부분의 연구가 고부가가치물질 추출 등으로 전개되어 왔으며, 산업화를 위한 규모화된 연구가 필요함을 보고하였다. 따라서 본 연 구에서는 lab scale 용량으로 100 mL, 1 L 단위로 리포좀 을 제조하였으며, prototype type으로서 10 L 단위로 리포 좀의 제조한 뒤 입자 크기 및 포집 효율을 측정하여 최적 제조 조건 및 농도를 선정하고 그에 따른 저장 안정성을 평가하였다.
재료 및 방법
재료 및 시약
코팅제인 레시틴(LIPOID S 75, fat free soybean phospholipids with 70% phosphatidylcholine)은 Lipoids GmbH (Ludwigshafen, Switzerland)에서 구입하여 사용하였고, 어피 펩타이드(Marine P)는 Weishardt International (Graulhet, France)에서 구입하였다.
Blank 리포좀 최적 조건 설정
증류수에 1% 레시틴을 첨가하여 30분 동안 교반하여 1% 레시틴 용액을 100 mL, 1 L, 10 L 용량으로 각각 1차, 2차 균질을 진행하여 제조하였다. 1차 균질 조건은 high speed homogenizer (T25 digital Ultra-turrax® high-speed mixer, IKA, Staufen, Germany)를 사용하여 3분간 각각 4,000 rpm, 8,000 rpm, 12,000 rpm으로 균질하여 리포좀을 제조하여 입자크기 및 제타전위를 측정하였다. 이 중 1차 균질 최적 조건을 설정하여 2차 균질 조건 실험을 진행하 였다. 2차 균질 조건은 초음파균질기(Model HD-2200, BANDELIN electronic·GmbH & Co. KG, Berlin, Germany) 를 이용하여 각각 40W, 60W, 80W로 3분간 균질하여 2 차 균질 최적 조건을 확립하였다.
어피 펩타이드 리포좀 제조
앞서 최적화한 blank 리포좀에 어피 펩타이드 농도를 각 각 3, 6, 12, 24%로 설정하여 첨가한 뒤 어피 펩타이드 리포좀을 100mL, 1 L, 10 L 용량으로 제조하였다.
리포좀 저장 조건
앞서 선정한 펩타이드 리포좀의 제조 조건(12,000 rpm, 60W, 3, 6, 12%)에 따라 제조한 리포좀을 4°C에서 4주 동안 냉장고(R-B501QM, LG, Seoul, Korea)에서 저장하며 입자크기 및 제타 전위를 측정하여 안정성을 측정하였다.
입자 크기 및 제타 전위 측정
리포좀 최적 조건 및 저장 기간에 따른 입자 크기, polydispersity index (pdI) 및 제타 전위를 큐벳(DTS1070, Malvern Instruments Ltd., Worcestershire, UK)에 각각 1mL씩 취하여 입도분석기(Zetasizer Nano ZS 90, Malvern Instruments, Worcestershire, UK)로 각각 3회 반복 측정하였다.
통계분석
통계분석은 SPSS 통계프로그램(Ver. 22.0 SPSS Inc., Chicago, IL, USA)을 사용하여 평균과 표준편차를 산출하 였으며, 분석결과에 대해 각 균질 조건, 펩타이드 농도, 저 장 기간에 따른 효과를 알아보기 위해 이원분산분석(twoway ANOVA)을 실시하였다. 시료간의 유의적인 차이를 검 증하기 위해서 ANOVA 분석을 통하여 Duncan's multiple range test를 p<0.05 수준에서 실시하였다.
결과 및 고찰
최적 blank 리포좀 조건 설정
균질 처리와 펩타이드 농도가 입자크기와 제타전위에 미 치는 영향을 이원분석한 결과를 Table 1에 나타내었다. 모 든 요인이 입자크기에 유의적으로 영향을 미쳤다(p<0.001). 입자크기와 제타 전위는 초고속균질 처리하였을 때와 초음 파 처리하였을 때 모두 제조용량이 가장 크게 유의적으로 영향을 주는 것으로 나타났으며(p<0.001), PdI는 초음파 처 리 시 제조 용량에 따라 유의적으로 영향을 받았으며 이외 에는 유의적으로 영향을 미치지 않았다.
Table 1.
Manufacturing and storage condition of blank liposome and fish peptide liposome
|
|
Treatment |
Condition |
Treatment time |
|
|
Primary homogenization condition |
High speed homogenizer |
4,000 rpm, 8,000 rpm, 12,000 rpm |
3 min |
|
Secondary homogenization condition |
Ultra sonification |
40W,60W,80W |
3 min |
|
Peptide concentration |
Concentration |
3%, 6%, 12%, 24% |
|
|
Storage condition |
Refrigeration |
4oC |
4 weeks |
Download Excel Table
제타전위는 입자의 안전성을 나타내며, 전위 값의 절대 치가 증가할수록 입자간의 반발력이 높아져 입자의 안전성 은 높다고 알려져 있다(Lim et al., 2010). 1차 균질 조건 및 제조용량에 따라 입자 크기 및 제타 전위를 측정한 결 과를 Fig. 1에 나타내었다. 전반적인 입자크기는 300 nm에 서 450 nm 사이에서 리포좀이 형성되었으며, 균질 속도가 증가할수록 입자크기가 유의적으로 감소하였다. 제조용량 이 증가할수록 입자크기가 증가하는 결과가 나타났고, PdI 값은 균질 속도가 증가할수록 감소하는 경향을 보였다. 제 타전위 측정결과 100 mL 단위로 제조하였을 때 균질속도 가 증가함에 따라서 유의적으로 제타전위의 절대 값이 증가 하였으나 8,000 rpm, 12,000 rpm에서는 균질속도에 따른 유 의적 차이는 보이지 않았다. 전반적으로 제조용량에 따른 유의적인 차이는 존재하였으나 그 값의 차이가 다소 나타 났고, 제타 전위의 절대값도 큰 차이를 보이지 않았다. 이 에 따라 산업적 공정비율을 고려하였을 때 4,000 rpm이 제 조용량증가에 따른 최적 1차 균질조건으로 생각된다.
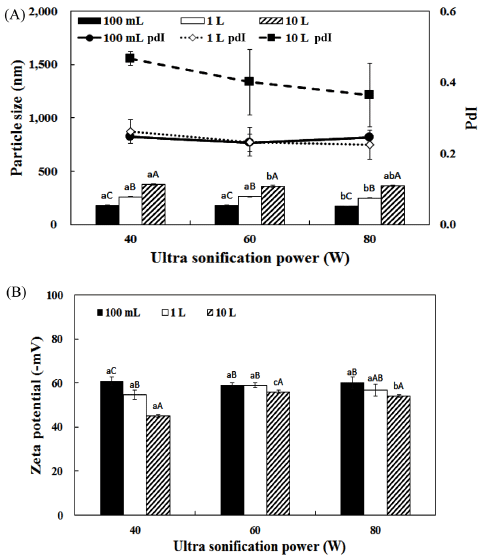
Fig. 1.
Comparison of particle size (A) and zeta potential (B) of blank liposome depending on manufacture scale and high speed homogenizer condition.
a-cDifferent superscript letters mean significantly different between homogenizer condition at p<0.05 level by Duncan's multiple range test. A-CDifferent superscript letters mean significantly different between manufacture scale at p<0.05 level by Duncan's multiple range test.
Download Original Figure
2차 균질 조건 및 제조용량에 따라 입자 크기 및 제타 전위를 측정한 결과를 Fig. 2에 나타내었다. 2차 균질 이후 전체적인 입자크기는 감소하였으며 초음파 균질 전력이 증 가함에 따라 입자크기는 감소하였다. 또한 제조용량이 증 가함에 따라서 입자크기 또한 증가하여 1차 균질 조건 결 과와 같은 경향이 보였다. 이는 초음파 균질기의 probe가 용액의 중앙에서 초음파를 처리하는 형태로 진행되기 때문 에 용량이 커질수록 초음파가 영향이 적어진 것으로 생각 된다. 또한 제조용량이 10 L일 때, 다른 제조 용량에 비해 서 pdI값이 높은 것으로 나타났다. 제타 전위 측정 결과, 제조용량이 증가함에 따라서 증가하는 경향을 나타내었다. 균질 전력에 따른 입자크기는 크게 차이를 보이지 않았으 며, 40W에 비해서 60W와 80W 조건에서 제타 전위가 안정된 결과를 보였다. 최종적으로 산업적 공정비용을 고 려하여 60W를 최적 조건으로 설정하였다. 본 연구에서 제조한 lab-scale blank 리포좀의 크기는 170-250 nm로 나 타났으며, 이는 Lee et al. (2016)는 레시틴을 사용하여 NaCl을 1, 2차 균질하여 리포좀 코팅한 결과와 비슷한 크 기로 나타났다. 1차, 2차 균질 결과 균질 속도와 초음파 전력이 증가할수록 입자크기가 감소하는 경향이 관찰되었 다. Park et al. (2012)는 균질속도가 증가할수록 초음파 처 리가 길수록 입자크기가 감소하였다고 보고하였다. 균질 최적조건 선정결과 전체적으로 제조 용량이 증가할수록 입 자크기가 유의적으로 증가하는 경향을 나타났다. 본 연구 결과 또한 1, 2차 균질이 용액 중앙에서 균질하는 형태로 진행되기 때문에 상대적으로 외곽 부분까지 영향이 덜 미 치는 것으로 사료된다.
Fig. 2.
Comparison of particle size (A) and zeta potential (B) of blank liposome depending on manufacture scale and ultrasonificator condition.
a-cDifferent superscript letters mean significantly different between ultrasonificator condition at p<0.05 level by Duncan's multiple range test. A-CDifferent superscript letters mean significantly different between manufacture scale at p<0.05 level by Duncan's multiple range test.
Download Original Figure
어피 펩타이드 리포좀 제조
이원배치분산분석 결과(Table 2)에서 펩타이드 농도에 따 라서 리포좀을 제조하였을 때는 입자크기 및 제타 전위에 펩타이드 농도가 가장 크게 유의적으로 영향을 주었으며 (p<0.001), pdI에는 유의적으로 영향을 미친 요인이 존재하 지 않았다(p>0.05).
Table 2.
F-values for the particle size, pdI and zeta potential of peptide liposome by peptide concentration, manufacture scale and storage period
|
|
|
Particle size |
PdI |
Zeta potential |
|
|
Primary homogenization condition |
Homogenizer speed |
359.83***
|
1.77 |
4.18*
|
|
Manufacture scale |
392.93***
|
0.29 |
33.73***
|
|
Homogenizer speed + Manufacture scale |
11.28***
|
0.99 |
2.96*
|
|
|
Secondary homogenization condition |
Ultrasonificatior power |
10.93***
|
2.29 |
18.18***
|
|
Manufacture scale |
3255.50***
|
35.62***
|
57.02***
|
|
Ultrasonificatior power + Manufacture scale |
5.44**
|
0.81 |
12.53***
|
|
|
Peptide concentration |
Peptide concentration |
673.82***
|
0.62 |
53.71***
|
|
Manufacture scale |
555.56***
|
0.72 |
1.97 |
|
Peptide concentration + Manufacture Scale |
148.47***
|
0.69 |
0.56 |
Download Excel Table
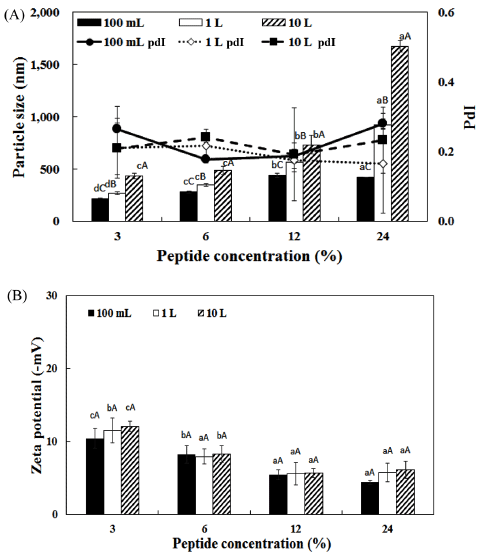
펩타이드 농도 및 제조용량에 따라 입자 크기 및 제타 전위를 측정한 결과를 Fig. 3에 나타내었다. 펩타이드 첨가 농도가 및 제조 용량이 증가함에 따라서 리포좀의 입자크 기는 유의적으로 증가하였으며, 제타 전위는 감소하는 경 향이 나타났다. 제타전위 값의 경우 절대 값이 blank 리포 좀에 비해서 크게 감소하였다. 어피 펩타이드의 경우 pH에 따라서 제타전위 값이 변하는데 본 연구의 펩타이드 리포 좀의 pH는 6.3으로 Yuping et al. (2009)에 따르면 pH 6.3 의 펩타이드 용액의 제타전위는 약 5 mV이다. 따라서 펩 타이드가 첨가됨에 따라서 제타전위가 감소한 것으로 생각 된다. Prototype type으로 펩타이드를 제조하였을 때 3, 6% 펩타이드 리포좀은 430-480 nm의 크기를 나타내었고, 12% 와 24%에서 각각 유의적으로 증가하는 경향을 나타내었다 (p<0.05). 특히 10 L 단위 제조에서 펩타이드 농도를 24% 이상 첨가하였을 때 입자크기는 1 mm 이상으로 크게 증가 하였다. 이후 저장 실험은 24%를 제외한 3, 6, 12% 세 가 지 어피 펩타이드 농도를 설정하여 진행하였다.
Fig. 3.
Comparison of particle size (A) and zeta potential (B) of fish peptide liposome depending on manufacture scale and peptide concentration.
a-dDifferent superscript letters mean significantly different between peptide concentration at p<0.05 level by Duncan's multiple range test. A-CDifferent superscript letters mean significantly different between manufacture scale at p<0.05 level by Duncan's multiple range test.
Download Original Figure
어피 펩타이드 리포좀 저장 안정성
펩타이드 리포좀의 입자크기와 제타전위에 펩타이드 농 도와 제조 용량, 저장 기간이 미치는 영향을 이원분석한 결과를 Table 2에 나타내었다. 입자크기 및 제타전위는 농 도, 제조용량, 저장기간 3가지 요인 모두에서 유의적으로 영향을 받는 것으로 나타났으며(p<0.001), Table 1의 펩타 이드 제조 농도와 동일하게 펩타이드 농도가 입자크기와 제타 전위에 유의적으로 가장 큰 영향을 미쳤다(p<0.001). PdI는 저장기간에 가장 크게 유의적으로 영향을 받았다 (p<0.001). 펩타이드 농도와 제조 용량은 유의적으로 영향 을 미치지 않은 것으로 나타났다(p>0.001).
Table 3.
F-values for the particle size, pdI and zeta potential of peptide liposome by peptide concentration, manufacture scale and storage period
|
|
Particle size |
PdI |
Zeta potential |
|
|
Peptide concentration |
576.14***
|
0.01 |
223.87***
|
|
Manufacture scale |
530.09***
|
0.23 |
107.94***
|
|
Storage period |
18.13***
|
8.97***
|
110.61***
|
|
Peptide concentration+Manufacture scale |
4.64***
|
0.39 |
38.24***
|
|
Peptide concentration+Storage period |
7.88***
|
1.36 |
14.29***
|
|
Manufacture scale+Storage period |
6.25***
|
1.23 |
25.32***
|
|
Peptide concentration+Manufacture scale+Storage period |
6.11***
|
2.31*
|
10.37***
|
Download Excel Table
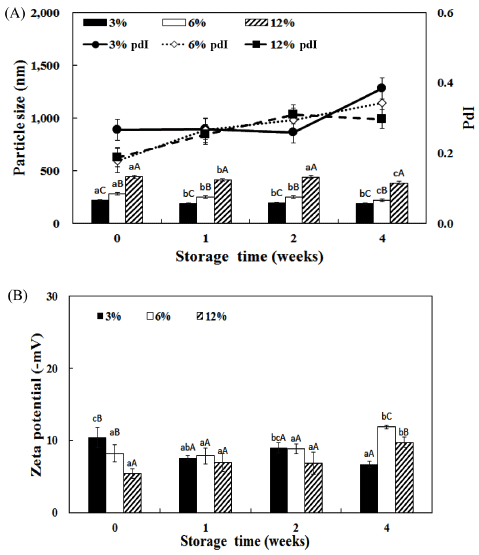
Fig. 4.
Comparison of particle size (A) and zeta potential (B) of fish peptide liposome manufactured in 100 mL depending on manufacture scale and peptide concentration.
a-cDifferent superscript letters mean significantly different between peptide concentration at p<0.05 level by Duncan's multiple range test. A-CDifferent superscript letters mean significantly different between storage time at p<0.05 level by Duncan's multiple range test.
Download Original Figure
Fig. 5.
Comparison of particle size (A) and zeta potential (B) of fish peptide liposome manufactured in 1 L depending on manufacture scale and peptide concentration.
a-cDifferent superscript letters mean significantly different between peptide concentration at p<0.05 level by Duncan's multiple range test. A-CDifferent superscript letters mean significantly different between storage time at p<0.05 level by Duncan's multiple range test.
Download Original Figure
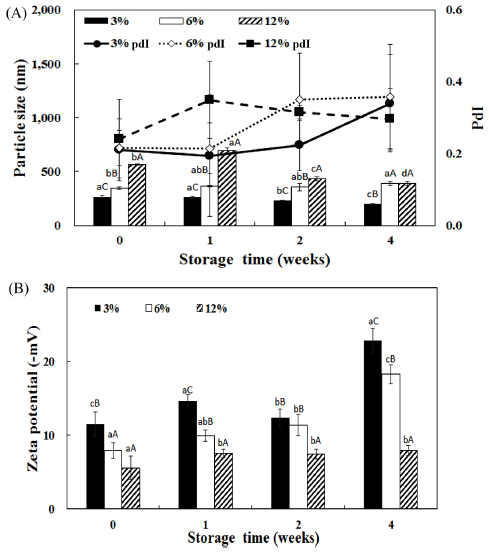
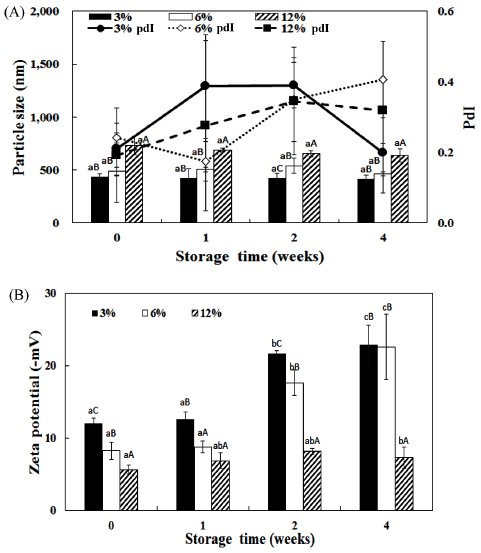
입자크기는 제조용량과 펩타이드 농도가 증가함에 따라 서 유의적으로 증가하는 경향을 보였으며, 저장기간이 증 가함에 따라서 감소하는 경향을 보였다. 제타전위는 저장 기간이 증가함에 따라서 증가하는 경향을 보였다. 10 L 용량으로 제조하였을 때 저장기간에 따라서 입자크기가 감소하였으나, 유의적인 차이는 보이지 않았다. 제타 전위 는 펩타이드를 3, 6% 첨가하였을 때 저장기간이 증가함 에 따라서 유의적으로 증가하는 경향을 보였으며, 12%에 서는 저장기간에 따른 유의적인 차이를 보이지 않았다. 추가적으로 실험을 진행하면서 12% 농도로 10 L로 제조 한 리포좀은 3주 이상 저장하였을 시에 침전물이 발생하 여 상대적으로 불안정한 것으로 생각되어 6% 농도의 어 피 펩타이드 리포좀이 산업적으로 적용하기에 적당하다고 판단된다.
Fig. 6.
Comparison of particle size (A) and zeta potential (B) of fish peptide liposome manufactured in 10 L depending on manufacture scale and peptide concentration.
a-cDifferent superscript letters mean significantly different between peptide concentration at p<0.05 level by Duncan's multiple range test. A-CDifferent superscript letters mean significantly different between storage time at p<0.05 level by Duncan's multiple range test.
Download Original Figure
요 약
본 연구에서는 lab scale 용량으로 100 mL, 1 L 단위로 리포좀을 제조하였으며, prototype scale로서 10 L 단위로 blank 리포좀의 제조한 뒤 입자 크기 및 포집 효율을 측정 하여 최적 제조 조건 선정하였다. 선정한 최적조건으로 어 피 펩타이드를 리포좀으로 포집하여 그에 따른 저장 안정 성을 평가하였다. 1차 균질 조건은 초고속균질기를 사용하 여 3분간 각각 4,000 rpm, 8,000 rpm, 12,000 rpm으로 균질 하였으며, 2차 균질 조건은 초음파균질기를 이용하여 각각 40W, 60W, 80W로 3분간 균질하여 최적 균질 조건을 확 립한 뒤 어피 펩타이드 리포좀을 농도에 따라 제조하여 4°C에서 냉장 저장하였다. 최적 제조 조건 실험 결과를 two-way ANOVA로 분석한 결과 1, 2차 균질에서는 제조 용량이 입자크기와 제타 전위에 유의적으로 가장 큰 영향 을 미쳤으며(p<0.001), pdI는 2차 균질 조건에서 제조용량을 제외하고는 어떤 요인도 유의적으로 영향을 미치지 못하였 다(p>0.05). 1차 균질 실험 결과 lab scale에서 prototype scale로 제조 용량이 증가하였을 때, 유의적으로 입자크기가 증가하였으며(p<0.05), 가장 입자크기가 작고 제타전위의 절대값이 높은 4,000 rpm을 최적조건으로 선정하였다. 2차 균질 실험결과 40W에서 제조 용량이 증가하였을 때 유의 적으로 제타전위가 감소하였으며, 60 W 이상에서는 안정적 인 결과가 나타났다. 리포좀의 산업적 적용을 고려할 때 공정비용 감소 측면에서 80W보다 60W가 적절하다고 사 료된다. 선정된 리포좀 최적 조건으로 농도(3, 6, 12, 24%) 별로 어피 펩타이드를 포집하였을 때, 24%에서 입자크기 가 1 mm 이상으로 크게 나타났다. 이후 저장실험에서는 24%를 제외한 3가지 조건으로 진행하였다. 1달간 어피 펩 타이드 리포좀을 냉장 저장한 결과를 two-way ANOVA로 분석한 결과, 펩타이드 농도에 따라 제조하였을 때는 입자 크기와 제타 전위가 제조용량보다 펩타이드 농도에 더 큰 영향을 받았다. 또한 저장기간은 pdI에 유의적으로 영향을 미치는 것으로 나타났다(p<0.001). 입자크기는 제조용량과 펩타이드 농도가 증가함에 따라서 유의적으로 증가하였으 며, 저장기간에 따라서 감소하였다. 제타전위는 10 L 용량 에서 저장기간에 따라 증가하는 경향을 보였다. 이는 리포 좀이 풀리면서 비표면적이 증가하여 제타전위가 증가한 것 으로 사료된다. 또한 12%에서 3주차부터 침전물층이 형성 되는 것이 관찰되어 6%가 가장 산업적용으로 적합한 농도 로 사료된다.
감사의 글
본 연구는 농림수산식품부 고부가가치식품기술개발사업(세 부과제명: 저분자 펩타이드와 커큐민을 이용한 나노식품 제 조기술의 산업체 상용화 연구 및 제품 개발, 세부과제번호: 314058-3)에 의해 이루어진 것임.
References
Akbarzadeh A, Rezaei-Sadabady R, Davaran S, Joo SW, Zarghami N, Hanifehpour Y, Samiei M, Kouhi M, Nejati-Koshki K.2013. Liposome: classification, preparation, and applications. Nanoscale Res. Lett. 8: 102.



Charcosset C, Juban A, Valour JP, Urbaniak S, Fessi H.2015. Preparation of liposomes at large scale using the ethanol injection method: Effect of scale-up and injection devices. Chem. Eng. Res. Des. 94: 508-515.

Cho HN, Cho DW, Hurk BS, Bae HA, Kim DE, Baek HH.2015. Characterization of off-odor compounds of collagen peptides from tilapia scale using GC-MS-olfactometry. Food Sci. Biotechnol. 24: 403-410.

Cox SD, Mann CM, Markham JL, Bell HC, Gustafson JE, Warmington JR, Wyllie SG.2000. The mode of antimicrobial action of the essential oil of Melaleuca alternifolia (tea tree oil). J. Appl. Microbiol. 88: 170-175.


Cui M, Wu W, Hovgaard L, Lu Y, Chen D, Qi J.2015. Liposomes containing cholesterol analogues of botanical origin as drug delivery systems to enhance the oral absorption of insulin. Int. J. Pharm. 489: 277-284.


Jin BS, Yoo JY.2001. A study on the characteristics and stability of liposomes. J. Life Sci. Stud. 6: 74-81.
Jung YM, Bnag EJ, Kang ST.2015. Quality characteristics of noodles added with freeze-dried fish scale collagen mixture powder. J. Korean Soc. Food Sci. Nutr. 44: 449-454.

Kang MJ.2014. Preparation and evaluation of proliposomes by freeze-drying method. MS thesis, Seoul National Univ., Seoul, Korea.
Kim DY, Lee JS.2015. Directions for eco-friendly utilization and industrialization of fishery by-products. J. Fish. Mar. Sci. Educa. 27: 566-575.

Kim KI, Lee SY, Lee JS, Lee JG, Min SG, Choi MJ.2015. Effect of liposome-coated hemicellulase on the tenderization of burdock. Korean J. Food Sci. Technol. 47: 698-703.

Kim S, Turker MS, Chi EY, Sela S, Martin GM.1983. Preparation of multivesicular liposomes. Biochim. Biophys. Acta. 728: 339-348.

Kim YA, Han HD, Hyun JH, Sin BC.2005. Stability of liposomal nano-powder with the addition of cryoprotectant. J. Korean Chem. Soc. 49: 189-195.

Kim YA, Han HD, Shin BC.2004. Effects of maltose on the stability of freeze-dried liposomes. J. Korean Chem. Soc. 4: 616-622.

Lee JM, Cho YJ, Park DJ, Ko SH, Lee SC.2008. Preparation of nano-liposome by sonication and pressure. Korean J. Food Sci. Technol. 40: 115-117.
Lee JS, Lee MY, Cho HY, Choi MJ.2016. Effect of liposomecoated salt on salty taste intensity of noodle. Food Eng. Prog. 20: 98-104.

Lee MJ, Jeong NH, Jeang BS.2010. Preparation and properties of soybean lecithin liposome using supercritical reverse phase evaporation method. J. Korean Oil Chem. Soc. 27: 391-398.
LI Y, Asadi A, Monroe MR, Douglas EP.2009. pH effects on collagen fibrillogenesis in vitro: Electrostatic interactions and phosphate binding. Mater. Sci. Eng. C, 29: 1643-1649.

Lim JS, Gang HJ, Yoon SW, Kim HM, Suk JW, Kim DU, Lim JK.2010. Preparation and its stability of a coenzyme Q10 nanoemulsion by high pressure homogenization with different valve type conditions. Korean J. Food Sci. Technol. 42: 565- 570.
M&C Life Science.2015. Natural liposome comprising red Ginseng, process for the preparation there of and food, pharmaceutical or cometic composition comprising the same. Korea patent NO. 101750616
Oh SR, Lee SB, Cho KM, Choi MJ, Jin BS, Han YM, Lee YM, Shim JK.2006. Preparation and characterization of nano-sized liposome containing proteins derived from Coptidis rhizome. Appl. Chem. Eng. 17: 52-57.
Park IC, Lee PJ, Yang JW, Kim JD, Choe TB.1994. Reduction of cell membrane toxicity of amphotericin B using micelle, liposome and polyethylene glycol. Kor. J. Appl. Microbial Biotechnol. 22: 290-295.
Park JB, Noh HG, Jung JH, Kim JM, Kang CY.2012. Enhanced transdermal delivery and optimization of nano-liposome preparation using hydrophilic drug. J. Pharm. Investig. 42: 57-63.

Park SH, Lee JK, Jeon JK, Byun HG.2011. Characterization of a collagenase-1 inhibitory peptide purified from skate Dipturus chilensis skin. Korean J. Fish. Aquat. Sci. 44: 456-463.

Sebaaly C, Greige-Gerges H, Stainmesse S, Fessi H, Charcosset C.2016. Effect of composition, hydrogenation of phospholipids and lyophilization on the characteristics of eugenol-loaded liposomes prepared by ethanol injection method. Food Biosci. 15: 1-10.

Sułkowski WW, Pentak D, Nowak K, Sułkowska A.2005. The influence of temperature, cholesterol content and pH on liposome stability. J. Mol. Struct. 744: 737-747.

Wilkinson MG, Kilcawley KN.2005. Mechanism of incorporation and release of enzymes into cheese during ripening. Int. Dairy J. 15: 817-830.

Xia S, Xu S.2005. Ferrous sulfate liposomes: Preparation, stability and application in fluid milk. Food Res. Int. 38: 289-296.

Yoo JY.2002. A study on the preparation and characterization of liposome using PVA hydrogel. MS thesis, Dongduk Womens Univ., Seoul, Korea
Zawada ZH.2004. Vesicles with a double bilayer. Cell. Mol. Biol. Lett. 9: 589-602.