서 론
지방간이란 지방의 과도한 섭취나 내인적으로 간세포 내 에 중성지방(triglyceride)이 전체 간의 5%이상 축적되어 경 도내지 중정도의 간 비대현상을 나타내는 것을 말하며 (Kleiner et al., 2005) 중성지질방울의 크기가 큰 거대소포 지방증(macrovesicular steatosis)과 반대로 크기가 작은 미 세소포 지방증(microvesicular steatosis)의 두 가지 형태가 관찰된다. 다양한 요인에 의하여 지방간이 유도되며, 비만 (obesity), 당뇨(diabetes), 이상지질혈증(dyslipidemia) 및 과 도한 알코올 섭취는 지방간의 가장 흔한 일반적인 위험인 자로 알려져 있다(Bellentani et al., 1997;Assy et al., 2000;Angulo 2002;Moscatiello et al., 2007). 특히, 알코올성 간 질환은 주된 만성 간질환 중의 하나이며, 단순 지방축적 (steatosis)에서부터 간경화(cirrhosis)에 이르는 광범위한 범 주의 질환군을 의미한다. 알코올성 간질환은 전 세계적으 로 널리 퍼져있으며, 알코올 관련 질환 중 가장 중요한 사 망원인이지만, 이들 질환에 대한 예방적 치료적 접근법은 아직 개발되지 않았다(Rehm et al., 2013).
만성적인 알코올 섭취는 다양한 경로를 통하여 간세포 내 지방대사 불균형을 초래하여 지방간을 유발한다(Sozio & Crabb, 2008). 특히, 알코올의 섭취에 의해 간세포에서 지방산 생성을 촉진시키는 sterol regulatory element-binding protein 1c (SREBP1c)의 활성이 증가(You et al., 2002)하 는 반면, 미토콘드리아에서 지방산 분해를 촉진시키는 AMP-activated protein kinase (AMPK)의 활성이 감소하여 지방간을 유도한다(You et al., 2004). 더욱이, 만성 알코올 섭취는 시토크롬 P-450 2E1 (CYP2E1)의 생성을 유도(Wu & Cederbaum, 1999)하여 자유라디칼 생성에 의한 산화스 트레스를 일으키거나(Di Luzio & Hartman, 1967) 염증반 응을 유도하여 알코올성 간손상을 초래한다(Nagata et al., 2007). 이러한 간손상 발생기전은 신체의 주요기관인 간 뿐만 아니라, 뇌, 췌장, 조혈기관, 면역계 등 체내 대사과정 에 매우 치명적인 영향을 준다(Linder et al., 1991).
다슬기(Semisulcospira libertina)는 하천이나 호수 등지에 서 흔히 볼 수 있는 다슬기과(Pleuroceridae)에 속하는 연 체동물로 동의보감 및 본초강목에서 다슬기는 간염, 간경 화, 지방간 등의 간질환 치료 및 개선에 이용되어 왔으며, 숙취해소와 신경통 완화, 빈혈증세 완화, 골다공증의 예방 과 치료에 이용되어 왔다고 알려져 있다. 다슬기에 대한 연구로는 식품학적 성분 및 품질 특성에 관하여 보고되었 고(Lim et al., 2009), 다슬기 추출물에는 십이지장의 근수 축 활성물질 및 혈관이완 활성물질이 존재한다는 보고가 있다(Cha & Bail, 1999). 다슬기 추출물의 생리활성으로는 항산화 활성, 혈압상승 억제, 간세포손상 억제 등이 보고된 바 있다(Lee et al., 2005;Kim et al., 2009). 또한, 저자들 은 이전 연구에서 산과 효소를 이용하여 추출한 다슬기 가 수분해물의 항산화 활성과 간손상 보호효과 및 숙취해소에 대한 효능을 확인하였다(Cho et al., 2017). 하지만 다슬기 가 수분해물의 알코올성 간세포 독성 및 간손상 보호 효과 등 의 관련 연구는 부족한 편이다. 따라서 본 연구는 National Institute on Alcohol Abuse and Alcoholism (NIAAA)에서 개발한 알코올성 지방간 유발 마우스 모델에서 다슬기 가 수분해물의 간 보호 효능을 평가하고자 하였다. 만성 알코 올 식이 급여와 동시에 경구투여를 통한 단회 알코올 폭음 에 의한 알코올성 간손상 마우스 모델에서 다슬기 가수분 해물을 알코올과 함께 투여했을 때, 간 손상의 지표들인 alanine aminotransferase (ALT), aspartate aminotransferase (AST), alkaline phosphatase (ALP) 등의 변화를 조사하였 다. 동시에 간 조직 내 조직학적 관찰과 생화학적 분석을 통하여 다슬기 가수분해물의 알코올성 지방간에 대한 예방 및 개선 효능을 확인하고자 하였다.
재료 및 방법
본 실험에서 사용된 다슬기는 ㈜정옥(Hadong, Korea)에서 제공받아 사용하였다. 다슬기 가수분해물은 다슬기 과육 100 g에 대하여 0.5% alcalase 2.4 L (Novozyme, Bagsvaerd, Denmark)을 포함하는 5배수의 용매(증류수)를 첨가하여 60°C water bath (JSEB-60T; JS Research Ich, Gongju, Korea)에서 5시간 추출하였다. 가수분해물은 80 mesh체로 슬러지를 제거하고 여과지(Whatman filter papers No.2; whatman international Co. Ltd., Maidstone, England)로 여과 하여 감압농축기(Loborota 20 Control; Heidolph, Schwabach, Germany)로 농축한 후 동결 건조하여 4°C에 보관하면서 실험에 사용하였다.
인간 간암 세포인 HepG2 (ATCC, Manassas, VA, USA) 세 포는 10% (v/v) Fetal Bovine Serum (FBS; Gibco, Carlsbad, CA, USA), 1% (v/v) penicillin-streptomycin (Gibco)을 첨 가한 RPMI-1640 배지(Gibco)로 37°C, 5% CO2가 유지되 도록 배양하였다. 배양된 세포는 2-3일 간격으로 계대 배 양하여 실험에 사용하였다.
다슬기 가수분해물의 세포 독성은 Cell Counting Kit-8 (CCK-8; Dojindo, Kumamoto, Japan)을 이용하여 측정하였 다. HepG2 세포를 1×104 cell/mL의 농도로 200 μL씩 96 well plate에 분주하여 37°C, 5% CO2 incubator에서 배양 하였다. 분주 16시간 후에 다슬기 가수분해물을 농도별로 처리하여 24시간 후 CCK-8 assay를 이용하여 세포생존율 을 측정하였다. 에탄올 독성 억제효과를 측정하기 위하여 CCK-8을 사용하여 에탄올(Sigma-Aldrich, Inc., St. Louis, MO, USA)을 통한 간세포 독성 유도 실험을 수행하였다. 즉 96-well plate에 세포 농도 1×104 cells/well로 분주한 다음 세포부착을 위해 16시간 배양한 후 에탄올과 다슬기 가수 분해물을 동시에 처리하였다. 24시간 후에 CCK-8 반응액 10 μL씩 96 well plate에 분주하여 37°C, 5% CO2 incubator 에서 2시간 반응시키고 microplate reader (VersaMax; Molecular Devices, Sunnyvale, CA, USA)에서 450 nm 흡광도 를 측정하여 세포생존율을 확인하였다.
동물실험을 수행하기 위하여 경상대학교 동물실험윤리위 원회에서 승인(GNU-161004-M0056)을 받았으며, 규정에 따라 동물실험에 관한 윤리 과정을 준수하여 연구를 진행 하였다. 실험동물은 (주)중앙 실험동물(Seoul, Korea)에서 구입한 7주령(20-22 g) 수컷 C57BL/6J 마우스를 사용하였 다. 실험동물은 온도 23±3°C, 상대습도 30-70%, 조도 150- 300 Lux, 12시간 간격의 명암 주기 환경에서 1주일 간 적 응시킨 후 실험에 사용하였다. 적응기간 동안 일반식이를 공급하였으며 식수로 멸균수를 자유롭게 섭취하도록 하였 고, 적응기간 후 정상식이군 6마리, 나머지는 8마리씩 3군 으로 분류하였다.
알코올 식이 급여와 동시에 경구 투여를 통한 알코올 단 회 폭음(single binge) 모델을 결합하여 사람과 유사한 알 코올성 지방간과 간염을 일으키는 NIAAA 마우스 모델을 사용하였다(Bertola et al., 2013). 동물실험에 사용된 식이 는 Liber-DeCarli 액체기본식이(Dyets, Inc., Bethlehem, PA, USA)를 사용하였다. 군 분리를 실시한 후 고체사료에서 액체사료의 적응을 위해 모든 실험 군을 액체 사료로 5일 간 순응시킨다. 이후 알코올 식이에 함유된 에탄올과 동일 한 열량을 말토스덱스트린으로 대체한 일반 식이 대조군 (control diet), 5% 에탄올을 포함하는 액체사료 식이를 공 급받는 알코올 식이 대조군(ethanol diet)으로 분류하였다. 다슬기 가수분해물은 1,000 mg/kg을 매일 1회 경구 투여하 였으며, 일반 식이 대조군과 알코올 식이 대조군은 증류수 를 매일 1회 경구 투여하였다. 에탄올을 섞은 Lieber-DeCarli 알코올 식이는 매일 투여 직전에 제조하여 공급하였고, 매 일 잔량을 체크한 후 교체하였다. 총 10일 동안 사육한 후 알코올 식이 대조군 모두에 단회 폭음으로 35% 에탄올 300 μL 용량으로 1회 경구 투여하였다.
모든 동물에 대하여 1일 1회 증상을 관찰하고 체중은 동물용 체중계를 이용하여 3일 간격으로 일정한 시간에 측 정하였다. 혈액은 단회 폭음 경구투여 9시간 후, 졸레틸50 (Virbac, Paris, France)과 럼푼(Bayelkorea Co., Seoul, Korea) 을 8:2로 섞은 후 10배 희석하여 몸무게에 따라 복강주사 로 마취(10 μL/10 g)시켜 심장에서 채혈하였다. 채혈한 혈 액은 1,700×g에서 15분 원심분리하여 혈청을 회수한 다음 혈청자동분석기(Hitachi 7180; Hitachi, Tokyo, Japan)를 이용 하여 alanine aminotransferase (ALT), aspartate aminotransferase (AST), alkaline phosphatase (ALP)등을 정량하였다.
간조직 내 지방질의 축적을 확인하기 위하여 실험 종료 후 간을 적출하여 액체질소로 동결하여 -70°C deep freezer 에 보관하였다. 적출한 간조직은 동결절편용 포매제인 OCT compound (Lab-Tek; Miles Laboratories Inc., Naperville, IL, USA)에 포매한 후 즉시 동결시켰으며, 냉동절편기(Leica CM 1950; Leica Biosystems, Heidelberg, Germany)를 이용 하여 10 μm 두께로 절편한 동결절편 슬라이드 표본을 제 작하였다. Oil-Red O stain 법을 이용하여 지방질의 분포를 광학현미경으로 조사하고 지방과립의 크기 및 분포를 분석 하여 지질침착도를 평가하였다. 또한, 적출한 간은 PBS에 씻어 남은 혈액을 제거하고 10% 중성 완충포르말린에 고 정하고 파라핀 블록을 만들었다. 파라핀 블록은 미세절편기 (Microm HM325; Thermo Fisher Scientific, Waltham, MA, USA)를 사용하여 5 μm 두께로 절편하였고 hematoxylin과 eosin에 이중 염색을 실시하여 광학 현미경(Nikon Eclipse 80i; Nikon, Tokyo, Japan)으로 관찰하였다.
간 조직은 lysis 완충액과 함께 분쇄기를 이용하여 균질화 하였다. 균질액은 4°C에서 13,000×g으로 15분간 원심분리한 후 상층액을 BCA Protein Assay Kit (Pierce, Rockford, IL, USA)를 이용하여 총단백질을 정량하였다. 정량된 단백질은 동일한 농도(30 μg)로 10% SDS polyacrylamide gel에서 전 기영동 후 nitrocellulose membrane (Millipore, Bedford, MA, USA)으로 옮기고 나서 5% skim milk (Difco, Detroit, MI, USA)가 첨가된 Tris-buffered saline with 0.05% Tween 20 (TBST) 완충액으로 1시간 실온에서 blocking 하였다. COX-2 (Santa Cruz Biotechnology Inc., Santa Cruz, CA) 에 대한 1차 항체를 5% skim milk에 희석하여 4°C 냉장고 에서 overnight시켰다. 다음날 horseradish peroxidase (HRP) 가 결합되어 있는 2차 항체와 1시간 동안 상온에서 반응 시켰다. 다시 TBST 완충액으로 10분간 3회 세척한 후 Clarity Western ECL Substrate (Bio-Rad Laboratories Inc., Berkeley, CA, USA)로 1분간 반응시킨 뒤 ChemiDocTM Touch Imaging System (Bio-Rad Laboratories Inc.)을 사용 하여 band를 검출했으며, β-actin (Sigma, St Louis, MO, USA)을 loading control로 사용했다.
간 조직의 total RNA는 TRIzol Reagent (Invitrogen, Carlsbad, CA, USA)를 이용하여 분리하였고, first-strand cDNA는 first-strand cDNA synthesis kit (Applied Biosystems Inc., Framingham, MA, USA)를 사용하여 합성하였다. 합성된 cDNA로부터 염증성 사이토카인 IL-1β (Cat# Mm00434228)와 IL-6 (Cat# Mm00446190) 유전자의 발현 을 확인하기 위해 각 유전자 특이적인 primer와 probe를 Applied Biosystems사로부터 구입하였다. TaqMan® Gene Expression Master Mix (Applied Biosystem Inc.) 및 ViiATM 7 Real-Time PCR System (Applied Biosystem Inc.)을 사 용하여 quantitative real-time PCR (qPCR)을 수행하였다. PCR은 95°C에서 10분 동안 초기 변성을 한 후, 94°C에서 15초, 60°C에서 1분, 40 cycles 조건으로 qPCR을 수행하였 다. Housekeeping gene인 glyceraldehyde-3-phosphate de hydrogenase (GAPDH; Cat# Mm99999915, Applied Biosystem Inc.) mRNA 발현량으로 표준화하였다.
결과 및 고찰
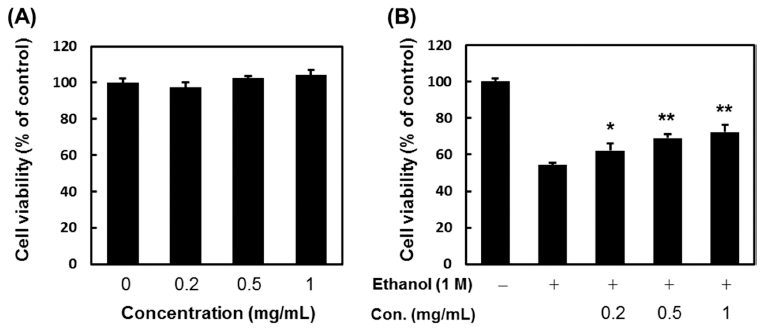
에탄올 유도 간세포 생존율 측정에 앞서 HepG2 세포에 대한 다슬기 가수분해물의 독성을 확인하였다. 다슬기 가수 분해물의 독성 측정은 추출물 최종 농도가 200, 500 및 1,000 μg/mL가 되도록 배지에 녹여 사용하였다. 세포의 독 성은 시료를 처리하지 않고 배양한 대조군에 대비한 세포 생존율로 측정하였으며, 실험 결과 다슬기 가수분해물은 수 행된 모든 농도에서 세포 독성을 나타나지 않았다(Fig. 1A). 에탄올은 예비실험을 통해 세포 생존율이 미처리 대 조군에 비해 40~50% 사멸되는 농도가 1 M임을 확인하였 으며 동일 농도에서 HepG2 세포의 손상을 유도하였다. 시 료 무첨가 대조군의 세포 생존율을 100으로 보았을 때 에 탄올 만을 처리한 대조군은 54.3±1.2%의 생존율을 보인 반 면 다슬기 가수분해물을 200, 500 및 1,000 μg/mL 농도로 전처리한 경우 에탄올 만을 처리한 대조군에 비해 농도의 존적으로 각각 8.0%, 14.6%와 18.0%의 간세포 생존율 증 가를 보였다(Fig. 1B). 따라서, 다슬기 가수분해물은 에탄올 에 의해 유발된 간세포 독성 보호효과를 가짐을 시사한다.
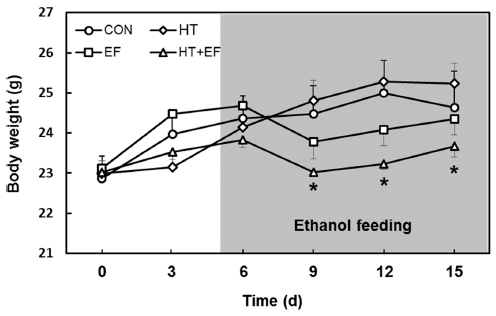
Liber-DeCarli 알코올 액체 식이 자유 급여와 동시에 경 구 투여를 통한 알코올 단회 폭음(single binge) 모델을 결 합하여 사람과 유사한 알코올성 지방간과 간염을 일으키는 NIAAA 마우스 모델(Bertola et al., 2013)을 제작하여 사용 하였다. Fig. 2는 실험 시작부터 종료까지 3일 간격으로 측 정한 마우스 체중의 변화를 나타낸 것이다. 5일간의 액체 식이 적응 기간 후, 5% 에탄올을 포함하는 액체 식이로 바꾸어 급여하였다. 알코올 식이 급여 후 4일까지 에탄올 처리군에서 체중이 감소하는 경향을 보이나 점차 비알코올 액체 식이 급여군과 유사한 체중으로 회복하였다. 또한, 다 슬기 가수분해물만을 첨가한 군(HT)에서는 정상 대조군 (CON)과 유사한 체중 변화를 보여주었다. 그러나 다슬기 가수분해물과 에탄올을 같이 투여한 군에서 정상 대조군에 비하여 통계적으로 유의한 체중감소가 나타났다. 이는 알 코올 중독 환자들의 경우, 식이섭취량이 유의적으로 감소 되고 다른 영양소의 흡수 저하로 인한 영양 결핍으로 체중 이 감소된다는 보고(Mezey, 1980)와 알코올을 과량으로 섭 취 시 열 발생으로 인한 에너지 소모가 증가되기 때문에 체중이 감소되는 현상이 발생한다는 연구 결과(Pikaar et al., 1987)와 일치한다.
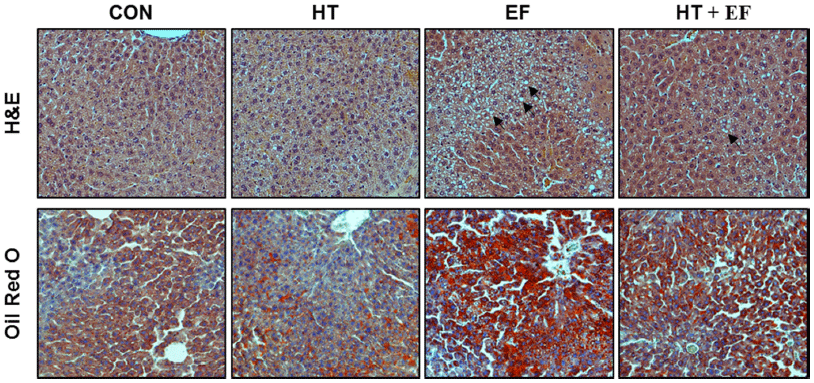
알코올성 간질환 초기의 조직학적 변화는 간세포의 지방 증(steatosis)으로 작은 지방방울에서 큰 지방방울로 진행되 면서 지방간염(steatohepatitis), 알코올성 간질환의 마지막 단계인 간조직의 섬유화에 의한 간경변증(steatofibrosis)으 로 진행된다(Lefkowitch et al., 2005). 이러한 알코올성 간 질환에서 다슬기 가수분해물의 간손상 개선 활성을 직접적 으로 확인하고자 간 조직을 염색하였다. 그 결과 Fig. 3에서 와 같이 대조 식이군에 비해 알코올 식이군의 간 조직에서 는 periportal region에 더 많은 양의 lipid droplet이 축적되 어 있는 macrosteatosis와 microsteatosis가 관찰되었다 또한, 지방성 염증의 한 증상으로 보이는 neutorophil이 peripheral 영역에서 관찰되었으며 에탄올과 함께 다슬기 효소분해물 을 투여한 군에서 지방 축적과 지방성 염증이 개선되는 것 을 관찰 할 수 있었다. 알코올성 간 손상과 유사한 특징을 보이는 Diethylnitrosamine (DEN)을 이용한 실험(Cho et al., 2016)에서 DEN 단독 투여군에서는 중심정맥과 문맥 주변으로 심한 괴사와 부종이 나타나고 염증세포의 침투 현상이 나타났으며, 만성 알코올성 지방간 유도 마우스 실 험(Choi et al., 2014)에서 알코올 섭취군의 간조직 내 과 도한 지방 축적과 지방성 염증 증상을 보여 본 실험과 유 사하였다. Cho et al. (2016)의 실험에서 알코올 단독 처리 군에 비해 알코올-비단벌레 분말을 동시에 투여한 군에서 간세포 손상 억제와 간 조직의 구조적 변화 감소를 보여주 었으며 Choi et al. (2014)의 연구에서도 유산균 발효 마늘 추출물 투여군에서 농도 의존적으로 지방 축적이 개선되어 본 연구 실험 결과와 유사하였다.
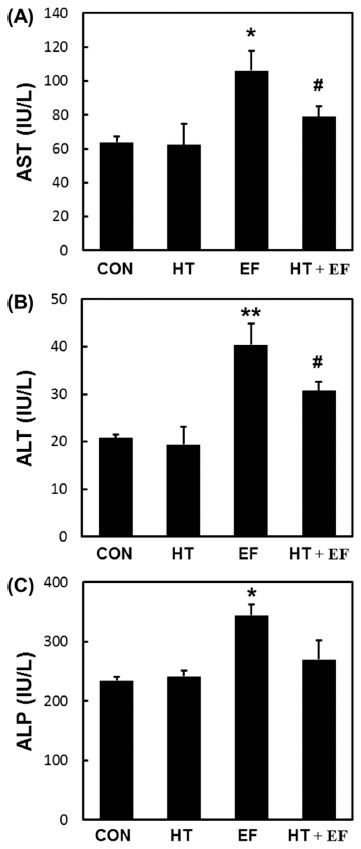
혈액에 간독성을 나타내는 혈액 생화학적인 지표로서 아 미노전이효소인 AST와 ALT 및 ALP 효소활성을 분석한 다. AST와 ALT 효소활성은 정상상태에서는 효소의 활성 이 낮지만 화학약품의 중독, 세균의 감염, 종양 혹은 저산 소증으로 간세포가 손상을 받게 되면, 간 조직 괴사와 같 은 병변이 유발되어 혈액으로 유출되어 혈청 내 활성이 증 가된다. 혈청 중 AST, ALT은 간 기능 검사를 위해 임상 실험에서 널리 이용되고 있다. 본 연구에서도 실험조건에 따른 간 손상을 확인하고자 간장 장애의 지표가 되는 AST, ALT 및 ALP 활성 여부를 확인하였다. Fig. 4는 만 성 알코올성 간손상 모델로서 알코올 식이 급여와 동시에 경구 투여를 통한 알코올 단회 폭음(single binge) 마우스 동물모델에서 다슬기 가수분해물의 간 기능 개선 효과를 확인하기 위해 혈청 내 간 손상 지표들을 측정한 결과로, AST, ALP 및 ALP 효소활성은 정상 대조군(CON)과 다슬 기 가수분해물 처리군(HT)에 비하여 에탄올을 먹인 실험 군(EF)에서 활성이 증가하였다. 이에 비해 다슬기 가수분 해물 투여군(HT+EF)에서 간 손상을 개선하는 경향을 보였 다. 다슬기 가수분해물 투여군(HT+EF)에서 AST, ALT, ALP 는 알코올 식이군(EF)에 비해 64.1%, 49.5%, 67.8% 각각 개 선되는 효과를 나타내어 다슬기 가수분해물이 장기 알코올 섭취로 인한 간 손상의 개선에 효과가 있음을 알 수 있었다. 최근 Son et al. (2016)은 해마(Hippocampus abdominalis) 유래 단백질 가수분해물을 투여한 실험군에서 알코올성 급 성과 만성 간 손상으로 인한 AST와 ALT 활성의 증가를 감소시켜 간 손상을 개선시키는 데 효과가 있다고 한 바 있으며, Cho et al. (2016)은 비단벌레(Bombyx mori) 분말 이 Diethylnitrosamine에 의해 유의하게 증가한 AST, ALT, ALP의 활성을 대조군과 유사한 수준으로 감소시켜 간 조 직을 효과적으로 보호할 것이라고 시사한 바 있다. 알코올 성 간질환은 만성 알코올 섭취에 의해 야기되는 간의 병태 생리학적인 변화들을 일컫는다. 알코올과 그 대사체들은 세포내 단백질과 지질을 세포 내에 축적하거나 활성산소종 을 생산하여 간세포의 대사작용을 손상시키며, 생성된 활 성산소종은 미토콘드리아 호흡쇄와 DNA를 손상시킨다. 최 근 늙은 쥐에게 필수 아미노산 혼합물을 식이로 보충했을 때 심장과 근골격 세포의 미토콘드리아의 크기와 수가 증 가하였고, 미토콘드리아의 기능을 향상시키는데 효과가 있 다고 한 바 있으며(D'Antona et at., 2010), 필수 아미노산 식이 보충으로 알코올에 의한 간 손상을 예방하거나 치료 할 수 있는 가능성을 제시하였다(Corsetti et al., 2011).
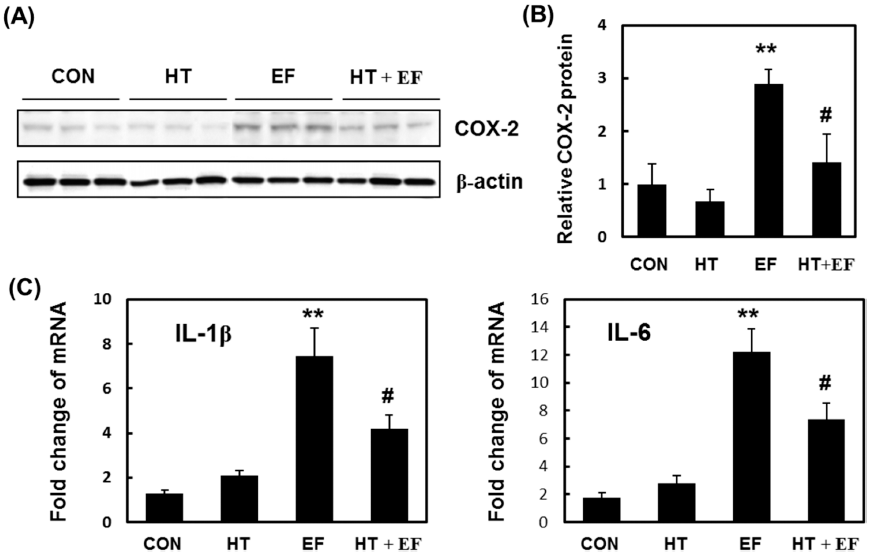
최근 간 손상에 따른 염증과 간암 발생의 관련성에 대해 서는 많은 연구에서 보고되었다(Luedde et al., 2007;Haybaeck et al., 2009;Schneider et al., 2012). 간 손상에 따라 쿠퍼세포는 활성화되고 IL-1β, IL-6, TNF-α와 같은 다양한 염증성 사이토카인들의 생성을 촉진할 뿐만 아니라 중성호구와 단핵구의 간 조직 내 침윤을 증가시킴으로써 더욱 심한 간 손상을 유도하게 된다(Liaskou et al., 2012). 알코올성 간 손상에 의한 간 조직의 염증반응에서 다슬기 가수분해물의 역할을 알아보기 위하여 대표적인 염증매개 효소인 COX-2의 단백질 발현양상을 웨스턴 블롯 분석법 으로 확인하였다(Fig. 5A). 정상 식이 대조군에 비해 알코 올 식이군의 간 조직 내 COX-2 발현은 2.9배 증가하였고, 알코올 식이와 함께 다슬기 가수분해물을 경구 투여한 실 험군에서 COX-2의 발현량은 정상 식이 대조군 대비 1.4배 증가를 보여, 알코올 단독 처리군에 비해 78.3% 감소하였 다(Fig. 5B). 알코올성 간손상의 병리적 기전에는 쿠퍼세포 (Kupffer cell), 간성상세포(hepatic stellate cell), 및 다양한 면역세포들로 구성된 비실질 세포(non-parenchymal cell)들 이 중요한 역할을 수행하는 것으로 알려져 있다. 특히, 쿠 퍼세포에서 만성음주로 인한 Toll-like receptor 4 신호전달 계의 활성화로 염증성 사이토카인, ROS 및 TGF-β의 생성 을 촉진하여 염증 반응을 증폭시키고 간손상을 일으키게 된다(Liaskou et al., 2012). 이러한 사실에 기초하여 다음 으로 NIAAA 모델 마우스를 사용하여 다슬기 가수분해물 경구 투여가 알코올성 지방간 조직의 염증상태에 미치는 영향을 조사하였다. 간 조직에서 염증성 사이토카인인 IL- 1β와 IL-6 mRNA 수준을 quantitative real-time PCR 방법 으로 측정하였다. 알코올성 지방간 조직에서 이들 사이토 카인의 mRNA 수준은 알코올 식이 대조군에 비해 다슬기 가수분해물 투여군에서 유의적인 감소를 보였다(Fig. 5C). Lu et al. (2014)은 야생 비트가드(Momordica charantia L.)를 경구 투여한 알코올성 지방간 마우스에서 산화 스트 레스와 염증반응을 감소시켜 간 손상을 보호함을 보임으로 서 본 실험의 결과와 일치하였다. 본 연구는 만성 알코올 섭취에 의하여 염증반응이 유발된 마우스 모델을 이용하여 염증반응이 다슬기 가수분해물 경구 투여한 실험군에서 유 의하게 감소되었음을 보여주었다.
요 약
본 연구는 다슬기의 간 보호 효능을 확인하고자 하였다. 다슬기를 단백질 가수분해효소인 alcalase를 이용하여 가수 분해물을 얻은 후 실험을 수행하였다. HepG2 세포에 다슬 기 가수분해물을 처리하였을 때 세포독성이 나타나지 않음 을 확인하였다. 그리고 다슬기 가수분해물과 에탄올(1 M) 을 가하여 24시간 후 세포생존율을 확인했을 때, 세포가 알코올 독성으로부터 보호되는 것을 확인할 수 있었다. 다 음으로 다슬기 가수분해물의 간 손상 보호 효과를 Liber- DeCarli 알코올 액체 식이 급여와 동시에 경구 투여를 통 한 알코올 단회 폭음(single binge)으로 알코올성 지방간과 염증을 유발시킨 마우스모델(NIAAA)을 사용하여 확인하 고자 하였다. 이들 마우스 모델에서 알코올 식이 급여 후 초기에 체중이 감소하는 경향을 보이나 점차 비알코올 식 이 급여군과 유사한 체중으로 회복하였다. 조직학적 관찰 에서 알코올로 유도된 간 세포내 지방 축적과 지방성 염증 이 에탄올과 함께 다슬기 가수분해물을 투여한 군에서 개 선되는 것을 관찰 할 수 있었다. 또한, 알코올 투여에 의 한 AST, ALT 및 ALP의 효소활성 증가가 다슬기 가수분 해물 처리에 의해 억제되었으며, 만성 알코올 섭취에 의한 염증 매개 효소와 염증성 사인토카인의 발현 증가는 다슬 기 가수분해물을 투여한 군에서 양성대조군에 비하여 유의 하게 감소하였다. 이상의 연구결과를 종합해 보면 다슬기 효소 가수분해물 소재는 알코올성 지방간의 예방 및 개선 을 위한 기능성식품용 상업적 소재로서 높은 실용화 가능 성을 시사한다.