서 론
활성산소(reactive oxygen species, ROS)는 스트레스, 과 식, 음주, 흡연, 방사선, 초음파 및 환경오염, 세포 내 대사 과정의 불균형 등의 요인으로 인해 대사의 균형이 깨지게 되면 과잉으로 생성된다(Alessio, 1993; Jenkins, 1993; Wink et al., 1993). 이렇게 생성된 과잉 활성산소는 세포막 단백 질의 변성, DNA 손상과 같은 비가역적인 변화를 일으켜 암과 고혈압 및 고지혈증과 같은 질병을 유발할 수 있다 (Halliwell et al., 1984; Kim, 2004).
현대사회는 도시화, 공업화로 인한 환경오염 그리고 과 다한 스트레스와 음주 및 흡연으로 인하여 암과 만성질병 의 발생위험도가 높아지고 있다. 항산화 물질은 생체 내에 서 생성되는 활성산소 및 이에 의해 유도되는 지질과산화 반응을 억제하며 고혈압, 협심증, 당뇨병과 같은 성인병을 예방해 주며 나아가 발암 및 노화를 억제하는 생리활성 물 질로서 크게 각광을 받고 있다(Kim et al., 2011). 또한 최 근 암 예방(chemoprevention)을 위한 물질의 항산화 효과 에 대한 실험들이 방대하게 이루어지고 있다(Chang et al., 2007).
소목(Caesalpinia sappan L.)은 인도, 말레이시아, 중국 남부 등의 열대 아시아에 분포하는 낙엽 관목의 콩과 식물 로 소방목, Sappan wood, Red wood라고도 불린다. 이들 지역에서는 소목 심재가 궤양, 설사, 간질, 월경이상에 대 한 민간요법으로 사용되었다(Wang et al., 2014). 통목재는 단단하고, 심재는 밝은 홍색이며 약용으로 사용되며, 나무 껍질과 열매에는 색소가 있어서 홍색염료로 사용된다. 염 료성분은 심재에 들어 있으며, 색소의 주성분은 벤조피란 (benzopyrane)류에 속하는 브라질레인(brazilein)이다. 소목 의 주 성분은 brazilin과 sappanchalcone이 있으며, 특히 brazilin은 소목 전체 20%를 차지하는 화합물로 공기 중에 서 산화되어 brazilin이 된다.
소목은 중국과 대만 등에서 전통 한약재로 농양(abscess), 옹종(carbuncle) 등의 감염성 질환을 치료하는데 사용되어 왔으며(Kim, 1989), 소목 심재는 전통적으로 식음료 원료 로 사용되었다(Toegel et al., 2012). 소목의 기능성 연구로 는 통증 및 항염증작용(Xie et al., 2000; Wu et al., 2011) 과 진경작용(Baek et al., 2000), 상처치유(Tewtrakul et al., 2015), 간보호(Srilakshmi et al., 2010), 항산화(Badami et al., 2003), 항관절염(Wang et al., 2011) 활성이 보고되었다. 지금까지 소목추출물에 대한 다양한 연구가 진행되어왔으 나 식품으로 활용하기 용이한 열수 및 주정을 이용한 추출 물의 생리활성을 비교한 실험은 찾아보기 힘들다. 따라서, 본 연구에서는 소목의 열수 및 에탄올 추출물의 총 폴리페 놀, 총 플라보노이드의 함량 분석과 함께 항산화 및 항암 활성 분석을 통해 기능성 식품 소재로의 이용가능성을 살 펴보고자 하였다.
재료 및 방법
본 실험에 사용한 소목(Caesalpinia sappan)은 대구 약령 시(Daegu, Korea)에서 구입하였다. 2,2-diphenyl-1-picrylhydrazyl (DPPH), 2-2'-azino-bis (3-ethylbenzothiazoline-6- sulfonic acid) diammonium salt (ABTS), dimethyl sulfoxide (DMSO),L-ascorbic acid, 3-(4,5-dimethylthiazol-2-yl)-2,5- dimethyl tetrazolium (MTT), sulforhodamine B (SRB), trichloroacetic acid (TCA), Folin-Ciocalteu's phenol reagent, gallic acid, quercetin, potassium hydroxide, sodium chloride, potassium chloride, trizama base는 Sigma Chemical Co. (St. Louis, MO, USA)에서 구입하였다. 세포배양에 사용한 fetal bovine serum (FBS), penicillin-streptomycin solution, trypsin 0.25% EDTA solution, dulbecco's modified eagle's minimal essential medium (DMEM), roswell park memorial institute medium (RPMI-1640 with L-glutamine), minimum essential medium (MEM)은 Hyclone Co. (Logan, UT, USA) 에서 구입하였다. 인체 암세포주인 A-549 (폐암 세포), HeLa (자궁암 세포), Hep3B (간암 세포)는 한국세포주은행 (Seoul, Korea)에서 분양 받아 사용하였다.
소목 열수 추출물은 건소목 100 g에 증류수 2 L를 가하 여 65°C의 수조에서 4시간 동안 추출하였고, 에탄올 추출 물은 건소목 100 g에 70% 에탄올 2 L를 가하여 25°C, 108 rpm으로 24시간 동안 진탕 추출하였다. 추출물은 여과지 (Toyo No. 2, Advantec, Tokyo, Japan)를 이용하여 여과하 고 감압농축기(LABOROTA 4000-efficient, Heidolph Instruments GmbH & Co., Schwabach, Germany)를 이용하여 농 축한 후 동결건조기(EYELA, Tokyo Rikakikai Co., Tokyo, Japan)에서 건조하여 실험에 사용하였다.
총 폴리페놀 함량은 Folin-Denis법으로 측정하였다(Folin et al., 1912). 희석된 시료 1 mL에 증류수 5 mL를 혼합한 후 Folin-Ciocalteu's phenol reagent 0.5 mL를 가하고 vortex 로 혼합하여 8분간 반응시키고 여기에 7% Na2CO3 (Duksan Pure Chemical Co., Ansan, Korea) 10 mL를 첨가하였다. 증 류수를 이용하여 최종 부피를 25 mL로 맞춘 후 상온의 암 소에서 2시간 동안 방치한 다음 UV/Vis spectrophotometer (DU 800, Beckman Coulter Inc., Fullerton, CA, USA)로 750 nm에서 반응액의 흡광도를 측정하였다. 표준물질로 gallic acid를 사용하여 총 폴리페놀 함량은 시료 g당 gallic acid mg 당량(mg GAE/g)으로 표시하였으며 결과값은 3회 반복 측정한 후 평균값으로 나타내었다.
총 플라보노이드 함량은 Moreno 등의 방법을 이용하여 측정하였다(Moreno et al., 2000). 희석된 시료 500 μL를 취한 후 10% aluminum nitrate (Duksan Pure Chemical Co., Ansan, Korea) 1 mL와 1 M potassium acetate (Duksan Pure Chemical Co.) 100 μL, 80% 에탄올 4.3 mL를 순서대 로 첨가한 후 암소에서 40분 동안 반응시킨 다음 510 nm 에서 반응액의 흡광도를 측정하였다. 표준물질로 quercetin 을 사용하여 검량곡선을 작성하고 시료의 흡광도를 측정하 여 총 플라보노이드 함량을 구하였다. 총 플라보노이드 함 량은 시료 g당 quercetin mg 당량(mg QE/g)으로 표시하였 으며 3회 반복 측정한 후 평균값으로 나타내었다.
DPPH radical에 대한 소거 활성은 Blois의 방법을 이용 하여 측정하였다(Blois, 1958). 0.1M sodium acetate buffer (pH 5.5)를 이용하여 희석된 시료 1 mL에 7.5×10−5M DPPH 용액 2 mL를 첨가하여 교반 후 37°C 암소에서 30분간 반 응시켰다. 이것을 UV/Vis spectrophotometer를 이용하여 517 nm에서 흡광도를 측정하였으며 positive control로는 Lascorbic acid를 사용하였다. DPPH radical 소거 활성은 다 음의 계산법을 사용하였고 3회 반복 측정한 후 평균값으로 나타내었다.
ABTS radical 소거 활성은 Re 등의 방법을 이용하여 측 정하였다(Re et al., 1999). 7 mM ABTS 용액과 2.45 mM potassium persulfate 용액을 1:1로 혼합하여 30°C 암소에서 12시간 방치하여 ABTS radical cation을 제조하였다. 그 후 5 mM potassium phosphate buffer (pH 7.4)로 희석하여 413 nm에서 흡광도가 0.7이 되도록 하였다. 희석된 ABTS 용액 4 mL에 0.1M sodium acetate buffer (pH 5.5)로 희석 된 시료 40 μL를 가하여 1분간 반응시킨 후 413 nm에서 흡광도를 측정하였으며 positive control로는 L-ascorbic acid를 사용하였다. ABTS radical 소거 활성은 DPPH radical 소거 활성과 동일한 계산법을 이용하였고 3회 반복 측정한 후 평균값으로 나타내었다.
A-549는 RPMI-1640배지, Hep 3B는 DMEM배지, HeLa 는 MEM배지를 사용하여 배양하였다. 각 배지에 10% (w/v) FBS와 1%(w/v) penicillin streptomycin을 첨가한 복합배지 를 조제하여 배양에 사용하였으며 37°C, 5% CO2 incubator (Forma 3546, Thermo Scientific Inc., Massachusetts, USA)에서 4일 간격으로 계대 배양하면서 실험에 사용하 였다.
추출물의 암세포 활성 저해 효과를 측정하기 위해 Carmichael 등의 방법으로 MTT assay를 시행하였다 (Carmichael et al., 1987). 즉, 미리 배양한 암세포를 1×105 cells/mL의 농도로 96 well plate에 180 μL씩 첨가하고 37°C, 5% CO2 incubator에서 24시간 동안 배양하였다. 기 존 배지 80 μL를 제거하고 각 well에 시료를 농도별로 100 μL씩 첨가하여 위와 같은 조건에서 48시간 동안 배양 한 후 각 well에 5 mg/mL의 MTT용액을 20 μL씩 첨가하 여 4시간 동안 배양하였다. 배양액 제거 후 DMSO와 ethanol을 1:1 비율로 혼합한 용액을 150 μL씩 각 well에 첨가하여 30분간 흔들어 반응시킨 뒤 ELISA reader (Versamax, Molecular Device, California, USA)를 이용하 여 550 nm에서 흡광도를 측정하였다. 시료 무첨가구는 시 료 대신 PBS를 첨가하여 위와 동일한 방법으로 실험하였 다. 암세포 저해 활성은 아래 계산법을 사용하여 암세포에 대한 시료의 세포 독성으로 나타내었다.
SRB assay는 Doll et al. (1981)의 방법을 이용하여 측정 하였다. 암세포를 5×104 cells/mL 농도로 96 well plate에 100 μL씩 분주하고 37°C, 5% CO2 incubator에서 24시간 동안 배양한 후 각 well에 시료를 농도별로 100 μL씩 첨가 하여 48시간 동안 추가 배양하였다. 배지를 제거한 다음 각 well에 10% TCA 100 μL를 첨가하여 4°C에서 반응시 켰다. 1시간 후 TCA를 제거하고 96 well plate를 멸균수로 5회 세척하여 실온에서 건조한 후, 각 well에 1% acetic acid에 용해한 0.4% (w/v) SRB 용액을 100 μL씩 첨가하여 실온에서 30분간 반응시켰다. SRB로 염색된 cell을 1% acetic acid로 5회 세척한 뒤 상온에서 건조시켰다. 건조된 96 well plate에 10 mM tris buffer (pH 10.5) 100 μL를 각 well에 첨가한 다음 ELISA reader를 이용하여 540 nm에 서 흡광도를 측정하였다. 시료 무첨가구는 시료 대신 PBS 를 이용하여 위와 동일한 방법으로 실험하였으며, 암세포 저해 활성은 MTT assay와 동일한 식을 이용하여 나타내 었다.
결과 및 고찰
본 연구에서 소목의 열수 추출물(CSWE)과 에탄올 추출 물(CSEE)의 총 폴리페놀 함량을 측정한 결과는 Table 1에 나타난 것과 같이 각각 22.6 mg GAE/g, 17.6 mg GAE/g으 로, 열수 추출물의 총 폴리페놀 함량이 유의적으로 높았다. CSWE와 CSEE의 총 플라보노이드 함량은 각각 14.5 mg QE/g, 13.2 mg QE/g으로 분석되어 총 폴리페놀과 같이 열 수 추출물이 에탄올 추출물에 비해 총 플라보노이드 함량 이 높게 나타났다(Table 1). 최근에 건강식품으로 인기가 있는 베리류의 총 폴리페놀 함량을 연구한 Lim 등에 의하 면 아사이베리, 블루베리, 산수유, 오디가 총 폴리페놀은 각각 83.8, 12.1, 37.9, 19.2 mg GAE/g을 함유하고 있고, 총 플라보노이드는 19.4, 21.3, 9.3, 12.0 mg QE/g을 각각 함유한 것으로 나타났다(Lim et al., 2015). 소목 추출물은 총 폴리페놀 함량에 있어 아사히베리나 산수유보다는 낮았 지만, 블루베리나 오디보다는 높은 함량을 보였고 총 플라 보노이드는 위의 베리류보다 상당히 높은 함량을 함유한 것으로 나타났다.
| Sample1) | CSWE | CSEE |
|---|---|---|
| Total polyphenols (mg GAE/g)2) | 22.64±0.05 | 17.63±0.75*4) |
| Total flavonoids (mg QE/g)3) | 14.54±0.30 | 13.15±0.46* |
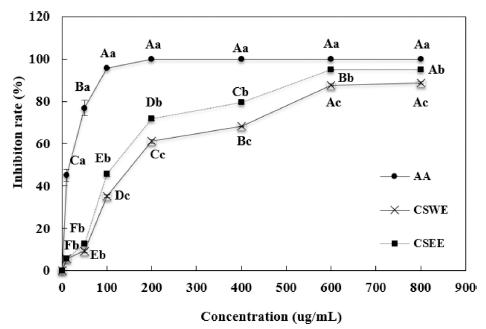
CSWE와 CSEE의 DPPH radical 소거 활성 측정 결과는 Fig. 1에 나타낸 바와 같이 두 시료 모두 농도가 증가함에 따라 유의적으로 DPPH radical 소거 활성이 증가하였다. 에탄올 추출물은 열수 추출물에 비해 전 농도에 걸쳐 DPPH radical 소거 활성이 유의적으로 높은 것으로 나타 났다. CSEE의 DPPH radical 소거활성은 10, 50, 100, 200, 400, 600, 800 ug/mL 농도에서 각각 36.5, 50.8, 59.4, 73.0, 79.1, 82.6, 82.8%로 나타났다. 80% 에탄올 소목추출 물의 DPPH radical 소거활성 결과를 조사한 연구에서는 800 ug/mL의 농도에서 87.9%로 본 연구와 유사한 결과를 보였다(Kang et al., 2013). 소목 유기용매 추출물을 이용해 DPPH를 이용하여 전자공여능을 조사한 연구에서는 5 mg/ mL 이상의 농도에서 모두 50% 이상의 전자공여능을 보여 주었고 그 중 ethylacetae 분획 층이 가장 우수한 항산화효 과를 보여준 반면 물층이 가장 낮은 효과를 보여 본 연구 와 유사한 결과를 나타내었다(Jeon et al., 2010). 본 연구 결과를 시판 한약재의 항산화활성을 조사한 연구와 비교하 면, 소목은 초두구, 미두령, 정향, 박하, 건강 등에 비해는 낮았으나 결명자, 비파엽, 감초, 황백, 갈근에 비해서는 높 은 활성을 보여주었다(Lee et al., 2002).
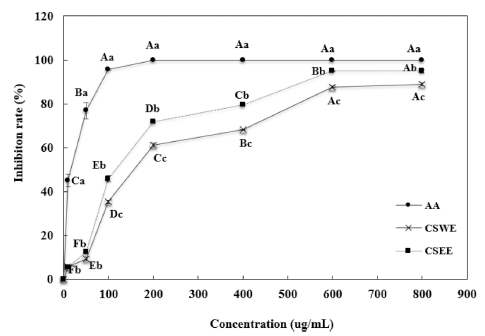
CSWE와 CSEE의 ABTS radical 소거 활성 측정 결과는 Fig. 2와 같이 두 시료 모두 농도가 증가함에 따라 ABTS radical 소거 활성이 유의적으로 증가하는 것으로 나타났으 며, 모든 실험 농도에서 CSEE가 CSWE에 비해 높은 ABTS radical 소거 활성을 나타내어 DPPH radical 소거 활성 측정 결과와 유사한 양상을 보였다. 800 μg/mL의 농 도에서 CSWE는 88.8%의 ABTS radical 소거 활성을 나타 냈으며, CSEE은 94.9%의 높은 소거 활성을 나타내었다. 베리류의 ABTS radical 소거능을 조사한 연구에 의하면 500 μg/mL의 농도에서 아사이베리, 블루베리, 산수유, 오디 가 83.1, 59.8, 90.5, 61.8%의 ABTS radical 소거능을 나타 냈다(Lim et al., 2015). 소목추출물은 400 μg/mL과 600 μg/mL의 농도에서 에탄올추출물이 79.5%와 94.9%의 소거 능을 보여 블루베리, 오디보다 높고, 아시이베리와는 유사 한 활성을 보인 것을 알 수 있다.
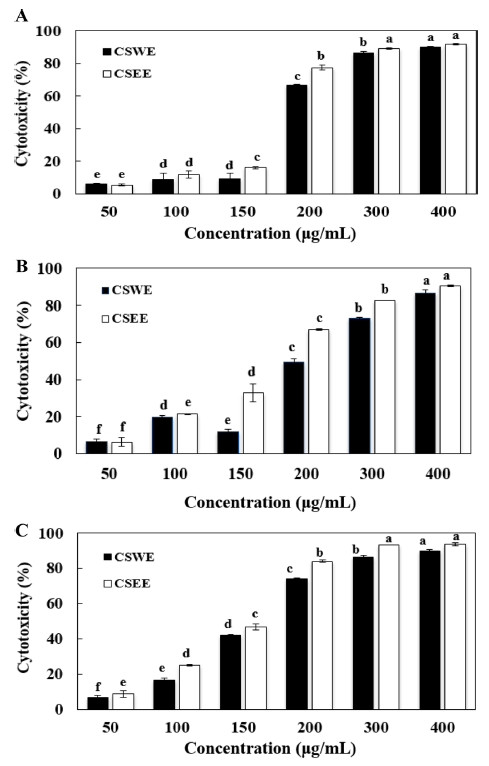
MTT assay는 살아 있는 세포의 효소작용으로 MTT가 환원되어 formazan crystal이 생성되는 정도를 흡광도로 측 정하여 세포독성을 측정하는 방법이다(Jeon et al., 2009). 본 연구에서 HeLa, Hep3B, A549 cell에 대하여 MTT assay를 이용하여 세포 독성을 측정한 결과는 Fig. 3과 같 다. CSWE와 CSEE를 400 ug/mL의 농도로 첨가하였을 때, HeLa에 대한 세포 독성은 CSWE가 90.0%, CSEE는 91.8%로 다른 암세포에 대한 세포 독성보다 유의적으로 높게 나타났다. CSEE는 HeLa, Hep3B, A549 cell에 대해 실험한 농도에서 모두 열수 추출물에 비해 높은 세포독성 을 보여주었다. 구강암 및 골육종세포주에 대한 항암효과 를 조사한 연구에서는 소목의 메탄올 추출물의 극성도에 따른 ethyl acetate, n-hexane, butanol 및 수층의 5분획의 MTT assay를 통한 IC50값을 측정한 결과, dichloromethane 분획이 가장 높은 항암효과를 보여 본 연구결과와 같이 추 출용매에 따른 항암효과에 대한 차이를 보여 주었다(Lee et al., 2007).
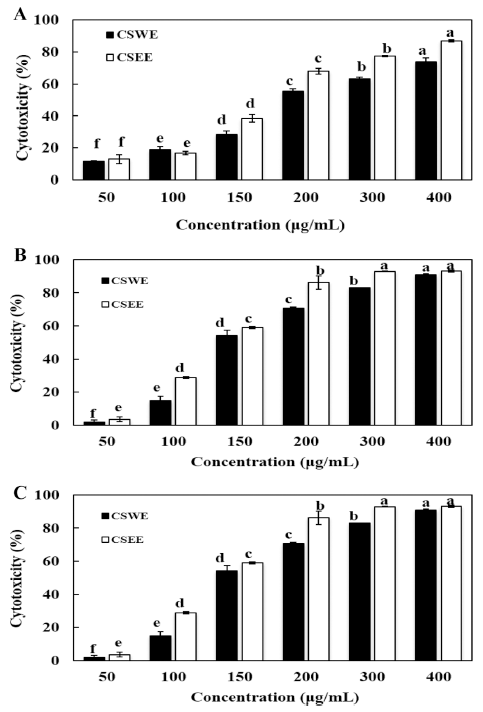
SRB assay는 살아 있는 세포 단백질을 염색하여 암세포 의 사멸 또는 증식 억제 정도를 평가하는 방법으로 CSWE 와 CSEE을 분석한 결과는 Fig. 4와 같다(Jeon et al., 2009). CSWE와 CSEE를 400 ug/mL의 농도로 첨가하였을 때, HeLa에 대한 세포 독성은 CSWE가 90.04%, CSEE는 91.79%로 다른 암세포에 대한 세포 독성보다 유의적으로 높게 나타났다. 소목에탄올 추출물은 HeLa, Hep3B, A549 cell에서 모두 열수 추출물에 비해 높은 세포독성을 보여주 었다. SRB assay는 MTT assay와 함께 세포독성 및 세포 증식 검색법으로 널리 사용되는 방법으로 세포주별 민감도 에서 차이가 있는 것으로 알려져 있으나, 본 연구에서 사 용한 HeLa, Hep3B, A549 cell에서는 큰 차이를 보이지 않 았다(Banasiak et al., 1999). Han 등에 의해 Hela cell을 이용하여 소목의 항암활성을 조사한 연구에서는 물추출물 이 110.7%의 세포증식을 유도했으나, chloroform 추출물이 12.2%, butanol 추출물이 46.5%의 세포독성을 보여주어 chloroform 추출물의 항암활성이 가장 큰 것으로 나타났다 (Han et al., 2007).
DPPH radical 소거능과 같은 항산화 활성과 폴리페놀 및 플라보노이드 화합물 함량 사이에는 유의한 상관관계가 있 음이 보고되고 있다. 식용 및 약용식품 에탄올 추출물의 항산화 활성을 연구한 실험에서는 DPPH radical 소거능과 폴리페놀 함량간에는 양의 상관관계가 있음을 보고하였다 (Choi et al., 2005). Kwak et al. (2004)은 한국산 메밀, 수 수, 기장, 율무의 플라보노이드 함량과 DPPH radical 소거 에 대한 IC50 값 사이에 음의 상관관계가 있음을 확인하였 다. 하지만, 본 연구에서는 총 폴리페놀과 총 플라보노이드 함량이 소목 열수 추출물에서 더 높은 결과를 보여주었음 에도 불구하고, DPPH radical 소거능과 같은 항산화활성과 함께 MTT, SRB 등의 시험을 통해 본 항암활성은 에탄올 추출물이 열수 추출물에 비해 더 높았다. Lee의 연구에서 천년초에 taxifolin과 같은 flavanol 계열의 화합물이 존재 하며, 이들 flavanol 화합물들은 용매추출 분획시 ethyl acetate와 같은 비교적 비극성 용매에 주로 이행되는 것으 로 알려져 있어 열수보다는 에탄올 추출물에 특정 활성성 분이 다량 함유될 수 있는 가능성이 있다(Lee, 2005). 또한 , 지금까지 알려진 소목의 항균활성이 가장 우수한 기능성 분인 brazilin은 ethyl acetate 분획에 가장 많이 함유되어 있다(Jeon et al., 2010). 따라서, 열수 추출물에 총폴리페놀 과 총플라보노이드 함량이 높았지만, 항산화와 항암활성을 보이는 brazilin과 같은 주요 기능성분은 에탄올 추출물에 다량 함유되어 있을 가능성이 있다. 이에, 향후 열수 및 에탄올 추출물내의 braninin 등의 기능성분의 함량 분석과 함께 주요 기능성분의 함량을 최대화할 수 있는 추출 조건 을 탐색하는 연구가 추가될 필요가 있다.
요 약
소목은 인도, 말레이시아, 중국 남부 등의 열대 아시아에 분포하는 낙엽 관목의 콩과 식물로써, 한방에서는 항통증, 항염증의 용도로 사용된다. 본 연구에서는 국내산 소목의 열수 및 에탄올 추출물의 총 폴레페놀, 총 플라보노이드의 함량 분석과 함께 항산화 및 항암활성 분석을 통해 기능성 소재로의 이용가능성을 살펴보고자 하였다. 소목 열수 추 출물은 건소목 100 g에 증류수 2 L를 가하여 65°C의 수조 에서 4시간 동안 추출하고 에탄올 추출물은 건소목 100 g 에 70% 에탄올 2 L를 가하여 25°C, 108 rpm으로 24시간 동안 진탕 추출하였다. 추출물은 모두 여과, 농축한 후 동 결 건조하여 시료로 사용되었다. 총 폴리페놀 함량은 열수 추출물 및 에탄올 추출물에서 각각 22.6 mg GAE/g과 17.6 mg GAE/g으로 나타났으며 총 플라보노이드 함량은 14.5 mg QE/g, 13.2 mg QE/g으로 에탄올 추출물에서 더 높은 함량을 보였다(p<0.05). DPPH 실험결과, 10-800 ug/mL의 농도에서 에탄올 추출물은 36.5-82.8%, 열수 추출물은 26.7-75.5%의 radical 소거능을 각각 나타내었다. DPPH실 험과 동일한 농도에서 ABTS radical 소거능 측정 결과, 에 탄올 추출물은 5.5-94.9%, 열수 추출물은 5.8-88.8%의 소 거능을 각각 나타내었는데, 결과적으로 소목 에탄올 추출 물이 열수 추출물에 비해 우수한 항산화력을 가지고 있음 을 보여주었다(p<0.05). 소목의 항암 활성 측정을 위해 인 체 암세포주인 A-549, HeLa, Hep3B cell에 대해 MTT assay와 SRB assay를 실시한 결과, 소목 에탄올 추출물의 농도가 증가함에 따라 각 세포주에 대한 세포 독성이 증가 하는 경향을 보였다. MTT assay와 SRB assay의 모든 실 험농도에서 폐암 세포인 A-549에 대해 가장 높은 세포 독 성을 나타내었으며, 특히 MTT assay에서는 300 ug/mL의 소목 에탄올 추출물이 A-549 cell에 대해 90% 이상의 높 은 암세포 억제효과를 보여주었다. 따라서, 우수한 항산화 활성과 항암 활성을 나타낸 소목 추출물은 향후 다양한 기능성 식품 및 의약 소재로서의 활용이 가능할 것으로 보인다.