Article
저산미의 두유 커드를 생성하는 젖산균의 동정과 발효 특성
김수인, 정민기, 이승민, 강문선, 성종환, 이영근, 김한수, 정헌식, 김동섭*
Identification and Fermentation Characteristics of Lactic Acid Bacteria that Produce Soy Curd With Low Sour Taste
Su-In Kim, Min-Gi Jung, Seung-Min Lee, Moon-Sun Kang, Jong-Hwan Seong, Young-Geun Lee, Han-Soo Kim, Hun-Sik Chung, Dong-Seob Kim*
Department of Food Science & Technology, Pusan National University
*Corresponding author: Dong-Seob Kim, Department of Food Science & Technology, Pusan National University, Miryang 50463, Republic of Korea +82-55-350-5359; +82-55-350-5359
Kds@pusan.ac.kr
© Korean Society for Food Engineering. All rights reserved.
Received: May 29, 2017; Revised: Jun 5, 2017; Accepted: Aug 1, 2017
Abstract
The acidity of soy curd fermented by lactic acid bacteria is a major factor degrading the sensory properties of soy curd. For preparation of soy curd with low sour taste, lactic acid bacteria were separated from kimchi. The lactic acid bacteria which showed yellow-clear zone around the colonies on BCP plate and formed soy curd with low level of acidity were selected. The selected strain was analyzed by 16S rDNA sequence and named as Pediococcus inopinatus Y2. The maximum viable cell number of the soy curd fermented by P. inopinatus Y2 was obtained at 10.73 log CFU/mL at 25°C for 24 h of fermentation. By the results of panel test, the overall sensory quality of the soy curd produced by P. inopinatus Y2 was higher than that of Leuconostoc mesenteroides No. 4395 and Lactobacillus sakei strain No. 383.
Keywords: fermentation characteristics; lactic acid bacteria; soy curd; identification; kimchi
서 론
콩과식물인 콩(Glycine max L.)의 단백질 및 유지는 식품 산업에서 폭넓게 사용하고 있다(L’Hocine & Boye, 2007; Singh et al., 2008). 콩은 다량의 아미노산과 단백질, 탄수화 물, 지방, 미네랄, 올리고당, 식이섬유, phytochemical 등과 같은 영양소가 풍부한 식품임에도 불구하고 효소 저해제 (enzyme inhibitors)와 같은 항영양인자를 함유하고 있다 (Onder & Kahraman, 2009). 식물계에서 보편적으로 발견 되는 항영양인자는 발아, 열처리, 불림 및 발효 등의 식품 가공법에 의해 함량을 감소시킬 수 있다(Omoruyi et al., 2007; Osman et al., 2007; Hammond & Jez, 2011). 특히, 발효는 식품의 독성이 있는 유해한 성분을 제거하고 쉽게 소화가 되는 형태로 바꿔주는 작용을 하는 것으로 보고되 고 있다(Potter et al., 1999). 두부, 된장, 템페, 낫토, 된장 등의 두류 가공품은 식품 단백질의 경제적인 공급원으로 간주되어 왔을 뿐만 아니라 고기 단백질보다 적은 콜레스 테롤을 가지고 있어 아시아에서 필수 아미노산의 섭취를 위한 단백질 공급원의 역할을 해왔다(Nagata et al., 1998; Taku et al., 2007).
콩은(Anderson et al., 1999; Setchell & Cassidy, 1999), 심장혈관질환(Setchell & Cassidy, 1999; Tsai et al., 2014), 비만(Ali et al., 2004; Lee et al., 2013; Tsai et al., 2014), 폐 경 후 질환(Setchell & Cassidy, 1999; Taku et al., 2012) 위 점막병변(Takekawa et al., 2006; Liu et al., 2009) 등을 예 방하는 작용 뿐만 아니라 콩 이소플라본은 산화를 중단시켜 죽상경화증 진행 유병률을 감소시키고(Setchell & Cassidy, 1999; Rodrigues et al., 2005) 강력한 항산화 활동을 나타 내는 것으로 알려져 있다(Wei et al., 1995). 또한 콩 미네 랄의 섭취는 골다공증(Setchell & Cassidy, 1999; Chiang & Pan, 2011), 고혈압(Appel et al., 1997) 등의 위험을 감 소시키는 작용을 하는 것으로 보고되고 있다. 특히, 식물성 에스트로겐의 주요 성분으로 구성된 콩의 섭취를 늘려줌으 로써 건강에 긍정적인 작용을 한다는 사실이 밝혀졌다 (Tham et al., 1998). 한 예로, 동아시아 일부 지역의 역학 조사에서 다량의 식물성 에스트로겐 섭취가 전립선암의 발 병률을 감소시키는 것이 확인되었다(Goetzl et al., 2007). 유산균 발효 대두는 식물성 에스트로겐(genistein, dadizein, glycitein)이 강화되는 특성을 보이는 것으로 알려져 있는데 그 중 다양한 생물학적 기능을 가지고 있는 genistein (5,7,4'- trihydroxyisoflavone) 및 daidzein (7,4'-dihydroxyisoflavone)은 발효 시 함량이 높아져 강력한 생체 효과를 나타낸다(Franke et al., 1994; Adlercreutz et al., 1995; Horn-Ross et al., 2000). 발효는 식품 성분의 기능적 특성을 강화하기 위한 효과적인 생물공정(bioprocess)으로(Sanders, 1998; Hsieh & Chou, 2006; Wang et al., 2006) 콩의 미생물에 의한 발효는 아시 아의 전통식품에 폭 넓게 사용되어 왔다. 최근 비발효성 식품인 두부 역시 유산균에게 우수한 배지로 보고되고 있 으며(Jooyandeh, 2011), 유산균에 의해 형성된 두유 커드를 제조하고 대두 치즈라고 부르기도 한다(Hang & Jackson, 1967; Liu et al., 2006).
기존에 유산균으로 발효된 두유 커드는 영양학적으로 뛰 어남에도 불구하고 균에 의해 생성된 과도한 산미와 같은 불쾌한 맛 때문에 소비자에게 두유나 발효유보다 관능이 떨어진다(Park & Lee, 1997). 또한, 과도한 산미의 생성은 두유 커드를 이용한 식품의 개발에 영향을 끼쳐 제한적인 제품 생산에 영향을 준다. 이러한 결점을 보완하기 위하여, 본 실험에서는 김치에서 분리된 젖산균을 두유에 접종 시 두유 커드를 생성하는 젖산균을 1차 선별하고 두유 커드의 산도 측정을 통하여 저산미의 관능이 개선된 커드를 형성 하는 미생물을 최종 선별하였다.
재료 및 방법
김치로부터 젖산균의 분리
60개의 김치 샘플을 멸균 증류수로 십진 희석한 다음 0.017% bromocresol purple을 함유한 MRS (Difco, San Jose, CA, USA) indicator plates (MRS-BCP)에 도말하였다 (Kaushik et al., 2009) 도말된 MRS-BCP plate는 30°C에서 48시간 동안 배양하고 균락 주위에 노란색의 투명환을 형 성하는 미생물을 분리하였다. 분리된 젖산균은 20% (v/v) 글리세롤 stock으로 만들어 -20°C에서 보관하여 사용하였다. 다음에 이어지는 실험 과정에서 사용된 균주는 모두 1% 접 종한 MRS broth (Difco Laboratories, Detroit, MI, USA)에 서 30°C의 온도로 두 번 계대 배양한 후 사용되었다. 또한 관능평가를 제외한 모든 실험은 3회 반복 수행하였으며, 결과는 평균값과 표준편차(SD)로 표시하였다.
젖산균 두유 커드의 제조
분리된 김치 젖산균 중 두유 커드를 형성하는 미생물을 선별하기 위하여 젖산균 두유 커드를 제조하였다. 먼저 5 배의 물을 가하고 25°C에서 6시간 동안 침지시킨 국산 콩 100 g은 800 mL의 물과 함께 분쇄기로 마쇄하고, 린넨 천 에 여과하여 콩 비지는 제거한 후 두유만을 분리하였다. 121°C에서 15분 동안 멸균된 두유는 약 25°C 이하로 냉각 시킨 후, 분리된 젖산균을 2% (v/v)로 접종하여 30°C에서 24시간 동안 발효시키고 두유 커드를 형성하는 미생물을 선별하였다.
제조된 젖산균 발효 두유 커드는 가장 낮은 산도를 나타 내는 시료를 선택하고 사용된 젖산균을 최종 선별하였다. 산도 측정은 균질화된 젖산균 두유 커드 10 mL와 증류수 10 mL를 혼합하여 교반한 후 0.1 N NaOH로 측정 pH가 8.3이 될 때까지 적정하였다. 시료에 첨가된 0.1 N NaOH 양은 다음의 계산식을 사용하여 젖산의 양(%)으로 환산하 였다.
Acidity (%) =mL of 0.1 N NaOH×factor×dilutionWeight of sample (mL)×100
선별균주의 유전학적 분석
최종 선별된 젖산균은 16S rDNA 염기 서열 분석으로 동정되었으며, 먼저 genomic DNA의 추출은 chelex bead 를 이용하여 boiling-method로 수행하였다. 미생물의 16S rRNA 유전자는 universal bacteria primer인 27F primer (5- AGAGTTTGATCMTGGCTCAG-3) 및 1492R primer (5- GGYTACCTTGTTACGACTT-3)를 사용하여 Life Touch thermal cycler (Alpha Laboratories Ltd., Eastleigh, UK)에 서 중합 효소 연쇄 반응(PCR)에 의해 증폭되었다. PCR 산물은 QIAquick PCR purification kit (Qiagen, Valencia, CA, USA)로 정제하고 Solgent (Daejeon, Korea)에 의뢰해 염기서열 분석을 진행하고, nucleotidesequence는 GenBank 의 데이터베이스에서 이용 가능한 모든 서열과 비교되었다. 모든 서열은 서열의 다중 정렬(multiple alignments)을 위한 CLUSTAL X (version 1.81) 프로그램으로 검사되었고 비교된 염기서열의 유사성은 phylogenetic tree 상에서 진화적 거 리(evolutionary distance)로 표시되었다. 계통 발생 분류는 tree view program을 이용하여 분석하였다.
선별균주의 생화학적·형태학적 분석
선별균주는 Gram 염색, catalase test, glucose로부터 가 스 생성능, MRS 고체평판배지에서 균락의 형태, 표면, 불 투명도, 색깔 등을 확인하고 주사 전자 현미경(scanning electron microscope, SEM)상의 관찰을 통하여 선별 균주 의 형태를 조사하였다.
SEM (HITACHI S3500N, Tokyo, Japan) 촬영에 사용된 미생물 시료는 먼저 2.5% glutaraldehyde로 전고정하고 1% osmium tetroxide로 후고정 처리하였다. 이어서 50, 60, 70, 90, 95%의 에탄올로 순차적으로 10분씩 처리하여 탈수시키 고 100% 에탄올로 10분간 2회 처리한 시료는 100% hexametyl-disilazane (HMDS)로 10분간 2회 처리하였다. 마 지막으로 시료를 sputter-coater (E-1010 10N, Hitachi, Tokyo, Japan)를 사용하여 금-팔라듐으로 코팅한 다음, 미생물의 형 태를 SEM으로 관찰하였다.
선별균주의 생육 조건
선별된 균주의 최적의 배양 조건을 확인하기 위하여 25, 30, 35, 37, 40°C에서 배양한 MRS broth는 UV/VIS spectrophotometer (Optizen POP, Mecasys Co. Ltd., Daejeon, Korea)를 이용하여 600 nm에서 3시간 간격으로 흡광도 값 을 측정하였다.
젖산균 발효 두유 커드의 생균수의 관찰
젖산균 발효 두유 커드는 homogenizer (HG-15D, DAIHAN scientific Co. Ltd., Wonju, Korea)로 균질화시키고 멸균 증류 수로 십진희석해 생균수를 측정하였다(Kim et al. 2011).
젖산균 발효 두유 커드의 pH와 산도 변화
Homogenizer로 균질화된 젖산균 발효 두유 커드는 pH meter (pH-200L, Istek, Seoul, Korea)를 이용하여 3시간 간 격으로 pH 값을 측정하였다. 적정산도의 측정은 젖산균 선 별 과정에서 사용한 방법과 동일하게 적용하였다.
젖산균 발효 두유 커드의 화학적 분석
화학적 성분 분석은 선별균주를 접종한 두유를 30°C에서 24시간 동안 발효시켜 분석하였다. 수분 함량은 AOAC (Helrich, 1990)법의 drying oven method 분석으로, 조회분 은 600°C 회화로에서 균질화한 1 g 시료를 백색이 될 때 질량을 측정하는 AOAC (Helrich, 1990)법으로 분석하였다. 조단백질 함량은 AOAC의 Kjeldahl법(Helrich, 1990), 조지 방은 AOAC의 Soxhlet 장치(Helrich, 1990)에 의해 평가되 었으며, 조섬유 역시 AOAC (Helrich, 1990)에 보고된 방 법으로 측정되었다. 조단백, 조지방, 조섬유의 측정에는 젖 산균 발효 두유 커드를 동결 건조시켜 시료로 사용하였다.
젖산균 두유 커드의 관능 평가
관능 평가는 Leuconostoc mesenteroides strain No. 4395 (Kim et al., 2011)와 Lactobacillus sakei strain No. 383 (Kim et al., 2011)에 의해 발효된 젖산균 두유 커드, 본 실험에서 선별된 미생물로 제조된 젖산균 두유 커드로 평 가되었다. 젖산균 두유 커드는 30°C에서 24시간 발효시킨 후 4°C에서 24시간 저장하여 실험에 사용하였으며 관능 평가는 19세에서 23세 사이의 연령대를 가진 11명의 패널 을 대상으로 실시하였다. 관능평가의 항목은 외관의 기호 도, 콩 비린내(콩취), 산미, 음용 시 질감 및 전반적인 맛의 기호도 등의 항목으로 평가되었다. 평가 시 9점 평점법으 로 콩 비린내, 산미는 특성 강도(9=극도로 강하게 감지할 수 있다, 1=감지 불가능하다)로 평가되었으며 나머지 평가 항목은 선호도로 평가하여 관능이 좋지 못한 평점을 1점으 로 하고 9점으로 갈수록 관능이 좋은 것으로 정하여 검사 하였다.
결과 및 고찰
김치로부터 분리된 젖산균의 선별
60개의 김치 시료로부터 MRS-BCP 고체평판배지 상에 서 균락 주위에 젖산의 생성으로 인한 노란색의 clear-zone 을 형성하는 젖산균을 분리하였다. 분리된 251종의 젖산균 은 글리세롤을 첨가하여 stock의 형태로 -20°C에서 보관하 였다.
두유로부터 저산도 발효 미생물의 분리 및 선별
김치로부터 분리된 젖산균 중 두유에 접종 시 커드를 형 성하는 미생물을 선별하고 그 중 가장 낮은 산도를 나타내 는 젖산균 Y2를 최종 선별하여 실험에 사용하였다(Table 1). 여러 연구들에서 연구자들은 단백질 분해효소로 처리하 여 콩 단백질 응고를 보고했다(Aoyama et al., 2000). 예를 들면 탈지 대두에서 분리된 수용성 대두 단백질은 bromelain 가수분해에 의한 응집과 겔화를 나타낸다(Fuke et al., 1985). 또한 이러한 응고물은 subtilisin Carlsberg와 같은 단백질 분해효소가 11S 글로불린에 subunit에 작용하여 저 분자량의 fragment로 전환시키고 fragment의 증가로 인해 응집이 유발된다고 알려져 있다(Inouye et al., 2002). 따라 서 젖산균이 형성하는 두유 커드는 미생물의 단백질 분해 효소에 의한 응집 및 겔화 작용으로 보여진다.
Table 1.
Acidity values of soy curd fermented by lactic acid bacteria
|
Strain |
Acidity |
Strain |
Acidity |
|
A1
|
1.016±0.040 |
S2
|
0.844±0.023 |
|
A5
|
0.868±0.010 |
T8
|
0.892±0.008 |
|
C7
|
1.000±0.016 |
V2
|
1.215±0.020 |
|
C8
|
0.663±0.022 |
V5
|
1.274±0.030 |
|
F6
|
0.551±0.007 |
V9
|
0.675±0.024 |
|
G1
|
0.859±0.011 |
V10
|
1.274±0.043 |
|
H3
|
0.764±0.013 |
X1
|
1.344±0.002 |
|
J4
|
0.887±0.006 |
X10
|
0.653±0.004 |
|
L4
|
0.767±0.020 |
Y1
|
1.037±0.014 |
|
R6
|
0.915±0.028 |
Y2
|
0.517±0.008 |
Download Excel Table
선별 미생물의 유전학적 동정
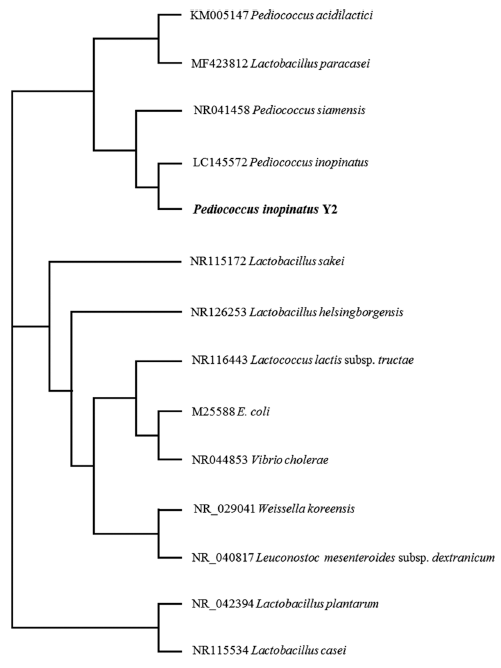
젖산균 두유 커드 중 가장 낮은 산미를 지닌 시료의 젖 산균 Y2를 16S rDNA 염기서열분석 결과는 Chromas program으로 확인하고 GenBank BLAST에서 1.2 kbp 이상의 데이터를 Genetyx program을 통해 sequence match 하였다. 그 결과, Pediococcus inopinatus로 확인되었고 Pediococcus inopinatus Y2로 명명하고 계통학적 관계는 Fig. 1에서 나타내 었다. Pediococci는 P. acidilactici, P. argentinicus, P. cellicola, P. claussenii, P. damnosus, P. ethanolidurans, P. inopinatus, P. lolii, P. parvulus, P. pentosaceus, P siamensis, P. stilesii, P. acidilactici, P. inopinatus, P. parvulus, P. pentosaceus, P. stilesii 등 총 12종으로 오이, 옥수수, 올리브, 사일리지 (silage)와 같은 과일과 식물의 발효에 관여하는 것으로 알 려져 있다(Holazpfel et al., 2009). 이렇게 Pediococcus sp.가 여러 가지 발효에 관여하지만 식품산업 전반에서 starter로의 활용은 미미하다. Pediococcus sp.를 starter로 활용하는 경 우는 주로 치즈이며(Castro et al., 2015), 이마저도 두 가지 균주 P. acidilactici와 P. pentosaceus만이 유제품 숙성에 사용되고 있다(Fuquay et al., 2011)
Fig. 1.
Phylogenetic position of P. inopinatus Y2 which produces fermented soy curd products on lowest level of sour taste.
Download Original Figure
P. inopinatus Y2 생화학적·형태학적 분석
P. inopinatus Y2의 생화학적·형태학적 분석 결과 P. inopinatus Y2는 glucose로부터 이산화탄소를 생산하지 않 았으며 그람 양성, 카탈라아제 음성으로 관찰되었다. 또한 Fig. 2는 P. inopinatus Y2의 SEM 분석결과로 4련구균의 형태를 관찰할 수 있었다. 이러한 P. inopinatus Y2의 특성 은 Pediococci의 전형적인 특성과 일치하는 결과를 보였다 (Holazpfel et al., 2009). Weissella sp. 및 Leuconostoc sp.과 같은 이상발효 젖산균(heterofermentative lactic acid bacteria) 과 일부 젖산균은 포도당에서 hexose monophosphate 또는 pentose 경로를 통해 같은 농도의 젖산, 이산화탄소 및 에탄 올을 생산하지만 Stretococci, Pediococci, Lactobacilli 등은 포도당으로부터 젖산만 생성하는 것으로 알려져 있다 (Holazpfel et al., 2009).
Fig. 2.
Scanning electronic microscopy (SEM) of P. inopinatus Y2 which produces fermented fermented soy curd products on lowest level of sour taste.
A: SEM magnification of ×3,000, B: SEM magnification of ×5,000.
Download Original Figure
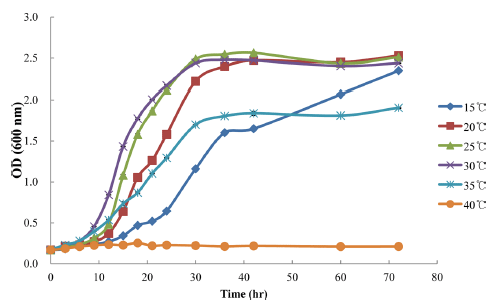
P. inopinatus Y2의 최적 배양 조건
P. inopinatus Y2의 생장 곡선은 600 nm에서 흡광도를 측 정하여 작성하였다. Fig. 3에서 보여지는 것과 같이 30°C에 서 배양된 P. inopinatus Y2는 가장 빠르게 대수기에 도달하 였으며 12시간에서 흡광도가 1.0에 도달하였다. P. inopinatus 의 일반적인 최적 생육온도는 30-32°C이며 최대 생육 가능 한 온도는 37-40°C이다(Holazpfel et al., 2009).
Fig. 3.
The growth curve of P. inopinatus Y2 in MRS broth.
The graph presents the average±standard deviation of three independent experiments.
Download Original Figure
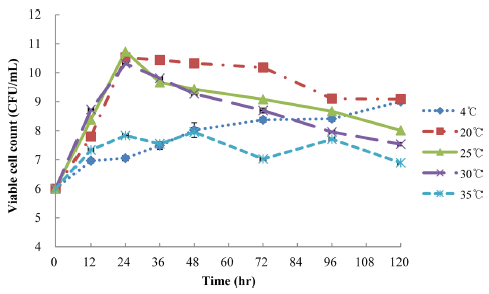
P. inopinatus Y2를 이용한 두유 커드의 생균수
P. inopinatus Y2에 의해 발효된 두유 커드는 Fig. 4에서 보여지는 것처럼 20-30°C에서 24시간 배양시 10 log CFU/ mL 이상의 높은 생균수를 보였으며 30°C의 온도에서 생균 수가 가장 빠르게 증가하였다. P. inopinatus Y2로 발효된 두유 커드의 최대 생균수의 온도는 25°C로 24시간 동안 10.73 log CFU/mL로 나타났다. 또한 P. inopinatus Y2의 두유 발효 시 최저·최고 온도에서 생균수의 특성은 4°C에 서 120시간 발효하는 동안 지속적으로 증가한 반면 35°C 이상의 온도에서는 생육이 저해되는 결과를 확인하였다. 이는 P. inopinatus의 최대 생육 가능한 온도가 37-40°C라 고(Holazpfel et al., 2009) 알려진 온도보다 두유에 접종하 여 발효 시 더 낮은 온도에서 억제된 생육 상태를 보였다.
Fig. 4.
The viable cell counts in soy curd fermented by P. inopinatus Y2.
The graph presents the average±standard deviation of three independent experiments.
Download Original Figure
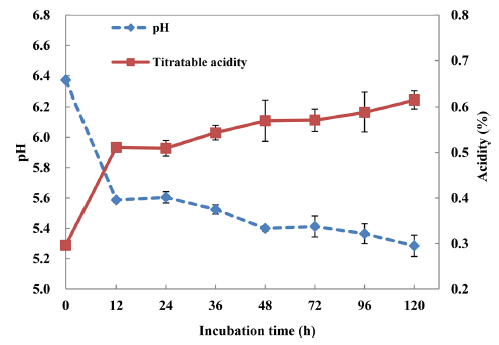
P. inopinatus Y2를 이용한 두유 커드의 pH와 적정산도 의 변화
P. inopinatus Y2에 발효된 두유 커드는 Fig. 5과 같이 30°C 에서 24시간 동안 발효 시 산도는 0.52%, pH 5.6을 나타내 었다. P. inopinatus Y2에 의해 발효된 두유 커드는 일반적 인 LAB 균주에 비해 산도가 낮고 pH가 높은 결과를 보 였다. 기존에 실험실에서 제조되었던 젖산균 두유 커드 (Leuconostoc mesenteroides strain No. 4395)와 비교 시에 도 낮은 산도와 높은 pH를 보이는 것으로 나타났다(Kim et al., 2011).
Fig. 5.
Changes of pH value and titratable acidity of soy curd fermented by P. inopinatus Y2.
The graph presents the average± standard deviation of three independent experiments.
Download Original Figure
P. inopinatus Y2에 의해 발효된 두유 커드의 일반성분 분석
P. inopinatus Y2로 제조된 두유 커드와 발효 전 두유의 일반성분 분석 결과는 Table 2에 나타내었다. P. inopinatus Y2에 의해 발효된 두유 커드의 수분, 조단백, 조지방은 발 효 전후의 분석 결과가 큰 차이가 없으나 회분은 발효 전과 비교 시 조섬유는 발효 전 0.04±0.00이었던 것이 0.02±0.00 으로 감소하였다. 이는 P. inopinatus Y2가 분비하는 효소의 작용에 의한 것으로 보여진다.
Table 2.
Analysis of chemical components in soy curd fermented by P. inopinatus Y2 Unit (%)
|
Component |
USM |
SPY |
|
Moisture |
93.98±0.06 |
94.05±0.03 |
|
Crude ash |
0.23±0.01 |
0.32±0.07 |
|
Crude protein |
2.90±0.08 |
2.80±0.09 |
|
Crude fat |
1.17±0.01 |
1.13±0.02 |
|
Crude fiber |
0.04±0.00 |
0.02±0.00 |
Download Excel Table
P. inopinatus Y2에 의해 발효된 두유 커드의 관능평가
Table 3에서 보여지듯이 P. inopinatus Y2에 의해 발효된 두유 커드의 관능검사 항목의 평가는 L. sakei strain No. 383, Leu. mesenteroides strain No. 4395에 의해 발효된 두 유 커드보다 전반적으로 좋은 점수를 받았다. 그 중 특성 강도로 평가한 콩 비린내, 산미의 항목에서는 P. inopinatus Y2에 의해 발효된 두유 커드가 가장 약하게 느껴지는 것으 로 나타났고 전반적인 맛의 기호도는 L. sakei strain No. 383, Leu. mesenteroides strain No. 4395에 의해 발효된 두 유 커드보다 높은 선호도를 보이는 것으로 확인되었다. 특 히 산미가 다른 시료보다 P. inopinatus Y2에 의해 발효된 두유 커드가 가장 약하게 느껴지는 것은 선행되었던 산도와 pH 실험에서 관찰되었던 결과에 기인하여 낮은 산도와 높 은 pH에 의해 가장 낮은 신맛을 보이는 것으로 사료된다.
Table 3.
Sensory evaluation value of soy curd fermented by lactic acid bacteria
|
Item |
Sensory score |
|
A |
B |
C |
|
Colour/appearance |
5.27±1.35 |
4.45±1.51 |
6.00±2.00 |
|
Beany flavor |
5.09±1.87 |
5.00±1.73 |
3.64±1.96 |
|
Sour taste |
5.55±1.63 |
7.00±1.79 |
2.09±1.51 |
|
Texture |
5.55±1.97 |
5.09±2.30 |
5.91±1.97 |
|
Overall acceptability |
4.00±1.61 |
3.18±1.94 |
6.45±1.57 |
Download Excel Table
요 약
많은 선행연구에서 젖산균 발효 두유 커드의 우수성이 입증이 되었지만 젖산균으로 발효된 두유 커드의 높은 산 도는 관능성을 저해하는 주요 요인으로 작용하여 제품의 개발로 이어지기 쉽지 않았다. 본 실험에서는 두유 커드 발효 시 관능성을 높일 수 있는 젖산균을 김치로부터 분리 하여 선별된 균주를 이용한 저산도 두유 커드를 제조하였 다. 최종 선별된 젖산균은의 16S rDNA 염기서열 분석을 통하여 Pediococcus inopinatus로 동정되었고 P. inopinatus Y2로 명명하였다. P. inopinatus Y2는 30°C에서 배양 시 가장 빠르게 대수기에 이르는 것으로 나타났으며 25°C에서 24 시간 발효 시 10.73 log CFU/mL의 최대 생균수를 보였 다. P. inopinatus Y2에 의해 발효된 두유 커드의 관능검사 결과 L. sakei strain No. 383, Leu. mesenteroides strain No. 4395에 의해 발효된 두유 커드보다 전반적인 기호도가 높 은 것으로 나타났는데 이러한 결과를 토대로 P. inopinatus Y2로 발효된 두유 커드는 식품 개발에 이용할 수 있을 것 이라 사료된다.
감사의 글
본 연구는 부산대학교 기본연구지원사업(2년)에 의해 수 행된 연구결과입니다.
References
Adlercreutz CH, Goldin BR, Gorbach SL, Höckerstedt KA, Watanabe S, Hämäläinen EK, Markkanen MH, Mäkelä TH, Wähälä KT, Hase TA, Fotsis T. Soybean phytoestrogen intake and cancer risk. J. Nutr. 1995; 125:757S-770S.

Ali AA, Velasquez MT, Hansen CT, Mohamed AI, Bhathena SJ. Effects of soybean isoflavones, probiotics, and their interactions on lipid metabolism and endocrine system in an animal model of obesity and diabetes. J. Nutr. Biochem. 2004; 15:583-590.

Anderson JJB, Anthony M, Messina M, Garner SC. Effects of phyto-oestrogens on tissues. Nutr. Res. Rev. 1999; 12:75-116.

Aoyama M, Yasuda M, Nakachi K, Kobamoto N, Oku H, Kato F. Soybean-milk-coagulating activity of Bacillus pumilus derives from a serine proteinase. Appl. Microbiol. Biotechnol. 2000; 53:390-395.

Appel LJ, Moore TJ, Obarzanek E, Vollmer WM, Svetkey LP, Sacks FM, Bray GA, Vogt TM, Cutler JA, Windhauser MM, Lin PH, Karanja J, Lawrence J, for the DASH Collaborative Research Group. A clinical trial of the effects of dietary patterns on blood pressure. N. Engl. J. Med. 1997; 336:1117-24.

Castro JM, Tornadijo ME, Fresno JM, Sandoval H. Biocheese A food probiotic carrier. BioMed. Res. Int. 2015. 2015.

Chiang SS, Pan TM. Antiosteoporotic effects of Lactobacillus-fermented soy skim milk on bone mineral density and the microstructure of femoral bone in ovariectomized mice. J. Agric. Food Chem. 2011; 59:7734-7742.

Franke AA, Custer LJ, Cerna CM, Narala KK. Quantitation of phytoestrogens in legumes by HPLC. J. Agric. Food Chem. 1994; 42:1905-1913.

Fuke Y, Sekiguchi M, Matsuoka H. Nature of stem bromelain treatments on the aggregation and gelation of soybean proteins. J. Food Sci. 1985; 50:1283-1288.

Fuquay JW, Fox PF, McSweeney PL. Encyclopedia of Dairy Sciences. 2011; 2nd EditionAcademic Press. San Diego, CA, United States: p. 2245-2247Four-Volume set.

Goetzl MA, Vanveldhuizen PJ, Thrasher JB. Effects of soy phytoestrogens on the prostate. Prostate Cancer Prostatic Dis. 2007; 10:216-223.

Hammond BG, Jez JM. Impact of food processing on the safety assessment for proteins introduced into biotechnologyderived soybean and corn crops. Food Chem. Toxicol. 2011; 49:711-721.

Hang YD, Jackson H. Preparation of soybean cheese using lactic starter organisms: I. General characteristics of the finished cheese. Food Technol. 1967; 21:95-96.

Helrich KC. Official methods of Analysis of the AOAC. 1990; 2(Ed. 15)Association of Official Analytical Chemists Inc. .

Holazpfel WH, Franz CMAP, Ludwig W, Dicks LMT. In: De Vos P, Garrity G, Jones D, Krieg NR, Ludwig W, Rainey FA, Schleifer K-H, Whitman WB, editors. Genus III. Pediococcus Claussen 1903, 6
8AL. Bergey's Manual of Systematic Bacteriology. 2009; 2nd ed3(The Firmicutes)Springer-Verlag. New York, United States: p. 513-532.

Horn-Ross PL, Barnes S, Lee M, Coward L, Mandel JE, Koo J, John EM, Smith M. Assessing phytoestrogen exposure in epidemiologic studies development of a database (United States). Cancer Causes Control. 2000; 11:289-298.

Hsieh ML, Chou CC. Mutagenicity and antimutagenic effect of soymilk fermented with lactic acid bacteria and bifodobacteria. J. Food Microbiol. 2006; 111:43-47.

Inouye K, Nagai K, Takita T. Coagulation of soy protein isolates induced by subtilis in Carlsberg. J. Agric. Food Chem. 2002; 50:1237-1242.

Jooyandeh H. Soy products as healthy and functional foods. Middle-East. J. Scientific Res. 2011; 7:71-80.

Kaushik JK, Kumar A, Duary RK, Mohanty AK, Grover S, Batish VK. Functional and probiotic attributes of an indigenous isolate of Lactobacillus plantarum. PLoS ONE. 2009; 4:8099.

Kim RU, Ahn SC, Yu SN, Kim KY, Seong JH, Lee YG, Kim HS, Kim DS. Screening and identification of soy curd-Producinglactic acid bacteria. J. Life Sci. 2011; 21:235-241.

Lee BH, Lo YH, Pan T M. Anti-obesity activity of Lactobacillus fermented soy milk products. J. Funct. Foods. 2013; 5:905-913.

Liu D, Li L, Yang X, Liang S, Wang J. Survivability of Lactobacillus rhamnosus during the preparation of soy cheese. Food Technol. Biotech. 2006; 44:417-422.

L'Hocine L, Boye J. Allergenicity of soybean new developments in identification of allergenic proteins, cross reactivities and hypoallergenization technologies. Crit. Rev. Food Sci. Nutr. 2007; 47:127-43.

Liu CF, Hu CL, Chiang SS, Tseng KC, Yu RC, Pan TM. Beneficial preventive effects of gastric mucosal lesion for soyskim milk fermented by lactic acid bacteria. J. Agric. Food Chem. 2009; 57:4433-4438.

Nagata C, Takatsuka N, Kurisu Y, Shimizu H. Decreased serum total cholesterol concentration is associated with high intake of soy products in Japanese men and women. J. Nutr. 1998; 128:209-213.

Omoruyi FO, Dilworth L, Asemota HN. Antinutritional factors, zinc, iron and calcium in some Caribbean tuber crops and the effect of boiling or roasting. Nutr. Food Sci. 2007; 37:8-15.

Onder M, Kahraman A. Antinutritional factors in food grain legumes. 1st International Syposium on Sustainable Development. 2009; ; June 8-10, Sarajevo-Bosnia3 p. 40-44.

Osman AM. Effect of different processing methods on nutrientcomposition, anti-nutritional factors and in vitro protein digestibility on Dolichos lablab bean (Lablab purpureus (L)Sweet). Pak. J. Nutr. 2007; 6:299-303.

Park MJ, Lee SY. Effects of lactose and yeast on the growth of lactic acid bacteria and sensory characteristics during the fermentation of soy yogurts. Korean. J. Food Sci. Technol. 1997; 29:533-538.

Potter NN, Hotchkiss JH. Food science. 19995th edSpringer. New York, USA: .

Rodrigues HG, Diniz YS, Faine L, Gklhardi CM, Burneiko R, Almeida J, Ribas B, Novelli ELB. Antioxidant effect of saponin potential action of a soybean flavonoid on glucose tolerance and risk factors for atherosclerosis. J. Food. Sci. Nutr. 2005; 56:79-85.

Sanders ME. Overview of functional foods emphasis on probiotic bacteria. Int. Dairy J. 1998; 8:341-347.

Setchell KDR, Cassidy A. Dietary isoflavones Biological effects and relevance to human health. J. Nutr. 1999; (Suppl). 129:758-767.

Singh P, Kumar R, Sabapathy SN, Bawa AS. Functional and edible uses of soy protein products. Compr. Rev. Food Sci. Food Saf. 2008; 7:14-28.

Takekawa S, Matsui T, Arakawa Y. The protective effect of the soybean polyphenol genistein against stress-induced gastric mucosal lesions in rats, and its hormonal mechanisms. J. Nutr. Sci. Vitaminol. 2006; 52:274-280.

Taku K, Melby MK, Kronenberg F, Kurzer MS, Messina M. Extracted or synthesized soybean isoflavones reduce menopausal hot flash frequency and severity systematic review and meta-analysis of randomized controlled trials. Menopause. 2012; 19:776-790.

Taku K, Umegaki K, Sato Y, Taki Y, Endoh K, Watanabe S. Soy isoflavones lower serum total and LDL cholesterol in humans a meta-analysis of 11 randomized controlled trials. Am. J. Clin. Nutr. 2007; 85:1148-1156.

Tham DM, Gardner CD, Haskell WL. Potential health benefits of dietary phytoestrogens A review of the clinical, epidemiological, and mechanistic evidence. J. Clin. Endocrinol. Metab. 1998; 83:2223-2235.

Tsai YT, Cheng PC, Pan TM. Anti-obesity effects of gut microbiota are associated with lactic acid bacteria. Appl. Microbiol. Biotechnol. 2014; 98:1-10.

Van der Schouw YT, De Kleijn MJ, Peeters PH, Grobbee DE. Phyto-oestrogens and cardiovascular disease risk. Nutr. Metab. Cardiovasc. Dis. 2000; 10:154-167.

Wang YC, Yu RC, Chou CC. Antioxidatives activities of soymilk fermented with lactic acid bacteria and bifidobacteria. Food Microbiol. 2006; 23:128-135.

Wei H, Bowen R, Cai Q, Barnes S, Wang Y. Antioxidant and antipromotional effects of the soybean isoflavone genistein. Proc. Soc. Exp. Biol. Med. 1995; 208:124-30.