서 론
알긴산은 기본 구성 성분이 uronic acid로 되어 있으며 (Atsuki et al., 1926), 주로 β-D-mannuronate (M)과 α-Lguluronate (G)가 2종류의 α-1,4 결합 또는 β-1,4 결합으로 이루어진 hetero형 다당류로 알려져 있다(Haug et al., 1966; Penman et al., 1972; Panikkar et al., 1996; Darget et al., 1997). 또, β-D-mannuronate (M)과 α-L-guluronate (G) 의 결합은 측쇄가 아닌 직쇄상 polymer로, 1) mannuronate 만으로 구성된 homo-polymannuronate block (polyM-block), 2) guluronate 만으로 구성된 homo-polyguluronate block (polyG-block) 및 3) mannuronate와 guluronate의 random배 열인 hetero-random copolymer (polyMG-blcok)의 3종류의 블록구조로 존재한다(Haug et al., 1967; Skjak-Braek et al., 1989; Decho, 1999). 이러한 알긴산을 분해하는 alginate lyase는 작용양식에 따라 polyM-block을 분해하는 polyM-specific lyase (EC 4.2.2.3), polyG-block을 분해하는 polyG-specific lyase (EC 4.2.2.11) 및 특이적으로 polyMGblock을 분해하는 polyMG-specific lyase (EC 4.2.2.-)가 보 고되고 있다. 대부분의 알긴산 분해효소에 관한 연구에서 는, 알긴산을 부분산분해해서 얻어진 polyM 및 polyG에 대한 작용양식에 따라 알긴산 분해효소의 기질특이성이 정 의되고 있다(Sutherland et al., 1995; Kim et al., 2011a). 또, 해양생물과 미생물에 의해 생산되는 알긴산 분해효소 는 알긴산의 구조분석에 사용되고, 화학구성이 알긴산의 성질에 어떤 영향을 미치는지 검토되고 있다(Chitnis and Ohman, 1990; Ostgaard, 1992). 현재 알긴산은 식품가공 시 안정제, 농후제, 유화제와 같은 식품첨가제로 사용되며, 실제로 아이스크림, 오렌지주스, 맥주, 치즈 등의 안정제로 이용되고 있다. 또한, 알긴산은 소화·흡수가 되지 않기 때 문에 알긴산으로 만든 젤리가 다이어트 식품으로 이용되기 도 한다. 동물실험에서는 유해 중금속을 흡착하여 체외로 배출시키고, 나트륨을 배설시켜 혈압을 낮추어 주는 것으 로 알려져 있다(Lee et al., 2003). 최근에는 고부가가치 해 조류 유래 기능성 신소재에 대한 관심이 깊어지면서 해조 다당류를 해조류로부터 효과적으로 추출할 수 있는 추출방 법의 최적화와 해조 다당류의 저분자화를 통하여 해조 다 당류 기능성 증진 방법에 대한 연구가 활발히 진행되고 있 다(Kim et al., 2011b). 최근 알긴산 유래 올리고당의 항균/ 항암 작용, 면역 증강, 항 콜레스테롤 효과, 항 응고 등 다 양한 생체조절 기능에 대한 보고들이 있어 알긴산을 이용 한 올리고당 제조에 관한 연구가 있었다(Guven et al., 1991). 또, 올리고당은 Bifidobacteria의 활성 촉진 및 장내 세균군의 개선, 생체조절인자 등의 역할이 알려지면서 많은 연구가 이루어지고 있다(Joo et al., 1996). 올리고당은 난소 화성으로 분해되지 않고 대장에 존재하는 Bifidobacterium 과 같은 유익균에 의해 acetate, propionate와 같은 휘발성 지방산(volitile fatty acid, VFA)으로 전환되므로 칼로리가 거의 없으며, Bifidobacterium 증식인자로 작용하는 반면 장내부패균의 증식을 억제한다(Colombel et al., 1987; Fuller, 1992; Ryu et al., 1998).
따라서, 본 연구는 hetero 구조적 특징을 가진 천연 유 래 알긴산을 기질로 하여, 이를 다양하게 분해하는 미생 물 효소를 이용하여 다양한 중합도를 이루는 올리고당을 제조하는데 목표를 두고 있다. 현재 알긴산은 알긴산 그 자체 또는 homo type 알긴산 올리고당으로써 이용되고 있으나, hetero type 알긴산 올리고당은 거의 이용되지 않 고 있는 상황이다. 알긴산의 3개의 블록구조 중에는 불균 일한 hetero-polymeric random sequence 구조(polyMGblock) 가 존재하고 그것에 대한 분해효소가 아직 많이 발 견되지 않은 것을 들 수 있다. 그렇기 때문에, 본 연구에 서는 Streptomyces violaceoruber 균주의 polyMG-specific lyase를 이용한 hetero type oligosaccharides 조제 및 분리를 목표로 하고 있으며, 중합도를 규명하여 중합도별 hetero oligosaccharides의 장내세균에 대한 생육활성을 비교·검토 하였다.
재료 및 방법
Streptomyces violaceruber IFO 15732는 일본 National Institute of Technology and Evaluation Biological Resource Center (NBRC, Tokyo, Japan)에서 분양 받아 실험에 사용 하였다. 효소생산의 배지조성은 sodium alginate (Junsei Co., Tokyo, Japan) 1.0%, peptone (Neogen Co., Lansing, MI, USA) 0.5%, yeast extract (Neogen Co., Lansing, MI, USA) 0.3%, KH2PO4 (Duksan Co., Seoul, Korea) 0.5%, MgSO4·7H2O (Duksan Co., Seoul, Korea) 0.05%를 함유하 는 액체배지 100 mL에 Streptomyces violaceruber 균주를 접종하여 30°C, 125 rpm에서 96시간 배양하여 4°C, 11,000 rpm에서 15분간 원심분리(rotor 14, Beckman Coulter, Inc., Brea, CA, USA)한 후 상층액을 효소액으로 사용하였다.
효소 활성 측정은 dinitrosalicylic acid (Sigma-Aldrich Co., St. Louis, MO, USA)를 사용하였고 alginate lyase의 활성은 DNS 환원당 정량법(Miller, 1959)에 의하여 수행하 였다. 즉, 0.5% sodium alginate를 포함한 pH 8.0의 50 mM Tris-HCl 완충용액을 기질 용액으로 하여 알긴산 가 수분해에 따른 환원당 생성량을 측정하였다. 효소활성은 0.9 mL의 기질 용액과 0.1 mL의 균체가 제거된 배양액을 혼합하여 30°C 항온조에서 30분간 반응시킨 후, 반응액 0.2 mL에 2.0 mL DNS 용액을 가하여 100°C에서 10분간 반응시켜 530 nm에서 흡광도를 측정하였다. 표준곡선은 mannuronic acid을 이용하여 표준 검량선을 작성하였고 1 unit의 alginate lyase는 동일조건에서 1분당 생성되는 mannuronic acid에 해당하는 1 mg/mL의 환원당을 방출하 는 효소의 양으로 정의하였다.
환원당은 DNS 정량법(Miller, 1959)에 의하여 수행하였 다. 즉 가수분해물 0.1 mL와 DNS 시약 1.0 mL를 혼합하 여 100°C 항온조에 10분간 물중탕을 하여 냉각시킨 후 희 석하여 530 nm에서 흡광도를 측정하였다. 표준곡선은 mannuronic acid를 0.1-1.0 mg/mL를 사용하였다.
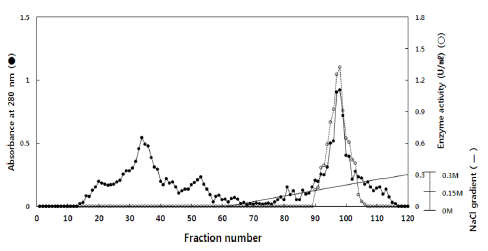
효소정제 수지로는 DEAE sephacel (GE-healthcare Co., Berkinghamshire, England), SP sepharose FF (GE-healthcare Co., Berkinghamshire, England)를 사용하였다. 20 mM Tris- HCl 완충용액(pH 8.0)로 평형화된 음이온 교환 수지인 DEAE sephacel (2.5×42 cm)에 packing하여 투석한 조효소 를 60 mL/h의 유속으로 fraction collector에 나누어 받았고, 각 용출액은 단백질양과 효소의 활성을 측정하였다. 기질 에 대해 활성이 강한 분획을 모아 농축하고, 다시 동일 완 충용액으로 평형화시킨 양이온 교환 수지인 SP sepharose FF (2.5×42 cm)에 농축한 효소액을 0-0.3M NaCl로 농도 구배법에 의해 60 mL/h 유속으로 fraction collector에 나누 어 수집하였고, 각 용출액은 단백질양과 효소의 활성을 측 정하여 정제 효소액으로 사용하였다.
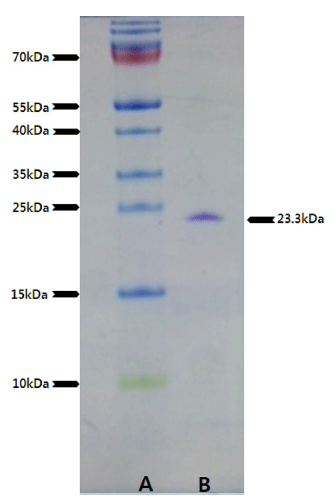
정제효소를 가열하여 변성시킨 후 분자량은 protein size marker (Thermo Scientific, Waltham, MA, USA)를 이용하 여 결정하였고, Schägger (2006)에 의해 tricine SDS-PAGE 를 수행하였다.
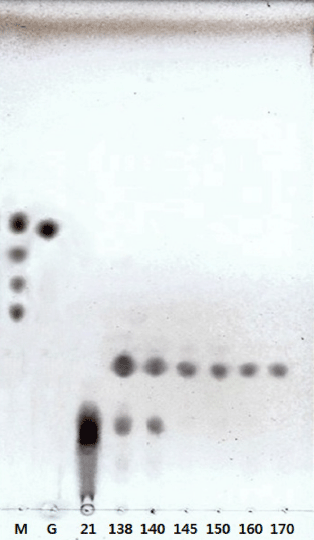
1차 activated carbon column chromatography; 정제 효소 액 50 mL (10 units)에 대해 0.5% sodium alginate를 30°C 에서 24시간 가수분해하여 TLC (Thin layer chromatography) 와 FACE (Fluorophore Assisted Carbohydrate Electrophoresis) 를 통해 pattern을 검토한 후 activated carbon column chromato-graphy (3×120 cm)를 이용해 당을 1차 분 리하였다.
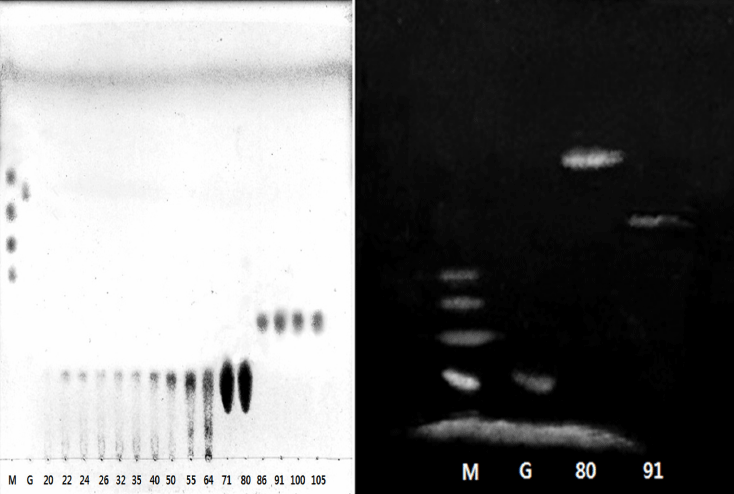
2차 Bio gel P-2 gel filtration; Activated carbon column chromatography에서 분리한 분획 중 phenol-sulfuric acid법 에 의해서 총 당함량을 측정하여 단일 spot이 나오지 않은 fraction을 다시 회수하여 bio gel P-2 gel filtration (3×120 cm)을이용해 각 중합도별로 2차 분리하였다.
TLC는 McCleary의 방법(McCleary, 1982)에 따라 다음 과 같은 조건하에서 전개 후 UV 조사 및 분무시약으로 분무하여 140°C에서 5분간 가열하여 당을 분석하였다. TLC plate; 20×20 cm silica gel 60 F254 (Merck, Darmstadt, Germany), Developing Solvent; n-butyl alcohol/acetic acid/water (5:3:2 v/v), Spray Reagent; 30% sulfuric acidethanol.
FACE는 ANTS에 유도화된 당의 전기영동으로 Jackson 의 방법(Jackson, 1996)에 따라 4-30%의 polyacrylamide gel을 사용하였다. 당용액 50 μL을 동결건조한 후 15% acetic acid에 0.15 M로 조제한 ANTS용액을 5 μL와 Dimethyl sufoxide (DMSO)에 1.0 M로 조제한 Sodium cyanoborohydride (NaCNBH3)용액 5 μL을 첨가하였다. 이 혼합액을 37°C에 15시간 반응시킨 후, 원심농축을 해서 20% glycerol 50 μL에 용해하였다.
시료의 중합도는 Timell’s modification method (Hirst et al., 1964)에 따라 측정하였다. 분리된 oligosaccharide 용액 200 μL에 1.0% sodium borohydride 200 μL를 혼합하였다. 대조 실험으로는 1 N sulfuric acid로 만든 1.0% sodium borohydride를 200 μL를 혼합하였다. 이것을 상온에서 1시 간 방치한 후 5% phenol 용액 1 mL를 첨가한 다음, Conc.-H2SO4 1 mL를 가하고 다시 상온에서 30분간 방치 한 후 490 nm에서 흡광도를 측정하였다. 이때 standard는 oligosaccharide 용액 대신에 증류수를 사용하여 측정하였으 며, 흡광도로부터 아래 식에 의해 중합도를 계산하였다(Joo et al., 1996).
(여기서,
(여기서, Q = non-reduced oligosaccharide의 O.D.값/reduced oligosaccharide의 O.D.값)
Bifidobacterium속 균주(B. animalis KCCM 11209, B. bifidum KCCM 12096, B. breve KCTC 3220, B. infantis KCCM 11207, B. longum KCCM 11953)와 Lactobacillus속 균주(L. acidophilus KCTC 3145, L. casei KCCM 12452, L. reuteri KCTC 3594)에 대한 생육 촉진 활성능을 측정 하기 위해 MRS media에서 탄소원인 dextrose 대신에 조 제·분리된 중합도별 M/G-oligosaccharides를 회수하여 진공 농축시킨 후 DNS법(Miller, 1959)을 이용하여 dextrose와 동일한 환원당량으로 조절하였다. M/G-oligosaccharides를 탄소원으로 121°C에서 15분간 멸균한 modified MRS media를 조제하여, 초기균수 107으로 희석하여 혐기적 조 건하에서 37°C, 48시간 평판배양한 후 colony수를 비교하 고(Deya et al., 1982), 동일한 조건으로 액체 배양하여 590 nm에서 흡광도를 측정하여 총균수를 비교하였다(Toba, 1985).
결과 및 고찰
조효소액을 Cellu·Sep MWCO 12,000-14,000 (Membrane Filtration Products Inc., Seguin, TX, USA)에 처리하여 150 mM NaCl이 포함된 50 mM Tris-HCl 완충용액(pH 8.0)으 로 4°C에서 하룻밤 투석하고 다시 20 mM Tris-HCl 완충 용액(pH 8.0)으로 4°C에서 하룻밤 투석하였다. 투석한 효소 액을 DEAE sephacel anion chromatography (2.5×42 cm)에 정제를 진행한 결과 분획 No. 19-64에서 효소 활성이 나 타났다(data not shown).
분획별로 tube에 수집된 활성 효소액을 모은 후, 10K centricon filter (Millipore Corporation, Billerica, MA, USA) 를 이용하여 농축하였다. 농축한 효소액을 Cellu·Sep MWCO 12,000-14,000 (Millipore Corporation, Billerica, MA, USA)에 처리하여 20mM Tris-HCl 완충용액(pH 8.0)으로 4°C에서 하 룻밤 투석한 후, SP sepharose FF cation chromatography (2.5×42 cm)에 loading한 결과 No. 95-105에서 효소 활 성이 높은 peak가 나타났다(Fig. 1). 각 정제 단계별 정 제도와 수율은 Table 1에 나타내었으며, DEAE sephacel chromatography 정제 결과, 비활성은 1.56 unit/mg, 정제도 는 4.4배였다. SP sepharose FF chromatography 정제 결과 최종적으로 정제된 효소의 비활성은 14.59 units/mg, 정제 도는 약 40.6배를 나타냈다.
정제효소는 tricine SDS-PAGE에 의해 단일밴드를 나타내 었으며(Fig. 2), alginate lyase의 분자량은 23.3 kDa으로 계 산되었다. Alteromonas sp. 272 유래 정제 alginate lyase에 서는 33.9 kDa, Streptomyces sp. ALG-5에서는 28.2 kDa, Vibrio sp. AL-145에서는 23 kDa, Pseudomonas aeruginosa에 서는 30 kDa의 분자량이 보고되고 있다(Kim et al., 2011b).
1차 activated carbon column chromatography에 의해 부 분적으로 분리된 당용액의 TLC pattern을 검토하였으며(Fig. 3), 중합도별 M/G-oligosaccharides를 회수하여 2차 bio gel P-2 column (3×120 cm)를 이용한 gel filtration을 수행하였 다. 60 mL/h 유속으로 tube당 10 mL씩 용출하여 동일한 방법으로 흡광도를 측정한 후(data not shown), peak를 나 타내는 각 분획을 회수하여 분리도 및 중합도를 확인하기 위하여 TLC (Fig. 4-A)와 FACE (Fig. 4-B)를 통해 Rf 값 에 의한 pattern을 비교·검토한 결과, 분획 No. 20-80에서 중합도 8의 M/G-oligosaccharide를, fraction No. 86-120에 서 중합도 6의 M/G-oligosaccharide를 회수하였다.
본 연구에서는 alginate 유래 M/G-oligosaccharides의 구 조식은 동정되지 않은 상태이나 중합도를 정확하게 정의하 기 위해 Timell’s modification method (Hirst et al., 1964) 에 따라 분석한 결과, 각각 분리·회수된 분획 No. 86-120 M/G-oligosaccharide의 Q는 1.194, Q-1는 0.194, Q/Q-1는 6.154로 분획 No. 20-80 M/G-oligosaccharide의 Q는 1.138, Q-1는 0.138, Q/Q-1는 8.246로 나타났다. 이에 분획 No. 86-120의 MG-oligosaccharide는 중합도 6, 분획 No. 20-80 의 MG-oligosaccharide는 중합도 8로 규명하였다(Table 2).
Bifidobacterium속 균주(B. animalis, B. bifidum, B. breve, B. infantis, B. longum)와 Lactobacillus속 균주(L. acidophilus, L. casei, L. reuteri)에 대한 생육 촉진 활성능을 측정하기 위해 MRS media에서 탄소원인 dextrose 대신에 조제·분리 된 중합도 6과 8 M/G-oligosaccharides를 첨가한 후 평판 배양을 하여 측정한 결과 올리고당이 첨가되지 않은 MRS broth에 비해 생육 촉진 활성을 보였다. 상기 방법으로 측 정한 결과, B. animalis, B. bifidum, B. breve, B. longum 그리고 L. casei에 있어서 D.P. 8의 경우 3배 이상의 상대 활성을 나타내었고, B. bifidum과 B. longum에 있어서도 D.P. 6의 경우 3배 이상의 상대활성을 나타내었다. 특히 B. longum에서는 D.P. 6 M/G-oligosaccharide를 탄소원으로 대 체한 경우 표준 MRS배지와 비교하여 4.25배, D.P. 8에서 6.44배의 상대활성을 나타내어 가장 우수한 생육활성을 나 타내었으며, B. bifidum의 경우에서도 D.P. 6에서 3.27배, D.P. 8에서 5.4배의 상대활성을 나타내었다. 반면에, L. reuteri에 대한 D.P. 8의 경우에서는 표준 MRS media와 비교하여 0.29배로 감소하였다. 또한 D.P. 8의 올리고당 이 D.P. 6의 올리고당보다 생육활성에 크게 기여하는 것으 로 나타났다(Table 3). 본 연구에서 사용된 Streptomyces violaceoruber의 alginate lyase는 polyMG block만을 특이적 으로 가수분해 시키는 polyMG-specific lyase (EC 4.2.2-) 으로 sodium alginate 유래 올리고당의 mannuronate와 guluronate 비율이 random한 hetero type M/G-oligosaccharides으로 생성하는 특징을 나타내고 있다. 동일 중합도를 갖는 homo type oligosaccharide와 hetero type oligosaccharide의 Bifidobacterium spp., Lactobacillus spp.에 대한 생육활성의 차이는 구조적인 측면에서 hetero type oligosaccharide의 mannuronate와 guluronate random 배열 구 성이 homo type oligosaccharide 보다 미생물 생육활성에 영향을 더 미치는 것으로 추론하고 있다. M/G-oligosaccharides의 mannuronate와 guluronate의 구성당비는 갈조류 의 종류, 채취부위, 채취시기 그리고 지역에 따라 다르기 때문에, M/G비나 분자량에 의해 oligosaccharides의 물리화 학적 역할도 다양하다. M/G구성비가 높은 저분자 올리고 당의 경우, 세균감염에 대한 면역 활성을 증강시키고, 케 라틴 성분 세포성장의 촉진효과와 피부섬유아세포 증식의 작용이 있다고 보고되고 있다(kawada et al., 1997; Tajima et al., 1999). 앞으로의 과제로서 본 연구에서 이용한 polyMG-specific lyase의 효율적 생산법 개발의 중요성과 다른 미생물 유래 polyMG-specific lyase를 이용한 효소분 해법에 대해 다양한 중합도의 hetero type oligosaccharides 의 수율 및 순도를 높이는 방법이 중요한 역할을 할 것으 로 생각된다.
요 약
DEAE sephacel anion chromatography 및 SP sepharose cation chromatography에 의해 Streptomyces violaceoruber 유래 alginate lyase의 정제를 수행하여 비활성 14.59 units/ mL 정제배율 40.64배를 나타내었다. Tricine SDS-PAGE에 의한 단일밴드를 확인하였고, 분자량은 23.3 kDa으로 결정 되었다. 정제효소에 의해 sodium alginate를 가수분해하여 1차 activated carbon column chromatography와 2차 bio gel P-2 gel filtration에 의해 당가수분해물을 분리 회수하여 TLC와 FACE를 통해 중합도를 확인하고 Timell’s method 에 의해 hetero type M/G-oligosaccharide 중합도 6, 8로 결정되었다. B. animalis, B. bifidum, B. breve, B. infantis, B. longum와 L. acidophilus, L. casei, L. reuteri에 생육활성에 대한 중합도 6, 8의 영향을 검토하기 위하여 modified-MRS media에 탄소원으로 중합도 6, 8를 대체하여 생육활성을 비교한 결과 B. longum에서는 D.P. 6 M/G-oligosaccharide 를 탄소원으로 대체한 경우 표준 MRS배지와 비교하여 4.25배, D.P. 8에서 6.44배의 상대활성을 나타내어 가장 우 수한 생육활성을 나타내었으며, B. bifidum의 경우에서도 D.P. 6에서 3.27배, D.P. 8에서 5.4배의 상대활성을 나타내 었다. 이외에도 B. animalis, B. breve그리고 L. casei에 있 어서도 D.P. 8의 경우 3배의 상대활성을 나타내었으나, L. reuteri에 대한 D.P. 8의 경우에서는 표준 MRS media와 비교하여 0.29배로 감소하였다. 결과적으로 D.P. 8의 올리 고당이 D.P. 6의 올리고당보다 생육활성에 크게 기여하는 것으로 나타났다.