서 론
웅담(bear bile)은 포유류(Mammalia) 곰과(Ursidae)에 속 하는 곰류의 쓸개를 말린 것으로 간질환, 소화기계 이상, 피부질환 및 임신중독 등의 치료에 특효가 있는 것으로 알 려져 있다(Lee et al., 1982; Joo et al., 2006; Bang et al., 2011; Kim et al., 2015). 담즙산(bile acid)는 간에서 콜레 스테롤로부터 합성되는 웅담의 주요성분으로서(Suzuki et al., 2013), 임산부의 담즙정체(intrahepatic cholestasis), 원발 경화성담관염(primary sclerosing cholangitis), 낭포성 섬유 증(cystic fibrosis)과 관련된 간질환 및 대숙주성 이식편병 (graft-versus-host disease) 등과 같은 각종 질병을 치료하는 데 약효가 월등하다(Angulo, 2002). 또한 일반 동물의 담 즙에는 전혀 함유되어 있지 않은 간 기능 활력을 강화시킬 수 있는 담즙산류인 urosodeoxycholic acid (UDCA)성분이 다량 함유되어 있다(Baig & Ahn, 1996). 담즙산은 카르복 시기(-COOH)와 히드록시기(-OH)가 포함된 스테로이드 골 격구조를 가지고 있다. 이러한 담즙산 중 cholic acid (CA) 와 chenodeoxycholic acid (CDCA)는 1차 담즙산으로서 콜 레스테롤로부터 합성되어 주로 glycine과 taurine이 결합된 형태로 존재한다. 이후 1차 담즙산은 십이지장으로 분비되 어 탈수화가 진행되고 이로 인해 2차 담즙산인 deoxycholic acid (DCA)와 lithocholic acid (LCA), UDCA가 생성되는데, 이들은 주로 회장 말단부에서 1차 담즙산들과 함께 간으로 운반되는 장간 순환을 통해 재흡수 된다. 또한 간에서 합 성된 담즙산은 간에서 분비되기 이전에 taurine 및 glycine 과 포합하여 수용성이 증가된 형태의 포합담즙산이 형성되 는데 이러한 포합담즙산으로 tauroursodeoxycholic acid (TUDCA), taurocholic acid (TCA), glycocholic acid (GCA), taurochenodeoxycholic acid (TCDCA), taurodeoxycholic acid (TDCA), glycochenodeoxycholic acid (GCDCA), glycodeoxycholic acid (GDCA) 등이 있다(Zhao et al., 2016). 이렇게 생성된 담즙산은 담낭에서 농축 및 저장되어 지방 의 소화와 흡수를 도우며 간에서 지질의 분비에 관여하는 등 신체기능과 건강유지에 있어 필수적인 역할을 한다 (Yang et al., 1998; Bang et al., 2011).
UDCA는 곰과 중에서 흑곰(Black bear), 북극곰(Polar bear), 불곰(Brown bear) 등의 담낭에 다량으로 존재하는 반면, 말레이곰(Sun bear), 느린보곰(Ceylon Sloth bear), 안 경곰(Spectacled bear) 등에는 소량 함유되어 있다고 보고 되고 있다(Hagey et al., 1993). 또한 웅담의 공급량은 제 한되어 있기 때문에 한의학에서는 돼지의 담낭을 말린 저 담(pig bile), 서양에서는 소의 담낭을 말린 우담(cow bile) 을 웅담 대신에 사용하기도 한다(Qin, 2008; Lee & Kim, 2009). 특히 동서양의학에서 저담 및 우담을 웅담 대신에 사용하기도 한 점으로 보아 UDCA 이외의 물질이 약효를 발휘할 가능성도 배제할 수 없다(Na et al., 1998; Han, 2006; Lee & Kim, 2009).
곰은 이미 국내에서는 거의 멸종된 상태이며 세계적으로 도 분포빈도가 매우 낮은 생물종이기 때문에 현재 웅담을 용이하게 구하기 힘든 실정이다. 이로 인해 야생 동·식물 종의 국제거래에 관한 협약(Convention on International Trade in Endangered Species of Wild Flora and Fauna, CITES) 대상인 곰의 웅담을 밀수하는 사례가 빈번히 발생 하고 있다. 또한 웅담으로 수입하였으나 실제로는 다른 동 물의 쓸개를 건조한 경우도 있어 국내에서 유통되고 있는 웅담의 진위여부를 확인하는 것이 필요하다. 이와 같이 웅 담의 제한적 공급으로 인해 최근 웅담과 다른 동물 유래 담즙 성분간의 비교 연구에 관한 관심으로 이어지고 있는 추세이며(Wang et al., 2011), 지금까지 high-performace liquid chromatography (HPLC), liquid chromatography/mass spectrometry (LC/MS), thin-layer chromatography (TLC), gas chromatoraphy (GC) 등의 다양한 분석 방법들이 활용되어 왔다(Yang et al., 1998; Lin et al., 2000; Si et al., 2015). 또한 종 특이적인 polymerase chain reaction (PCR) 및 PCR-restriction fragment length polymorphism (PCR-RFLP) 기반의 유전자 분석을 통해 웅담과 기타 담즙류를 구별하는 방법도 보고되고 있다(Kwon et al., 2009).
본 연구에서는 시판되고 있는 웅담, 저담 및 우담의 담 즙산 및 지방산 조성을 분석하고 유전자 분석을 통해 이들 의 진위여부를 확인할 수 있는 기초자료를 제공하고자 한 다. 또한 상기 이화학적 특성 분석을 통해 확보된 바이오 마커를 바탕으로 국내에 수입되고 있는 담낭 및 담즙의 웅 담 여부를 확인하고자 하였다.
재료 및 방법
본 연구에 사용된 담낭 및 담즙은 총 10종으로서 정품 웅담 2종 및 마장동 시장에서 구입한 저담 2종, 우담 2종, 그리고 세관 통관 시 압류 조치되어 분석 의뢰된 수입 건 조 담낭 2종과 담즙 2종을 분석시료로 사용하였다.
웅담, 저담 및 우담 내의 담즙산은 HPLC (Agilent-1200 series, Agilent Technology, Santa Clara, CA, USA)를 사용 하여 분석하였다. 웅담, 저담, 우담의 담즙 0.1 g을 75% methanol (v/v)에 현탁 한 후 0.45 μm syringe filter로 여과 하여 분석용 시료로 사용하였다. HPLC 분석조건은 컬럼 (ZORBAX Eclipse XDB-C18, 4.6×250 mm, 5 μm, Agilent Technologies)을 사용하였으며 이동상으로 buffer A는 50 mM potassium phosphate (pH 3.0) 그리고 buffer B는 acetonitrile을 사용하였다. 이동상의 농도 구배 조건은 buffer B를 0분에서 45분까지 28%에서 55%로 일정하게 증가시킨 후 50분까지 28%로 감소시켰다. 유속은 1.2 mL/min으로 하 였으며 컬럼의 온도는 45°C, 검출기는 DAD (Diode Array Detector, G1315D, Agilent Technology), 검출파장은 205 nm 에서 측정하였다.
시료는 AOAC 방법(AOAC, 2005)에 의해 메틸레이션 전처리 이후 GC (Agilent 7890A)를 사용하여 지방산 조성 을 분석하였다. 분석에 사용된 컬럼은 HP-INNOWAX (30m×0.25mm×0.25 μm, J&W Scientific, Folsom, CA, USA) 이었고 검출기는 flame ionization detector (FID, Agilent Technology), carrier gas는 헬륨을 사용하였다. 오븐의 온도 는 60°C에서 시료 주입 후 170°C까지 5°C/min의 속도로 승온하고 5분간 유지한 후 185°C까지 2°C/min로 승온 후 1분간 유지, 다시 220°C까지 2°C/min로 승온 후 20분간 유지하였다. 시료 주입량은 1 μL, 주입구 및 검출기의 온 도는 250°C이었다.
1,1-Diphenyl-2-picrylhdrazyl (DPPH)는 free radical에 대한 시료의 항산화 활성을 평가하기 위해 Kim et al. (2002)의 방법을 응용하여 측정하였다. 메탄올에 용해시켜 0.2 mM DPPH 용액 0.5 mL에 동량의 시료를 첨가하여 혼합한 후 실온에서 30분간 방치한 후 UV/VIS spectrophotometer (Optizen 3220UV, Mecasys, Daejeon, Korea)를 이용하여 517 nm에서 흡광도(Absorbance, A)를 측정하였다. DPPH에 의한 전자공여능(Electron donating ability, EDA)은 식 (1) 과 같이 계산하여 항산화 활성 정도를 분석하였다. Ablank와 Acontrol은 각각 시료 자체의 흡광도와 시료가 첨가되지 않은 DPPH 용액의 흡광도를 의미하며, Asample은 DPPH 용액과 시료 반응액의 흡광도를 나타낸다.
웅담의 진위여부를 확인하기 위한 유전자 분석을 위해 각 시료의 genomic DNA를 DNeasy Blood & Tissue Kit (QIAGEN, Valencia, CA, USA)을 활용하여 추출하였으며 종에 특이적인 primer를 제작(Peppin et al., 2008a; Park et al., 2012)하여 PCR을 진행하였다. 곰에 특이적인 primer로서 UT172F (5-GACGCGACTACAGCCTTTTC-3')와 UT367R (5′-CTATGAATGCGGTGGCTATAAC-3')를 사용하였으며 annealing 조건은 60°C/1 min, 35 cycles 조건에서 PCR을 수행하였다. 반면 돼지에 특이적인 primer는 SF11-Pig-F (5'-CAACCTTGACTAGAGAGTAAAACC-3')와 SF11-Pig-R (5'-GGTATTGGGCTAGGAGTTTGTT-3')를, 소의 경우에는 SF11-Cow-F (5'-TATCTTGAACTAGACCTAGCCCAATG- 3')와 SF11-Cow-R (5'-GGTACTTTCTCTATAGCGCCGTAC- 3')를 사용하였으며 annealing 조건은 59°C/10 s, 40 cycles 조건으로 PCR을 수행하였다. 증폭된 PCR 산물은 3500 genetic analyzer (Applied Biosystems, Foster, CA, USA)를 이용하여 염기서열 분석을 진행하였고 그 결과는 NCBI BLASTN을 통해 GenBank (Bensen et al., 2013)에 등록된 염기서열 정보를 대상으로 상동성을 비교함으로써 각 시료 의 유래 동물 종을 확인하였다.
결과 및 고찰
웅담, 저담, 우담의 건조된 담즙에 함유된 주요 포합담즙 산을 HPLC로 분석한 결과(Fig. 1) 웅담에서는 TUDCA와 TCDCA, 저담에서는 TCDCA와 GCDCA, 우담에서는 TCA와 GCA가 주요 담즙산으로 확인되어(Table 1), 각 시 료의 담즙 간에 분명한 차이점을 보였으며 이를 통해 담즙 산 조성의 monitoring을 통해 각 담즙의 구분이 가능할 것 으로 판단된다(Watanabe & Tsuneyama, 2012). TUDCA의 경우 간기능 활력을 강화시킬 수 있는 웅담에서만 확인되 었으며 저담에서도 소량 확인되었으나 우담에서는 나타나 지 않았다. 상기 결과는 기존 Yokota et al. (2004) 및 Si et al. (2015)의 연구결과와 같은 경향을 보였다. 확인된 웅 담의 TUDCA 함량은 14.24-31.85%로 웅담의 종에 따라 TUDCA 함량이 1.4-38.8%로 보고된 연구결과와 유사하였 으며(Hagey et al., 1993). 저담은 GCDCA 함량이 25.62- 32.90%로 웅담과 우담에 비해 높았으며, 우담의 TCA 함 량은 22.45-51.15%로 1% 이하인 웅담과 저담에 비해 높 게 나타났다. 또한 GCA의 경우 우담에서는 10.72-30.48% 가 검출된 반면 웅담과 저담에서는 검출되지 않았기 때문 에 우담의 특징적인 바이오마커로 활용될 수 있을 것으로 판단된다.
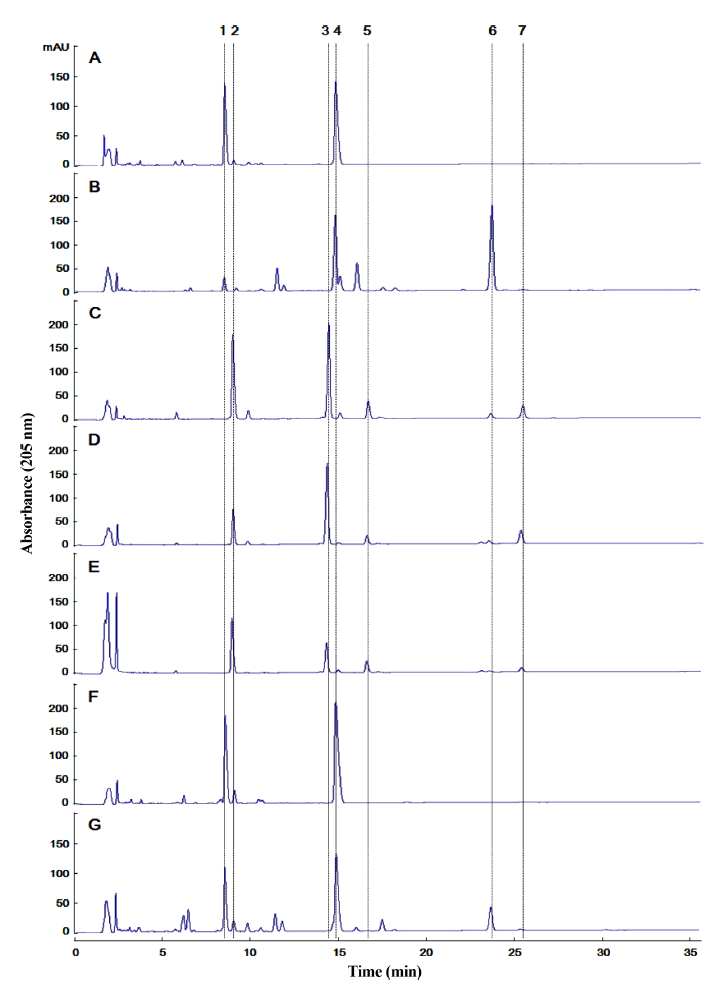
다음으로 상기 담즙산 조성 분석 결과를 바탕으로 국내 에 수입되어 웅담으로 거래되고 있는 시료 4종의 담즙산 분석을 수행하여 웅담의 진위여부를 확인하고자 하였다 (Table 1). 그 결과 수입 시료 1과 2는 GCA (22.55%)와 TCA (7.91%)가 주요성분이며 기타 GDCA (5.37%) 및 TDCA (2.22%) 등이 확인되는 것으로 보아 웅담이 아닌 우 담일 확률이 높은 것으로 판단되었다. 반면 수입 시료 3은 TCDCA (41.98%)와 TUDCA (28.06%)가 주요성분이며, 그 이외의 담즙산류가 확인되지 않은 것으로 보아 웅담으로 확 인되었다. 또한 수입 시료 4는 웅담에서 확인되는 TCDCA (18.67%)와 TUDCA (9.98%), 그리고 저담에서 확인되는 GCDCA (6.10%)가 주요 성분으로 검출되었으며 이를 통해 웅담과 저담이 혼합되어 있는 형태의 시료인 것으로 추정되 었다. 수입 시료 4에서 웅담 이외에 저담의 혼합 여부를 재 확인하기 위하여 HPLC 분석을 추가 수행하였으며 그 결과 돼지 담즙 추출물(Bile extract porcine, Sigma B8631, St. Louis, MO, USA)과 유사한 HPLC 크로마토그램을 보였다 (Fig. 2). 뿐만 아니라 웅담과 돼지 담즙 추출물을 혼합한 시 료와 비교한 결과 역시 유사한 크로마토그램을 나타냈으며 이를 통해 수입 시료 4의 저담 혼합을 재확인할 수 있었다.
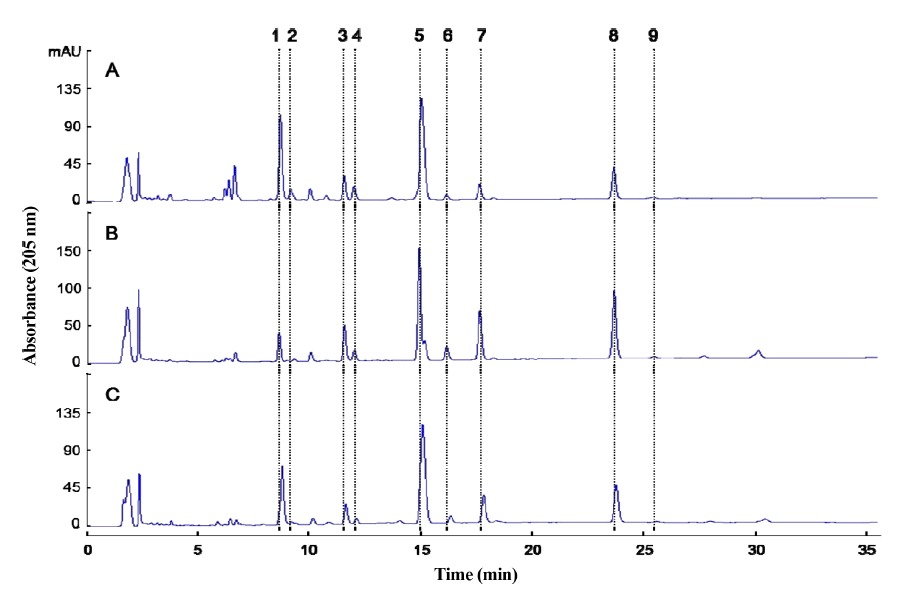
상기 HPLC 크로마토그램 분석을 기반으로 웅담과 저담 그리고 우담은 각각 특이적인 담즙산 조성을 보였으며 다 른 종류의 담즙이 혼합된 경우에도 그 혼합 여부를 확인할 수 있었다. 따라서 시중에 유통되는 가짜 웅담 및 혼합 웅 담의 판정기준으로 HPLC 기반의 담즙산 조성 분석이 유 용할 것으로 판단된다.
본 연구에 사용된 시료의 지방산 조성을 GC로 분석한 결과 지방산 조성 비율은 Table 2와 같으며, 웅담은 linoleic acid (C18:2)의 함량이 가장 높았으며, palmitic acid (C16:0), stearic acid (C18:0), oleic acid (C18:1) 순으로 확인되었고, 저 담은 palmitic acid (C16:0)의 함량이 가장 높았고 linoleic acid (C18:2)과 oleic acid (C18:1)은 거의 유사하였으며 stearic acid (C18:0) 순으로 확인되었다. 반면, 우담은 palmitic acid (C16:0)과 oleic acid (C18:1)의 함량이 유사하게 가장 높았고 stearic acid (C18:0), linoleic acid (C18:2) 순으로 확인되었다. 상기 지방산 함량 분석 결과는 기존 1% (w/w) 웅담 및 우 담, 저담의 식이에 의한 ICR mice의 혈청 및 간 내에 존재 하는 지방산 분석 결과와 유사한 것으로 나타났다. 이와 더 불어 웅담 및 저담과는 달리 우담의 식이로 인해 전체 지방 산 중에서 oleic acid (C18:1)의 비율이 증가하였고, palmitic acid (C16:0)과 stearic acid (C18:0)의 비율이 감소한다는 결과를 보고하였으며, 또한 우담 식이의 경우에만 간에서 cholesterol ester가 축적되고 이로 인해 지방간의 손상을 유도한다고 보 고하였다(Watanabe & Tsuneyama, 2012).
각 지방산 별로 그 함량을 비교한 결과 oleic acid (C18:1) 의 함량 비율은 저담(23.56-24.44%)과 우담(30.01-30.48%) 에 비해 웅담(12.37-14.59%)에서 낮았고, linoleic acid (C18:2)의 경우에는 웅담(23.46-27.96%)과 저담(19.21-22.27%) 에서 유사한 비율을 나타냈으나 우담(10.99-15.15%)의 그 비율은 상대적으로 낮은 경향을 보였다. 또한 C16:0/C18:1(t)의 비율은 웅담(1.79-1.92), 저담(1.35-1.44), 우담(0.95-1.05) 간 에 약간의 차이가 나타났으며, C18:2/C16:0의 비율은 웅담(0.9- 1.18), 저담(0.58-0.66), 우담(0.39-0.47) 순으로 분석되었다. Oleic acid (C18:1)의 trans/cis의 비율은 웅담(1.44-2.14), 저담 (9.67-10.03), 우담(13.09-21.90) 간에 큰 차이가 있음을 확인 할 수 있었다.
담즙산 분석과 마찬가지로 웅담으로 수입된 시료 4종의 지방산 조성 분석을 통해 웅담의 진위여부를 확인하였다. 수 입 시료 1, 2의 oleic acid (C18:1) trans/cis의 비율이 10.42과 11.27, C16:0/C18:1(t)의 비율이 1.12과 0.67, C18:2/C16:0의 비율이 0.39과 0.44로 우담의 조성 비율과 유사하게 나타났다. 수입 시료 3은 oleic acid (C18:1)의 trans/cis 비율이 2.12, C16:0/C18:1(t) 의 비율이 1.77, C18:2/C16:0의 비율이 1.01로 웅담과 유사한 경 향을 보임을 확인하였다. 반면 수입 시료4의 경우에는 oleic acid (C18:1) trans/cis의 비율이 1.28, C16:0/C18:1(t)의 비율이 2.85, C18:2/C16:0의 비율이 0.92로 상대적으로 웅담과 유사하지 만 수입 시료 3의 경우처럼 웅담만이 함유된 시료의 지방 산 조성과는 약간 상이한 결과를 보였다. 이를 통해 수입 시료 4의 경우에는 HPLC 분석을 통한 담즙산 조성의 결과 와 마찬가지로 웅담 이외에 다른 담즙이 혼합되어 있을 것 으로 판단되나 정확한 혼합여부는 확인하기 곤란하였다.
상기 결과를 바탕으로 각 담즙의 지방산 함량 비율 간에 도 차이가 있음을 GC 분석을 통해 확인할 수 있었으며, 지방산 비율을 통해 웅담과 저담 및 우담을 구분하는 것이 가능할 것으로 판단된다. 특히 HPLC 기반의 담즙산 조성 결과와 대부분 일치하는 것으로 보아 담즙간 혼합 시료를 제외한 웅담의 진위여부를 구분하는데 지방산 조성은 중요 한 바이오마커로 활용이 가능할 것으로 기대된다.
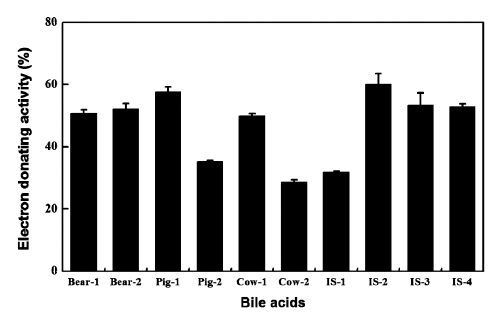
자연계에 존재하는 다양한 항산화 물질을 탐색하기 위하 여 DPPH에 의한 전자공여능측정이 많이 이용되고 있는데 비교적 짧은 시간 안에 항산화 활성 정도를 측정할 수 있 기 때문이다(Que et al., 2006). 본 연구에 사용된 각 담즙 시료의 DPPH assay 결과는 Fig. 3과 같다. 대부분 시료의 전자공여능은 50% 이상의 수준이었으나, 저담 1종 및 우 담 1종, 그리고 수입 시료 1종(시료 1)은 30% 수준으로 나타났다. 이러한 연구 결과는 기존 초식동물의 쓸개즙 추 출물이 가지는 DPPH에 의한 항산화 활성 측정 결과와 유 사했다(Shim et al., 1999). 항산화 활성을 측정하는 방법이 항산화의 메커니즘에 따라 DPPH에 의한 전자공여능 뿐만 아니라 ferric reducing antioxidant power (FRAP) 및 oxygen radical absorption capacity (ORAC) 등도 있기 때문 에(Yu et al., 2012), 본 연구에서 사용된 각 담즙 시료 간의 항산화 활성 정도가 큰 차이를 보이지 않는 결과를 바탕으 로 담즙산의 조성과 항산화 활성간의 관계를 정확히 설명 할 수는 없을 것으로 판단된다. 따라서 다양한 항산화 활 성 분석을 통해 담즙의 구별을 위한 바이오마커로 적용이 가능하도록 추가 연구가 필요할 것으로 생각된다.
웅담으로 수입된 시료 4종의 진위여부를 확인하기 위하 여 상기 HPLC 기반의 담즙산 분석 및 GC 기반의 지방산 조성 분석을 수행하였고 이를 통해 수입 시료 3을 제외한 3종의 시료가 웅담이 아닌 우담(수입 시료 1, 2) 그리고 웅 담과 저담이 혼합된 시료(수입 시료 4)임을 확인하였다. 이 러한 이화학적 분석 결과를 뒷받침하기 위한 유전자 분석 을 수행하고자 각 동물(곰, 돼지, 소) 종의 특이적인 primer를 제작하여 PCR 스크리닝을 수행하였다(data not shown). 소에 특이적인 primer (SF11-Cow-F/SF11-Cow-R) 를 사용한 경우 수입 시료 1과 2에서만 PCR 산물이 확인 되었으며 BLASTN 분석 결과 2개 시료 모두 Bos taurus isolate HT2-MLT10 haplogroup mitochondrion의 partial sequence (GenBank Accession number KT343749)와 100%의 상동성을 보였다. 이를 통해 수입 시료 1과 2는 이화학적 분석 결과와 마찬가지로 웅담이 아닌 우담임을 확인할 수 있었다. 또한 곰에 특이적인 primer (UT172F/ UT367R)을 활용하여 PCR을 수행한 결과 수입 시료 3과 4에서 PCR 산물을 확인할 수 있었으며, BLASTN 분석을 통해 Ursus thibetanus isolate Gaungua cytochrome b gene 의 partial sequence (GenBank Acc. No. JN709956)와 99%의 상동성을 나타냈다. 2개 시료 모두 곰 이외에 돼지 및 소에 특이적인 primer와는 반응을 하지 않았으며 기존 이화학적 분석 결과 수입 시료 3이 웅담으로 확인되었기 때문에 수입 시료 3의 유전자 분석 및 사용된 primer는 향 후 웅담의 진위여부를 확인하는데 유용하게 사용될 수 있 을 것으로 판단된다. 그러나 수입 시료 4는 HPLC 분석을 통해 웅담과 저담이 혼합되어 있을 것으로 판단되었으나, 유전자 분석 결과 돼지에 특이적인 primer (SF11-Pig-F/ SF11-Pig-R)를 사용하였을 때 PCR 산물이 확인되지 않아 저담의 혼합 여부를 추가적으로 증빙할 수는 없었다. 이는 GC 기반의 지방산 분석 결과와 유사한 경향으로써 단일 시 료가 아닌 혼합 시료일 경우 특이적으로 나타나는 문제일 수 있다고 판단된다. 또한 돼지에 특이적인 PCR primer의 제작 문제일수 있기 때문에 향후 primer를 재개발하여 혼합 담즙 시료의 유전자 분석 연구를 추가적으로 수행할 필요가 있다고 판단된다(Peppin et al., 2008b; Park et al., 2012).
요 약
본 연구에서는 시판되고 있는 웅담 및 저담, 우담의 담즙 산 및 지방산 조성 등의 이화학적 특성 분석과 유전자 분 석을 통해 각 담즙을 구별하기 위한 기초자료를 제공하고자 하였다. 또한 이러한 이화학적 특성 분석을 통해 확보된 바 이오마커를 바탕으로 국내에 수입되고 있는 웅담의 진위여 부를 확인하고자 하였다. 그 결과 HPLC 기반의 담즙산 분 석은 각 담즙산 유래에 따른 주요 담즙산의 차이는 향후 단일 시료 및 혼합 담즙산의 진위여부를 판단할 수 있는 바이오마커로 충분히 활용이 가능한 방법이라고 판단된다. GC 기반의 지방산 분석의 경우 단일 담즙산의 진위여부는 확인이 가능하나 혼합 시료의 경우에는 정확한 담즙의 유래 를 판단하기 곤란하였다. DPPH에 의한 전자공여능 분석을 통해 각 담즙 시료들의 항산화 활성을 측정한 결과 큰 차 이를 보이지 않았으며, 향후 DPPH 이외의 다양한 항산화 활성 분석을 통해 담즙 구별을 위한 바이오마커로 적용이 가능하도록 추가 연구가 필요할 것으로 판단된다. 마지막으 로 유전자 분석을 수행한 결과 GC 기반의 지방산 조성 분 석과 마찬가지로 단일 담즙산 시료의 경우에는 확인이 가능 하나 혼합 시료의 경우 저담의 혼합 여부를 추가적으로 증 빙할 수는 없었다. 따라서 혼합 시료의 경우에는 담즙산 분 석 결과를 뒷받침할 수 있는 추가적인 분석 방법에 대한 연구가 향후 수행될 필요가 있다고 판단된다.
지금까지 국내에서는 각종 동물의 담즙 조성과 함량을 분석한 연구결과가 희박하여 시중에 유통되는 담즙의 종류 를 확인하는데 어려움이 있었다. 하지만 상기 연구를 통해 HPLC 기반의 담즙산 분석 및 GC 기반의 지방산 조성 분 석 그리고 유전자 분석을 통해 1개의 혼합 시료를 제외하 고 대부분의 시료에서 담즙의 종류를 판단할 수 있었다. 또한 이를 바탕으로 국내에 수입되는 웅담 시료를 분석한 결과 웅담이 아닌 다른 종류의 단일 동물 유래 담즙 또는 웅담과 혼합된 형태의 담즙으로 확인되어 국내에서도 비정 상적인 담즙이 유통되고 있음을 확인하였다. 이러한 연구 결과를 바탕으로 본 연구는 향후 국내에 유통되고 있는 웅 담의 진위여부를 확인하여 담즙의 불법유통 방지 및 식품 의 안전관리에 중요한 기초자료로 활용될 수 있을 것으로 판단된다.