Article
커큐민 나노에멀젼의 특성에 미치는 바이오폴리머 유화제의 영향
조연지, 김현이1, 권윤중1,*
Influence of Biopolymer Emulsifier on the Characteristics of Curcumin Nanoemulsions
Yeon-Ji Jo, Hyunyi Kim1, Yun-Joong Kwon1,*
Department of Bio-Industrial Technology, Konkuk University
1Department of Food Science and Biotechnology, Kyonggi University
*Corresponding author: Yun-Joong Kwon, Department of Food Science and Biotechnology, Kyonggi University, San 94-6, Iui-dong, Yeongtonggu, Suwon, 16227, Korea +82-31-249-9651; +82-31-249-9650
yjkwon@kgu.ac.kr
© Korean Society for Food Engineering. All rights reserved.
Received: Sep 13, 2016; Revised: Oct 11, 2016; Accepted: Oct 11, 2016
Abstract
Curcumin is a natural polyphenolic phytochemical, which has a number of potential benefits in biological activities. However, curcumin has extremely low water solubility and low bioavailability, which makes it difficult to incorporate into many food products. In this study, we investigated the effects of biopolymer emulsifier type and environmental stress on the physical stability of nanoemulsions containing curcumin. Nanoemulsion containing curcumin stabilized by sodium caseinate (SC), whey protein isolate (WPI), modified starch (MS), and gum arabic (GA) were prepared using microfludizer. The droplet size of nanoemulsions decreased significantly from 1028 nm to 169 nm as emulsifier concentration increased (p<0.05). The optimum concentration of emulsifiers for stable curcumin nanoemulsions were determined to be 1% of SC and 1% of WPI, respectively. The storage study showed that the nanoemulsions were physically stable for 5 weeks at 25°C. In addition, nanoemulsions were physically stable against heat, freeze-thaw, pH, and NaCl solution. However, extensive droplet aggregation occurred in protein-stabilized nanoemulsions at CaCl2 solution, which was attributed to hydrophobic interaction between droplets.
Keywords: nanoemulsion; biopolymer; curcumin; droplet size
서 론
커큐민(cumcumin)은 강황(turmeric, Curcuma longa)의 뿌리부분을 건조한 다음 빻아 만든 노란색을 띤 향신료의 주요성분으로서(Khanna, 1999), 다양한 질환에 치료효과를 나타내고 부작용 또한 없어 제약이나 건강식품 산업에서 많은 관심과 주목을 받고 있다. 커큐민은 폴리페놀성분으 로써 항 염증 효과와 더불어 치매예방, 암 예방에 효능을 지니고 있다고 보고되었으나(Chan et al., 1998; Khar et al., 1999), 실제적으로 커큐민을 이용하기에는 많은 한계점 이 존재한다.
커큐민은 물에 잘 녹지 않는 지용성 소재로서, 중성에서 염기성인 pH 조건에서 불안정하며, 산성 pH 조건에서는 비교적 안정하다고 알려져 있다(Maiti et al., 2007). 즉, 커 큐민은 용해도가 매우 낮고 구강 섭취 시 생체 내 이용률 및 흡수력이 현저히 떨어진다. 이러한 문제점을 최소화하 고 액상식품 내 첨가를 용이하게 하기 위하여 나노에멀젼 화 기술이 많이 이용되고 있으며, 이러한 기술은 커큐민과 고기능성 물질의 낮은 용해도를 향상시키기 위한 방법으로 각광받고 있다(Ahmed et al., 2012; Jo & Kwon, 2014). 특히, 나노 크기를 가진 입자에 커큐민을 포집함으로써 포 집된 지용성 물질들을 외부환경으로부터 보호하고 안정한 상태에서 체내 흡수를 향상시킬 수 있기 때문에 액상 식품 에 적용이 가능할 것으로 생각된다.
일반적으로 유화제(emulsifier)는 에멀젼 형성 시 분산된 입자의 안정성을 부여하기 위하여 사용되며, 입자를 생산 함에 있어서 분산상 입자간의 반발력에 의해 서로 응집이 일어나지 않고 고르게 분산될 수 있도록 해야 한다(Chang & Fogler, 1997; Surassmo et al., 2010). 최근 들어 유화제 로 많이 사용되고 있는 바이오폴리머(biopolymer)는 유화 제와 비슷한 성질을 지니고 있으며, 계면활성제의 대체성 분으로 에멀젼을 안정화시키는데 이용되고 있다. 다양한 종류의 바이오폴리머는 천연 고분자로써 환경친화적이며 인체에 무해하다는 장점을 가지고 있으며, 입자계면에 흡 착하여 계면장력을 낮춰줌으로써 그들의 안정성 및 기능성 특성을 유지하는데 중요한 역할을 한다고 알려졌다 (Murray, 2002; McClements et al., 2007; Anarjan et al., 2011; Charoen et al., 2012; Liang et al., 2013). 이전 연구에서는 Tween 계열의 합성 유화제를 이용하여 커큐민 함유 나노 에멀젼을 생산하였으며, 이들의 입자크기는 100 nm 정도 를 나타내며 오랜 저장기간에도 불구하고 물리적으로 매우 안정한 상태를 유지하였다(Jo et al., 2014). Tween 계열의 유화제는 유화력과 가용화력이 매우 뛰어나기 때문에 에멀 젼 생성 시 작고 안정한 입자를 형성하는 특성을 지닌다 (Spernath et al., 2002). 그러나 많은 유화제가 화학합성에 의해 제조되므로 현대 소비자들의 천연 및 건강지향적 관 심을 고려하면 합성 유화제에 대한 소비기피 현상은 더욱 커질 것으로 생각된다.
또한 나노에멀젼의 상업적 적용을 위하여 식품 및 음료 산업에서 많은 시도들이 행해지고 있다. 일반적으로 나노 에멀젼은 일반 에멀젼에 비해 매우 안정한 상태를 유지하 나 식품에 첨가하거나 외부환경에 노출될 경우 이들의 물 리적 안정성은 파괴될 가능성이 높다. 특히, 식품에 첨가되 는 나노에멀젼의 바이오폴리머 유화제 사용은 여러 종류의 환경과 접하게 되어 에멀젼의 조성과 성질이 변하게 된다. 그러므로 본 연구에서는 나노에멀젼 제조 시 사용한 바이 오폴리머의 종류와 농도가 나노에멀젼의 물리적 성질과 안 정성에 미치는 영향을 조사하였으며, 열, 냉해동, pH, 염 종류 및 농도에 따른 나노에멀젼의 안정성을 검토하였다.
재료 및 방법
실험재료
본 연구에 사용한 커큐민(30% in corn oil)은 Sigma Chemical Co. (St. Louis, MO, USA)에서 구입하였다. 또한 분산상으로 이용한 medium chain triglyceride (MCT) 오일 은 SHS International Ltd. (Liverpool, UK)으로부터 공급받 았다. Whey protein isolate (WPI)은 Sungpoong (Asan, Korea)에서 구입하였으며, sodium caseinate (SC), modified starch (MS) 및 gum arabic (GA)는 Sigma Chemical Co.에 서 구입하였으며, 기타 모든 시약은 분석용을 사용하였다.
나노에멀젼의 제조
커큐민 함유 수중유적형(O/W) 나노에멀젼은 바이오폴리 머 유화제 종류 및 농도를 달리 하여 제조하였으며, 고압 균질기(Model M-110L Microfluidizer Processor, Microfluidic Corporation, Newton, ME, USA)를 이용하여 나노크기의 입자를 생산하였다. 나노에멀젼의 분산상은 1% (w/w) 커 큐민을 함유한 MCT 오일을 이용하였으며, 연속상으로는 서로 다른 바이오폴리머를 증류수에 충분히 용해시켜 준비 하였다. 바이오폴리머의 종류는 WPI, SC, MS 및 GA를 선택하였고, 첨가한 유화제의 농도는 0.1-10%로 하여 제조 하였다. 커큐민을 함유한 분산상은 140°C 이상의 MCT 오 일에 커큐민 1%를 분산시키고 몇 초간 용해시킨 후 바로 상온에서 냉각하여 준비하였다. 제조된 분산상과 연속상은 고속 혼합기(high speed mixer, Ultra-Turrax T18, IKA Works, Guangzhou, China)를 이용하여 11,000 rpm의 속도 에서 약 3분간 교반하여 마이크로에멀젼을 제조하였다. 분 산상과 연속상은 5:95 또는 10:90의 비율로 혼합하였다. 마이크로에멀젼을 120 MPa의 고압 균질기에 2회 통과시 킴으로 나노에멀젼을 제조하였다.
입자크기 및 제타전위 측정
커큐민 함유 나노에멀젼의 평균 입자크기 및 제타전위는 dynamic light scattering 원리에 의해 Zetasizer Nano-ZS 90 (Malvern Instruments, Worcestershire, UK)로 분석하였 다. 용매로 쓰인 증류수로 기준광을 잡고 나노에멀젼을 적 절히 희석한 후 1 mL을 취하여 3회 반복 측정하여 평균 값으로 나타내었다.
저장기간에 따른 물리적 안정성 평가
본 연구에서는 고압 균질기의 동일한 조건에서 나노에멀 젼 제조에 쓰인 바이오폴리머 중 SC와 WPI를 선택하여 제조된 커큐민 함유 나노에멀젼(분산상과 연속상 비율, 5:95)을 상온(25°C)에서 5주 동안 저장하면서 일정 기간마 다 입자크기 변화를 측정하였다.
열처리의 영향
커큐민 함유 나노에멀젼 5 mL을 시험관에 옮긴 후, 약 60°C incubator에서 약 4시간 정도 가온시킨 다음 상온에 서 냉각시켰다. 이때, 응집(aggregation)정도를 확인하고 입 자특성을 분석하였다.
냉·해동처리의 영향
커큐민 함유 나노에멀젼 5 mL을 시험관에 옮긴 후, 냉 동고(-20°C)에서 24시간동안 보관한 다음 상온에서 녹인다. 위 과정을 3회 반복한 후 입자특성을 분석하였다.
pH의 영향
pH에 대한 입자 안정성을 평가하기 위하여 다양한 범위 의 pH 완충용액(pH 1, 3, 5, 7, 9, 11)을 제조하였다. 이 때 사용된 pH 완충용액은 다음과 같다; HCl, KCl 완충용 액(pH 1, 25°C), citric acid, NaOH 완충용액(pH 3, 25°C), citric acid, sodium citrate 완충용액(pH 5, 23°C), phosphate 완충용액(pH 7, 25°C), tris (hydroxymethyl) aminomethane, HCl 완충용액(pH 9, 25°C), Na2HPO4, NaOH 완충용액(pH 11, 25°C) and NaOH, KCl 완충용액(pH 13, 25°C). 제조된 나노에멀젼과 pH 완충용액을 1:3으로 혼합한 후 상온에서 24시간동안 방치시킨 다음 입자특성을 분석하였다.
이온강도의 영향
이온강도가 나노에멀젼의 안정성에 미치는 영향을 알아 보기 위하여 1가 양이온을 포함하는 NaCl 용액과 2가 양 이온을 포함하는 CaCl2 용액을 사용하였다. 이 때, 염용액 의 농도는 0-200 mM이며, 제조된 커큐민 함유 나노에멀 젼과 염용액을 1:3으로 혼합하여 상온에서 24시간 보관 후 입자특성을 분석하였다.
통계처리
통계분석은 SPSS 통계프로그램(Statistical Package for the Social Science, Ver. 22.0 IBM., Chicago, IL, USA)을 통하여 평균과 표준편차를 산출하였으며, ANOVA (analysis of variation) 분석 후, Duncan's multiple range test를 이용 하여 평균치간의 유의성을 p<0.05 수준에서 실시하여 각 시료간의 유의적인 차이를 검증하였다.
결과 및 고찰
바이오폴리머 종류 및 농도에 따른 입자특성
Table 1와 Table 2는 분산상과 연속상 비율을 5:95와 10:90으로 달리하여 나노에멀젼을 제조하여 입자특성을 분 석한 결과이다. 분산상의 농도가 높을수록 입자크기는 크 게 측정되었으며, 입자분산지수(polydispersity index, PdI) 또한 분산상의 농도가 낮은 경우보다 상대적으로 높은 수 치를 나타내었다(p<0.05). 입자분산지수는 입자의 분산정도 를 나타내는 지표로써 범위는 0에서 1내로 표시된다. 입자 분산지수가 0.3 이하에서는 단분산상 형태이며, 0-3-0.6 범 위는 중분산상 형태, 0.6 이상은 다분산상 형태의 에멀젼 입자가 분포되어있음을 의미한다(Yuan et al., 2008). 또한 바이오폴리머의 농도가 증가할수록 나노에멀젼의 입자크기 는 감소하는 경향을 보여주었다(p<0.05). 이는 Jo & Kwon (2014)의 연구와 유사한 결과로써 입자크기가 작을수록 표 면적이 커지게 되는데, 이 때 입자 표면을 감싸기 위하여 더 많은 유화제를 필요로 하기 때문이라 생각된다. 유화제 농도 증가에 따른 입자크기 변화와 더불어 제타전위 값 또 한 유사한 경향을 나타내었으며, 유화제의 농도가 증가할 수록 제타전위 값이 감소하는 경향을 보였다(p<0.05). 일반 적으로 제타전위의 절대값은 입자의 안정도를 나타내는 기 준으로 사용될 수 있으며, ±30 mV 이상일 때 에멀젼의 입 자가 안정하다고 인정한다. 본 실험에서는 MS로 유화된 나노에멀젼을 제외하고는 모든 농도구간에서 -30 mV 이상 의 제타전위 값을 확인할 수 있었으며, 이는 에멀젼 입자 가 매우 안정한 상태를 유지하고 있음을 보여주고 있다.
Table 1.
Physical properties of curcumin nanoemulsion with biopolymer; ratio of disperse phase and continuous phase, 5:95 (mean ± SD, n=3)
|
Emulsifiers1) |
Property |
Concentration (%) |
|
0.1 |
0.5 |
1 |
2.5 |
5 |
10 |
|
SC |
D (nm)2) |
205.7±14.854bC |
218.0±1.25aC |
188.0 ± 0.503cB |
169.8 ± 2.879deB |
177.8 ± 2.954cdB |
166.0 ± 0.462eB |
|
PdI3) |
0.375±0.389aB |
0.285±0.039aA |
0.246 ± 0.034aB |
0.235 ± 0.045aB |
0.212 ± 0.048aA |
0.222 ± 0.015aB |
|
ζ-potential (mV) |
-48.6±0.306dAB |
-45.3±0.404bcB |
-46.5 ± 0.850cB |
-44.6 ± 1.250bC |
-45.4 ± 1.473bcD |
-40.9 ± 0.954aD |
|
|
WPI |
D (nm) |
707.8±8.351aB |
259.2±3.172bC |
198.9 ± 1.185cB |
185.5 ± 1.686dB |
179.5 ± 1.453dB |
180.4 ± 1.274dB |
|
PdI |
0.456±0.036aAB |
0.226±0.042bA |
0.136 ± 0.008bB |
0.137 ± 0.010bB |
0.163 ± 0.018bA |
0.173 ± 0.028bB |
|
ζ-potential (mV) |
-59.4±0.854fB |
-45.7±0.777eB |
-44.0 ± 0.700dB |
-35.2 ± 0.577cB |
-32.0 ± 1.997bB |
-28.9 ± 1.229aB |
|
|
MS |
D (nm) |
1028.4±190.6aB |
605.6±2.343bB |
427.4 ± 2.023cB |
222.8 ± 1.504dB |
179.5 ± 7.605dB |
150.5 ± 1.537dB |
|
PdI |
1.000±0.000aA |
0.351±0.091cA |
0.100 ± 0.013dB |
0.802 ± 0.002bA |
0.458 ± 0.020cA |
0.153 ± 0.027dB |
|
ζ-potential (mV) |
-32.0±0.351dA |
-24.7±0.100cA |
-23.1 ± 0.802bA |
-25.1 ± 0.458cA |
-22.4 ± 0.152bA |
-20.9 ± 0.850aA |
|
|
GA |
D (nm) |
3778±691.0aA |
1785±345.2cA |
2559 ± 356.1bA |
1507 ± 385.3cA |
791.9 ± 8.409dA |
467.2 ± 41.18dA |
|
PdI |
0.206±0.129bB |
0.41±0.214abA |
0.875 ± 0.217aA |
0.847 ± 0.265aA |
0.418 ± 0.344abA |
0.833 ± 0.290aA |
|
ζ-potential (mV) |
-45.3±2.639eAB |
-42.4±2.511dB |
-40.1 ± 1.739bcB |
-40.7 ± 0.473bC |
-37.8 ± 0.265bC |
-32.5 ± 1.212aC |
Download Excel Table
Table 2.
Physical properties of curcumin nanoemulsion with different biopolymers; ratio of disperse phase and continuous phase, 10:90 (mean ± SD, n=3)
|
Emulsifiers1) |
Property |
Concentration (%) |
|
0.1 |
0.5 |
1 |
2.5 |
5 |
10 |
|
SC |
D (nm)2) |
258.4 ± 11.218aC |
213.2±0.399bC |
225.9±0.211cC |
200.4±0.525dB |
180.9±0.336dB |
169.3±0.543dB |
|
PdI3) |
0.875 ± 0.216aA |
0.267±0.029cB |
0.376±0.028bcA |
0.471±0.011bBC |
0.511±0.028bB |
0.537±0.036bA |
|
ζ-potential (mV) |
-58.4 ± 0.643dB |
-43.2±0.971bB |
-46.7±0.854cB |
-45.6±0.458cC |
-44.2±0.902bC |
-42.5±0.115aD |
|
|
WPI |
D (nm) |
1335.3 ± 108.5aB |
441.7±15.84aBC |
275.8±5.794bBC |
209.4±0.651cB |
189.3±0.987cB |
181.2±1.997cB |
|
PdI |
1.000 ± 0.000aA |
0.255±0.193dB |
0.130±0.058bA |
0.171±0.017bC |
0.141±0.014bC |
0.157±0.023bB |
|
ζ-potential (mV) |
-70.6 ± 1.559eB |
-47.0±0.473dB |
-44.9±0.917dB |
-39.3±2.214cB |
-34.1±1.518bB |
-28.4±0.862aB |
|
|
MS |
D (nm) |
1264.9 ± 359.5aB |
1051.9±150.4bcA |
795.2±123.1bB |
275.8±1.836bB |
208.2±185.3cB |
149.6±1.100cB |
|
PdI |
1.000 ± 0.000aA |
0.85±0.002abA |
0.888±0.477abA |
0.655±0.033bB |
0.200±0.032cC |
0.100±0.016cB |
|
ζ-potential (mV) |
-36.1 ± 0.208dA |
-28.1±0.998cA |
-25.4±0.709cA |
-24.6±0.196bcA |
-23.3±0.237bA |
-21.0±0.166aA |
|
|
GA |
D (nm) |
3062.0 ± 531.269aA |
966.7±75.17bcAB |
1543.7±403.0bA |
1403.1±558.6bA |
718.8±1.65cA |
495.4±78.46cA |
|
PdI |
0.390 ± 0.128bB |
0.582±0.115abAB |
0.757±0.350abA |
1.000±0.000aA |
1.000±0.000abA |
0.800±0.346aA |
|
ζ-potential (mV) |
-40.6 ± 2.928cAB |
-43.8±1.193cB |
-43.3±1.168cB |
-35.9±1.450bB |
-41.3±3.602cC |
-31.4±0.896aC |
Download Excel Table
탄수화물계 바이오폴리머로 유화된 나노에멀젼의 입자분 포는 다분산 형태이며, 크기는 149.6 nm에서 3.8 μm 범위 를 나타내었다. 특히 GA로 유화된 에멀젼은 GA 2.5% 이 상일 경우 1.4 μm 이상의 입자크기와 대부분 0.6 이상의 입자분산지수를 나타내었다. 단백질계 바이오폴리머로 유 화된 나노에멀젼의 입자크기는 0.1% WPI를 제외하고는 500 nm 이하의 입자크기를 나타내었으며, 대체적으로 낮은 입자분산지수를 나타내었다. 특히, 분산상과 연속상 비율이 5:95일 경우, 1% 단백질 이상에서는 200 nm 이하의 입자 크기를 확인할 수 있었다. 즉, 1% SC와 1% WPI로 유화 된 나노에멀젼의 입자크기는 각각 188.0 nm와 198.9 nm로 나타났으며, 이후의 커큐민 나노에멀젼의 외부환경에 따른 입자 안정성 실험에서는 위 조건으로 제조된 에멀젼을 선 택하여 수행하였다.
저장 중의 물리적 안정성 평가
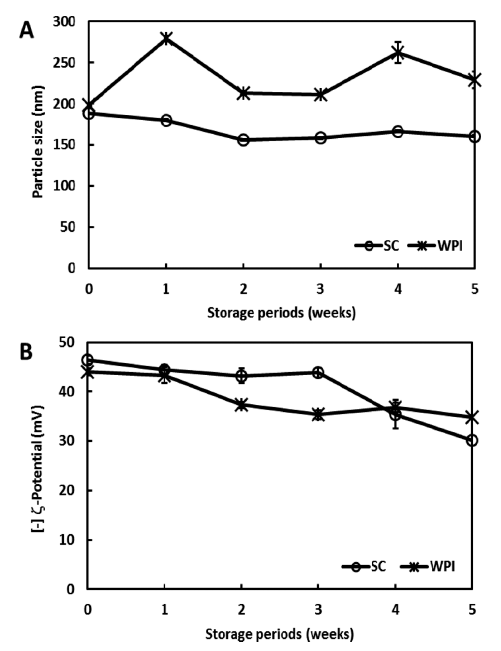
커큐민 함유 나노에멀젼의 물리적 안정성은 입자크기의 변화에 기초하여 평가하였다(Fig. 1). 저장기간 동안 이들 의 입자크기는 크게 변화하지 않았으므로(p<0.05), 물리적 으로 매우 안정한 상태임을 확인할 수 있었다. 또한 일반 적으로 입자의 안정도를 나타내는 기준으로 사용되는 제타 전위의 절대값은 약간 감소하였으나 큰 변화는 없었으므로 안정하다고 할 수 있었다.
Fig. 1.
Changes in (A) particle size and (B) ζ-potential of the curcumin nanoemulsions at 25°C for 5 weeks.
Download Original Figure
열처리와 냉·해동처리의 영향
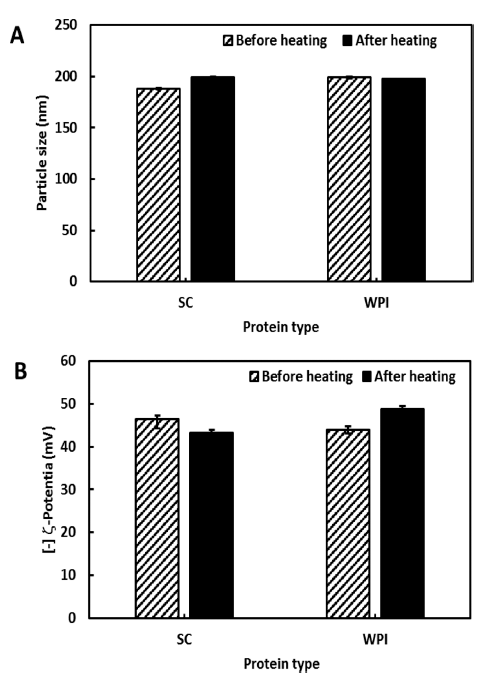
Fig. 2에 60°C에서 4시간 열처리한 커큐민 함유 나노에 멀젼의 입자크기의 변화를 나타내었다. SC와 WPI로 유화 된 나노에멀젼은 열처리 전과 후의 입자크기 및 제타전위 변화가 거의 나타나지 않았으며(p<0.05), 입자간의 침강이 나 응집현상을 나타내지 않았다. 즉, 200 nm 이하의 안정된 나노입자를 유지함으로써 단백질계 유화제로 제조된 나노 에멀젼은 열처리에도 매우 안정한 상태임을 확인하였다.
Fig. 2.
Changes in (A) particle size and (B) ζ-potential of the curcumin nanoemulsions before and after heating treatment.
Download Original Figure
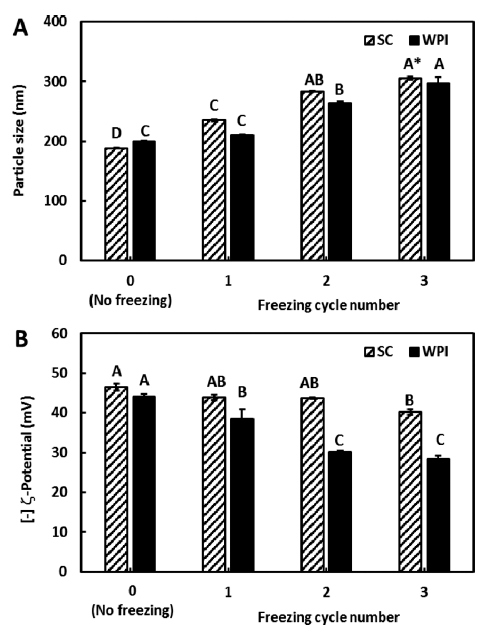
냉동처리에 따른 커큐민 함유 나노에멀젼의 안정성을 입 자크기 및 제타전위로 측정하여 그 결과를 Fig. 3에 나타 내었다. SC와 WPI로 유화된 나노에멀젼을 -20도에서 냉동 한 후 SC와 WPI로 유화된 나노에멀젼 모두 냉·해동 반 복횟수가 증가할수록 입자크기는 증가하는 반면 제타전위 는 감소하는 경향을 보여주었다(p<0.05). 이러한 현상은 냉 동과 해동이 반복될수록 물의 재결정화에 의한 나노 크기 입자들의 붕괴 및 융합에 의한 것이라 생각된다.
Fig. 3.
Changes in (A) particle size and (B) ζ-potential of the curcumin nanoemulsions before and after freeze-thaw treatment.
*Data points labeled with different letters (A-D) within the same treatment group have statistically significant differences (p <0.05) by Duncan’s multiple range test.
Download Original Figure
pH의 영향
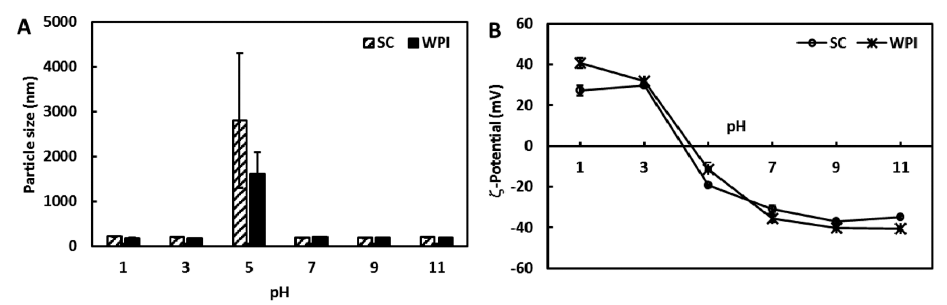
서로 다른 pH 조건(pH 1, 3, 5, 7, 9)에 따른 커큐민 함 유 나노에멀젼의 입자크기 및 제타전위를 측정한 결과를 Fig. 4에 나타내었다. pH 5 용액과 SC와 WPI로 제조된 나노에멀젼을 혼합한 경우를 제외하고는 대부분의 입자크 기가 200 nm로 측정되었다. 단백질의 등전점과 비슷한 pH 5인 경우에는 입자간의 응집으로 인해 1 μm 이상으로 입자크기가 급격히 증가하였다. 일반적으로 입자는 인력에 의해 서로 응집되는 경향을 보이며 이는 입자크기에 영향 을 끼친다(Chu et al., 2008). 또한 흡착된 단백질 표면의 전하는 pH에 의존하는 성향을 나타내며 특히 단백질은 등 전점 부근에서 입자의 전하가 0이 되어 서로 응집하게 된다. 제타전위 측정결과에서 보는 바와 같이 pH 3 (SC, 29.6 mV; WPI, 32.0 mV)과 pH 5 (SC, -19.3 mV; WPI, -11.6 mV) 사이 범위에서 전위값이 양에서 음으로 변화하였다. 즉, pH가 낮을수록 양의 전하 값을 나타내었으며 pH가 증 가할수록 제타전위 값은 감소하는 경향을 보여주었다. 다 시 말해, 단백질을 포함한 입자는 낮은 pH에서 양전하를 나타내며, 이는 단백질의 아미노그룹이 양전하를 띄는 반 면에 카르복실기그룹이 중성화를 나타내기 때문에 전체적 인 단백질의 전하는 양전하가 된다(McClements, 2005; Qian et al., 2012). 이 때, pH를 증가시키게 되면 아미노그 룹의 양전하는 감쇄되고, 아미노 그룹은 결국 중성화가 되 며, 카르복실기그룹은 음전하를 나타내게 된다(McClements, 2005).
Fig. 4.
Changes in (A) particle size and (B) ζ-potential of the curcumin nanoemulsions stabilized by SC and WPI with pH.
Download Original Figure
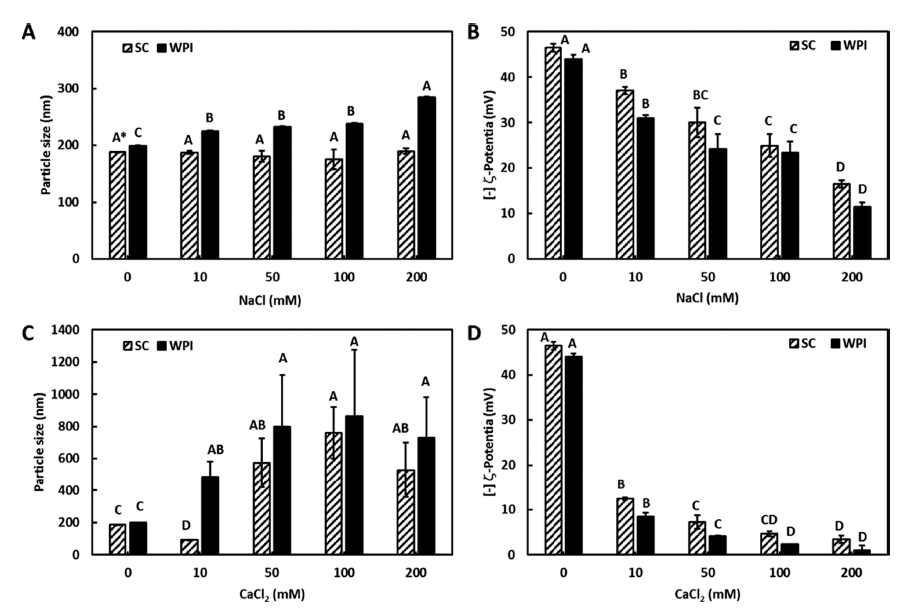
이온종류 및 농도의 영향
NaCl과 CaCl2 농도에 따른 입자크기 및 제타전위의 변 화를 Fig. 5에 제시하였다. Na+의 영향은 WPI로 유화된 에멀젼이 Na+ 농도에 따라 약간 증가하는 경향을 보였으 나, SC로 유화된 에멀젼은 Na+의 영향을 받지 않았다 (p<0.05). 반면에, Ca2+ 농도에 대한 입자크기는 SC와 WPI 로 유화된 에멀젼 모두 Ca2+ 농도가 높아질수록 유의적으 로 증가하는 경향을 보여주었다 (p<0.05). 특히 500 mM 이상부터는 500 nm 이상의 입자크기를 나타내었으며, 육 안으로도 입자간의 응집 및 융합을 확인할 수 있었다. 단 백질로 유화된 나노에멀젼의 제타전위는 이온 종류에 관계 없이 그 농도가 증가할수록 급격히 감소하는 경향을 나타 내었다(p<0.05). 일반적으로 미네랄은 정전기적 반발력이 감소한 수용액상의 이온강도를 증가시킴으로써 입자간의 정전기적 반발력을 감소시키며, 감소된 정전기적 반발력에 의해 입자간의 응집이 발생한다고 알려져 있다(Dalgleish, 1997; Kulmyrzaev et al., 2000). 즉, 특정한 이온의 이온결 합 또는 이온강도의 변화는 에멀젼 입자에 흡착된 단백질 의 구조적 형태를 변화시키기 때문에 입자는 서로 응집되 고 입자의 안정성은 감소하게 된다(Dalgleish, 1997). 본 연 구에서는 2가 양이온이 1가 양이온보다 입자의 제타전위를 큰 폭으로 감소하는 경향을 보여주었으며 (p<0.05), 입자크 기 측정결과에서도 2가 양이온이 입자간의 더 큰 응집을 발생시킴을 확인할 수 있었다.
Fig. 5.
Changes in (A, C) particle size and (B, D) ζ-potential of the curcumin nanoemulsions stabilized by SC and WPI with (A, B) Na+ and (C, D) Ca2+ ion concentration.
*Data points labeled with different letters (A-D) within the same treatment group have statistically significant differences (p <0.05) by Duncan’s multiple range test.
Download Original Figure
요 약
본 연구에서는 여러 종류의 바이오폴리머를 이용하여 지 용성 생리활성 물질인 커큐민 함유 나노에멀젼을 제조하였 으며, 실제 저장 과정 중에 발생할 수 있는 여러 가지 외 부환경적 스트레스에 대한 물리적 안정성을 평가하였다. 바이오폴리머의 종류 및 농도, 분산상과 연속상의 비율에 따라 다양한 입자크기의 나노에멀젼을 제조한 결과 단백질 계 바이오폴리머(SC, WPI)를 이용하여 제조된 나노에멀젼 이 좁은 분산도와 200 nm 이하의 입자크기를 나타내었으 며 물리적으로 매우 안정한 상태를 보여 주었다. 또한 주 위 환경에 대한 안정성을 검토한 결과, 2가 양이온인 CaCl2 용액과 혼합된 나노입자를 제외하고는 열처리, 냉· 해동처리 처리, pH, NaCl 용액 등에 대하여 매우 높은 안 정성을 보여 주었다.
감사의 글
이 논문은 2014년도 경기대학교 연구년 수혜로 연구되 었으며 이에 감사드립니다.
References
Ahmed K, Li Y, McClements DJ, Xiao H. Nanoemulsion and emulsion-based delivery systems for curcumin encapsulationand release properties. Food Chem. 2012; 132:799-807.

Anarjan N, Mirhosseini H, Baharin BS, Tan CP. Effect of processing conditions on physicochemical properties of sodium caseinate-stabilized astaxanthin nanodispersions. LWT - Food Sci. Technol. 2011; 44:1658-1665.

Chan MMY, Huang HI, Fenton MR, Fong D.
In vivo inhibition of vitric oxide synthase gene expression by curcumin, a cancer preventive natural product with anti-inflammatory properties. Biochem. Pharmacol. 1998; 55:1955-1962.

Chang CL, Fogler HS. Controlled formation of silica particles from tetraethyl orthosilicate in nonionic water-in-oil microemulsions. Langmuir. 1997; 13:3295-3307.

Charoen R, Jangchud A, Jangchud K, Harnsilawat T, Decker EA McClements DJ. Influence of interfacial composition on oxidative stability of oil-in-water emulsions stabilized by biopolymer emulsifiers. Food Chem. 2012; 131:1340-1346.

Chu BS, Ichikawa S, Kanafusa S, Nakajima M. Stability of protein-stabilised ß-carotene nanodispersions against heating, salts and pH. J. Sci. Food Agr. 2008; 88:1764-1769.

Dalgleish DG. Adsorption of protein and the stability of emulsions. Trends Food Sci. Technol. 1997; 8:1-6.

Jo YJ, Lee SB, Kwon YJ. Preparation of nanoemulsions containing curcumin by high pressure homogenization. Food Eng. Prog. 2014; 18:341-347.

Jo YJ, Kwon YJ. Characterization of ß-carotene nanoemulsions prepared by microfluidization technique. Food Sci. Biotechnol. 2014; 23:107-113.

Khanna NM. Turmeric - nature's precious gift. Curr. Sci. India. 1999; 76:1351-1356.

Khar A, Ali AM, Pardhasaradhi BVV, Begum Z, Anjum R. Antitumor activity of curcumin is mediated through the induction of apoptosis in AK-5 tumor cells. FEBS Lett. 1999; 445:165-168.

Kulmyrzaev A, Chanamai R, McClements DJ. Influence of pH and CaCl2 on the stability of dilute whey protein stabilized emulsions. Food Res. Int. 2000; 33:15-20.

Liang R, Shoemaker CF, Yang X, Zhong F, Huang Q. Stability and bioaccessibility of ß-carotene in nanoemulsions stabilized by modified starches. J. Agr. Food Chem. 2013; 61:1249-1257.

Maiti K, Mukherjee K, Gantait A, Saha BP, Mukherjee PK. Curcumin-phospholipid complex Preparation, therapeutic evaluation and pharmacokinetic study in rats. Int. J. Pharmaceut. 2007; 330:155-163.

McClements DJ. Food Emulsions Principles, Practice, and Techniques. 2005CRC Press. Boca Raton, FL, USA: .

McClements DJ, Decker EA, Weiss J. Emulsion-based eelivery systems for lipophilic bioactive components. J. Food Sci. 2007; 72:R109-R124.

Murray BS. Interfacial rheology of food emulsifiers and proteins. Curr. Opin. Colloid In. 2002; 7:426-431.

Qian C, Decker EA, Xiao H, McClements DJ. Physical and chemical stability of β-carotene-enriched nanoemulsions Influence of pH, ionic strength, temperature, and emulsifier type. Food Chem. 2012; 132:1221-1229.

Spernath A, Yaghmur A, Aserin A, Hoffman RE, Garti N. Food-grade microemulsions based on nonionic emulsifiers media to enhance lycopene solubilization. J. Agr. Food Chem. 2002; 50:6917-6922.

Surassmo S, Min SG, Bejrapha P, Choi MJ. Effects of surfactants on the physical properties of capsicum oleoresinloaded nanocapsules formulated through the emulsion–diffusion method. Food Res. Int. 2010; 43:8-17.

Yuan Y, Gao Y, Mao L, Zhao J. Optimisation of conditions for the preparation of β-carotene nanoemulsions using response surface methodology. Food Chem. 2008; 107:1300-1306.