Article
젖산균 발효 천문동의 항균활성 및 발효 특성
김수인, 이승민, 이충렬1, 손홍주2, 황대연3, 이희섭4, 김동섭*
Antimicrobial Activity and Characteristics of Asparagus Cochinchinensis Fermented With Lactic Acid Bacteria
Su-In Kim, Seung-Min Lee, Chung-Yeol Lee1, Hong-Joo Son2, Dae-Youn Hwang3, Hee-sup Lee4, Dong-Seob Kim*
Department of Food Science & Technology, Pusan National University
1Kanglim Organic Co., Ltd.
2Department of Life Science and Environment Biochemistry
3Department of Biomaterials Science
4Departmentof Food Science and Nutrition and Kimchi Research Institute, Pusan National University
*Corresponding author: Dong-Seob Kim, Department of Food Science & Technology, Pusan National University, Miryang 50463, Korea +82-55-350-5359; +82-55-350-5359
Kds@pusan.ac.kr
© Korean Society for Food Engineering. All rights reserved.
Received: Jul 23, 2016; Revised: Oct 21, 2016; Accepted: Nov 4, 2016
Abstract
Asparagus Cochinchinensis is known to ameliorate respiratory disease. We evaluated the antimicrobial activity of non-fermented and fermented A. cochinchinensis using lactic acid bacteria and investigated the physicochemical characteristics of the fermented A.cochinchinensis. Non-fermented A.cochinchinensis showed lower levels of antimicrobial activity than the fermented A.cochinchinensis. Ethyl acetate (EtOAc) extracts of the fermented A. cochinchinensis showed antimicrobial activities against the indicator strains at lower minimum inhibitory concentration (MIC). The MIC of the EtOAc extract of non-fermented A. cochinchinensis against Escherichia coli, Staphylococcus epidermidis, and Stphylococcus aureus were 100, 75, and 100 mg/ml. In contrast, the MIC of the EtOAc extract of ACLM was 25 mg/mL against E. coli. The MIC of the EtOAc extract of ACLS was 12.5 mg/mL against S.epidermidis, and the MIC of the EtOAc extract ofACLP was 12.5 mg/mL against S.aureus. The viable cell number, pH, and acidity of A. cochinchinensis fermented by Lactobacillussakei 383 were similar to those of A. cochinchinensis fermented by Leuconostocmesenteroides 4395, but were different from those of A. cochinchinensis fermented by Lactobacillus.plantarum KCCM 11322. These results suggested that the fermented A. cochinchinensis by lactic acid bacteria may be a good candidate for application to ameliorate respiratory disease.
Keywords: Asparagus Cochinchinensis; antimicrobial activity; lactic acid bacteria; fermentation
서 론
호흡기 질환의 유병률은 미세먼지, 아황산가스, 일산화탄 소 등의 대기오염 물질과 관련되어 증가하는 것으로 알려 져 있다(Kang et al., 2001; Seo et al., 2006). 우리나라에 서 발생하는 대기 미세먼지는 중국발 미세먼지로 장거리 이동오염물질과 자체오염원에 의한 영향을 함께 받고 있다 (Park et al., 2013). Ha et al. (2003)은 대기오염과 영아사 망과의 관계에 대한 연구에서 미세먼지에 노출된 어린이의 경우 미세먼지가 42.9 μg/m3 증가 시 영아 사망률이 14.2%나 증가한다는 결과를 발표하였다.
천문동(Asparagus cochinchinensis (Lour.) Merr.)은 백합 과(Liliaceae) 식물로 덩이뿌리는 우리나라, 중국, 일본 등 지의 동북아시아에서 전통 약용식물로 널리 사용되며(Lee et al., 2008) 병약합편이나 동의보감과 같은 고서에 의하면 해열, 이뇨, 강장이나 폐 관련 질환에 효험이 있는 것으로 알려져 있다. 천문동 추출물은 간암 세포에서 종양 괴사를 유도를 하고(Koo et al., 2000) 조골 세포의 활성 증가와 파 골 세포의 생성 억제 효과를 한다고 보고 되고 있다(Lee et al., 2008). 천문동에는 monosaccharides, oligosaccharides, polysaccharides, steroidal saponins, phenolic compounds 등 의 기능성 성분이 함유되어 있는데(Tenji et al., 1979; Du & Duo, 1990; Zhang et al., 2004;Shen et al., 2011; Guo- Lei et al., 2014), Son et al. (2013)의 보고에 의하면 천문 동에 함유된 asparagine, β-sitosterol, quercetin 중 quercetin (IUPAC name: 2-(3,4-dihydroxyphenyl)-3,5,7-trihydoxy-4Hchromen- 4-one)은 강력한 항산화와 MCF-7, Hep-G2, NCIH460, HeLa cell 등의 인간암 세포에서 뛰어난 항암 작용을 한다고 한다. Lee et al. (2015a)은 천문동으로부터 추출한 methylprotodioscin (IUPAC name: 3-O-[α-l-rhamnopyranosyl- (1→2)-{α-l-rhamnopyranosyl-(1→4)}-β-d-glucopyranosyl]-26-O-[β-d-glucopyranosyl]-22-methoxy-25(R)-furost-5-ene-3β,26- diol)이 염증성 유발인자인 IL-6와 IL-8, 종양괴사유발인자 TNF-α의 생성을 강하게 저해하는 등 기도 염증을 약화시 키고 기도 염증 질환 저해 작용을 하는 물질이라고 보고하 고 있다. Lee et al. (2015b)의 연구에서도 천문동으로부터 추출한 dioscin과 methylprotodioscin은 기도 상피 세포에 작용하여 muc5ac mucin 유전자 발현을 억제하는 결과를 보여 염증성 폐 질환에 활용될 것으로 보고 있다. 또한 한 방에서 사용하는 천문동이 첨가된 phytoformula의 처리는 in vitro 및 in vivo 연구에서 폐 염증 억제에 효과가 있음 을 보여준다(Jung et al., 2014; Jeong et al., 2016).
한편, 젖산균은 Generally Recognized As Safe (GRAS) 로 항암, 항산화, 항균, 면역력개선, 항알레르기 등의 뛰어 난 효능을 가진 것으로 잘 알려져 있으며(Olsen et al., 1995; Cross et al., 2001; Perdigón et al., 2001; Rafter et al., 2002; Karovičová et al., 2003) 식품이나 채소, 전통약 용식물에 적용 시 항균작용이 강화되는 등의 긍정적인 효 과를 보인다(Kang & Kim, 2011). 이는 발효를 통하여 특 정 기능성 성분이 체내에 흡수되기 좋은 형태로 전환되거 나 그 양이 증가되는 효과를 가진다는 것을 의미한다. 특 히, 천문동의 경우 발효에 대한 연구가 매우 부족한 실정 이며 실험을 통해 천문동 발효물의 항균 활성 효과에 대한 과학적인 고찰이 필요하다 여겨진다. 따라서 본 연구에서 는 천문동의 젖산균 발효를 통해 호흡기 질환을 유발하는 미생물을 저해하는 항균효과를 확인하고 제조된 젖산균 발 효 천문동의 특성을 살펴보았다.
재료 및 방법
실험 균주 및 배양
발효 추출물의 항균 활성 실험에 사용된 병원성 미생물 은 그람 양성균 2종, 그람 음성균 2종으로 한국미생물보전 센터(KCCM, Seoul, Korea)에서 분양 받아 사용하였다. 그 람 양성균은 천식 등의 호흡기 질환을 일으키는 Staphylococcus aureus KCCM 40881 (Bachert et al., 2002; Davis et al., 2015), 비용종을 유발한다고 알려진 Staphylococcus epidermidis KCCM 35494 (Dunnette et al., 1986)를 사용 하였으며 그람 음성균은 만성폐쇄성질환, 낭포성 섬유증 등 의 폐질환에서 관찰되는 미생물인 Pseudomonas aeruginosa KCCM 11328 (Valderrey et al., 2010), 병원 내 감염되는 폐렴균주인 Escherichia coli KCCM 11234 (Igusa et al., 2012)을 사용하였다. 배양에 사용된 배지는 Difco (San Jose, CA, USA) 제품을 사용하였으며 세균의 배양 및 항 균력 측정에는 각각 Triptic Soy Broth (TSB)와 Muller Hinton Broth에 Bacto Agar를 0.8% 첨가한 Muller Hinton Agar (MHA)를 각각 사용하였다.
천문동 발효에 사용된 미생물은 Lactobacillus sakei 383 (Kim et al., 2011), Leuconostoc meseteroides 4395 (Kim et al., 2011), Lactobacillus plantarum (KCCM 11322)으로 L. sakei 383, Leu. meseteroides 4395은 본 실험실에서 분 리·동정된 것을 사용하였다. 발효에 필요한 미생물배양에는 MRS Broth (Difco)를 사용하였다.
실험에 사용된 미생물은 모두 2회 계대 배양한 뒤 UVspectrophotometer (Optizen POP, Mecasys Co., Ltd., Daejeon, Korea)를 이용하여 호흡기 질환 병원성 미생물은 O.D.650nm= 0.4에서 발효 미생물은 O.D.600nm=1.0의 농도로 실험에 사용 되었다.
천문동의 발효
수세한 17년산 천문동 뿌리(고창천문농원)는 동결 건조 (FD5510S-FD5520S, Ilshinbiobase Co., Dongduchon, Korea) 하고 분쇄기(MF-3100S, Hanil Electric Co., Seoul, Korea) 처리한 뒤 50 mesh 이하로 균질화하여 실험에 사용하였다. 균질화한 천문동 37.5 g과 증류수 250 mL를 121°C에서 15 분간 멸균하여 발효에 사용하였다. 멸균된 천문동은 발효 균주(L. sakei 383, Leu. meseteroides 4395, L. plantarum KCCM 11322)를 5%(v/v)씩 접종한 뒤 30°C에서 48시간 동안 정치 배양하여 실험에 사용하였다.
추출물의 제조
유산균 발효 천문동 추출물 제조 시 용매는 증류수(DW), 메탄올(MeOH), 에탄올(EtOH), 노르말헥산(n-hexane), 에틸 아세테이트(EtOAc), 에테르(Ether)를 사용하였다. MeOH과 EtOH추출은 용매 250 mL를 가한 뒤 진탕항온수조(SHWB- 30/45, Woori Science Instrument Co., Pocheon, Korea)에 서 각각 60°C, 70°C, 110 rpm으로 24시간 3회 추출하였다. EtOAc와 n-hexane 추출은 용매 250 mL를 가한 뒤 진탕항 온수조에서 50°C, 110 rpm으로 24시간 3회 추출하였다. Ether 추출은 용매 250mL를 가한 뒤 실온에서 190 rpm으로 24시간 3회 추출하였다. 추출된 시료들은 여과지(Whatman No. 2)를 사용하여 감압여과 후 진공 농축시켜 일정 농도로 희석 후 실험에 사용하였다. 물 추출물은 121°C에서 45분간 추출하였다. 각 조건 별로 제조된 추출물은 25, 50, 100 mg/mL의 농도로 적정 희석하여 호흡기 관련 질환 미생물 의 항균활성 측정실험에 사용하였다.
항균활성 측정
천문동 발효 추출물의 항균활성은 agar-well diffusion method (Irshad et al., 2012)을 변형하여 실시하였다. 호흡 기 질환 관련 병원성 미생물(S. aureus KCCM 40881, S. epidermidis KCCM 35494, E. coli KCCM 11234, P. aeruginosa KCCM 11328)은 MHA에 1% 접종 후 균일하 게 섞어 petri dish에 20 mL 분주하였다. 제조된 plate는 실 온에서 응고시킨 후 pasteur pipette을 이용하여 직경 6 mm well을 만들어 각 용매 추출물을 25, 50, 100 mg/mL의 농도 로 희석하여 각 well에 70 μL씩 주입하고 negative control 은 각각의 추출 용매를 주입하였다. plate는 35°C에서 일정 시간 배양 후 well 주위에 형성되는 생장저해환의 직경 (mm)을 측정하여 항균활성을 측정하였다. 실험은 3회 반복 하고 결과는 평균으로 나타내었다.
최소저해농도(MIC)의 측정
발효 추출물 중 뛰어난 항균활성이 나타나는 추출물을 선 별 후 선별된 추출물의 최소저해농도(Minimum Inhibitory Concentration, MIC)를 측정하였다. MIC는 plate상에서 8 mm 이상의 생육저해환이 나타나는 추출물의 농도로 정하 였으며, mg/mL로 나타내었다(Yoo et al., 2005; Choe et al., 2014). 실험은 3회 반복하였으며 결과는 평균과 표준편 차로 나타내었다.
생균수 측정
발효균주(L. sakei 383, Leu. meseteroides 4395, L. plantarum KCCM 11322)를 접종한 천문동 시료의 측정은 30°C의 온도에서 0, 12, 24, 36, 48, 60, 72, 96, 120시간마 다 이루어졌으며 시료를 멸균 증류수로 십진희석하고 MRS plate에도 말한 뒤 배양하여 colony의 수를 측정하고 Log CFU/mL로 표시하였다. 실험은 3회 반복하고 결과는 평균과 표준편차로 나타내었다.
pH 및 산도 변화측정
동결건조한 천문동 분말 15 g과 D.W 100 mL를 넣고 멸 균하여 발효 균주(L. sakei 383, Leu. meseteroides 4395, L. plantarum KCCM 11322)를 접종하고 30°C의 온도에서 0, 12, 24, 36, 48, 60, 72, 96, 120시간 발효 시간 별로 천 문동의 pH 및 산도 변화를 측정하였다. pH는 pH meter (pH-200L, Istek, Seoul, Korea)를 이용하여 측정하였다.
산도는 발효 천문동 10 mL에 DW를 10 mL 첨가하여 교 반 후 0.1 N NaOH를 이용하여 측정 pH가 8.3이 될 때까 지 적정하였다. 사용된 0.1 N NaOH 양을 다음의 계산식으 로 젖산으로 환산하였다.
실험은 3회 반복하고 결과는 평균과 표준편차로 표시하 였다.
수분 및 회분의 측정
발효 천문동의 수분은 105°C 상압가열건조법, 조회분은 직접회화법을 이용하여 측정하였다(AOAC, 1990). 실험은 3회 반복하고 결과는 평균과 표준편차로 표시하였다.
환원당 및 총당 측정
환원당은 DNS법(Miller, 1959), 총당은 phenol-sulfuric acid법(Dubois et al., 1956)을 이용하여 측정하였다.
환원당은 동결건조된 천문동 시료 4 g에 증류수 100mL로 정용한 뒤 30°C에서 120 rpm으로 2시간 교반한 후 10% TCA (v/v in water)를 소량 첨가하여 단백질을 침전시킨 후 15분간 방치하여 여과하였다. 각각의 여액 0.5 mL에 3,5-dinitrosalicylic acid (DNS) 시약 1.5 mL를 넣고 90°C에 서 10분간 발색시킨 후 535 nm에서 흡광도를 측정하였다.Fig. 1
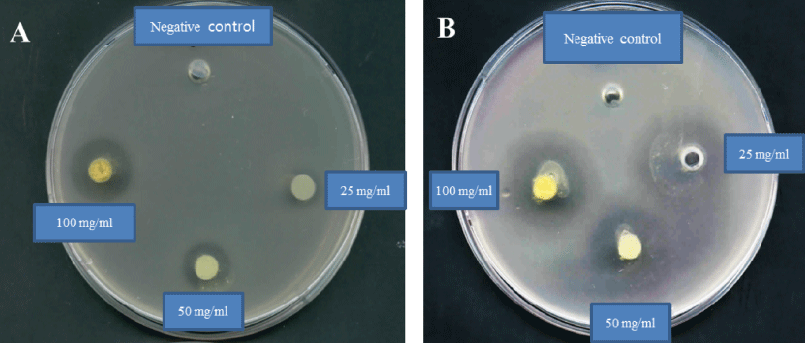
Fig. 1.
Antimicrobial activity of ethyl acetate extract of A. cochinchinensis with lactic acid bacteria.
A: Antimicrobial activity of ethyl acetate extract of ACLP, B: Antimicrobial activity of ethyl acetate extract of ACLS.
Download Original Figure
총당은 시료 0.2 mL에 25% HCl (v/v in water) 1 mL와 증류수 9 mL를 첨가하여 95°C에서 2시간 동안 산분해시킨 후 여과지(Whatman fliter paper No. 2)로 여과하였다. 각각 의 여액 0.5 mL에 5% phenol 0.5 mL와 진한황산 2.5 mL를 가하여 혼합한 후 15분간 반응하여 분광광도계로 550 nm 에서 흡광도를 측정하였다. 실험은 3회 반복하였으며 결과 는 평균과 표준편차로 표시하였다.
결과 및 고찰
천문동 발효추출물의 항균활성
젖산균으로 발효된 천문동의 용매 추출물별 항균활성 측 정 결과 젖산균 발효 천문동의 EtOAc 추출물에서 가장 뛰 어난 항균활성을 나타내었다. Zaghloul et al. (2001)은 꿀 의 항균활성 측정 시 diethyl ether 추출물보다 EtOAc 추 출물에서 뛰어난 항균활성을 보인다고 보고하고 있다. E. coli는 Leu. Mesenteroides 4395로 발효된 천문동(ACLM) 의 EtOAc 추출물, S.aureus는 L. plantarum KCCM 11322 로 발효된 천문동(ACLP)의 EtOAc 추출물, S. epidermidis 는 L. sakei 383으로 발효된 천문동(ACLS)의 EtOAc추출 물에 의해 크고 선명한 inhibition zone을 형성하여 이어지 는 실험에 사용하였다(Table 1).
Table 1.
Inhibition zone of ethyl acetate extract of A. cochinchinensis fermented with lactic acid bacteria
|
Ethyl acetate extracts |
Zone of Inhibition |
|
E. coli
|
S. aureus
|
P. aeruginosa
|
S. epidermidis
|
|
ACLS |
Concentration (mg/mL) |
100 |
25 |
100 |
25 |
|
Diameter (mm) |
+++ |
++ |
+++ |
+++ |
|
|
ACLM |
Concentration (mg/mL) |
25 |
50 |
ND* |
50 |
|
Diameter (mm) |
+++ |
++ |
ND |
+++ |
|
|
ACLP |
Concentration (mg/mL) |
ND |
25 |
ND |
25 |
|
Diameter (mm) |
ND |
+++ |
ND |
++ |
Download Excel Table
선행 연구에서 발효 전 천문동의 항균활성은 MeOH, EtOH추출물에서 200 mg/mL의 농도로 항균활성 측정 시 S. epidermidis, P. aeruginosa에서 8 mm 미만의 생육저해가 나타나고 EtOAc 추출물에서 동일한 농도로 측정 시 8-9 mm의 생육저해환을 형성하였다(Jung et al., 2016). 천문동 발효 전·후 동일하게 EtOAc 추출물에서 가장 높은 항균활 성력을 보였으나 젖산균으로 발효된 천문동의 MeOH, EtOH 추출물에서는 생육저해환이 관찰이 되지 않는 반면 ACLS의 열수추출물에서 E. coli (100 mg/mL, 8 mm), S. aureus (10mg/mL, 6 mm)의 생육저해환이 관측되었고 ACLM의 열수추출물에서 E. coli (100 mg/mL, 7 mm)의 생육저해환이 나타났다(data not shown). 또한 ACLM의 n-hexane 추출물에서 E. coli (100 mg/mL, 7 mm)의 생육저해 환이 관찰되었고 ACLM의 ether 추출물에서 P. aeruginosa (50mg/mL, 7 mm)의 생육저해환이 나타나 천문동 발효 전 ·후의 항균활성 차이를 보였다(data not shown). 이는 천문 동의 젖산균 발효로 인하여 항균활성을 갖는 기능성 물질 의 생물전환이 일어난 것으로 추측된다(Shin et al., 2007).
실험 결과를 토대로 천문동 발효 균주(L. sakei 383, Leu. meseteroides 4395, L. plantarum KCCM 11322)별로 병원 성 미생물에 대해 가장 적은 농도에서 높은 항균활성을 나 타내는 추출물을 MIC의 측정에 사용하였다.
유산균 발효 천문동 추출물의 최소저해농도(MIC)
용매 별 추출물의 항균활성 측정 결과를 바탕으로 ACLM의 EtOAc 추출물은 E. coli, ACLS의 EtOAc 추출 물에서는 S. epidermidis 그리고 ACLP의 EtOAc 추출물은 S. aureus에 대한 MIC를 각각 측정하였다. MIC는 추출물 이 병원성 미생물에 나타내는 생육저해환이 8 mm 이상인 최소 농도로 정하고 측정한 결과 ACLM의 EtOAc 추출물 은 E. coli에서 25 mg/mL, ACLS의 EtOAc 추출물은 S. epidermidis에서 12.5 mg/mL, ACLP의 EtOAc 추출물은 S. aureus에서 12.5 mg/mL로 나타났다(Table 2). 이는 선행연 구에서 발효하지 않은 천문동의 EtOAc 추출물의 MIC가 E. coli는 100 mg/mL, S. epidermidis는 75 mg/mL, S. aureus 에서는 100 mg/mL의 농도에서 측정된 것(Jung et al., 2016)과 비해 발효된 천문동의 EtOAc 추출물에서 항균활 성에 작용하는 물질의 함량이 증가했거나 강력한 항균활성 물질로 전환이 된 것으로 사료된다. 이는 젖산균 발효로부 터 천문동의 호흡기 유발 미생물에 대한 항균활성이 크게 개선된 결과로 천문동 발효물이 호흡기에 도움을 줄 수 있 을 것이라 기대할 수 있으며 추후 천문동 발효에서 생물 전환과 관련된 효소와 기능성 물질에 대한 연구가 더 필요 할 것으로 여겨진다.
Table 2.
Minimum Inhibitory Concentration of ethyl acetate extracts (Unit : mm)
|
Extracts |
Respiratory microorganism |
25 mg/mL |
12.5 mg/mL |
6.25 mg/mL |
3.125 mg/mL |
1.5125 mg/mL |
|
ACLM |
E. coli
|
11.67±0.58 |
7.33±0.58 |
ND* |
ND |
ND |
|
ACLS |
S. epidermidis
|
10.67±0.58 |
8.67±0.58 |
ND |
ND |
ND |
|
ACLP |
S. aureus
|
9.33±0.58 |
9.00±0.00 |
6.67±0.29 |
ND |
ND |
Download Excel Table
유산균 발효 천문동의 생균수 변화
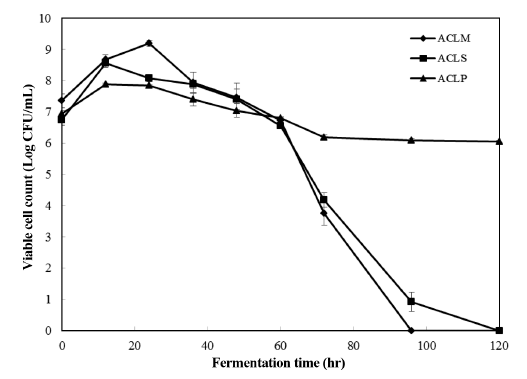
ACLM의 경우 24시간 발효 시 가장 높은 생균수를 나타 낸 반면 ACLS는 12시간 발효 시 높은 생균수를 보였다. 두 경우 모두 60시간 이후 생균수가 급격히 감소하여 사 멸하는 것을 관찰할 수 있었다. 이와는 다르게 ACLP의 경우 120시간 발효 시에도 생균의 수는 감소가 크지 않고 거의 일정하게 유지되는 경향을 관찰할 수 있었다(Fig. 2).
유산균 발효 천문동의 pH 및 산도 변화
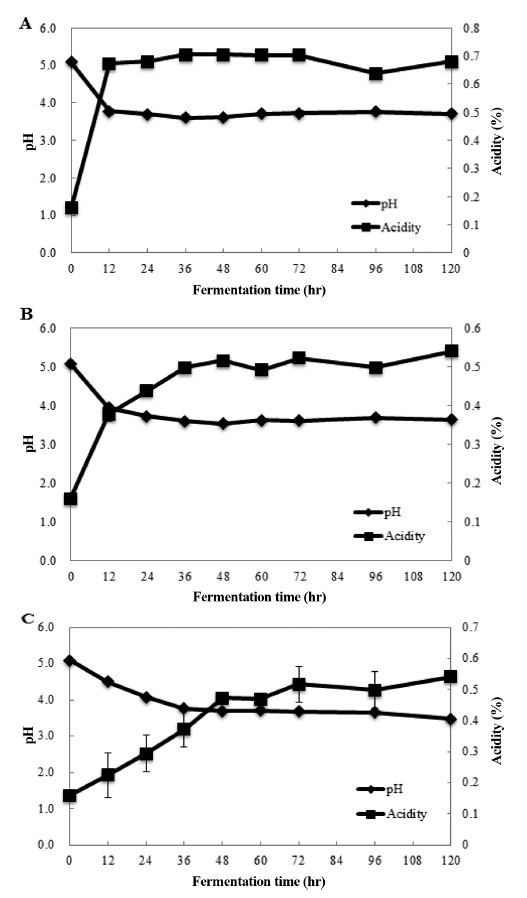
발효 균주로 발효한 천문동의 pH와 산도는 Fig. 3에서 보여지는 것과 같다. ACLS와 ACLM의 pH는 12시간까지 감소하며 산도의 경우 반대로 증가하는 경향을 보인 반면 ACLP는 48시간까지 pH는 일정하게 감소하고 산도는 일정 하게 증가하다 일정해지는 형태를 보였다. 이와 같은 결과 는 pH의 저하와 산도의 상승은 생균수의 증가와 유사한 형태로 나타나는 것을 확인할 수 있었다.
Fig. 3.
pH and acidity of A. cochinchinensis fermented with lactic acid bacteria.
*Mean±SD (n=3). A: ACLM, B: ACLS, C: ACLP.
Download Original Figure
유산균 발효 천문동의 수분, 회분, 환원당 및 총당 분석
결과는 Table 3에서 보여지는 것과 같이 발효 천문동의 수분 함량은 89.90-91.03% 조회분은 0.76-0.87%로 발효 균주의 차이에 따른 차이는 크지 않은 것으로 보인다.
Table 3.
Moisture and crude ash in A. Cochinchinensis (Unit : %)
|
Item |
Moisture |
Crude Ash |
|
Non fermented A. Cochinchinensis
|
90.84±0.18* |
0.76±0.04 |
|
ACLS |
89.90±0.01 |
0.80±0.10 |
|
ACLM |
90.77±0.00 |
0.77±0.06 |
|
ACLP |
91.03±0.01 |
0.87±0.06 |
Download Excel Table
발효 전 천문동의 총당, 환원당은 984.33±26.82, 98.12± 1.13 mg/mL이었던 반면 발효 후에는 총당은 305.79-381.21 mg/mL, 환원당은 15.08-71.81 mg/mL으로 총당과 환원당 모두 감소하였다(Table 4). 특히 생균수의 변화가 가장 크 고 높은 수의 생균을 나타낸 ACLM의 총당과 환원당이 가장 낮게 나타났다. 발효로 인한 총당과 환원당의 감소는 젖산균이 당분을 발효 기질로 이용된 것으로 보여진다 (Hong et al., 1998; Jang et al., 2004).
Table 4.
Reducing sugar and total sugar in A. Cochinchinensis (Unit : mg/mL on dry basis)
|
Item |
Reducing sugar |
Total sugar |
|
Non fermented A. Cochinchinensis
|
98.12±1.13* |
984.33±26.82 |
|
ACLS |
64.87±9.60 |
343.92±23.67 |
|
ACLM |
15.08±0.84 |
305.79±61.28 |
|
ACLP |
71.81±1.95 |
381.21±31.66 |
Download Excel Table
요 약
호흡기 질환 개선에 도움을 주는 천문동의 젖산균 발효 및 호흡기 병원성 미생물에 대한 항균활성 특성을 확인하 고자 연구를 진행하였다. 발효 전 천문동과 젖산균 발효 천문동의 항균활성은 추출물 별로 차이가 나타났고 EtOAc 추출물에서 항균활성은 더욱 개선된 것을 확인할 수 있었 다. EtOAc 추출물에서 MIC는 생육 저해환이 발효 전 천문 동의 MIC가 E. coli는 100 mg/mL, S. epidermidis는 75 mg/ mL, S. aureus에서는 100 mg/mL의 농도였던 것이 ACLM 은 E. coli에서 25 mg/mL, ACLS는 S.epidermidis에서 12.5 mg/mL, ACLP는 S.aureus에서 12.5 mg/mL로 나타났다. 이 러한 결과로부터 젖산균 발효를 통하여 천문동의 항균활성 이 크게 증가하고 호흡기 질환에 효과가 있을 것이라 기대 할 수 있다. ACLM와 ACLS의 경우 생균수, pH, 산도가 비슷한 경향을 나타낸 반면 ACLP은 120시간 발효 시에도 생균의 수는 감소가 크지 않고 거의 일정하게 유지되고 pH, 산도는 각각 48시간까지 일정하게 감소 또는 증가하다 일정해지는 형태를 나타내었다. 일반성분 중 수분과 회분 은 천문동 발효 전·후에서 큰 차이가 없었다. 총당과 환원 당은 발효 전 천문동에 비하여 발효 후 그 값이 크게 감 소하여 미생물의 발효에 당이 사용되었음을 추측할 수 있 었다.
감사의 글
본 연구는 농림수산식품기술기획평가원(관리번호 114034- 03)의 지원에 의해 수행되었으며 이에 감사드립니다.
References
AOAC Official methods of analysis. 1990Association of analytical chemists. Arlington, VA, USA: (No. 934.06).

Bachert C, Gevaert P, Van Cauwenberge P.
Staphylococcus aureus superantigens and airway disease. Curr. Allergy Asthma Rep. 2002; 2:252-258.

Choe SB, Kang ST. Investigation of antimicrobial activity and stability of
Orixa japonica Thunb. leaf extract. Korean. J. Food Sci. Technol. 2014; 46:39-43.

Cross ML, Stevenson LM, Gill HS. Anti-allergy properties of fermented foods an important immunoregulatory mechanism of lactic acid bacteria?. Int. Immunopharmacol. 2001; 1:891-901.

Davis MF, Peng RD, Mc Cormack MC, Matsui EC.
Staphylococcus aureus colonization is associated with wheeze and asthma among US children and young adults. J. Allergy Clin. Immunol. 2015; 135:811.

Du XH, Duo YZ. Studies on the isolation of antitumor active constituents of polysaccharides from Chinese herb
Asparagus Cochinchinensis (Lour.) Merr. [J]. J. Shenyang Pharm. Coll. 1990; 7:197-201.

Dubois M, Gillers KA, Hamilton JK, Robers PA, Smith F. Colorimetric method for determination of sugar and related substance. Anal. Chem. 1956; 28:350-352.

Dunnette SL, Hall MM. Microbiologic analysis of nasal polyp tissue. J. Allergy Clin. Immunol. 1986; 78:102-8.

Ha EH, Lee JT, Kim H, Hong YC, Lee BE, Park HS, Chrisiani DC. Infant susceptibility of mortality to air pollution in Seoul, South Korea. Pediatrics. 2003; 111:284-290.

Hong KP, Park JY. Changes in microorganisms, enzymes and texture of Dongchimi by high hydrostatic pressure treatment. Korean. J. Food Sci. Technol. 1998; 30:596-601.

Igusa R, Narumi S, Murakami K, Kitawaki Y, Tamii T, Kato M, Sato M, Tsuboi M, Ota K.
Escherichia coli pneumonia in combination with fungal sinusitis and meningitis in a tsunami survivor after the Great East Japan Earthquake. Tohoku. J. Exp. Med. 2012; 227:179-184.

Irshad S, Mahmood M, Perveen F. In vitro antibacterial activities of three medicinal plants using agar well diffusion method. Research J. Biol. 2012; 2:1-8.

Jang MS, Park JE. Effect of Maesil (
Prunusmume Sieb. etZucc) juice on Yulmoo Mul-kimchi fermentation. Korean. J. Food Cookery Sci. 2004; 20:511-519.

Jeong HG, Lee CW, Lee JH, Kim SJ, Kwon YS, Heo Y, Kim HP. The New Phytoformula Containing Morusalba, Schizandrasinensis and
Asparagus Cochinchinensis Inhibits Lung Inflammation in vitro and in vivo. Natural Product Sciences. 2016; 22:70-75.

Jung KH, Choi HL, Park S, Lee G, Kim M, Min JK, Min BI, Bae H. The effects of the standardized herbal formula PM014 on pulmonary inflammation and airway responsiveness in a murine model of cockroach allergen-induced asthma. J. Ethnopharmacol. 2014; 155:113-122.

Jung MG, Kim SI, Jeong HJ, Lee CY, Son HJ, Hwang DY, Lee HS, Kim DS. Antimicrobial Activity against Respiratory Bacteria by
Asparagus Cochinchinensis Extracts and its Antioxidant Capacity. Microbiol.Biotechnol. 2016; 43:367-372.

Kang DH, Kim HS. Functionality analysis of Korean medicine fermented by Lactobacillus strains. Kor. J. Microbiol. Biotechnol. 2011; 39:259-265.

Kang SK, Lim DH. Kim JH, Son BK, Lim JW, Hong YC. Relationship of air pollution and pediatric respiratory diseases in Incheon city. Pediatr. Allergy Respir. Dis. 2001; 11:354-362.

Karovičová J, Kohajdova Z. Lactic acid fermented vegetable juices. Hortic. Sci. 2003; 30:152-158.

Kim RU, Ahn SC, Yu SN, Kim KY, Seong JH, Lee YG, Kim HS, Kim DS. Screening and identification of soy curd-producing lactic acid bacteria. J. Life Sci. 2011; 21:235-241.

Koo HN, Jeong HJ, Choi JY, Choi SD, Choi TJ, Cheon YS, Kim KS, Kang BK, Park ST, Chang CH, Kim CH, Lee YM, Kim HM, An NH, Kim CH. Inhibition of tumor necrosis factor-α-induced apoptosis by
Asparagus Cochinchinensis in Hep G2 cells. J. Ethnopharmacol. 2000; 73:137-143.

Lee HJ, Park JS, Yoon YP, Shin YJ, Lee SK, Kim YS, Hong JH, Son JH, Lee CJ. Dioscin and methylprotodioscin isolated from the root of
Asparagus Cochinchinensis suppressed the gene expression and production of airway MUC5AC mucin induced by phorbol ester and growth factor. Phytomedicine. 2015; 22:568-572.

Lee JH, Lim HJ, Lee CW, Son K H, Son J K, Lee SK, Kim HP. Methyl protodioscin from the roots of
Asparagus Cochinchinensis attenuates airway inflammation by inhibiting cytokine production. Evid. Based Complement. Alternat. Med. 2015; 2015:12.

Lee SY, Kim SN, Kim JK. Effects of
Asparagus Cochinchinensis (Lour.) Merr. on the stimulation of osteoblast differentiation and inhibition of osteoclast generation. J. Korean Soc. Food Sci. Nutr. 2008; 37:16-19.

Miller GL. Use of dinitrosalicylic acid reagent for determination of reducing sugar. Anal. Chem. 1959; 1:426-428.

Olsen A, Halm M, Jakobsen M. The antimicrobial activity of lactic acid bacteria from fermented maize (kenkey) and their interactions during fermentation. J. Appl. Bacteriol. 1995; 79:506-512.

Park G, Jeong JW, Cho GG. Report of air quality in Busan 2012. Busan Metropolitan City Institute of Health & Environment. 2013; 22:142-159.

Perdigón G, Fuller R, Raya R. Lactic acid bacteria and their effect on the immune system. Curr. Issues Intest. Microbiol. 2001; 2:27-42.

Rafter J. Lactic acid bacteria and cancer mechanistic perspective. Brit. J.Nutr. 2002; 88:S89-S94.

Seo JH, Ha EH, Lee BE, Park HS, Kim H, Hong YC, Yi OH. The Effect of PM 10 on respiratory-related admission in Seoul. J. Kosae. 2006; 22:564-573.

Shen Y, Xu CL, Xuan WD, Li HL, Liu RH, Xu XK, Chen HS. A new furostanolsaponin from
Asparagus Cochinchinensis. Arch. Pharm. Res. 2011; 34:1587-1591.

Shin SY, Bajpai VK, Kim HR, Kang SC. Antibacterial activity of bioconvert edeicosapentaenoic (EPA) and docosahexaenoic acid (DHA) against foodborne pathogenic bacteria. Int. J. Food Microbiol. 2007; 113:233-236.

Son HL, Anh NP. Phytochemical composition, in vitro antioxidant and anticancer activities of quercetin from methanol extract of
Asparagus Cochinchinensis (LOUR) Merr. Tuber. J. Med. Plant. Res. 2013; 7:3360-3366.

Tenji K, Junzo S. Studies on the constituents of Asparagi Radix. On the structures of furostanololigosides of
Asparagus Cochinchinensis (Loureio) Merrill [J]. Chem. Pharm. Bull. 1979; 27:3086-3094.

Valderrey AD, Pozuelo MJ, Jimenez PA, Macia MD, Oliver A, Rotger R. Chronic colonization by
Pseudomonas aeruginosa of patients with obstructive lung diseases cystic fibrosis, bronchiectasis, and chronic obstructive pulmonarydisease. Diagn. Microbiol. Infect. Dis. 2010; 68:20-27.

Yoo MY, Jung YJ, Yang JY. Antimicrobial activity of herb extracts. Prev. Nutr. Food Sci. 2005; 34:1130-1135.

Zaghloul AA, El-Shattawy HH, Kassem AA, Ibrahim EA, Reddy IK, Khan MA. Honey, a prospective antibiotic extraction, formulation, and stability. Die. Pharmazie. 2001; 56:643-647.

Zhang HJ, Sydara K, Tan GT, Ma C, Southavong B, Soejarto D D, Pezzuto JM, Fong HH. Bioactive Constituents from
Asparagus Cochinchinensis. J. Nat. Prod. 2004; 67:194-200.

Zhu GL, Hao Q, Li RT, Li HZ. Steroidal saponins from the roots of
Asparagus Cochinchinensis. Chin. J. Nat. Med. 2014; 12:213-217.