서 론
오늘날 식품산업은 소비자에게 안전하고 좋은 품질의 식품을 보증하는데 중점을 두고 있으며, 새로운 기술의 발전을 통하여 지속적으로 제품의 품질을 향상시키기 위 하여 노력하고 있다. 식품은 저장 및 유통 과정 동안 물 리적, 화학적, 미생물학적 작용에 의하여 품질이 변화하며, 이러한 식품 품질의 변화를 모니터링하기 위한 다양한 도 구들이 개발되어 오고 있다. 이 중 식품 품질 지시계(food quality indicator)는 식품의 포장에 부착되어 식품 품질을 지시할 수 있도록 고안된 것이며, 시간-온도 지시계(timetemperature indicator), 가스 지시계, 바이오센서 등과 같 은 다양한 도구들이 식품 품질 지시계로 사용되고 있다 (Yam et al., 2005).
포장식품에서 이산화탄소의 분압은 품질의 지표로써 중 요한 인자 중의 하나이다. 예를 들면, 발효식품은 포장 직 후부터 지속적으로 발효가 진행되며 시간이 지남에 따라 이산화탄소와 같은 기체 발효 대사 산물을 포장 내 헤드스 페이스에 축적한다. 따라서 포장 내 이산화탄소의 농도의 수준 변화는 식품의 신선도 및 숙성도와 상관관계가 있으 며, 이는 식품의 품질을 반영할 수 있는 지표로 이용될 수 있다. 식품포장에서 이산화탄소 분압 프로파일은 저장 시 간에 따라 변하며, 식품의 유형, 호흡특성, 포장재료, 헤드 스페이스의 부피, 저장조건 등에 영향을 받는다. 특히, 포 장 내부의 헤드스페이스에서 이산화탄소 수준의 변화를 나 타내는 지시계는 이산화탄소의 생성량과 상관성이 있는 식 품의 품질에 대한 정보를 시각적으로 제공할 수 있다(Ge et al., 2003).
키토산(chitosan)은 키틴(chitin)을 탈아세틸화한 것(Xu et al., 1996)으로, 고체상태에서 semi-crystalline 상태이기 때 문에 pH가 중성인 용액에 현탁시킬 경우 외관이 뿌옇고 탁하다(Rinaudo, 2006). 반면에, 키토산은 산성의 조건에서 아민기(-NH2)가 양이온(-NH3+)화되기 때문에 물에 용해될 수 있으며 투명한 외관을 보인다(Rinaudo et al., 1999). 따 라서, 식품포장 내부에서 이산화탄소가 발생되면, 생성된 이산화탄소는 중성의 키토산 현탁액에 용해되어 탄산을 형 성하고 결과적으로 키토산 현탁액의 pH를 감소시킨다. 그 결과, 불투명한 외관의 키토산 현탁액은 이산화탄소에 의 해 낮아진 pH에 의한 키토산의 용해로 인하여 투명한 외 관으로 변한다.
최근 색 변화를 이용하여 식품의 품질을 간접적으로 나 타낼 수 있는 지시계들이 많이 개발되고 있다(Nopwinyuwong et al., 2010). 하지만 지금까지 대부분의 지시계는 식 품 품질 변화가 진행되는 동안 전후의 색 변화 및 외관 변 화의 차이가 크지 않아 시각적 변화의 명확성이 모호한 측 면이 많아 왔다. 따라서 식품 품질 변화 시 지시계의 색 변화를 명확하게 할 수 있는 시각적 신호를 강화하는 기술 의 개발이 중요하다. 2-Amino-2-methylpropan-1-ol (AMP)는 알카놀아민의 한 종류이며, 다양한 산업에서 이산화탄소를 흡수하는데 주로 이용되고 있다(Xiao et al., 2000). 특히 AMP는 탄소에 연결된 아미노 그룹과 이산화탄소와의 반응 을 통하여 carbamate를 형성하기 때문에 이산화탄소를 축 적하는 것으로 알려져 있으며(Sartori & Savage, 1983), 이 산화탄소의 축적 반응속도도 우수한 것으로 보고되고 있다 (Yih & Shen, 1988). 2-Aminoethanol (monoethanolamine, MEA)도 AMP와 유사한 특성을 보이고 있다(Choi et al., 2009). 본 연구에서는 AMP 및 MEA의 첨가로 이산화탄소 의 검출을 위해 사용되는 키토산 현탁액의 이산화탄소 흡 수를 증가시키고 이에 따라 투과도 변화의 차이를 증폭할 수 있어 이산화탄소 지시 성능을 강화할 수 있다고 판단하 였다.
본 연구에서는 식품포장 내부의 이산화탄소 농도 변화에 반응하는 지시계를 개발하기 위하여 키토산 현탁액을 제조 하고, 이산화탄소 노출 환경에서의 pH 및 투과도 반응 특 성을 연구하였다. 또한 키토산 현탁액의 이산화탄소 지시 성능 강화를 위하여 AMP 및 MEA의 첨가량에 따른 지시 계의 지시 반응 변화를 연구하였다.
재료 및 방법
키토산 분말(22 kDa, 탈아세틸화도 84%)은 (주)키토라이 프(Pyeongtaek, Korea)로부터 제공받았다. AMP는 Acros Organics (Geel, Belgium)의 제품을 구입하였으며, hydrogen chloride (HCl)와 sodium hydroxide (NaOH)는 (주)대정화 금(Shiheung, Korea)으로부터 구입하였다.
키토산(100 mg)을 0.1 M HCl 10 mL에 첨가하고 1시간 동안 교반하여 완전히 용해시켰다. 제조된 키토산 현탁액 (1 mL)의 pH를 1 M HCl과 NaOH를 이용하여 pH 2, 3, 4, 5, 6, 7, 8, 9로 조정하고 최종 용량이 5 mL이 될 때까지 증류수로 채웠다. 키토산 현탁액의 투과도는 UV-spectrophotometer (DU 730, Beckman Coulter Inc., Fullerton, CA, USA)를 이용하여 600 nm에서 측정하였다.
키토산(200, 400, 800 mg)을 40 mL의 0.1M HCl에 첨가 하고 1시간 동안 교반하여 완전히 용해시켰다. 각 시료를 1M HCl과 NaOH를 이용하여 pH 7.0으로 조정한 후에 2 시간 동안 추가적으로 교반하였다. 마지막으로 증류수를 가하여 최종 용량이 200 mL이 될 때까지 채우고 pH를 7.0으로 조정하였다. 이산화탄소 농도 지시를 위한 키토산 현탁액의 키토산 농도는 각각 5, 10, 20 mg/mL이었으며, 함량비율로 표기하면 각각 0.1, 0.2, 0.4% 이었다.
이산화탄소 농도 지시를 위해 제조된 키토산 현탁액의 입 자 관찰을 위하여, pH 7.0의 키토산 현탁액에서 시료를 미 량 채취하여 광학현미경(Nikon eclipse 80i, Nikon, Tokyo, Japan)을 이용하여 측정하였다. 이산화탄소 대기 하의 노출 에 따른 키토산 현탁액의 외관 변화 양상은 디지털 카메라 를 이용하여 촬영하였다.
이산화탄소 노출 환경에서 키토산 현탁액의 시각적 지시 특성을 알아보기 위하여, 키토산 현탁액 5 mL를 일반 대기 및 100%의 이산화탄소 조건의 가스제어 챔버(Bactron I, Sheldon Manufacturing Inc., Cornelius, OR, USA)에서 3시 간 동안 노출시켰다. 이산화탄소 대기 하의 노출에 따른 키토산 현탁액의 pH와 투과도는 각각 pH meter와 UVspectrophotometer를 이용하여 측정하였다.
AMP의 비율에 따른 시각적인 지시성능의 증가를 알아 보기 위하여 10, 20, 40 mL의 AMP를 100 mL의 증류수와 혼합하고 키토산(400 mg)을 첨가하였다. 키토산 현탁액의 pH를 1M HCl과 NaOH를 이용하여 pH 7.0으로 조정한 후에 700 rpm으로 2시간 동안 교반하였다. 이후 키토산 현 탁액에 증류수를 가하여 최종 용량을 200 mL로 맞추고 pH를 7.0으로 조정하였으며, 이때 제조된 키토산 현탁액의 AMP 농도는 0, 5, 10, 20%이었다. 키토산 현탁액의 pH와 투과도 변화는 일반대기 및 100%의 이산화탄소 조건에서 3시간 동안 노출시키면서 측정하였다. 시각적인 지시성능의 증가를 위한 MEA의 비율(0, 5%)에 따른 시각적인 지시성 능의 증가를 알아보기 위한 키토산 현탁액의 경우에도 AMP 첨가의 경우와 같은 방법을 사용하여 제조하였다.
결과 및 고찰
이산화탄소 농도 지시를 위해 제조된 키토산 현탁액이 이산화탄소 대기 하에서 노출되기 전후의 외관은 Fig. 1A 와 같다. 이산화탄소에 노출되기 전 키토산 현탁액은 불투 명하고 뿌연 외관을 보였지만, 이산화탄소에 충분히 노출 된 후의 키토산 현탁액의 외관은 투명하였다. Fig. 1B에서 보듯이 키토산은 이산화탄소에 노출되기 전에는 이온화되 지 않아 불용성의 입자 형태로 현탁액 내에 존재하였다. 이산화탄소에 노출된 후에는 키토산 현탁액의 pH가 낮아 져 키토산 분자가 이온화되어 용해되므로 외관이 투명해 졌다.
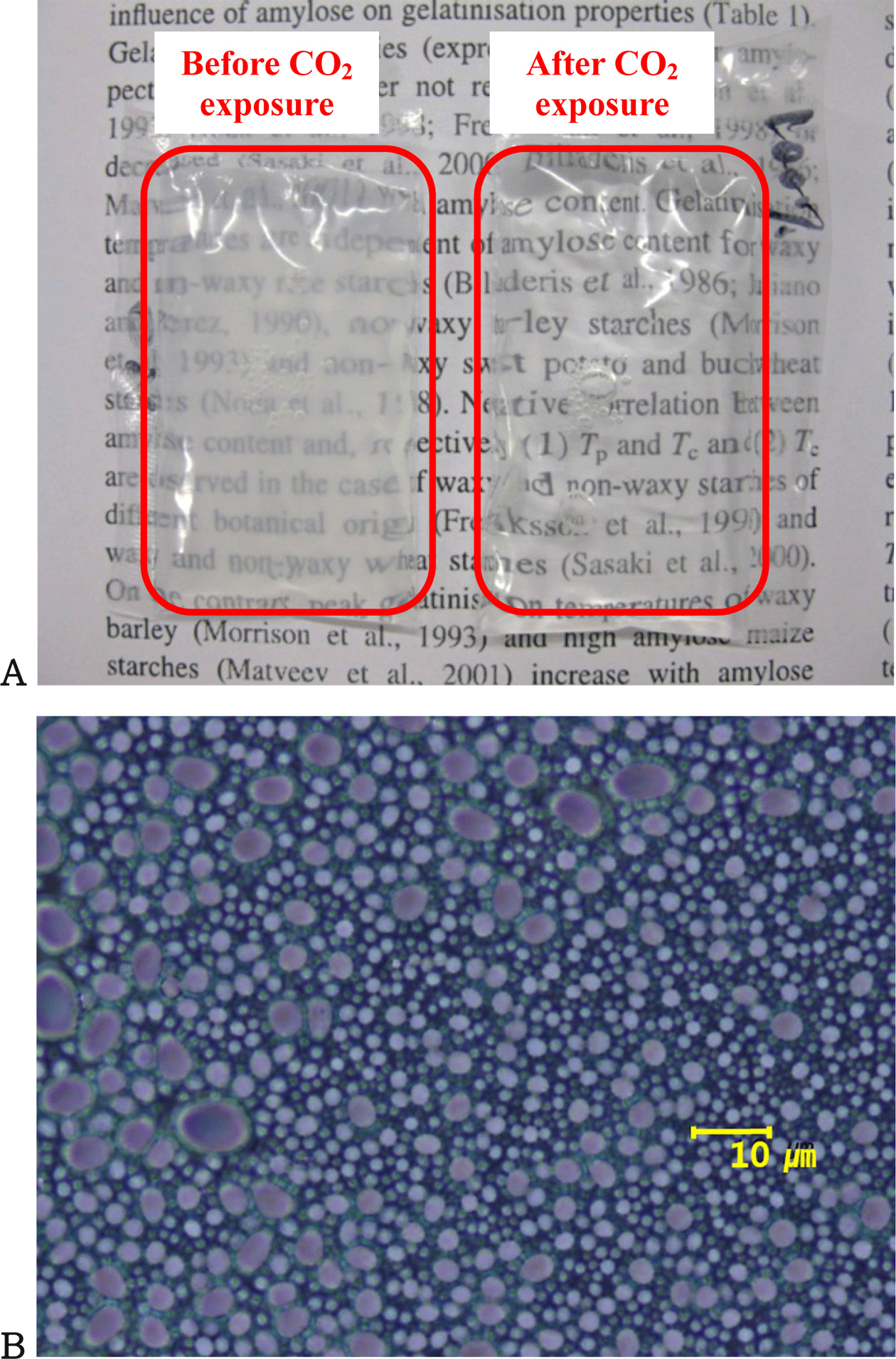
키토산 현탁액의 이산화탄소 검출 원리는 이산화탄소가 수중에 용해되어 유래된 산성 환경에서 키토산 분자의 용 해도를 기초로 한다(Neethirajanet al., 2009). 이산화탄소의 검출은 키토산 분자를 포함하는 현탁액에서 이산화탄소가 용해되는 현상을 기반으로 하는데, 포장 내 헤드스페이스 로부터 현탁액 내로 이산화탄소가 전달되어 용해되면 pH 감소를 유발하고 키토산이 용해되기 시작한다. 이산화탄소 는 물에 용해되어 탄산을 형성하고 물 분자와 상호작용하 여 수소이온과 중탄산염 이온으로 분리된다. 분리된 수소 이온은 키토산 분자의 아미노기와 양성자화 반응에 참여하 게 된다. 그 결과, 불투명한 현탁액은 키토산 분자의 용해 로 인하여 투명한 현탁액으로 변한다(Rinaudo, 2006). 따라 서, 식품 품질은 포장 내 헤드스페이스의 이산화탄소 농도 증가에 따라 키토산 현탁액의 투과도 변화를 통해 감지될 수 있다. 따라서, 발효식품과 같이 포장식품 내에서 이산화 탄소를 발생하여 축적하는 식품의 품질을 예측하는데 사용 할 수 있다(Puligundla et al., 2012; Meng XP et al., 2015).
Fig. 1A는 키토산 현탁액은 이산화탄소조건에 노출 전후 의 비교 사진이다. pH에 따른 키토산 현탁액의 투과도 변 화 양상은 Fig. 2와 같다. Fig. 1A에서 보듯이 키토산 현 탁액은 pH가 감소할 때 불투명한 백색에서 투명하게 변하 였다. 키토산 현탁액의 투과도는 pH 6 이하에서 100%에 가깝게 관찰되었으나, pH 6 이상에서는 투과도가 거의 40%까지 급격하게 감소하였다. 이는 키토산 현탁액의 투 과도가 키토산의 용해도와 밀접한 관련이 있기 때문인데, 키토산 분자는 약산성의 수용액에 잘 용해되는 반면 중성 이나 염기성 조건에서 불용성을 나타낸다. 일반적으로 85% 탈아세틸화한 불용성 키토산이 pH 6과 8 사이에서 급격한 용해도 변화를 보이며(Qin et al., 2006), 키토산은 pH 6.5 이하의 산성조건에서 용해될 수 있다(Ilium, 1998; Mao et al., 2004). 키토산의 용해도는 pH, 이온세기, 아세 틸기의 분포도, 키토산 분자의 아세틸화 정도와 밀접한 관 계가 있다. 키토산이 산성 조건에 있을 때, 용액 중에 풍 부해진 H+와 키토산 분자의 아민기(-NH2)가 결합하여 키토 산-NH3+ 구조를 이루며(Rinaudo et al., 1999), 이러한 구조 는 물과 높은 친화력을 가져 용해된다. 키토산의 분자량은 용해도를 결정하는 또 다른 인자가 되는데, 키토산의 분자 량이 작을수록 반데르발스 인력이나 소수성 결합 같은 키 토산 분자간의 인력이 적어 수용성이 높다(Kubota et al., 2000). 키토산 현탁액에서 육안으로 보이는 현저한 투과도 의 변화는 포장식품의 품질 변화점을 판별하는데 이용될 수 있으며, 발효식품과 같이 포장식품 내부의 헤드스페이 스에서 이산화탄소의 수준 변화와 식품 품질의 변화가 높 은 상관성을 보이는 식품들의 품질에 대한 정보를 시각적 으로 제공하게 하는 것을 가능하게 한다.
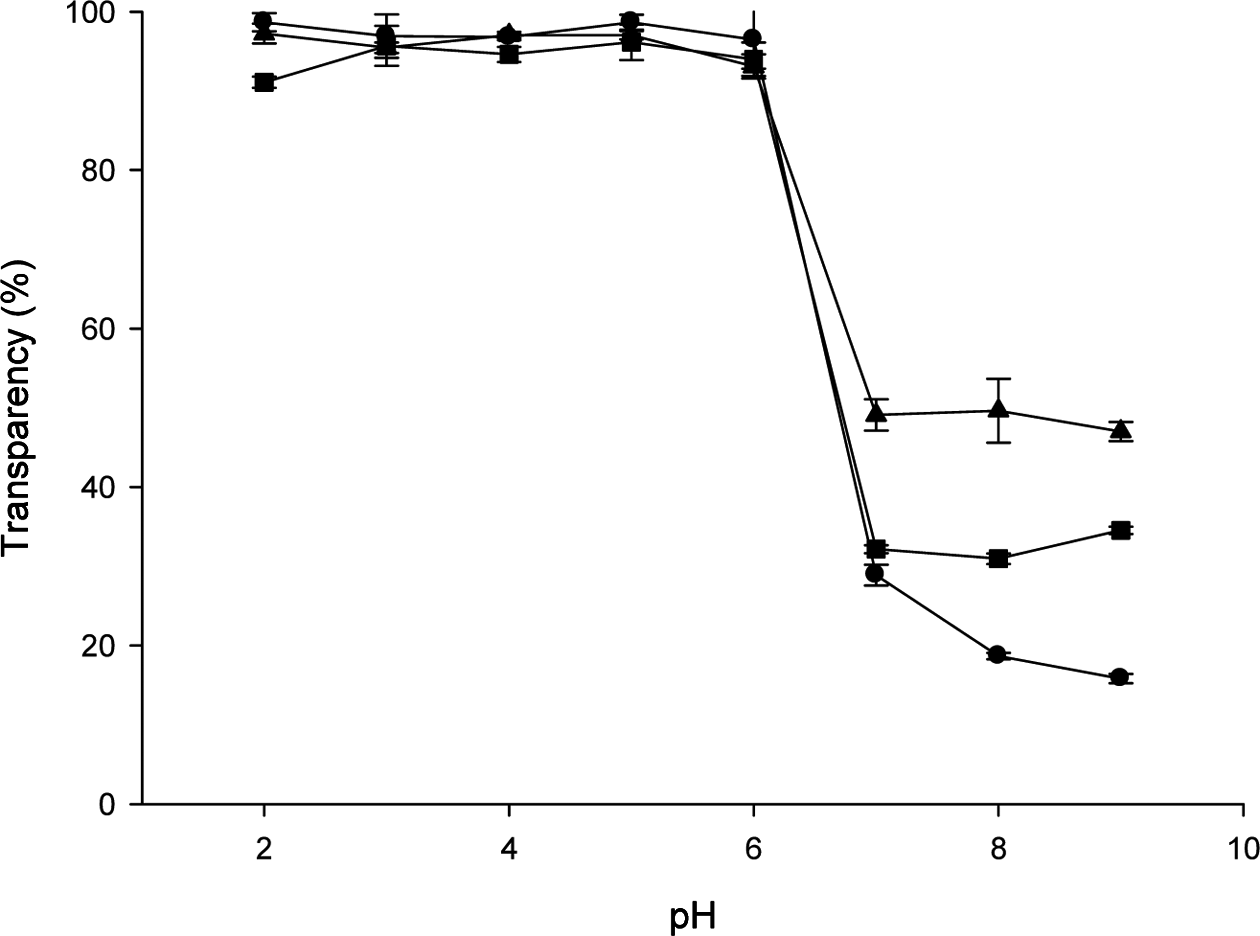
Fig. 3A는 이산화탄소 노출 환경에서 농도가 다른(0.1, 0.2, 0.4%) 키토산 현탁액의 pH 변화를 보여준다. 이산화 탄소 노출 초기 단계에서 모든 키토산 현탁액의 pH는 급 격하게 감소되었으나 20분 후부터는 변화가 없었다. 또한 0.1, 0.2, 0.4% 키토산 현탁액의 pH는 각각 pH 6.0, 6.3, 6.5까지 감소하였다. 낮은 농도의 키토산 함량을 가진 현탁 액이 이산화탄소에 노출되었을 때 상대적으로 pH가 더 낮 아지는 현상을 보였다.
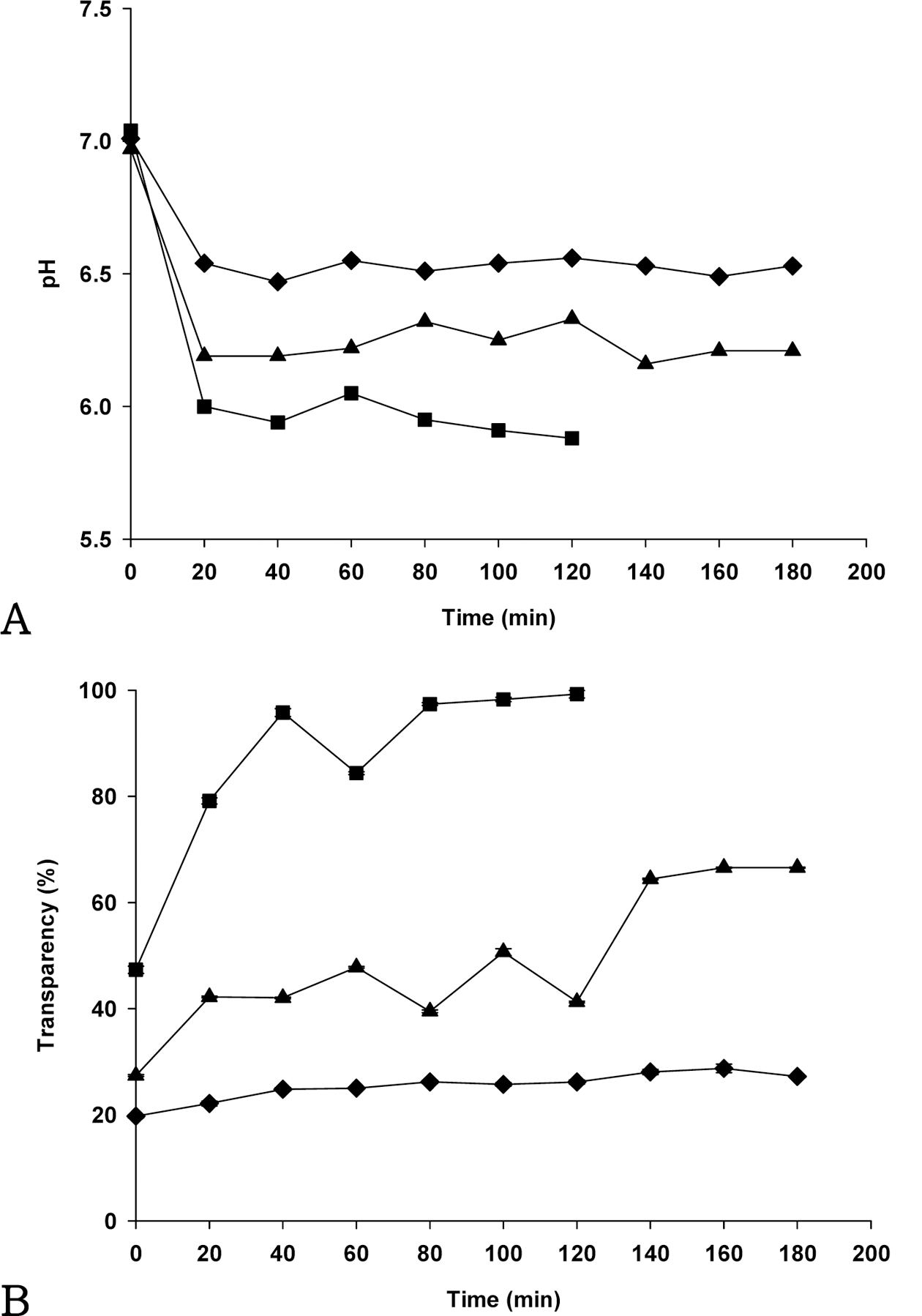
Fig. 3B는 이산화탄소 노출 환경에서 농도가 다른 키토 산 현탁액의 투과도 변화를 보여준다. 이산화탄소에 노출 되기 전 0.1, 0.2, 0.4% 키토산 현탁액의 초기 투과도는 각 각 47.3, 27.4, 19.7%로 측정되었다. 0.4% 키토산 현탁액 의 투과도는 시간이 지남에 따라 큰 변화가 없는 반면, 0.1, 0.2%의 키토산을 함유하는 현탁액의 투과도는 점점 증가하였다. 0.1% 키토산 현탁액의 투과도는 이산화탄소 환경에서 노출된 지 40분이 지난 후에 96%까지 도달한 반면 0.4% 키토산 현탁액은 측정이 끝날 때까지 투과도가 거의 일정하게 유지되었다.
현탁액의 페이스트와 같은 물성은 빛의 투과도에 영향을 미친다. 키토산의 농도는 키토산 현탁액의 점도(자료 미제 시)에 영향을 주었고, 특히 0.4% 키토산 현탁액은 상대적 으로 농도가 낮은 키토산 현탁액과 비교하여 높은 점도를 보였다. 키토산 함량이 높은 키토산 현탁액의 점도는 이산 화탄소의 용해도에 영향을 주는 것으로 보이며, 키토산 농 도 증가에 따른 점도의 증가는 키토산 분자들 간의 결합력 을 증가시켜 흐름에 대한 저항이 커지기 때문이다(Mucha, 1997). 키토산 농도가 높은 환경에서는 키토산 입자들 내 부구조 사이에 물 분자들이 위치하게 되므로 이산화탄소의 용해도가 낮아지는 결과를 초래한다. 이러한 이유로 0.4% 키토산 현탁액은 이산화탄소 노출 초기 단계에서 20%의 낮은 투과도를 보여주었고, 이산화탄소 노출 시간이 증가 하였음에도 불구하고 더 이상 변화가 없었다. 결과적으로 0.4% 키토산 농도는 이산화탄소 농도에 반응하는 키토산 현탁액의 제조에 적합하지 않다는 것을 보여준다.
Fig. 4A는 AMP의 첨가량(0, 5, 10, 20%)이 다른 키토산 현탁액이 이산화탄소가 거의 존재하지 않는 일반 대기 (ambient air, 대기 중 농도 약 0.03%)와 이산화탄소의 농 도가 100%인 환경에서 노출되었을 때의 pH 변화를 보여 준다. 일반 대기 환경에서 노출된 키토산 현탁액의 pH는 시간이 지남에 따라 큰 변화가 없었지만, 100% 이산화탄 소 환경에서 노출된 키토산 현탁액의 pH는 초기에 빠르게 감소하였다. AMP를 첨가하지 않은 키토산 현탁액이 가장 빠르게 감소하였으며, 초기 단계에서 AMP 함량이 증가 할수록 pH는 감소되었다. AMP 첨가량에 관계없이 pH 6.3에 도달한 이후 모든 키토산 현탁액의 pH는 100분까지 천천히 감소하였다.
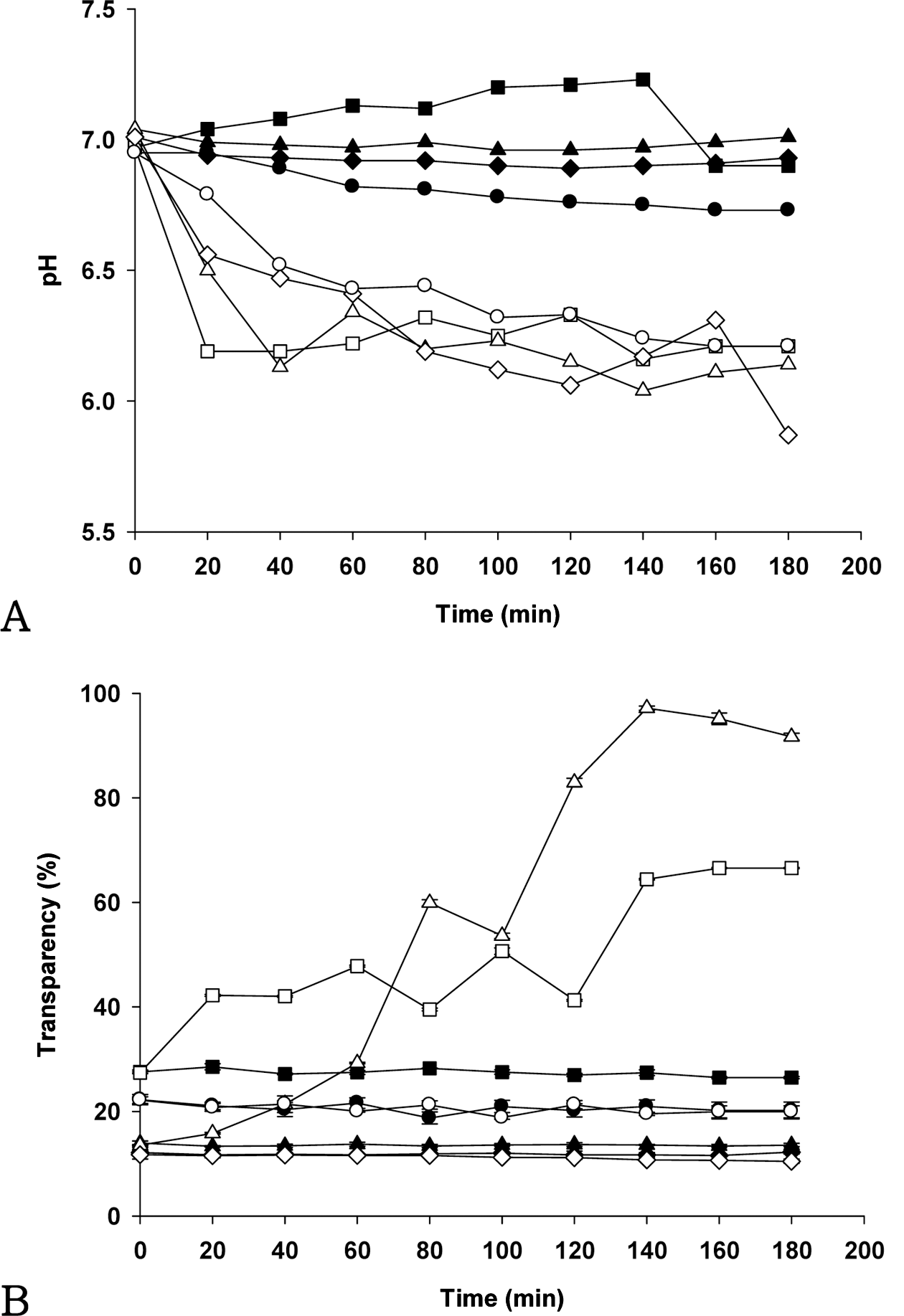
Fig. 4B는 AMP의 첨가량이 다른 키토산 현탁액이 현탁 액이 이산화탄소가 존재하는 환경에서 노출되었을 때의 투 과도 변화를 보여준다. 일반 대기 환경에서 노출된 키토산 현탁액의 투과도는 시간이 지남에도 불구하고 변화 없이 불투명하고 탁한 백색을 유지하였다. 일반 대기 환경에 노 출된 키토산 현탁액 중의 키토산 분자는 용해되지 않았기 때문에 키토산 입자에 의한 빛의 산란에 의하여 혼탁도는 유지되었다. 100% 이산화탄소 노출 환경에서 5% AMP 키토산 현탁액의 투과도는 91.7%까지 빠르게 증가하였으 며, 그 증가량은 AMP를 첨가하지 않은 키토산 현탁액 (27.4-66.6%) 보다 높았다. 특히 5% AMP 키토산 현탁액 의 투과도는 AMP를 첨가하지 않은 경우와 비교하여 초기 에 상대적으로 더 낮았으며, 이산화탄소에 노출된 후에는 투과도가 더 높았다. 이산화탄소에 노출되기 전후의 투과 도의 차이가 크다는 결과로부터 5% AMP의 첨가가 시각 적 지시성능 증가에 도움을 줄 수 있는 것으로 판단된다.
Fig. 5는 MEA의 첨가(5%)가 키토산 현탁액의 이산화탄 소의 지시 성능에 미치는 영향을 보여주며, 이산화탄소가 거의 존재하지 않는 일반 대기와 이산화탄소의 농도가 100%인 환경에서 노출되었을 때의 pH 및 투과도 변화 양 상을 나타내고 있다. 키토산 현탁액이 일반 대기 환경에서 노출되었을 경우 된 MEA 첨가 키토산 현탁액의 pH와 투 과도는 AMP 첨가에서처럼 시간이 지남에 따라 큰 변화가 없었다. 100% 이산화탄소 환경에서 노출된 키토산 현탁액 의 pH는 MEA를 5% 첨가한 경우와 첨가하지 않은 경우 모두 키토산 현탁액에서 빠르게 감소하였으며, 투과도 역 시 증가하였다. 하지만 5% MEA 첨가 키토산 현탁액의 지시 성능은 MEA를 첨가하지 않은 경우와 비교하여 높지 않았으므로, AMP 첨가군과는 달리 시각적 지시성능의 증 가에 미치는 효과는 크지 않았다.
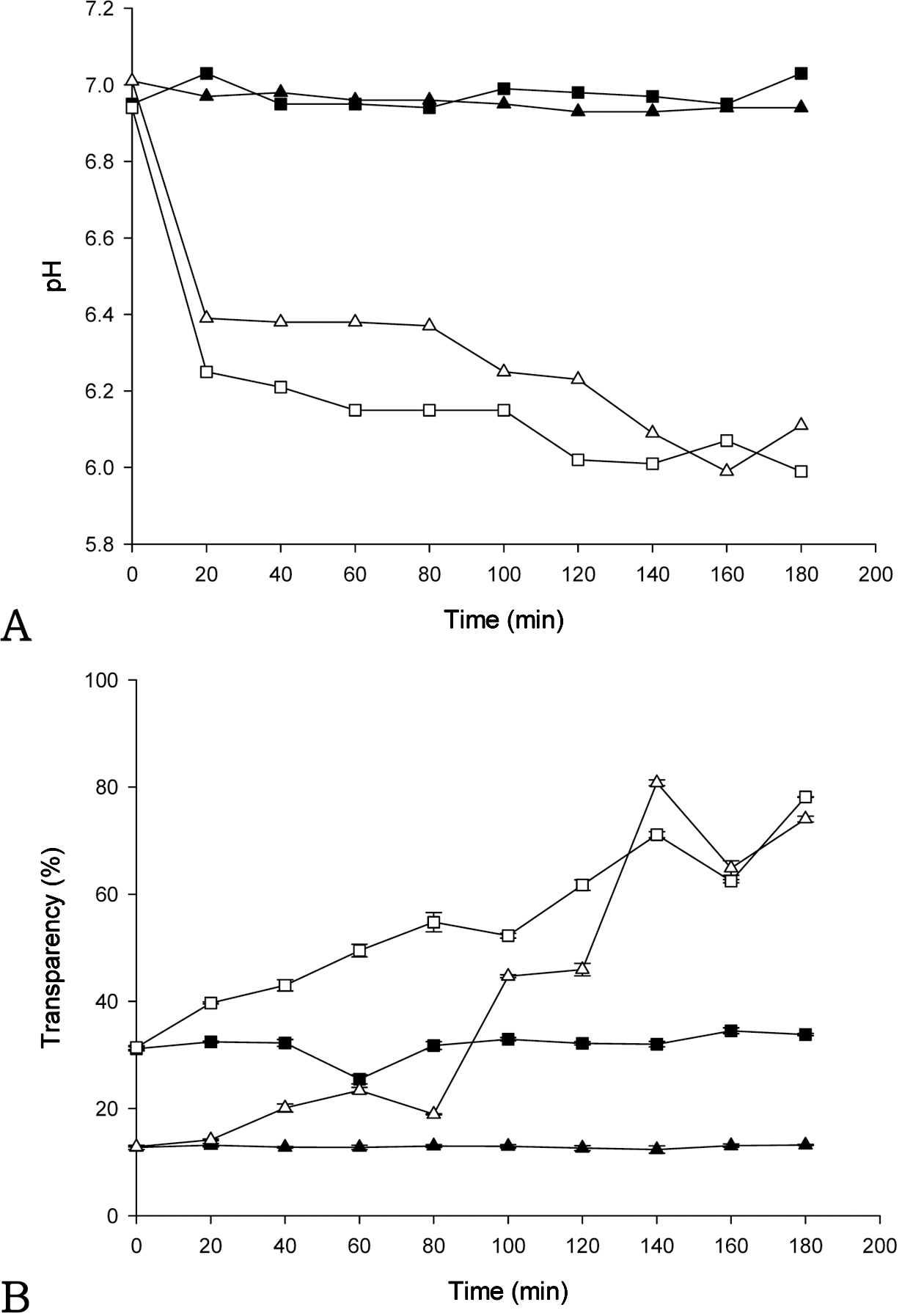
Fig. 6, 7, 8은 AMP의 첨가(5%)가 키토산 현탁액의 이 산화탄소 지시 성능에 미치는 영향을 보여준다. Fig. 6A, 7A, 8A는 각각 키토산의 농도가 0.1, 0.2, 0.4%인 현탁액 이 일반 대기와 이산화탄소의 농도가 100%인 환경에서 노 출되었을 때의 pH 변화를 보여준다. 100% 이산화탄소 환 경에서 노출되었을 경우 키토산의 농도가 0.1, 0.2, 0.4%인 현탁액 모두에서 pH는 초기에 감소하고 감소율은 점차 줄 어들어 pH 6.0 부근에 도달한 후 계속 유지되었다. 키토산 의 농도가 0.1, 0.2, 0.4%인 현탁액 모두에서 AMP를 첨가 하지 않은 키토산 현탁액의 pH는 0.5% AMP 키토산 현탁 액에 비하여 초기에 상대적으로 빠르게 감소하였다.
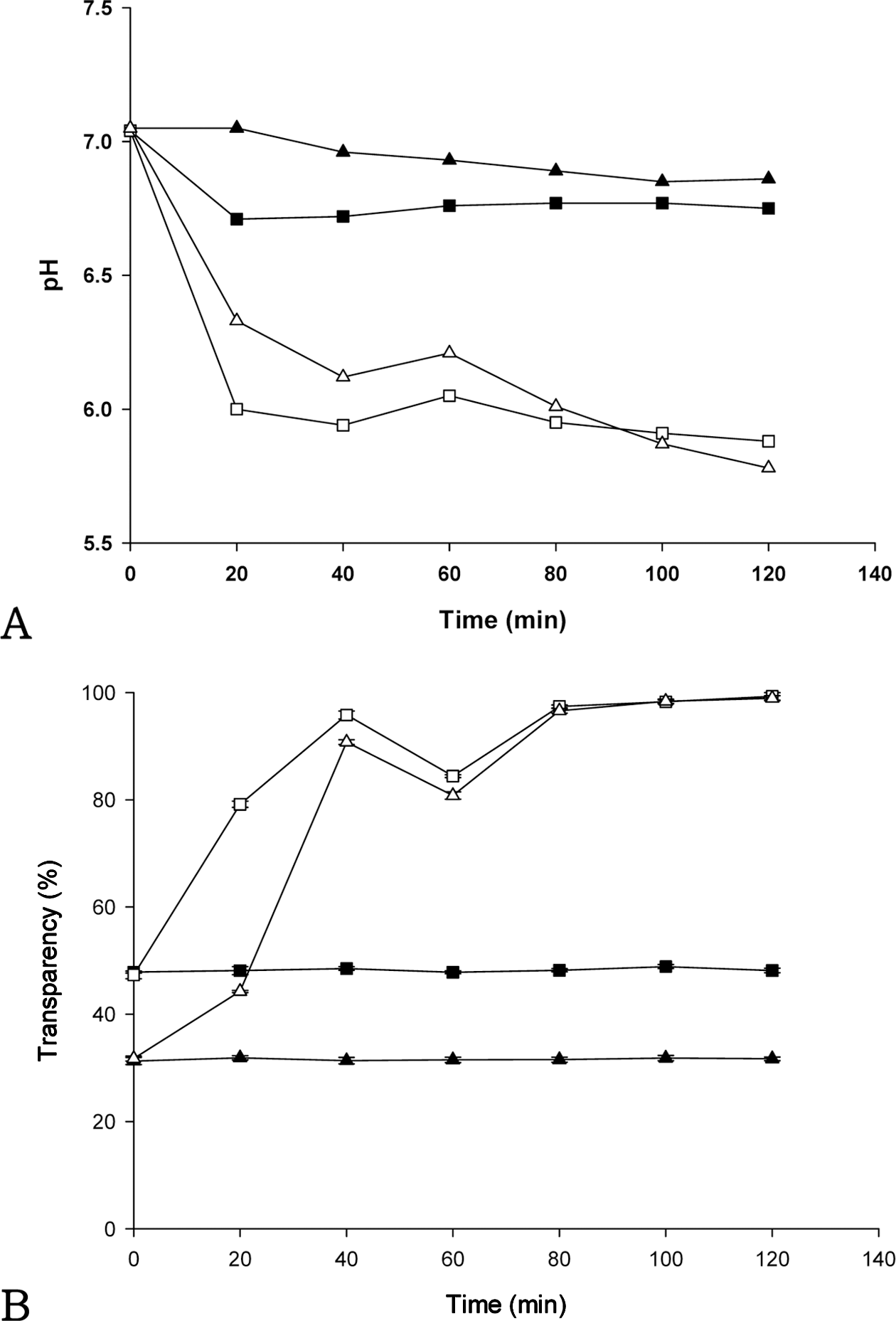
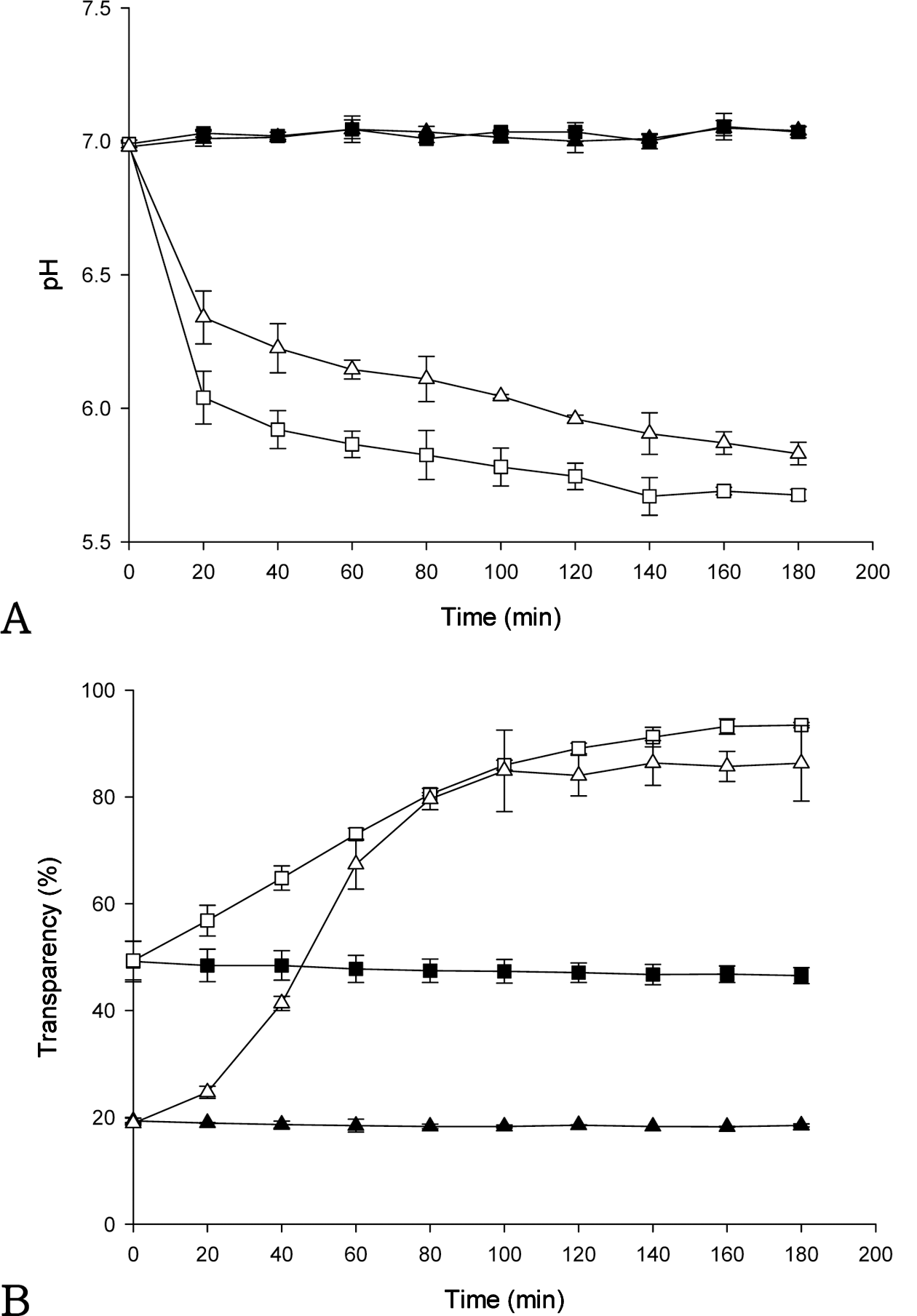
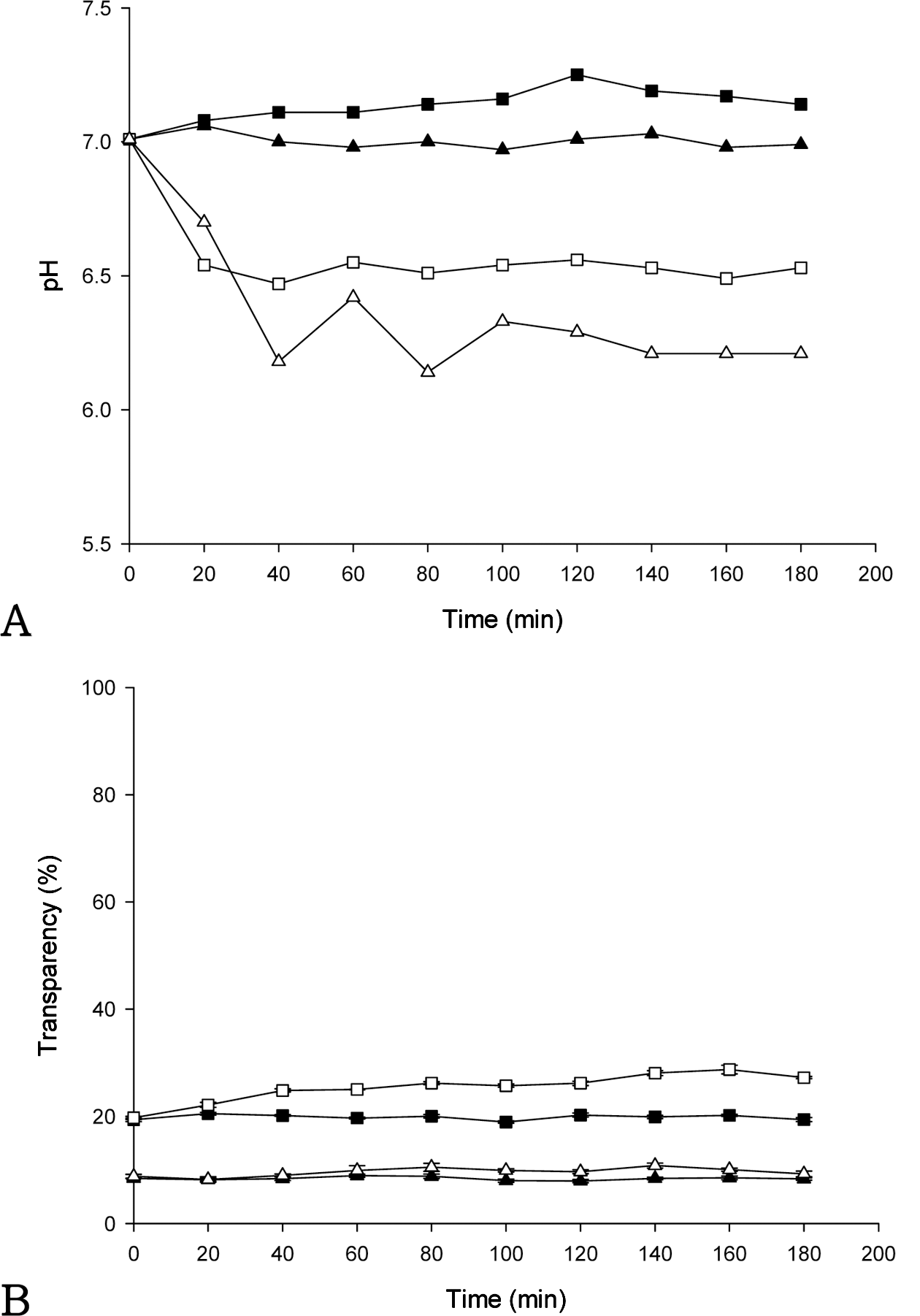
Fig. 6B, 7B, 8B는 각각 키토산의 농도가 0.1, 0.2, 0.4% 인 현탁액이 이산화탄소가 존재하는 환경에서 노출되었을 때 키토산 현탁액의 투과도 변화를 보여준다. 키토산의 농 도가 0.1, 0.2%인 현탁액에서 AMP를 5% 첨가한 경우와 첨가하지 않은 경우 모두 투과도는 시간이 지남에 따라 증 가하였다. 특히 5% AMP를 첨가하였을 경우 키토산의 농 도가 0.1, 0.2%인 현탁액의 투과도는 이산화탄소 환경에서 노출을 마친 후 85% 이상에 도달하였다. 5% AMP를 첨 가하였을 경우 키토산 현탁액의 초기 투과도는 약 20-30% 정도로 AMP를 첨가하지 않은 경우(약 50%)와 비교하여 상대적으로 더 낮았으므로, 이산화탄소 농도를 지시하기 위해 노출되는 초기에 더 혼탁한 상태로 지시 반응이 시작 될 수 있었다. 키토산의 농도가 0.1, 0.2%인 현탁액에 AMP를 5% 첨가한 경우, 이산화탄소의 농도가 100%인 환 경에서 노출되었을 때 키토산 현탁액의 투과도 변화 범위는 각각 32-99%(변화폭 67% 포인트), 19-86%(변화폭 67% 포인트)이었다. 반면에 AMP를 첨가하지 않았을 경우, 키 토산의 농도가 각각 0.1, 0.2%인 현탁액의 투과도 변화 범 위는 각각 47-99%(변화폭 52% 포인트), 49-93%(변화폭 44% 포인트)이었다. 키토산 현탁액의 투과도 변화는 5% AMP 키토산 현탁액이 AMP를 첨가하지 않은 키토산 현 탁액에 비하여 더 큰 영향을 받는 것으로 생각된다. 5% AMP의 첨가는 이산화탄소에 노출되기 전후의 투과도 변 화폭을 증가시킨다는 결과로부터, 키토산 현탁액의 시각적 지시성능 증가에 도움을 줄 수 있는 것으로 판단된다. 반 면에 키토산의 농도가 0.4%인 현탁액은 100% 이산화탄소 환경에서 노출되었음에도 불구하고 AMP를 5% 첨가한 경 우와 첨가하지 않은 경우 모두 투과도의 변화가 크지 않았 으므로, 이산화탄소의 농도를 지시하기에는 키토산의 농도 가 너무 높아 부적합하였다.
AMP를 포함하는 키토산 현탁액은 저장 및 유통 중 이 산화탄소를 생성하는 포장식품의 품질 지시계로 사용될 수 있는 가능성이 있다. 예를 들면, 김치와 같은 발효식품은 포장 후에도 지속적인 미생물의 활동으로 인하여 품질변화 가 진행된다. 따라서, 포장김치의 경우, 소비자에게 적정 숙성 여부와 같은 품질 정보를 제공하는 것이 매우 중요하 다. 본 연구에서 개발된 키토산 현탁액 기반 이산화탄소 지시계는 김치의 숙성과정 동안 생성되는 이산화탄소의 농 도를 지시할 수 있으므로 이와 상응하는 김치의 품질을 나 타낼 수 있으며, 김치 이외에도 저장 및 유통 중에 이산화 탄소를 발생하는 발효식품의 품질 지시에 적용될 수 있는 가능성이 크다.
요 약
본 연구의 목표는 포장식품의 이산화탄소 농도 지시를 위한 키토산 현탁액 기반 지시계를 개발하고, 지시 성능 강화를 위하여 2-amino-2-methylpropan-1-ol (AMP) 및 2- aminoethanol (monoethanolamine, MEA)의 첨가량에 따른 지시 반응 변화를 연구하는 것이다. 키토산 현탁액은 증류 수에 키토산(0.1, 0.2, 0.4%)을 혼합하여 제조 한 후 AMP 또는 MEA를 첨가한 다음 pH를 7.0으로 조정하였다. 이산 화탄소의 농도에 따른 지시 반응 평가를 위하여 이산화탄 소 지시계를 일반 대기 및 100% 이산화탄소 환경에서 노 출하며 시간경과에 따른 키토산 현탁액의 pH 및 투과도 변화를 측정하였다. 100% 이산화탄소 환경에서 노출된 키 토산 현탁액의 pH는 초기에 빠르게 약 6.3 정도까지 감소 하였으며 이후에는 약간 감소되거나 유지되었다. 키토산의 농도가 0.1, 0.2%인 현탁액에 AMP를 5% 첨가한 경우, 이 산화탄소 환경에서 노출되었을 때 키토산 현탁액의 투과도 변화 범위는 각각 32-99%, 19-86%이었다. 5% AMP의 첨 가는 이산화탄소에 노출되기 전후의 투과도 변화폭을 증가 시키므로 키토산 현탁액의 시각적 지시성능을 증가시켰다. 본 연구에서 개발된 AMP를 포함하는 키토산 현탁액은 저 장 및 유통 중 이산화탄소를 생성하는 포장식품의 품질 지 시계로 사용될 수 있는 가능성이 있다.