서 론
Cronobacter sakazakii는 자연계에 널리 분포하는 세균으 로 Enterobacteriacae과의 간균으로 그람 음성, 통성혐기성, 그리고 포자를 형성하지 않는 특성을 갖고 있다(Farber et al., 2008). C. sakazakii는 과거에는 Enterobacter sakazakii 로 명명되다가 Iversen et al. (2006)에 의해 Cronobacrter spp.로 새롭게 분류되었다(Iversen et al., 2006). Enterobacter spp. 중 E. cloacae, E. agglonerans와 더불어 Cronobacter spp.는 대표적인 병원성 세균으로 알려져 있으며(Urmenyi et al., 1961), 최근 들어 분유 등 영유아식에 오염되어 영 유아에게 치명적인 질환을 유발시키기 때문에 제어가 필요 한 병원성 세균으로 주목 받고 있다(Gurtler et al., 2005).
영유아의 급식용으로 사용되는 조제분유와 이유식은 비 살균 공정으로 생산되는 식품이므로 C. sakazakii에 의해 오염되기 쉽고 실제 한국의 영 유아 식품에서의 오염도가 약 20%에 달하는 것으로 보고되었다(Jung & Park, 2006). Muytjens et al. (1988)은 가장 높은 오염원으로 알려진 건 조 유제품을 35개국에서 141개의 조제분유를 수집하여 분 석한 결과 14.2%의 오염율을 보였다고 보고하였다 (Muytjens et al., 1988). 이처럼 C. sakazakii는 조제분유 혹 은 유아식에서 주로 검출되는 것으로 알려져 있으나 그 외 에도 C. sakazakii는 토양, 쥐, 파리, 우유분말공장, 초콜릿 공장과 집 등 주변 환경에서 자주 검출되는 미생물로 보고 되었으며 식품공장을 포함한 다양한 인공 환경에서 분리되 었다. 식품 중에는 쌀과 빵을 포함하는 곡류식품, 발효 음 료, 양배추와 같은 채소류가 있고 자연환경으로는 옥수수, 오이, 레몬 등의 식물 뿌리와 물 토양 등에서 확인되었다 (Mahaff & Kloepper, 1997; Cottyn et al., 2001; Soriano et al., 2001). 또한 그 외에도 치즈, 육류, 허브, 향신료를 포 함한 식품에 널리 분포되어있다(Adamson et al., 1981; Farber et al., 2008).
C. sakazakii의 위험성이 높아짐에 따라 C. sakazakii의 영유아식품에서의 제어 연구가 진행되고 있다. C. sakazakii 는 낮은 Aw에서는 높은 수분활성도에 비해 더 오래 생존 한 것으로 나타냈는데 습도가 낮을수록 C. sakazakii의 생 존율이 높은 것으로 알려져 있다(Breeuwer et al., 2003). 또한, C. sakazakii의 기능적으로 다른 유전자 중 건조 stress에 관여하는 유전가 발현되기 때문이라고 보고되었다 (Gurtler et al., 2005). 그리고, Barron과 Forsythe는 C. sakazakii는 30개월간 건조 조제분유에서 실험한 결과 다 른 장내 세균들 보다 건조내성이 크다고 보고하였다(Barron et al., 2007). 또한 Edelson-Mammel et al. (2005)은 조제 분유의 높은 영양성분으로 인해 700일 이상 bacterial cell의 생존이 가능하다고 보고하였다. 또한 Gurtler & Beuchat, (2007)은 C. sakazakii가 건조 시에 Aw가 감소할수록 생존 률이 높다고 보고하였다(Gurtler & Beuohat 2007). 이렇게 C. sakazakii가 분말형 건조식품이나 환경 등에 오염이 높 게 보고되는 것은 C. sakazakii가 다른 미생물 혹은 다른 Enterobacteriacae 종에 비하여 삼투압과 건조 스트레스에 높은 저항성을 가지기 때문이다(Lehner & Stephan, 2004). 또 다른 원인으로는 C. sakazakii의 biofilm 형성능력을 들 수 있는데 biofilm은 물리적 장벽을 형성함으로써 UV light, 삼투압 스트레스, 열처리, 영양고갈, 산, 세정액, 항생 제 등의 환경스트레스에 대하여 저항성을 높여준다 (O'Toole et al., 2000). Lehner et al. (2005)은 56종의 C. sakazakii 중 23종의 균주가 유리표면에서, 33개 균주가 air-solid 표면에서, 16종의 균주가 두 가지 표면에서 모두 biofilm을 형성하는 것을 확인하였다.
이러한 C. sakazakii와 biofilm 제어를 위해 열처리 등의 물리적 방법이나 화학적 살균소독제 등이 사용되어 왔으나 그 효과가 식품에서는 크지 않은 것으로 알려져 있다. 아 울러 소비자는 가능하면 최소의 열처리 등의 가공을 원하 므로 새로운 천연 식품보존 및 살균제의 개발이 요구 되고 있다. 이에 따라서 천연항균제, 박테리오파지, endolysin 등 이 새롭게 제안되고 있다(Clark et al., 2006). 그 중 박테 리오파지는 세균만을 감염시키는 선택성을 가지고 있고 식 품 및 자연 환경 속에 아주 많이 분포하고 있으므로 잘 활 용하면 훌륭한 식중독 세균 천연제 어 방법이 될 수 있으 리라 사료된다(Brussow et al., 2005). 최근에는 미국 FDA 에서 닭고기 등의 즉석섭취 식품에 Listeria monocytogenes 파지의 실용화가 승인(www.ebifoodsafety.com) 되었고, E. coli와 Salmonella enterica 제어 파지 제품이 승인되어 활 용되고 있다.
따라서 본 연구에서는 C. sakazakii의 제어를 위한 박테 리오파지를 김치와 오수 시료로부터 분리하여 특성을 분석 하고 C. sakazakii의 생육 억제 및 biofilm 저감화 효과를 확인하고자 한다.
재료 및 방법
시료는 다양한 미생물들이 존재하고 있는 김치와 오수를 선택하였다. 경기도 재래 시장에서 시판 중인 김치와 성남 시 하수처리장으로부터 오수를 채취한 후 실험실에서 -80℃ 에 보관 후 박테리오파지의 분리에 사용하였다. 실험에 사 용된 균주는 C. sakazakii ATCC29544와 기 분리된 100주 의 야생형 C. sakazakii를 사용하였으며(Lee et al., 2010; Lee et al., 2012), DFI agar (Oxoid, Hampshire, UK)에 각 각 평판 획선하고 37℃에서 배양한 후 단일 집락을 Luria Bertani broth (Difco Laboratory, Detroit, MI, USA)에 접 종하고 37℃에서 200 rpm으로 교반하면서 배양하였다. 배 양된 균주를 10 mM CaCl2 (Sigma Aldrich, St. Louis, MO, USA)가 첨가된 LB broth (LBC)에 접종한 후 동일한 조건으로 배양하고 실험에 사용하였다.
시료를 취해 균질화한 후 LBC broth에서 전 배양된 C. sakazakii을 약 7-8 log CFU/mL 수준의 배양액을 균질화한 시료에 첨가한 후 24시간 동안 2,000 rpm으로 37℃에서 교반하며 배양하였다. 그리고 10,000 g에서 10분 동안 원심 분리한 후 상등액을 취해 0.22 μm syringe filter (Millipore, Billerica, MA, USA)를 사용하여 제균한 후 제균액을 double overlay agar법을 통한 plaque 분석을 수행하고 37℃에서 24시간 배양하였다. 이 분석을 통해 생성된 plaque의 크기, opaque 정도 등의 형태학적인 특성에 따라 단일 plaque를 취해 다시 plaque 분석을 하여 순수 분리하였다. 순수 분 리된 박테리오파지의 증식과 농축은 Sambrook et al. (2001)에 의한 방법에 준하여 수행하였다.
순수 분리된 박테리오파지를 대상으로 하여 Escherichia coli, E. coli O157:H7, S. enterica Typhimurium 등의 식중 독 세균과 C. sakazakii ATCC29533 및 다양한 식품으로부 터 분리, 100주의 야생형 C. sakazakii에 대해 숙주저해범 위를 spot assay를 수행하여 확인하였다. 다양한 식중독 세 균들은 Tryptic Soy Broth(Oxoid, Hampshire, UK)에서 3 회 이상 계대 배양한 후 LBC broth에 접종한 후 0.1 mL 을 취해 LBC soft agar에 분주하고 LBC agar 위에 중층 하였다. 그리고 분리된 파지 용액 10 μL를 분주한 후 37℃ 에서 24시간 배양하고 plaque 형성 여부를 확인하였다.
분리된 C. sakazakii 박테리오파지의 형태학적 특성을 분 석하기 위해 투과전자현미경을 사용하여 검경하였다. PEG 8000 (Sigma Aldrich, St. Louis, MO, USA)을 이용해 약 10-11 log PFU/mL 수준으로 농축된 파지를 2% uranyl acetate (Sigma Aldrich)를 이용하여 negative stain을 수행 한 후 80 kV 하에서 투과 전자 현미경(Jeol JEM-100S, Japan Electronics and Optics Laboratory, Tokyo, Japan)을 통해 형태 학적 특성을 확인하였다. 그리고, 분리된 박테리 오파지를 70℃에 노출시키고 처리 시간에 따라 희석하여 plaque assay를 수행한 후 형성된 plaque를 개수하여 열에 대한 안정성을 확인하였으며, 실험은 3회 반복하여 평균으 로 나타내었다.
분리된 박테리오파지를 사용하여 C. sakazakii를 LB broth에서 대수 증식기까지 배양하고, 배양액을 50 mL의 LBC broth에 접종하고 LBC broth에서 다시 대수 증식기 까지 배양하였다. 배양 후 50 mL의 LBC broth에 각각 접 종하고 MOI (multiplicity of infection)가 약 0.1 수준으로 박테리오파지 혼합액을 접종한 후 시간에 따라 생육 정도 를 흡광도 측정하였다. 또한, 박테리오파지를 MOI 약 0.1 수준으로 동일하게 C. sakazakii 배양액에 각각 첨가한 후 시간에 따른 생균수를 10진 희석법에 따라 DFI agar에 각각 도말한 후 24시간 이후에 계수하여 생육 억제 효과 를 확인하였고, 실험은 3회 반복 실험 후 평균으로 나타 내었다.
기 분리된 24주의 C. sakazakii의 biofilm 형성을 위해 12-well plastic plate assay를 수행하였다. Tryptic Soy Broth에 C. sakazakii를 접종하여 37℃에서 하루 동안 배양 된 배양액을 12-well tissue culture plate의 각 well에 2 mL씩 배양액을 접종한 후 37℃, 48시간동안 배양하였다. 각 조건에서 배양된 plate의 부유세균과 배양액을 aspirator 를 이용하여 제거한 후 2.5 mL 식염수로 3회 수세한 후, 형성된 biofilm에 분리된 박테리오파지를 처리한 후 시간 에 따른 biofilm의 저감화 효과를 확인하였다. 그리고, 식 염수로 수세한 후 2 mL의 99% methanol (Sigma Aldrich) 을 각 well에 분주하고 15분 동안 방치하여 biofilm을 표 면에 부착시켰다. Methanol 제거 후 완전히 건조시키고 각 well마다 2 mL의 1% crystal violet (Hucker, sigma, USA) solution 분주 후 5분 동안 방치하였다. Crystal violet solution을 제거하고 건조 후 2.5 mL D.W로 1회 washing 하고 33%(v/v) glacial acetic acid (Sigma Aldrich)를 1.6 mL씩 분주하여 착색된 crystal violet을 용출시켜 660 nm 에서 흡광도의 감소 정도를 측정하여 박테리오파지에 의한 biofilm 저감 효과를 확인하였다. 그리고, 실험은 3회 반복 실험 후 평균으로 나타내었다.
결과 및 고찰
최근 다양한 연구자들이 C. sakazakii의 생물학적 제어제 로써 박테리오파지를 적용하고자 하는 연구가 진행되고 있 다(Kim et al., 2007; Lee et al., 2011; Abbasifar et al., 2014). 하지만, 현재까지 다른 식중독 세균들에 비해 박테 리오파지를 활용해 C. sakazakii의 제어에 응용은 시작 단 계에 있으므로, C. sakazakii의 제어를 위해 박테리오파지 를 적용할 수 있는 다양한 방법에 대한 연구가 필요할 것 으로 사료된다. 김치와 오수로부터 C. sakazakii에 대한 박 테리오파지를 plaque assay를 수행하여 형성된 plaque 중 크기가 크고 선명한 박테리오파지를 선별하여 KCES2 파 지와 ESP 2949-2 파지를 각각 분리하였다. 분리된 C. sakazakii의 KCES2 파지와 ESP 2949-2 파지에 대해 숙주 저해 특성을 확인하기 위해 E. coli, E. coli O157:H7, E. cloacae, S. enterica Typhimurium, S. enterica Enteritidis와 기 분리된 100주의 C. sakazakii의 숙주 감염 범위를 확인 한 결과는 Table 1과 같다. KCES2 파지와 ESP 2949-2 파 지는 C. sakazakii를 제외한 다른 세균에 대해서는 감염시 키지 못하는 것으로 나타났다. 또한, 야생형에 C. sakazakii 에 대해서는 각각 26.3%와 19.3%의 숙주 저해 특성을 확 인하였다.
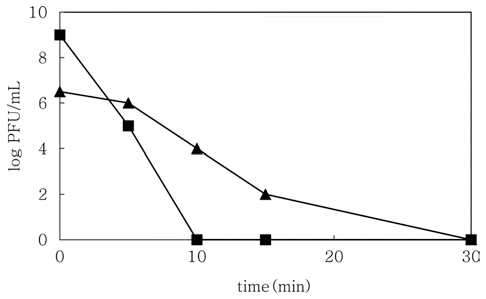
분리된 KCES2 파지와 ESP 2949-2 파지의 형태학적 특성을 투과 전자 현미경을 통해 확인한 결과 ES2는 Myoviriadae family에 속하는 것으로 나타났다(Fig. 1). 세 균을 숙주로하는 바이러스에 일종인 박테리오파지는 형태 학적인 특성에 따라 대부분 Siphoviridae, Myoviridae, Podoviridae family에 속하는 것으로 분류되는 것으로 알려 져 있다. 특히, Myoviridae family에 속하는 박테리오파지 는 수축성 tail을 갖는 특성을 가지고 있는 특성을 보유하 고 있다(Ackermann, 2007). 최근까지 알려진 C. sakazakii 의 박테리오파지의 경우 다수가 Myoviridae family에 속하 는 것으로 보고되고 있다. 그리고, KCES2 파지와 ESP 2949-2 파지에 대해 70℃에서의 열안정성에 대해 확인한 결과는 Fig. 2와 같다. KCES2 파지는 70℃에 노출했을 때 약 10분 후에 모두 사멸되는 것으로 나타났으며, ESP 2949- 2 파지의 경우는 약 2 log PFU/mL로 감소 후 30분 후 모 두 사멸하였다. Lee & Park (2011)이 보고한 C. sakazakii 파지의 경우도 30분 후 대부분이 사멸되는 것으로 확인되 었다. 기존에 보고된 일부 박테리오파지의 열안정성의 경 우는 70℃에서 30분 동안 처리했을 때 약 2~8 log PFU/ mL 수준으로 감소되거나 모두 사멸되는 것으로 나타났으 며(Buzrul et al., 2007; Li et al., 2010; Coffey et al., 2011; Lee et al., 2015), 일부 박테리오파지의 경우 90℃ 이상의 고온에서도 안정한 것으로 보고되었다(Guglielmotti et al., 2011).

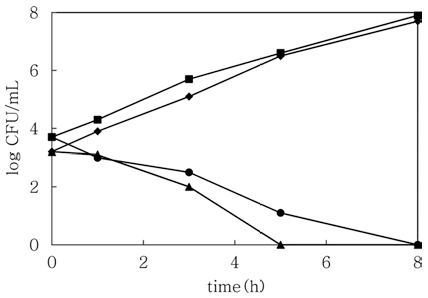
분리된 KCES2 파지와 ESP 2949-2 파지를 MOI가 0.1 수준으로 접종하여 C. sakazakii 에 대한 생육 억제 효과를 확인하기 위해 LBC broth에서 흡광도를 측정하여 확인하 였다(data not shown). 그 결과 박테리오파지를 접종하지 않았을 경우는 C. sakazakii는 흡광도 값이 약 1.0 수준까 지 증가하였으나, KCES2 파지와 ESP 2949-2 파지를 각각 접종하였을 경우는 흡광도 값이 약 0.1 수준으로 나타나 생육이 억제 혹은 사멸되는 것을 확인하였다. 또한 분리된 박테리오파지들을 MOI가 약 0.1이 되도록 하여 LBC broth에 접종하고 생육 정도를 DFI agar에 도말하여 확인 한 결과는 Fig. 3과 같다. KCES2 파지와 ESP 2949-2 파 지를 접종하지 않은 경우 초기 약 3 log CFU/mL에서 8시 간 이후에는 약 8 log CFU/mL 수준으로 증가하는 것을 확인할 수 있었다. 그러나, 박테리오파지를 접종하였을 때 KCES2 파지는 약 5시간 이후에 C. sakazakii는 확인되지 않았으며, ESP 2949-2 파지는 약 8시간 이후에 검출되지 않았다. 이러한 결과를 통해 KCES2 파지와 ESP 2949-2 파지의 C. sakazakii의 생육 억제 특성이 상이함을 확인할 수 있었다. Kim et al. (2007)은 오수 시료로부터 분리한 C. sakazakii의 박테리오파지를 이용하여 분유에서 C. sakazakii의 저감화를 확인하였으며, Lee & Park (2011)은 돼지분변으로부터 분리된 박테리오파지를 야채 주스와 분 유에 적용하여 C. sakazakii의 제어 효과를 확인하였다. 따 라서, 본 연구에서 분리된 KCES2 파지와 ESP 2949-2 파 지를 활용하여 식품에 오염된 C. sakazakii의 제어를 위한 생물학적 제어제로 적용이 가능할 것으로 사료된다.
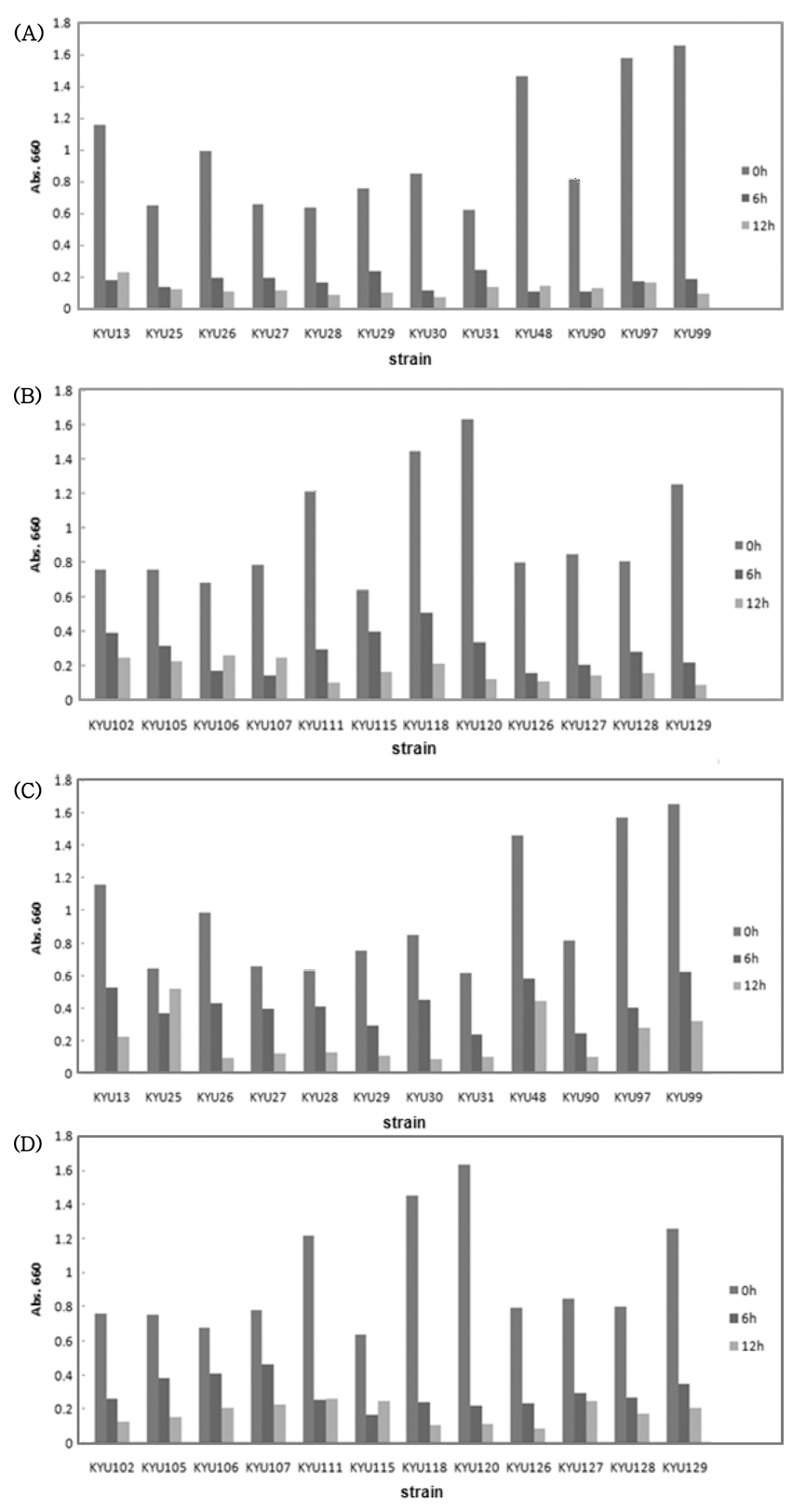
본 연구에서 분리한 KCES2 파지와 ESP 2949-2 파지를 기 분리된 biofilm 형성 C. sakazakii들의 제어 효과를 확 인하기 위해 microtiter plate assay법을 수행하였다(Fig. 4). Biofilm 형성능을 확인한 결과 기 분리된 24주의 C. sakazakii의 biofilm 생성능은 분리 균주 마다 상이한 것으 로 나타났으면, 이는 분리 균주의 생리특성 및 biofilm 형 성 조건에 따라 차이가 나는 것으로 판단된다. Biofilm 형 성 C. sakazakii에 KCES2 파지와 ESP 2949-2 파지를 각 각 처리하여 제어 효과를 확인한 결과 각각의 박테리오파 지를 접종한 후 6시간과 12시간 이후에 흡광도 값이 모두 감소하는 것으로 나타났다. Biofilm의 제어를 위해 물리적 방법과 화학적 방법 등이 다양하게 적용되고 있음에도 불 구하고 제어가 어려운 것으로 알려져 있다. Biofilm은 미 생물이 생물학적 또는 비생물학적 표면에 부착하여 자라면 서 형성한 3차원적 구조를 의미하며, 통상적으로 미생물과 미생물이 분비한 extrcellular polymeric substance (EPS), 외부에서 부착된 물질들을 통칭한다(O'Toole et al., 2000). Biofilm을 형성한 미생물은 EPS를 분비하여 미생물을 보호 하게 되고, 그 결과 열, 낮은 pH, 낮은 수분활성도, 산화제 등의 환경스트레스 요인에 대하여 현저하게 증가된 저항성 을 갖게 된다. 이러한 biofilm은 해양생태계, 산업 환경, 인 체 등 미생물이 존재하는 지구상에 대부분에 만들어지면서, 미생물의 생육, 외부 환경에 대한 방어, 병원성 등의 기능 을 하고 있다. 특히, 대부분의 식품은 미생물이 존재할 수 있기 때문에 biofilm을 형성한 상태로 있을 가능성이 높다. 이에 따라 최근 연구자들이 식품, 의료 기구 등에서 biofilm 형성 E. coli O157:H7, Staphylococcus aureus, Listeria monocytogenes, Bacillus cereus, Pseudomonas aeruginosa 등 의 제어를 위해 박테리오파지를 적용하여 효과를 확인하였 다. Jassim et al. (2012)은 박테리오파지 처리를 통해 biofilm 형성 E. coli를 약 3 log 이하로 감소하는 효과를 확인하였으며, Lee & Park (2015)과 Sharma et al. (2005) 은 stainless coupon에서 biofilm 형성 E. coli O157:H7을 박테리오파지 처리를 통해 제어 효과가 있는 것으로 보고 하였다. 또한, Carson et al. (2010)과 Liao et al. (2012)은 카테터에 박테리오파지를 처리하여 biofilm 형성을 방지할 수 있는 것으로 나타났다. 그러므로, 본 연구에서 분리된 KCES2 파지와 ESP 2949-2 파지를 이용해 biofilm 형성 Cronobacter spp.의 제어하는 데 응용할 수 있을 것으로 사료된다.
요 약
본 연구에서 김치와 오수로부터 KCES2 파지와 ESP 2949-2 파지를 각각 분리하였으며, 숙주 저해 범위는 기 분리된 C. sakazakii에 대해 KCES2 파지는 약 26.3%와 ESP 2949-2 파지는 19.3%로 확인되었다. 또한, 형태학적 특성을 확인한 결과 모두 Myoviridae family에 속하는 것 으로 나타났으며, 각각의 박테리오파지에 대해 열안정성 은 70℃에서 30분 처리시에 모두 사멸되었다. 그리고, 분 리된 KCES2 파지와 ESP 2949-2 파지를 접종한 결과 C. sakazakii의 생육 억제 효과가 있었다. 또한, biofilm 형성 C. sakazakii에 박테리오파지를 각각 처리했을 때 6시 간, 12시간 이후에 모두 저감화 효과가 있는 것으로 확인되 었다. 따라서, 본 연구를 통해 분리된 KCES2 파지와 ESP 2949-2 파지를 C. sakazakii와 biofilm 형성 C. sakazakii의 생물학적 제어제로 적용이 가능할 것으로 사료된다.