서 론
소금은 인간의 생존을 위한 생리기능을 유지하기 위해 필수적인 무기물로서 근육의 흥분성을 유지하고 신진대사 를 촉진시킬 뿐만 아니라 체내에서 세포막의 삼투압을 유 지시키며 산과 알칼리의 균형을 이루는 등 생명현상 유지 에 필수적인 특성을 나타낼 뿐만 아니라 식생활에서도 음 식의 간을 맞추는 역할을 기본으로 하면서 가공식품의 제 조 및 저장성 향상 등에 중요한 역할을 하는 성분이다 (Kim et al., 2004).
소금의 생리적 특성은 소금성분 중 체내에서 적절한 삼 투압과 혈장의 부피유지, 신경흥분, 근육 수축 등에 중요한 역할을 하는 Na+ 이온의 생리작용과 관련이 있는 것으로 알려져 있다. 또한 소금의 주성분인 염화나트륨 이외에 CaSO4, MgSO4, MgCl2, KCl 등의 무기물이 혼합되어 있는 데, 이 중 K, Mg 및 Ca 등은 혈압을 낮추는 효과가 있다 고 알려져 있다(Joffers et al., 1960; Schroeder, 1960).
질병 관리본부의 2011년도 국민영양조사 결과는 우리나 라 국민의 평균 소금 섭취량은 2010년 12.27 g에 비해 소 량 감소한 12.16 g을 기록하여 해마다 소금의 평균 섭취량 이 감소하고는 있으나 세계보건기구(WHO) 권고기준인 5 g (나트륨 환산 1,969 mg)에 비해 2배 이상 높은 수치이며 (MFDS, 2012) 영국 및 미국은 물론 비교적 염분의 섭취가 많은 일본보다도 높은 수치이다. Yon et al. (2011)에 따르 면 우리나라 남자의 염분섭취량은 30-40대의 연령군이 가 장 높아 평균 5,400 mg을 상회하며 이러한 이유는 김치류 와 라면, 된장 등에 의하여 염분의 섭취량이 증가하는 것 을 확인하였다. 이러한 나트륨의 과다 섭취로 인하여 고혈 압, 심장병, 뇌·심혈관 질환, 신장질환, 위암 등 만성질환 의 주요 원인으로 작용하고 있다(Stamler et al., 1991: Freedman & Petitti, 2001). 이중에서도 한국인들의 고혈압 발생은 만성적인 나트륨의 과잉섭취와 밀접한 관련이 있는 것으로 알려져 있다. 나트륨의 과다섭취는 수분재흡수 등 과 호르몬 작용에 관여해 혈액의 양을 늘게 하는 등 말초 저항을 증가시키고 결과적으로 고혈압을 야기한다(Son & Huh, 2001).
따라서 나트륨 섭취를 줄이기 위해 여러 연구들이 수행 되고 있다. 그 중 하나는 소금의 나트륨 이온을 다른 염으 로 대체하는 방법으로 Horita et al. (2011)은 소금의 나트 륨 이온 대신 칼슘, 마그네슘, 칼륨을 이용해 모짜렐라 치 즈를 제조하였으며 Corral et al. (2013)은 저염소금을 이용 한 소시지를 제조하여 다양한 평가를 진행하였으나 모두 관능적인 문제를 해결할 수 없었다.
그 밖에도 해조성분을 강화시킨 기능성 소금의 특성연구 (Kim et al., 2007), 소금의 종류별 미네랄 함량과 외형구조 비교 연구(Ha & Park, 1998) 등 소금과 관련된 기능성 및 제조공정 또는 성분에 관한 다양한 연구가 진행되었다.
γ-Aminobutyric acid (GABA)는 자연계에 널리 분포하는 비단백질 구성 아미노산으로서, 사람에 있어서는 신경계, 혈액 함유되어 있으나, 대부분은 뇌의 골수에 존재하여 aectylcholine이라 불리는 신경전달 물질을 증가시키고, 뇌 기능을 촉진시키는 등의 생리작용뿐 아니라, 혈압 저하 작 용, 이뇨작용, 항산화 작용, 성장 호르몬의 분비 조절에도 관여하며, 통증 완화에도 효과가 있는 것으로 알려져 있다 (Chang et al., 1992; Shelp et al., 1999; Park et al., 2002).
GABA는 glutamic acid decarboxylase (GAD)에 의해 glutamate가 비가역적으로 탈탄산화되어 생성되는데, GAD 와 GABA는 미생물에서부터 고등생물까지 널리 발견되고 있다. 고등생물의 중추신경계에서 GABA는 억제성 neurotransmitter로 잘 알려져 있는데, GAD에 의해 흥분성 neurotransmitter인 glutamate와 GABA의 농도가 조절되고 있다 (Ueno, 2000).
GABA는 각종 야채, 과일, 쌀, 콩 등에 널리 분포되어 있는 것으로 알려져 있으나, 그 함량이 낮아 생리작용을 나타내지 못한다. 그러나 최근에는 쌀 및 콩 발효 식품, 김치 및 젓갈 등에서 분리한 다양한 유산균들이 GABA를 고농도로 생산하는 것으로 보고되었다(Ueno et al. 1997; Park & Oh, 2006; Kook et al., 2009; Li et al., 2010; Lee et al., 2014).
발효법에 의한 GABA의 생산 메커니즘은 배지 중에 첨 가한 mono sodium glutamate (MSG)에 대한 발효균의 탈 탄산효소의 작용에 의하여 배양액 중에 GABA가 생성되는 것으로 이렇게 외부에서 첨가된 MSG를 원료로 GABA를 생산하는 공정에서 배지 중 잔류하는 MSG는 국내의 경우 소비자의 입장에서 선호도에 매우 나쁜 영향을 미칠 수 있 다. Kook et al. (2009)은 미배아추출물을 원료로 사용한 배지에서 배지 중에 첨가한 7% (w/v)의 MSG를 100% 전 환하는 결과를 얻었으나 변수가 존재하는 발효 공정의 특 성상 발효액 중 MSG의 잔류가능성은 항상 존재한다. 이 러한 문제점을 해결하기 위하여 본 연구에서는 배지 중에 MSG 대신에 glutamic acid를 첨가하였다.
본 연구에서는 glutamic aicd를 배지 중에 첨가하여 생산 되는 GABA 함유 배양액과 담수를 제거한 해양 심층수에 서 유래하는 염수를 원료로 하여 생리활성을 나타낼 수 있 는 농도 이상의 GABA를 함유한 소금을 제조함으로써 소 금의 과잉섭취에서 발생할 수 있는 다양한 질환을 예방할 수 있는 기능성 소금의 제조 가능성을 살펴보았다.
재료 및 방법
본 연구에 사용한 균주는 김치로부터 분리한 Lactobacillus sakei B2-16을 (주)바이오벤(Bucheon, Korea)에서 제공받아 사용하였으며, 30%의 glycerol stock으로 -70°C에 서 냉동 보관하던 균주를 Lactobacilli MRS broth에 접종 하여 30°C에서 계대 배양 후 사용하였다.
염수 및 실험을 통하여 제조된 소금의 염도는 digital salt meter (ES-421, ATAGO, Tokyo, Japan)를 사용하여 측 정하였다. 제조된 소금을 증류수에 용해하여 염도를 측정 하였으며 염도의 측정 값에 희석배수를 곱하여 염도를 측 정하였다.
ICP/OES (Optima 8300, Perkin Elmer Inc., Waltham, MA, USA)를 이용하여 파장범위 163-782 nm 범위에서 Na, Ca, K, Mg의 양을 측정하였다. 측정하고자 하는 일정 량의 시료에 0.5 N HNO3 (Merck, Darmstadt, Germany) 2 mL를 가한 후 hot plate (VS-130SH, Vision Scientific, Daejeon, Korea) 에서 90°C로 한시간 가열한 후 분석 가능 한 범위로 희석한 후 분석하였다.
미강은 김포의 농협 미곡종합처리장(rice processing complex, RPC)에서 도정한지 24시간 이내의 것을 제공받 아 -18°C에서 냉동보관하면서 사용하였으며 미강추출물은 미강에 10배(v/w)의 물을 첨가한 후 미강에 포함된 전분이 호화되지 않도록 55-60°C에서 12시간 이상 교반한 후 5,000 rpm으로 10분간 원심분리하여 상등액을 배지의 기 본성분으로 하였으며 이때 추출액의 고형분은 2.5-3% 수 준이다. 미강추출물에는 GABA 생산 유산균의 생육에 필 요한 기본적인 영양분이 포함되어 있으나 충분한 탄소원과 질소원을 제공하지는 못한다. 따라서 미강 추출물에 2%의 sucrose (w/v, 이하 동일)와 1%의 yeast extract, 0.5%의 sodium acetate를 첨가함으로써 GABA 함유 배양액을 생 산하기 위한 산업용 배지를 완성하였다.
GABA생산을 위해 준비된 산업용 배지에 전환에 필요한 농도의 MSG를 첨가한 후 80°C에서 30분간 살균한 후 3%의 seed를 접종하였다. 첨가되는 seed는 MRS배지에 1%의 MSG를 첨가하여 사용하였으며 30°C에서 48시간 정 치배양하였으며 본 배양은 30 L 발효조에 working volume 을 20 L로 진행하였으며 산업용배지에 6%의 MSG 및 5% 의 glutamic acid를 각각 첨가한 후 pH의 조절 없이 30°C 에서 50 rpm으로 교반하며 72시간 동안 발효를 진행하였 으며 생성되는 GABA의 함량, 세포 수 및 pH 등을 확인 하였다.
배양액 중의 GABA 함량을 분석하기 위하여 첨가된 glutamic acid 및 생산된 GABA를 정량 분석하기 위하여 RP-HPLC (Waters 2487 Dual λ Absorbance detector, Waters 1525 Binary HPLC pump, Waters 717 plus Autosampler, Milford, MA, USA)를 이용하였다. RP-HPLC를 이용한 분 석 조건은 Ibolya & Vasanits (1999), Tcherkas et al. (2001)이 보고한 것을 참조하였다. 시료를 8,000 rpm에서 10분간 원심 분리 후 상등액을 0.45 μm cellulose acetate membrane filter (Advantec MFS Inc., Dublin, CA, USA) 로 여과하여 적정 농도로 희석한 후 ο-phthaldialdehyde (OPA)를 이용한 유도체화 후 RP-HPLC로 분석하였다. XTerra column (RP18, 5 m×4.6 mm×150 mm, Waters, Milford, MA, USA)을 사용하였으며, 이동상으로는 0.05 M sodium acetate (pH 7.2)를 용매 A로, 그리고 0.1 M sodium acetate, acetonitrile (HPLC grade), methanol (HPLC grade)이 각각 46:44:10 (v/v)으로 섞인 것(pH 7.2)을 용매 B로 사용하였다. 이동상의 농도 구배는 용매 A를 100%로 하여 분석을 시작해서 30분 경과 후에는 용매 B가 100% 가 되고, 40분 경과 후까지 용매 B가 100%, 45분 경과 후까지는 다시 용매 A가 100%가 되게 하였으며, 60분 후 까지 용매 A가 100%가 되도록 조절하였다. 이동상의 유 속은 1 mL/min로 고정하였고, 358 nm의 UV detector로 GABA를 검출하였다.
결정화 과정에서 소금에 포함된 GABA와 유사한 분자량 의 다양한 이온의 간섭을 피하기 위하여 LC-MS를 이용하 여 GABA함량을 분석하였다. HPLC는 Ultimate 3000 RS UHPLC (Thermo Scientific Co. Ltd., Hudson, NH, USA) 를 사용하였으며 Mass spectrometry는 LTQ Orbitrap XL (Thermo Scientific Co. Ltd., Hudson, NH, USA), ESI Ion source, column은 acquity uplc BEH C18 (1.7 μm, 2.1× 100 mm, Waters, Milford, MA, USA)을 사용하였다. SIM mode, [+] mode로 측정하였으며 sheath gas는 50, spray voltage는 5 kV를 사용하였다. HPLC는 A용매는 증류수, B용매는 acetonitrile에 formic acid를 0.1% 용해하여 flow rate는 0.25 mL/min로 고정시킨 후 3분에 A용매의 비율을 95%에서 5%로, B용매의 비율을 5%에서 95%로 전환한 후 5.5분에 원래의 비율로 복귀시킨 후 6분까지 유지하였 으며 standard curve는 99% 이상의 순도를 갖는 γ- aminobutyric acid (MW 103.12, Sigma-Aldrich Co., St. Louis, MO, USA)를 사용하여 500-50,000 ppb 사이의 농 도에서 작성하였으며 시료의 injection volume은 5 μL로 하였다.
GABA가 함유된 발효액의 색을 제거하기 위하여 (주)신 기화학(Yongsan, Korea)의 식품용 분말정제 활성탄 SGS- 100을 사용하였다.
발효가 끝난 배양액을 80°C로 가열한 후 1.0-5.0% (w/v) 의 활성탄을 첨가하고 활성탄이 침전하지 않도록 교반하면 서 3시간을 유지하였다. 교반이 끝난 배양액은 8,000×g 이 상의 원심분리를 통하여 활성탄과 미생물을 동시에 제거하 였으며 활성탄이 제거된 배양액은 증류수를 control로 하여 260 nm에서 O.D. 값을 측정하였다.
탈색이 완료된 GABA함유 배양액과 해양심층수로부터 역삼투압방식에 의하여 담수를 분리한 염수를 이용하여 GABA함유 소금을 제조하였다. (주)동해천일염(Gosung, Korea)에서 직접 제작한 pilot규모의 생산설비를 이용하여 결정화를 진행하였다. 열전도율이 높고 녹이 슬지 않도록 티타늄으로 제조된 결정판(4m×1.5m×0.05m)에 2-3 cm 두 께로 염수와 GABA 함유 배양액을 혼합한 용액을 첨가한 후 결정화를 진행하였다. 이때 결정지에 유입되는 염수의 염도는 증발지에서 25%까지 상승시킨 것을 사용하였으며 GABA함량 3% (w/v) 농도의 배양액을 소금 완제품 g당 10-40 mg이 되도록 첨가하여 결정판별로 GABA함량이 다 른 소금을 제조하였다.
결과 및 고찰
미강을 주원료로 한 산업용 배지에 6%의 MSG와 5%의 glutamic acid를 각각 첨가한 후 72시간 동안 30°C에서 배 양하면서 발효액 중 축적되는 GABA의 함량, pH변화 및 생균수를 측정하였다(Fig. 1). 그림에서 보는 바와 같이 배 지 중 첨가된 6%의 MSG(함수물, 분자량 187.13)는 발효 진행 48시간에 97%, 72시간에는 거의 100% GABA로 전 환되어 발효액 중 3.3% 수준의 GABA가 생성되었다. 반 면 5%의 glutamic acid(분자량 147.13)를 첨가한 경우에는 MSG를 첨가한 경우에 비하여 낮은 값을 나타내어 48시간 경과 후에 88.3%, 72시간에는 90.9%의 전환률을 나타내어 3.18%의 GABA가 함유된 배양액을 제조할 수 있었다. 이 는 미배아 추출물을 사용한 배지에서 배지 중 첨가한 6-7% 의 MSG를 48시간에 100% 전환시킨 Kook et al. (2009) 의 연구와 유사한 결과를 나타내었다. 6%의 MSG에서 sodium 성분을 제외한 4.72%의 glutamic acid가 GABA로 전환된 것은 배지 중 첨가한 5% glutamic acid중 4.55%가 GABA로 전환된 수치와 큰 차이를 나타내지 않는다. 이는 본 실험에 적용된 배지 및 균주 조합에서 최고 수준의 전 환능력이 발휘되었다고 할 수 있다.
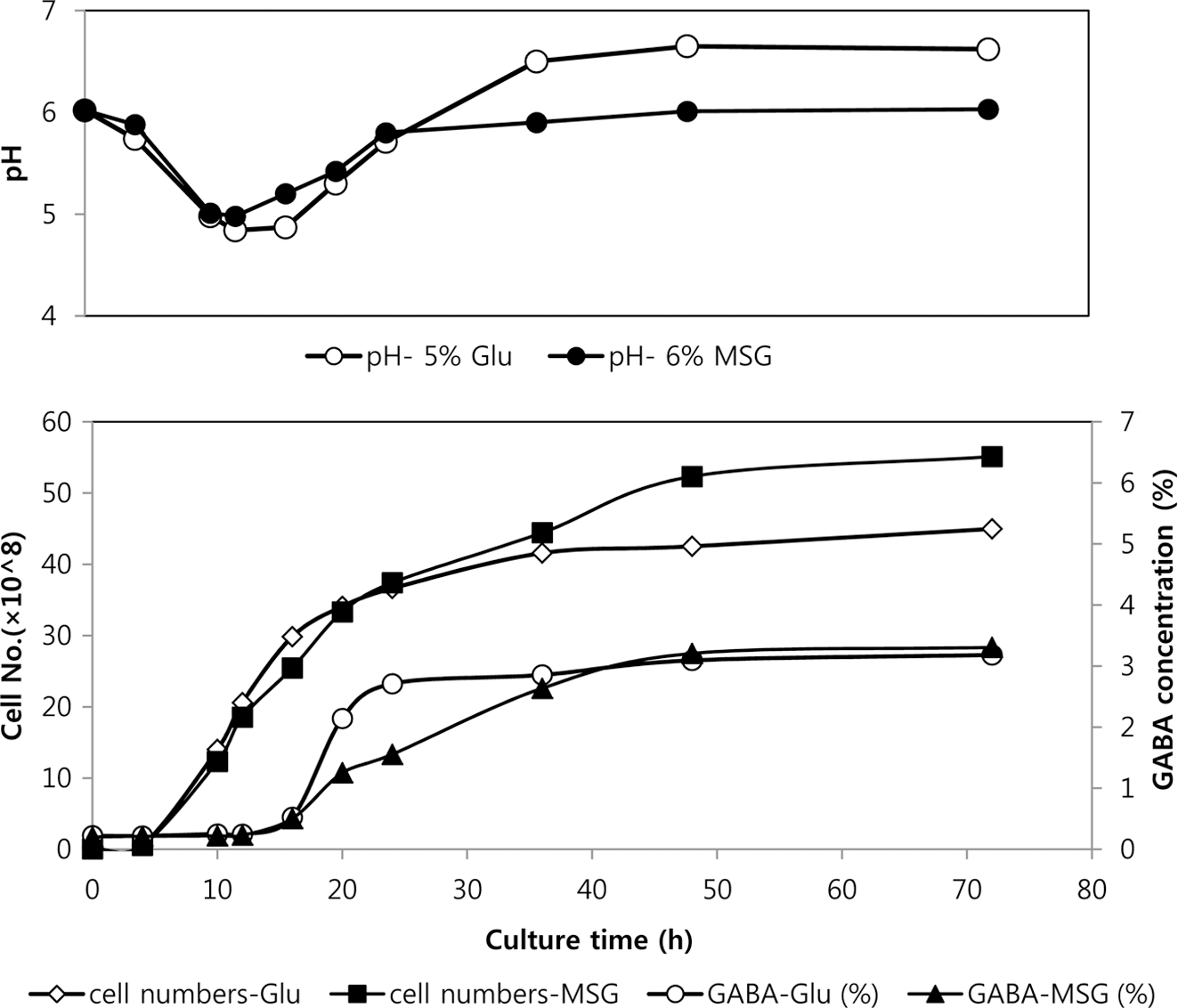
GABA로의 전환률 이외에 발효 중 세포수 및 GABA전 환시점, 배양액의 pH 변화 등은 큰 차이를 나타내지 않았 으나 GABA의 생성이 급격히 진행되는 시점에서 glutamic acid를 첨가한 경우 세포의 성장에 따르는 pH의 변화 및 GABA의 전환이 앞당겨져서 발생하는 것으로 나타났는데 이는 glutamic acid용해를 위하여 소량 첨가되는 알칼리에 의한 pH변화에 의하여 GABA 전환 메커니즘이 빠른 속도 로 활성화 된 것으로 판단된다(Baum et al., 1996; Kang, 2002). 본 실험을 통하여 염수와 혼합하여 결정화를 시킬 수 있는 GABA함량 3% 이상의 발효액을 제조하였다.
활성탄이 첨가된 배양액을 80°C에서 5시간 교반한 후 원심분리하여 배양액 고유의 갈색을 가장 잘 흡수하는 260 nm에서 흡광도를 측정한 결과 활성탄의 함량이 증가 할수록 흡광도는 감소하였으며 활성탄 함량 3% 이상에서 는 육안으로 구별이 안되는 투명한 색을 나타내어 더 이상 의 탈색이 진행되지 않는 것을 알 수 있었다. 배양액의 흡 광도는 0.425±0.31로 나타났으며 활성탄을 1%, 2% 및 3% 처리한 결과 각각 0.315±0.44, 0.203±0.31, 0.017±0.02의 흡광도를 나타내어 활성탄 함량 3% 까지는 배양액의 색도 가 유의성 있게 감소하였으나 그 이상의 처리량에서 유의 성 있는 색도의 감소는 나타나지 않았다.
활성탄 처리시간을 결정하기 위하여 3%의 활성탄을 처 리한 후 시간 별로 색도의 변화를 확인하였다. 3%의 활성 탄을 한시간 및 두시간 처리한 결과 흡광도는 각각 0.263± 0.23과 0.018±0.03을 나타내어 시간이 증가할수록 색도가 옅어지는 결과를 나타내었으나 2시간 이후부터는 흡광도의 유의차 있는 변화가 없는 것으로 확인되어 GABA소금의 제조에 사용된 배양액의 탈색은 3%의 활성탄을 첨가하여 2시간 동안 진행하였다.
결정판(4 m×1.5 m×0.05 m)에 2-3 cm의 두께로 염수와 GABA 함유 배양액을 혼합한 용액을 부은 후 결정화를 진 행하였다. 이때 결정지에 유입되는 염수는 해양심층수에서 음용수로 사용하기 위한 담수를 일부 제거한 심층수를 증 발지에서 25%까지 염도를 상승시켜 사용하였으며 GABA 함량 3% (w/v) 농도의 배양액을 염수와 다양한 비율로 혼 합한 후 결정화를 진행하였다. 최종적으로 소금의 일일 섭 취 권장량인 5 g에 GABA성분이 생리활성을 나타낼 수 있 는 농도 범위인 50-200 mg (10-40 mg/g slat) 이 포함되도 록 결정판별로 GABA함량이 다른 소금을 제조할 수 있었 으며 각 결정판에는 염수 12 L를 첨가한 후 1-4 L의 발효 액을 각각 혼합하여 결정화를 진행하였다.
배양액과 염수의 혼합비율을 달리하여 결정화 공정을 거 치는 과정에서 첨가된 GABA가 염수의 다양한 미네랄 성 분과 함께 결정화되는지 확인하기 위한 LC-MS 결과를 Table 1에 나타내었다. 이론적으로 첨가된 GABA의 함량 과 결정화된 제품의 GABA함량이 큰 차이를 보이지 않는 것으로 나타나 첨가해 준 배양액 중의 GABA가 대부분 결정화 공정에서 소금에 흡착되는 것으로 나타났는데 첨가 된 GABA의 농도가 제품 무게 당 2%를 넘는 농도에서는 첨가된 GABA의 일부가 결정화되지 않은 것으로 나타났다. 4%의 GABA농도에서는 첨가된 배양액 중의 GABA 중 10% 정도가 결정화되지 않은 것으로 나타나 단순한 결정 화 공정으로 고농도의 GABA를 함유한 소금을 제조할 경 우에는 공정상 일부 손실이 발생하는 것을 확인하였다. 공 정상의 편의를 위한 고농도의 GABA함유 소금을 제조하기 위하여 소금과 동시에 결정화되는 GABA함량의 최대치에 관한 연구는 추가적으로 진행할 필요가 있으나 하루 5 g의 권장량을 섭취할 경우 생리활성을 나타내는 농도인 50-200 mg (10-40 mg/g salt) 범위의 GABA가 함유된 소금을 제 조하는 것은 일반적인 결정화조에서 결정화공정을 통하여 가능함을 알 수 있었다.
| GABA added (mg GABA/g salt) | GABA analysed (mg GABA/g salt) | Theoretical yield (%) (Analyzed amount/ Theoretical amount)×100 |
|---|---|---|
| 10 | 11.2 | 112 |
| 20 | 22.8 | 114 |
| 29 | 27.6 | 95.2 |
| 40 | 36.2 | 90.5 |
시료로 사용되는 염수의 염도는 담수의 제거율에 따라 약간의 차이를 보였으나 대부분 22-24% 사이의 값을 나타 내어 해수를 사용하여 천일염을 제조하는 경우의 염수 농 도와 유사하였다.
시중에 유통되는 천일염(전남산), 정제염 및 구운소금과 실험에 사용된 염수의 미네랄 성분을 Table 2에 나타내었 다. 정제염인 꽃소금과 구운소금과 비교하여 해양심층수에 서 분리한 염수의 경우는 천일염과 유사한 Na의 함량을 보였으며 K, Mg의 함량은 천일염과 비교해서도 매우 높은 것으로 나타났다. 이는 바닷물인 심층수에서 담수를 제거 하는 공정 및 담수의 제거비율에 따라서 미네랄 성분이 종 류별로 특이하게 농축되는 효과를 나타내는 것으로 보이며 따라서 본 연구결과로 제조되는 소금은 GABA와 함께 특정 미네랄의 함량이 특이적으로 높은 특징을 보유하게 된다.
광학현미경을 사용하여 소금 g당 20 mg의 GABA가 함 유된 소금을 400배의 배율로 관찰한 결과를 Fig. 2에 나타 내었다. 기본적인 결정의 형태를 나타내기는 하였으나 정 제염 등에서 찾아볼 수 있는 육각형의 결정은 관찰되지 않 았다. 결정화 공정 중에 NaCl 이외에 고농도로 존재하는 다양한 염류의 간섭으로 결정화를 진행하는 과정 중 일부 형태의 변화가 있었던 것으로 판단되며 이는 정제염과 달 리 천일염의 경우 결정구조의 핵이 중복되면서 겹을 이루 고 있었다는 Ha & Park (1998)의 연구결과와 일치한다. 또한 간수와 불순물을 제거한 천일염을 재결정화시킨 경우 에도 Han (1999)의 보고와 같이 정육면체의 결정구조를 찾아보기 어려웠다는 Lee & Kim (2008)의 결과를 고려할 경우 소금의 결정형태를 결정하는 데는 결정화 공정에서 존재하는 NaCl이외의 염류의 농도 이외에도 다른 요소가 관여하는 것으로 판단된다. 반면 별도의 이물질 형태로 존 재하는 입자는 관찰되지 않아 GABA 함유 배양액이 소금 에 흡착되는 형태로 함께 결정화가 진행된 것으로 판단되 며 이는 전자현미경을 이용한 표면 관찰에서도 확인이 되 었는데(Fig. 3) 일반 염전에서 결정화 공정을 거쳐 시판 중 인 소금과 비교하여 외관상 특별한 차이점을 나타내지 않 았으며 소금과 GABA의 결정화가 분리되거나 별도의 성분 별로 과립화가 발생하는 현상은 나타나지 않았다.

요 약
해양심층수에서 담수가 제거된 염수와 유산균에 의하여 생산된 GABA 함유 배양액을 혼합하여 GABA가 함유된 소금을 제조하였다. 담수가 제거된 염수에는 일반 소금과 비교하여 나트륨의 함량은 낮았으나 칼슘, 칼륨, 마그네슘 함량은 상대적으로 높은 것을 알 수 있었다. 미강의 열수 추출물에 탄소원과 질소원을 일부 보강하여 제조한 상업용 저가배지에 6%의 MSG와 5%의 glutamic acid를 배지 중 에 첨가하여 발효를 진행한 결과 72시간 후 MSG는 100% 의 전환률을 나타내고 glutamic acid는 90% 수준의 전환률 을 나타내어 3% 이상의 GABA가 함유된 발효액을 얻을 수 있었으며 활성탄을 이용하여 탈색을 진행하여 투명한 액을 얻을 수 있었다. 탈색된 배양액과 염수를 사용하여 결정화를 진행하였다. 염수와 다양한 농도의 GABA가 함 유된 배양액을 혼합하여 결정화를 시킨 결과 배양액 중에 함유된 GABA가 결정화 후 대부분 소금에 흡착된 것으로 분석되었으며 염전에서 생산되어 시판되는 소금과 광학현 미경과 전자현미경을 통한 외관 및 표면관찰을 통해서는 차이점을 찾을 수 없었다. 특히 첨가된 GABA성분과의 분 리 및 별도로 과립화되는 현상은 나타나지 않아 GABA가 함유된 배양액과 염수를 혼합하여 결정화함으로써 GABA 가 함유된 소금을 제조할 수 있다는 사실을 확인하였다.
