서 론
우리나라에서 생산되는 토마토는 대부분 생과(fresh tomatoes) 형태로 소비되고 있으며, 일부분만이 주스나 토 마토 케첩 등으로 가공되고 있다. 유통중인 주스는 가열처 리나 산성화하지 않은 그대로의 주스, 유기산을 첨가하여 산성화시킨 주스, 가열 살균한 주스, 발효에 의한 고산성인 주스 등으로 구분하며(Lee et al., 1995), 또한 가공방법에 따라 혼탁 주스와 청징 주스로 나뉘는데, 청징 주스의 경 우는 착즙 후에 주스에 함유된 혼탁 부유물질을 여과에 의 해 제거하는 비효소적 청징 방법과 효소로 분해하는 청징 방법이 활용되고 있다(Kim et al., 1989; Ko et al., 1999).
토마토 박(tomato pomaces)은 토마토 주스 및 케첩 가공 공정의 펄퍼(pulper) 처리단계에서 부산물로 발생하고 있으 며, 토마토 박에는 토마토 펄프와 씨가 함유되어 식이섬유 가 풍부하다. Rao (1991)는 토마토 박에 단백질, 인, 칼슘, 마그네슘이 풍부할 뿐만 아니라 식이섬유도 풍부하게 함유 되어 있다고 보고하였으며 동물사료에 좋은 영양과 기능성 을 제공해 준다고 제시하고 있다. Koh et al. (2012)은 토 마토 박에는 식이섬유가 약 24% 함유되어 있으며, 이 중 중성세제불용성 섬유소(neutral detergent fiber, NDF) 및 산 성세제불용성 섬유소(acid detergent fiber, ADF)가 각각 24.04% 및 41.02% (d.b.)로 존재하며, 그 외 단백질이 2.54%, 미네랄이 10.8% (d.b.)가 함유되어 있다고 보고하였 다. 토마토 박의 영양성분 보고에도 불구하고, 토마토 박의 가공과 관련된 연구는 극히 한정되어 있으며. 토마토 박의 활용에 대한 연구는 거의 없는 실정이다.
펙틴은 인체내 소화효소에 의해 분해되지 않는 식이섬유 로서 식물조직에서는 세포벽 또는 세포벽 사이에 존재하는 얇은 층에 주로 존재하며, 세포벽 내부 또는 세포의 사이 를 결착시키는 물질로 알려져 있다(McNeil et al., 1984). 펙 틴은 유가공, 육가공 및 제과 제빵 제품 등에 물성 개량제로 서(May, 1990), 아이스크림 및 치즈 제조 등에 지방 대체제 로서 이용되고 있다(식품산업편집부, 1993). 펙틴은 인체의 혈중 콜레스테롤 저하, 포도당 과민성(glucose intolerance) 감소 등의 생리활성이 밝혀지고 있어 관심의 대상이 되고 있다(Yamada, 1994). Nishina et al. (1991)은 검류(gums)를 비롯한 수용성 식이섬유가 혈청 또는 간에서의 콜레스테롤 농도를 낮추는데 효능이 있다고 보고하였으며, Cho et al. (2007)과 Patil et al. (2004)은 결명자 씨로부터 분리한 수용 성 식이섬유가 콜레스테롤을 낮추는 효과가 있다고 발표하 였다. Silaste et al. (2007)은 토마토 주스가 LDL-콜레스테 롤을 감소시키는 결과를 발표하였으며, Friedman et al. (2000)도 지방 제한 식이에서 수용성 식이섬유의 혈청 내의 지질저하 효과로 혈청 콜레스테롤 수치가 약 20-30% 감소 하였다고 보고하였다.
산을 이용한 펙틴의 화학적 처리방법이 환경적 문제점으 로 대두되어 효소를 이용한 처리방법에 대한 연구가 다양하 게 이루어지고 있다(Hur et al., 1989; Sohn et al., 2002). 국내에서 효소를 주스 제조에 적용한 연구로는 Hur et al. (1989)이 polygalacturonase을 사용하여 과실 주스를 청징한 연구, Jeong et al. (1999)이 pectinase를 이용하여 감식초을 청징한 연구, Sohn et al. (2002)이 pectinase로 혼합과채 주 스 가공에 적용한 연구 등을 들 수 있다. 그 외 효소를 식 이섬유 분해에 적용한 연구로는, Cho (1996)가 hemicellulase 를 사용하여 사과 세포벽 추출에 적용한 연구, Choi et al. (2000)이 cellulase, hemicaellulase, amyloglucosidase와 산업 용 효소제품인 Econase®을 사용하여 사과 펙틴의 특성을 비교 연구한 사례가 있다.
따라서, 본 연구에서는 토마토 주스 제조공정에서 부산 물로 발생하는 토마토 박을 식품 자원으로 활용하기 위하 여 토마토 박의 화학적 특성을 파악하고, 토마토 박 펙틴 의 효율적 가수분해에 적합한 산업적 펙틴 효소의 선정과 선정된 효소의 반응 조건을 설정하고자 하였다.
재료 및 방법
본 실험에 사용한 토마토(Lycopersicon esculentum)는 국 내에서 재배되는 중·소 크기의 150-200 g의 완숙 토마토였 으며, 산업용 펙틴분해효소는 Novozymes사(Bagsvaerd, Denmark)의 제품을 사용하였다. 표준 리코펜(lycopene)은 Sigma사(L9879, St. Louis, MO, USA)의 것을 사용하였으 며, 이외 본 연구에 사용한 시약과 유기용매는 분석시약 등급을 사용하였다.
총 리코펜(lycopene) 함량은 Kozukue와 Friedman (2003) 이 개발한 분광광도법으로 측정하여 계산하였다. 즉, 균질 화된 시료를 합성 항산화제가 첨가된 추출용매(헥산:아세톤 :메탄올=50:25:25, v/v/v)로 추출하고, 헥산 층을 회수하여 분광광도계(Perkin Elmer UV/VIS Lambd35)를 이용하여 470 nm에서 흡광도를 측정하고 표준 리코펜의 표준곡선과 표준식에 의하여 계산하였다. 총 고형분 함량은 105°C 건 조기를 이용하여 건조중량으로 계산하였으며, 단백질 및 식이섬유 등의 일반성분은 AOAC (1990)의 표준분석법에 준하여 실시하였다. 시료의 pH 측정은 증류수로 시료를 희 석하고 30초간 격렬하게 균질화한 후에 여과지(Wattman No.4)로 여과한 여과액을 pH meter (model 420A, Orion, USA)를 사용하여 측정하였다.
토마토 박(tomato pomace)은 구입한 완숙 토마토를 수세 및 꼭지 제거를 한 후 100°C 스팀에서 5분간 처리하고, Koh et al. (2010)의 방법에 따라 펄퍼(pulper; AG-5500, Angel Juicer Co., Pusan, Korea)로 처리하여 씨를 포함한 박을 분리 회수하여 동결 건조하여 제조하였다. 이후에 1.0 mm 메쉬 망이 부착된 분쇄기(Cyclote 1093 Sample Mill, Tecator AB, Hoganas, Sweden)로 분쇄하고 40-80 메쉬 입 자를 회수하여 냉동 보관하면서 본 실험에 시료로 사용하 였다.
토마토 박으로부터 물-알코올 불용성 펙틴(water-alcohol insoluble pectins, WAIP)의 제조는 건조 토마토 박을 50배 의 증류수와 혼합하여 균질기(D-500, Wiggen Hauser, Berlin, Germany)로 1분간 균질화한 후, 여과포로 여과하여 얻어진 고형물을 10배의 에탄올에 현탁시키고 수조(water bath)에서 20분간 끓인 후 고형물을 회수하고, 에탄올과 아 세톤으로 다시 세척한 다음에 60°C의 진공 조건으로 건조 하여 Tomato Pomace-WAIP를 제조하였다.
제조된 Tomato Pomace-WAIP으로부터 가수분해 펙틴의 추출에는 선별된 Novozymes사의 β-glucanase 활성을 갖는 Viscozyme L (효소기원: Aspergillus aculeatus; 100 FGB/g; 1.21 g/mL)과, polygalacturonase 활성의 Pectinex BE 3L (효 소기원: Aspergillus aculeatus 및 Aspergillus niger; 3000 PECTU/mL, 20,000MOU/mL; 1.17 g/mL), Pectinex AFP L4(효소기원: Aspergillus aculeatus 및 Aspergillus niger; 4,500 PECTU/mL; 1.16 g/mL) 및 Citrozym Ultra L (효소기 원: Aspergillus aculeatus 및 Aspergillus niger; 4,500 PECTU/ mL; 1.15 g/mL)을 1% (v/v) 효소용액으로 제조한 후 실험 에 사용하였다.
WAIP에서 펙틴의 효소분해 추출과정은 Choi (1996)가 제시한 방법과 같이 WAIP를 증류수에 현탁시킨 후 최적 의 반응조건을 선정하기 위하여 효소 용액의 첨가량, 반응 온도 및 반응시간을 각각 달리하여 실시하였다. 즉, Tomato Pomace-WAIP는 선정된 효소의 최적온도에서 150 rpm으로 120분간 효소반응을 시킨 후 4°C의 조건에서 15분간 8,000 rpm으로 원심 분리하여 상등액을 회수하고, 이를 100°C에서 10분간 가열 처리한 후 교반하면서 70% (v/v) 아세톤을 첨가하고 여과하여 얻은 수용성 다당 성분 을 회수하여 60°C에서 하루 동안 건조하여 얻은 것을 시 료로 사용하였다.
효소 추출에의한 수용성 다당류의 수율은 Tomato Pomace WAIP의 건조 중량에 대한 수용성 다당류의 건조 중량의 백분율로 표시하였다.
펙틴의 주골격은 폴리갈락투론산(poly-galacturonic acid) 으로 Tomato Pomace-WAIP의 효소처리에 의한 수용성 다 당류의 펙틴은 무수갈락투론산(anhydrogalacturonic acid, AGA) 함량으로 계산하였다. 무수갈락투론산 함량의 측정 은 Blumenkrantz와 Asboe-Hansen (1973)가 소개한 mhyroxyldiphenyl법에 준하여 실시하였다. 즉, 펙틴 용액 0.5 mL을 준비하여 얼음-물의 저온수조에서 5분간 냉각한 후 에 A 용액(0.0125M sodium tetraborate in concentrated sulfuric acid) 3 mL을 첨가하여 30초간 격렬하게 교반하고 100°C에서 5분간 가열한 이후에 저온수조에서 5분간 냉각 시켰다. 이후 B 용액(0.15% (w/v) m-hydroxydiphenyl in 0.5% (w/v) sodium hydroxide) 0.05 mL을 첨가하여 30초 간 격렬하게 교반시키고 20분 후에 520 nm에서 흡광도을 측정하여, 표준 갈락투론산 농도(1-100 mg/L)의 표준곡선과 관계식(y=64.743X+0.3353, R2=0.9989)에 의거하여 계산하 였다.
Tomato Pomace-WAIP의 효소처리를 하여 얻은 수용성 펙틴의 수율 측정은 증류수를 사용하여 Tomato Pomace- WAIP 용액을 제조하였으며, Novozymes사의 Viscozyme L, Pectinex BE 3L, Pectinex AFP L4 및 Citrozym Ultra L을 각각 1% (v/v) 효소용액으로 제조한 후 1 g의 Tomato Pomace-WAIP 분말 기준에 각 0.5 mL씩 첨가하였고, 최적 반응온도는 Viscozyme L을 포함하여 Pectinex BE 3L 및 Pectinex AFP L4의 경우는 50°C에서, Citrozyme Ultra L 의 경우는 35°C에서 3시간 동안 반응을 실시하여 수율을 계산하였다. Tomato Pomace-WAIP에 효소처리를 하여 생 성된 AGA 함량 측정은 1% (w/v) Tomato Pomace-WAIP 용액에 1% (v/v)의 효소 용액을 각각 2% (v/v)로 첨가하 여 3시간 동안 반응시켜 얻은 수용성 펙틴을 사용하여 계 산하였다.
Tomato Pomace-WAIP의 효소처리에 의한 수용성 다당류 의 프럭토즈(fructose) 측정은 건조 분말 시료에 가온한 증 류수를 가하여 1 mg/mL의 용액으로 만들고 0.2 μm 실린지 필터(syringe filter)로 여과한 것을 시료로 사용하였으며, 프 럭토즈 함량은 프럭토즈가 hexokinase (HK), phosphoglucose isomerase (PGI)와 glucose-6-phosphate dehydrogenase (G6PDH) 에 의해 D-gluconate-6-phasphate로 전환되면서 NADP+ 가 NADPH로 환원된 양을 340 nm에서 측정하는 UV법으 로 계산하였다(Steegmans et al., 2004).
결과 및 고찰
신선 토마토를 세척과 탈수 단계까지 전처리 하고 주스 가공하는 경우와 토마토를 100°C에서 5분간 스팀처리 하 는 전처리 단계까지를 포함하여 가공하는 경우에 얻어진 토마토 박의 수율은 각각 22.8%와 19.9% (w.b.)로 나타났 다. Table 1에 나타난 바와 같이, 토마토 주스와 토마토 박 의 고형물의 함량은 각각 7.15% (w.b.)와 8.84% (w.b.)였 으며, 토마토 박의 리코펜 함량은 각각138.7와 188.2 μg/g (w.b.)이었다. 이는 본 연구진이 선행연구에서 보고한 토마 토의 스팀처리에 의해 토마토 리코펜 함량이 88 μg/g에서 113 μg/g (w.b.)으로 증가한 결과와도 일치하였다(Koh et al., 2010).
Rao (1991)는 토마토 seed cake의 일반성분을 분석한 결 과, 조단백은 31.2%, 조지방은 21.5%, 회분은 4.7%, 조섬 유는 20.8%로 분석되었다고 보고하였다. 본 연구에서 생산 한 토마토 박은 조단백과 조지방 함량은 각각 14.6%와 1.9% (d.b.)로 Rao의 보고에 비해 낮았지만, 조섬유 함량은 33.9% (d.b.)로 현저히 높은 함량을 나타내었다. 또한, 스팀 처리된 토마토 박의 식이섬유의 함량은 토마토 주스에 비 해 약 2배 수준으로 분석되어, 토마토 박이 식이섬유 원으 로서의 충분한 가치가 있다고 판단되었다. 증류수와 혼합· 처리하여 얻은 토마토 박의 불용성 부분을 다시 에틸알코 올로 처리하여 불용성 부분으로 회수된 물-알코올 불용성 펙틴(Water-Alcohol Insoluble Pectins)인 Tomato Pomace- WAIP의 수율은 42.75% (d.b.)로 나타났다.
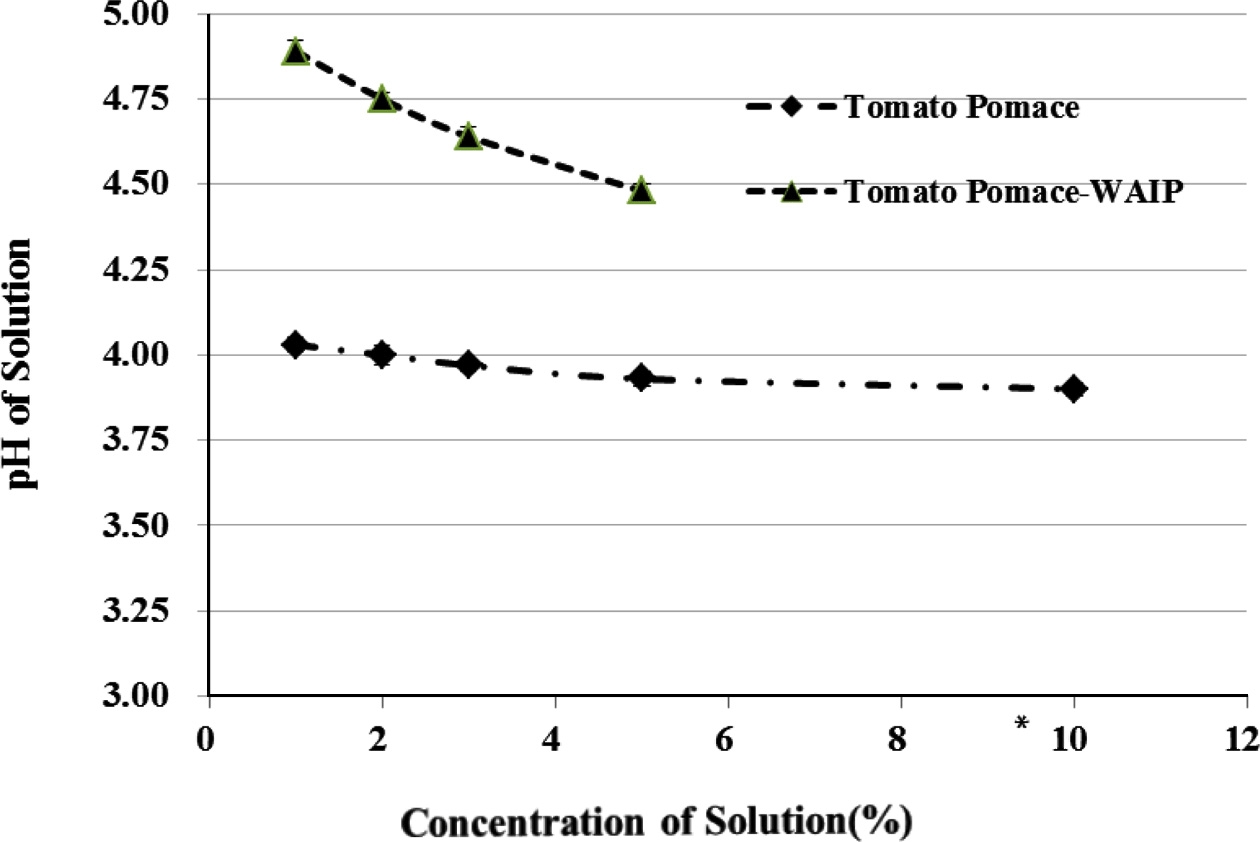
토마토 박 및 토마토 박으로부터 제조한 Tomato Pomace- WAIP를 1-10% (w/v)까지의 함량이 되도록 수용액을 제조 하였을 때의 pH는 Fig. 1과 같이, 토마토 박의 경우는 pH 가 4.00에서 3.90로 농도에 의한 pH변화가 미미하였다. 반 면, Tomato Pomace-WAIP의 경우 토마토 박에 비해 상대 적으로 높은 pH를 보였으며, WAIP 농도가 증가함에 따라 pH가 4.89에서 4.48로 감소하는 경향을 나타냈다. Tomato Pomace-WAIP는 짧은 시간 내에 수분과 흡수반응을 일으 켜 5% (w/v) 첨가수준까지는 전체적으로 수용화 또는 겔 화가 형성되었지만 그 이상의 함량에서는 전체적으로 겔화 가 진행되지 않아서 10% (w/v) 이상에서는 pH의 측정이 불가능 하였다. Table 2
| Crude Fiber (%) | Crude ash (%) | Crude protein (%) | Crude lipid (%) | Tomato Pomace-WAIP* (%) | |
|---|---|---|---|---|---|
| Pomace | 33.9 | 4.7 | 14.6 | 1.9 | 42.75±0.75 |
| Juice | 16.6 | 5.6 | 21.4 | 1.5 | - |
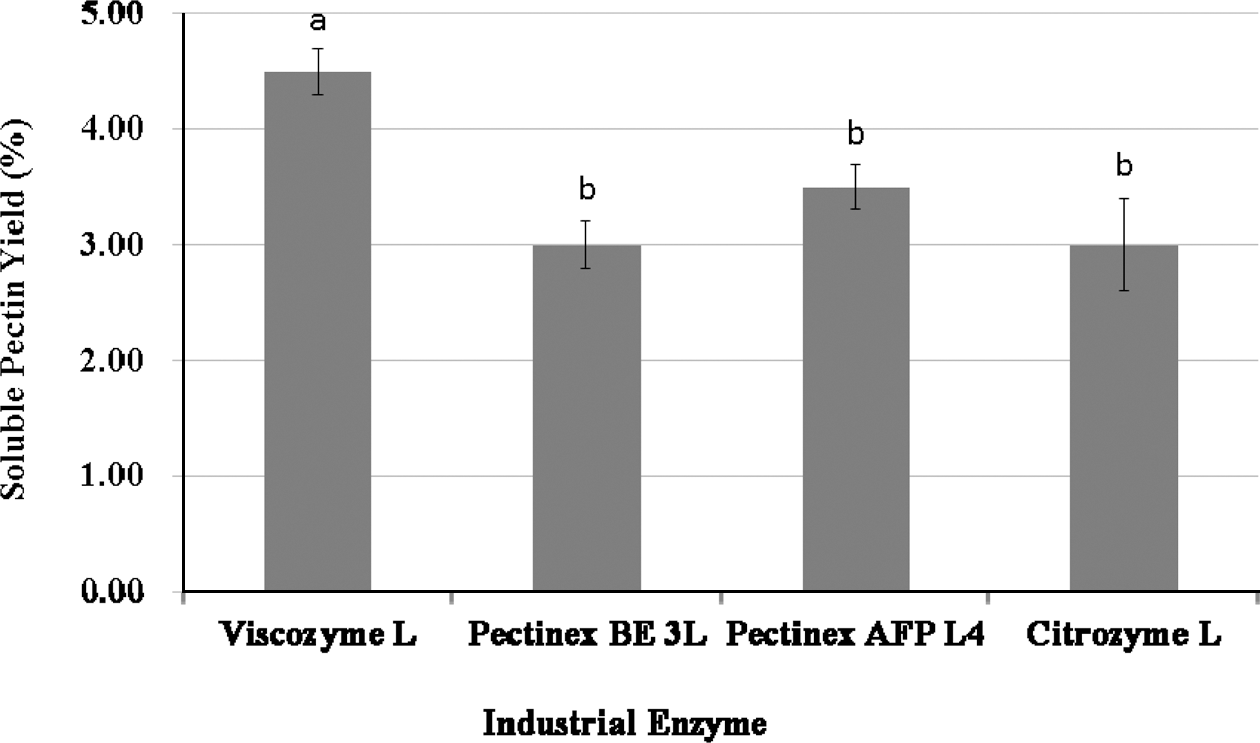
수용성 펙틴의 제조에 적합한 선행 실험으로부터 선정된 산업효소 중에서 Novozymes사의 Viscozyme L, Pectinex BE 3L, Pectinex AFP L4 및 Citrozym Ultra L가 사용되 었으며, 1% (w/v) Tomato Pomace-WAIP용액에 각 1% (v/ v) 효소용액을 0.5mL 씩 첨가하여 최적 반응온도에서 3시 간 동안 반응하여 얻은 수용성 펙틴의 수율은 Viscozyme L의 경우는 4.5% (p<0.05), Pectinex AFP L4의 경우는 3.5%, Pectinex AFP L4 및 Citrozym Ultra L의 경우는 3.0% (d.b.) 수준이었다(Fig. 2). 따라서, 통계적으로 가장 높은 수율을 나타낸 Viscozyme L이 다른 산업효소제품보 다는 적합한 것으로 판단되었다.
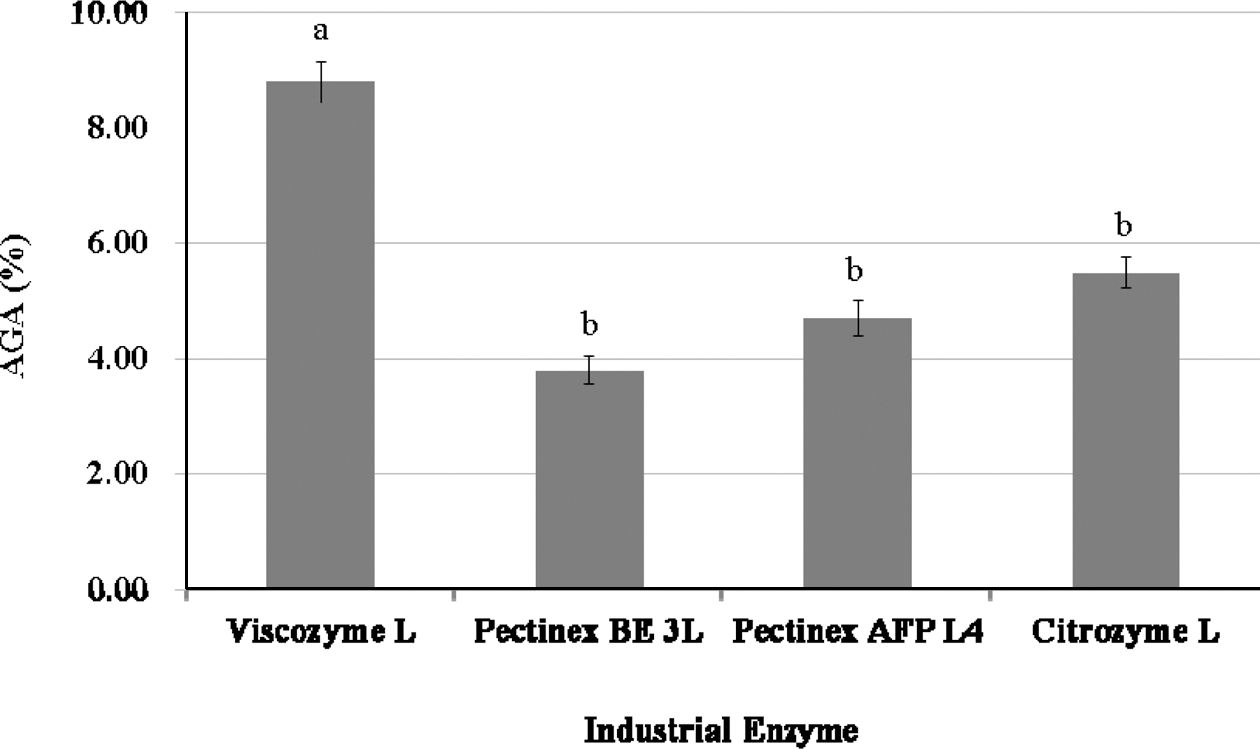
Tomato Pomace-WAIP에 효소처리를 하여 생성된 anhydrogalacturonic acid (AGA)의 함량은 Fig. 3에 나타난 바와 같이 Viscozyme L의 처리 시 8.80% (d.b.)로 가장 높았으며, Citrozym Ultra L로 처리한 경우의 AGA 함량 5.50% (d.b.) 보다 약 1.6배 높은 결과를 보였다. 또한 Pectinex AFP L-4 처리의 경우는 4.70%, Pectinex BE 3-L 처리의 경우는 3.80% (d.b.)를 보여, Viscozyme L이 AGA 함량을 위해서도 가장 적합한 효소로 판명되었다.
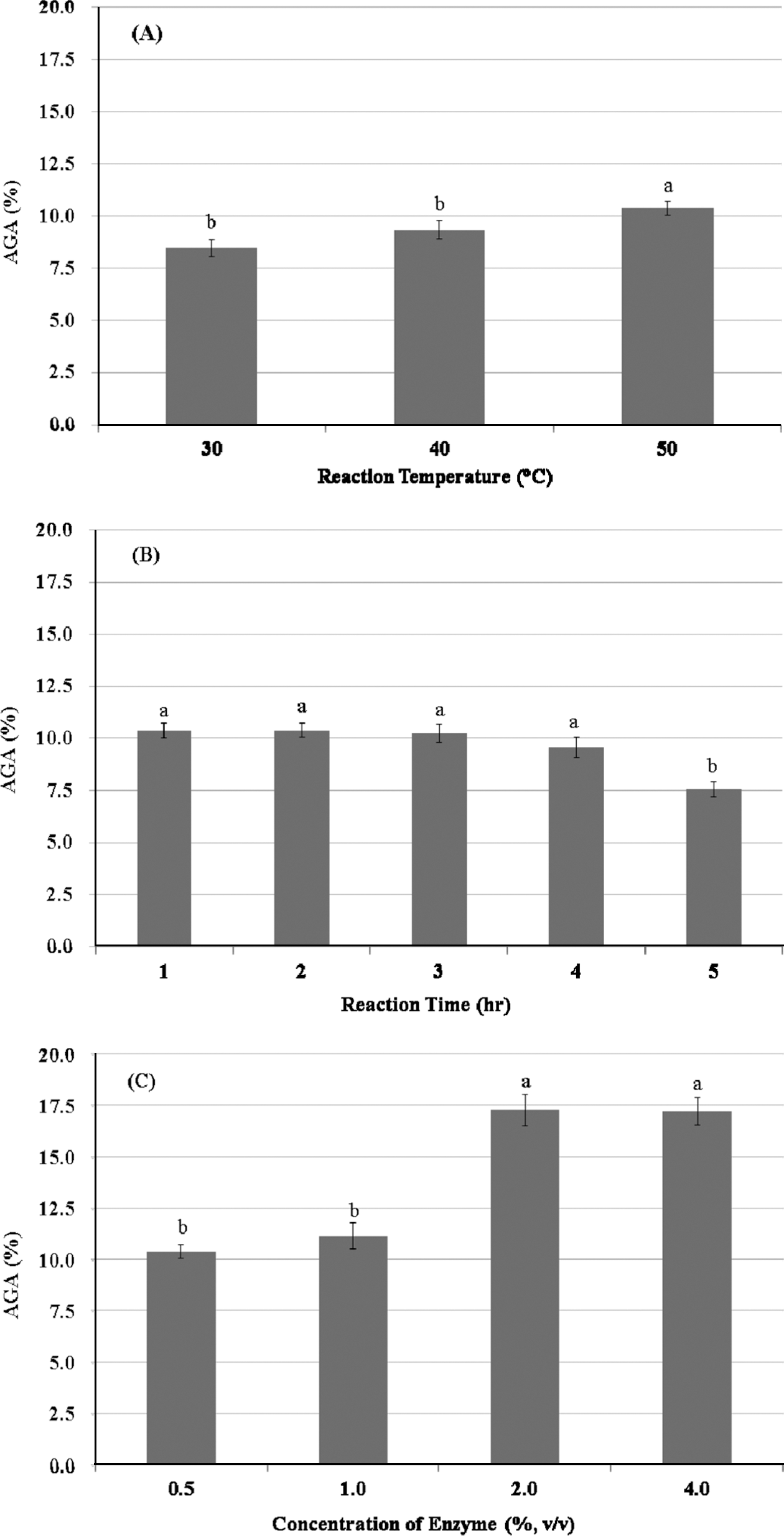
Tomato Pomace-WAIP처리에 가장 적합한 산업용 펙틴분 해효소로 선정된 Viscozyme L에 대하여 효소 반응온도, 반응시간 및 효소첨가량에 대하여 조사하였다. 최적 반응 온도는 30°C, 40°C 및 50°C 조건에서 0.1% (w/v)의 Tomato Pomace-WAIP 용액에 대하여 1% (v/v) Viscozyme L 효소용액을 0.5% (v/v)로 첨가하여 2시간 동안 반응하여 얻은 AGA 함량으로 판단한 결과, Fig. 4(A)에서와 같이 통계적으로 가장 높은 AGA 함량인 10.38% (d.b.)를 보인 50°C로 판명되었다(p<0.05). 선정된 50°C 온도에서 Tomato Pomace-WAIP 용액에 대한 Viscozyme L 효소용액을 첨가 하여 1-5시간 동안 반응하여 얻은 AGA 함량은 Fig. 4(B) 에서와 같이 통계적으로 유의한 결과를 보이지는 않았으나 , 2시간 반응조건에서 가장 높은 AGA 함량을 나타내어, 2 시간 반응을 최적 반응시간으로 결정하였다. 계속하여, 50°C에서 2시간의 반응 조건에서의 Tomato Pomace-WAIP 용액에 대하여 Viscozyme L 효소용액을 0.5-4.0% (v/v)로 되도록 첨가하여 가수분해하여 얻은 AGA 함량은 Fig. 4(C)에서와 같이 1% (v/v) Viscozyme L 용액을 2.0% (v/ v)로 첨가하였을 때, 통계적으로 유의한 17.3% (d.b.)의 AGA 함량을 보였다(p<0.05). 따라서, 본 연구에서 사용된 산업용 펙틴분해요소인 Viscozyme L의 최적 반응조건은 2.0% (v/v) 효소농도를 가하여 50°C에서 2시간 반응으로 결정되었다. 또한, 최적 반응조건에서 처리된 Tomato Pomace-WAIP의 프럭토즈 함량은 약 18 mg/g (d.b.)으로 조사되었다.
요 약
토마토 주스의 가공제조공정에서 부산물로 발생하는 토 마토 박을 식품자재로 활용하기 위한 목적으로 가공에 적 합한 산업용 펙틴효소의 선정과 그 효소의 처리 조건을 구 명하고자 본 연구를 실시하였다. 생 토마토의 100°C에서 5 분 간 스팀처리는 처리하지 않은 대조구에 비해 토마토 박 의 수율과 리코펜의 함량이 증가하여 토마토 박 가공에 적 합한 전처리로 판명되었다. 토마토 박의 물-알코올 불용성 펙틴(Tomato Pomace-WAIP)의 수율은 약 42.8% (d.b.)의 이었으며, Tomato Pomace-WAIP의 효소처리에 따른 수용성 펙틴 수율과 AGA 함량은 산업용 효소 중에서 Viscozyme L를 처리한 경우에 가장 높아, Viscozyme L을 토마토 박 생산에 적합한 효소로 선정하였다. Viscozyme L의 Tomato Pomace-WAIP (0.1%, w/v) 생산을 위한 최적 반응조건을 검토한 결과, 반응온도 및 반응시간은 각각 50°C와 2시간 이었으며, 최종 효소농도는 0.02% (v/v)로 판명되었다. 최 적 효소 반응조건에서 생산된 Tomato Pomace-WAIP의 AGA 및 프럭토즈 함량은 각각 17.26%와 18 mg/g (d.b.)의 을 나타내었다.