서 론
과일과 채소는 자연에서 얻기 쉬우며, 건강을 유지하기 위해 필요한 영양분(미네랄, 비타민, 항산화물질, 섬유질 등 )을 함유하고 있다. 하지만 과일을 이용한 제품들은 미생물 에 의해서 변패가 일어나기 쉬우며, 효소에 의해서 갈변현 상이 일어나고 이취를 발생하는 문제점을 가지고 있다. 이 러한 현상을 막고 오랜 기간 동안 보관하기 위해서 과일들 은 주로 잼이나 주스의 형태로 소비되어왔다(Chakraborty et al., 2014).
일반적으로 과일에는 효소와 기질이 분리돼 있으나, 착 즙 과정에 의해서 분리돼 있던 효소와 기질이 반응하여 갈 변현상을 초래하고 주스의 탁도와 점도를 증가시킨다. 가 공된 과일제품에 영향을 미치는 효소는 polyphenol oxidase (PPO)와 peroxidase (POD)가 있으며, 이들은 갈변 현상을 초래하고, 이취를 생성하며, 비타민의 손실을 초래 한다(Zhong et al., 2007). PPO는 산소의 존재 하에 페놀 화합물을 감소시키는 촉매작용을 한다. 예를 들어 PPO는 o-diphenol를 산화시켜 o-quinones의 형태로 만들고, 생성된 o-quinones은 다른 o-quinones과 중합되어 brown pigments 를 생성하여 제품에 원하지 않던 갈변현상을 일으키고, 이 취를 발생시킨다(Sulaiman & Silva, 2013). POD는 식물 효소로서 자연계에 넓게 분포되어 있으며, 과일의 색의 손 실과 텍스쳐의 변화를 초래하고, 식물에 따라 또는 이성질 체에 따라 공유결합된 당질의 양이 다르게 분포한다(Połata et al., 2009). POD의 경우 열에 매우 안정적인 특성을 가 지고, 이러한 특성을 이용하여 채소의 열처리가 효과적으 로 되었는지 알아보는 지표로 사용되고 있다(Yemenicioğlu et al., 1998; Thongsooksf & Barrett, 2005).
PPO와 POD를 불활성 시키기 위해서 일반적으로 가열 처리를 많이 사용하고 있다. 가열처리는 효과적으로 미생 물을 살균하고 효소를 불활성 시킬 수 있지만, 가열처리에 의해서 색과 맛에 변화를 일으키며 비타민, 항산화물질 등 과 같은 영양소의 감소를 초래한다(Weemaes et al., 1998). 하지만 소비자들은 영양소도 풍부하게 함유되어있고 외관 상으로도 실제의 과일과 동일한 상태의 제품들을 선호하고 있다. 이에 맞춰 열을 이용하지 않고 가공 처리가 가능한 high voltage pulsed electric fields (PEF), high pressure homogenization (HPH), ultraviolet light (UV), high hydrostatic pressure (HHP) 등 과 같은 많은 비가열 처리 기술의 연구 가 활발히 진행되고 있다(Welti-Chanes et al., 2009; Sonne et al., 2012; Pala & Toklucu 2013). 비가열 처리 중 HHP 처리는 100-1,000 MPa까지의 영역에서 처리가 가능하며, 상온에서 처리가 가능하다는 장점을 가지고 있다(Patterson, 2005). 초고압 기술이 처리과정상 영양소의 파괴를 최소화 하고, 미생물을 살균하며, 새로운 식감의 물질을 만들어 낸 다는 장점은 수많은 논문들을 통해 증명되어왔다(Hendrickx et al., 1998; Matser et al., 2004; Oey et al., 2008a; Oey et al., 2008b). 따라서 본 연구에서는 최근 많 이 상용화되고 있는 비가열처리 과일주스 제조공정에 도움 을 주고자 감귤 및 사과주스에 존재하는 PPO와 POD를 비가열처리방법인 초고압 처리와 일반적인 열처리에 의해 서 불활성화시키고 이들의 동역학을 연구하였다.
재료 및 방법
본 실험에 사용된 감귤과 사과는 재래시장에서 구입하여 사용하였으며, catechol, p-phenylenediamine은 Sigma-Aldrich Co. Ltd. (St. Louis, MO, USA), hydrogen peroxide와 sodium phosphate monobasic anhydrous는 Daejung Co. Ltd. (Shiheung, Korea), sodium phosphate dibasic anhydrous은 Duksan Pure Chemicals Co., Ltd. (Incheon, Korea)에서 구 입하여 사용하였다.
감귤은 껍질을 벗기고 사과는 껍질을 벗기지 않은 상태 로 Tefal사의 믹서기(BL3051, Zhejiang Shaoxing Supor Domestic Electrical Appliance Co., Ltd., Beijing, China)를 이용하여 분쇄하여 추출물을 얻었다. 상업적으로 판매되는 비가열처리 혼탁주스와 동일한 조건으로 실험을 하기 위해 침전 여과 과정을 거치지 않고 열처리와 비가열처리(HHP) 에 사용하였다. 가열처리는 항온수조(HB-205SW, Hanbaek Co. Ltd. Seoul, Korea)를 이용하여 70, 80, 90°C로 2.5, 5, 7.5, 10, 20, 30분 동안 처리하였고, 비가열처리는 초고압 장 치(ISA-CIP-80-50-270, Ilshin autoClave. Co. Ltd, Daejeon, Korea)를 이용하여 100, 300, 500MPa로 10, 20, 30, 40, 50, 60분 동안 처리하였다. 가공처리가 끝난 후 침전 여과 과정을 거친 다음 PPO와 POD의 활성을 측정하였다.
PPO의 활성은 Terefe et al. (2010)의 방법을 이용하여 측정하였다. 추출액 0.075 mL과 0.07 M catechol 3.0 mL을 혼합하여 25°C에서 420 nm의 흡광도를 측정하였다. POD 의 활성은 Cano et al. (1990)의 방법을 이용하여 측정하였 다. 추출액 0.025 mL과 0.05M sodium phosphate buffer 2.7 mL, 1% (w/v) p-phenylenediamine 0.2 mL, 1.5% (w/v) hydrogen peroxide 0.1 mL을 혼합하여, 25°C에서 485 nm의 흡광도를 측정하였다.
상대활성은 식 (1)을 이용하여 계산하였고, 반응속도상수 는 식 (2)를, 활성화에너지는 식 (3)을 이용하여 구하였다 (Nienaber & Shellhammer, 2001; Ly-Nguyen et al., 2003).
여기서, At는 일정시간 후의 효소의 상대활성, A0는 초기 효소의 상대활성, k는 반응속도상수, t는 시간, Ea는 활성화 에너지, RT는 일정온도에서의 기체상수, T는 절대온도를 나타낸다.
결과 및 고찰
추출한 감귤 주스에 초고압을 가하여 갈변현상의 원인이 되는 PPO와 POD의 활성 변화를 측정한 결과를 Fig. 1에 나타내었다. POD는 500 MPa로 처리를 하였을 때 최대 40% 불활성화 되었으며, 100, 300MPa에서는 각각 40, 20 분 구간에서 활성이 증가하였다. 오렌지 주스의 POD는 450 MPa에서 최대 25% 불활성화 되었고, 32°C에서 400 MPa 의 조건으로 처리하였을 때는 50%가 불활성화되어 최대의 효과를 얻을 수 있었다고 보고하였으며(Cano et al., 1997), 토마토의 POD는 상온에서 350MPa의 조건으로 처리했을 때 활성이 증가하였고, 350MPa 이상으로 처리해야 불활 성화되는 경향을 보였으며, 더 높은 압력(400-500 MPa)과 더 높은 온도(30-60°C)에서는 오히려 활성이 증가하였다고 보고하였다(Hernández & Cano, 1998). 펩타이드의 헬리컬 구조를 유지하는 수소 결합은 높은 압력에서 파괴되지만, 낮은 압력에서는 오히려 강해진다고 알려져 있다(Balny & Masson, 1993). 따라서 500 MPa의 높은 압력에서는 2차 구조가 일부 파괴되면서 원상태로 되돌아올 수 없는 구조 로 변성이 일어나므로 불활성화가 일어났고, 비교적 낮은 압력 조건인 100, 300MPa에서는 2차 구조가 파괴되지 않 고 구조가 더욱 강해졌기 때문에 부분적으로 활성이 높아 진 것으로 생각할 수 있다.

감귤 주스의 PPO는 전체적으로 불활성화시키기 어려웠 으며, 500 MPa로 처리하였을 때 최대 10%의 불활성화 정 도를 보였다. PPO는 POD에 비해 상대적으로 불활성화시 키기 어려웠으므로 압력에 대해서 내성을 가지는 것을 알 수 있었다. 딸기의 PPO는 200 MPa로 15분간 처리하였을 때 약 20% 불활성화 되었고, 600MPa로 처리하였을 때는 약 80%가 불활성화 되었다고 하였으며(Sulaiman & Silva, 2013), 상온에서 500 MPa로 처리를 하였을 때 활성을 유 지하였고 그 이상의 압력에서 불활성화 되기 시작하여 800MPa로 처리하였을 때는 95% 활성이 떨어지는 결과를 보였다고 보고하였다(Dalmadi et al., 2006). 본 연구에서는 실험기기 상의 한계로 500MPa 이상으로 처리를 할 수 없 었기 때문에 PPO의 불활성화 정도에 큰 영향을 주지 않은 것으로 판단된다.
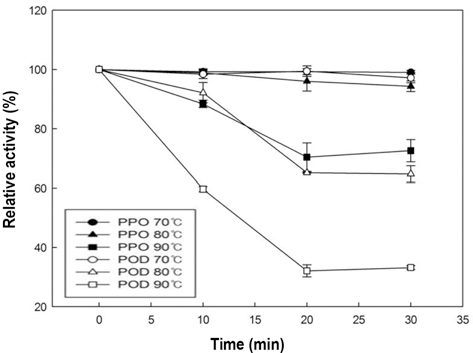
가열처리에 의한 감귤주스 PPO와 POD의 불활성화 정 도를 Fig. 2에 나타내었다. 전반적으로 가열처리가 초고압 처리 보다 더 효과적으로 두 효소를 불활성 시킬 수 있었 다. POD의 경우 온도가 상승함에 따라 불활성화도는 감소 하는 경향을 보였으며, 90°C로 처리하였을 때 약 80% 불 활성화 되는 것을 확인 할 수 있었다. 한편 PPO는 초고압 처리 결과와 비슷하게 POD 보다 상대적으로 열에 대해서 도 내성을 가졌지만 초고압 처리보다는 상대적으로 높은 불활성화도(20%)를 나타내었다. 브로콜리 POD의 경우 열 처리를 하였을 때, 온도가 증가 함에 따라 활성이 떨어졌 고, 최대 80%의 불활성도를 보고하였다(Thongsook & Barrett, 2005). 당근 주스 POD의 경우 75°C 이하의 조건 에서는 bi-phasic한 경향을 보이나 75°C 이상으로 처리 하 였을 때는 mono-phasic한 경향을 보이고 약 10분 처리하 였을 때 POD의 활성이 0%에 가깝게 불활성화 되는 결과 를 얻었다고 하였다(Soysal & Söylemez, 2005). 본 연구에 사용된 감귤 주스의 PPO와 POD는 상대적으로 열에 안정 적인 것을 알 수 있었고, 완전하게 불활성화시키기 위해서 는 더 높은 온도의 처리가 필요한 것으로 판단된다.
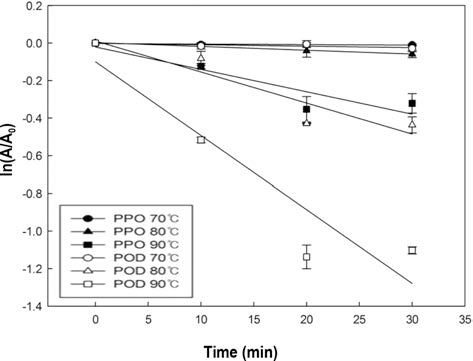
감귤 주스 PPO와 POD의 동역학을 알아보기 위해서 식 (2)을 이용하여 Fig. 3의 그래프를 도출해 내었다. POD의 경우 처리시간 10분을 기준으로 열에 안정적인 구간(k)과 불안정한 구간(k′)으로 나뉘어졌으므로, 두 구간으로 나누 어 반응속도상수 값을 구하였다(Table 1). 열에 불안정한 구간은 상대적으로 빠르게 불활성화 되었고, 열에 안정적 인 부분을 불활성화시키기 위해서 상대적으로 긴 시간이 필요했다. 당근의 POD에서도 열에 안정적인 구간과 불안 정한 구간으로 나뉘는 경향을 보였으며, 다른 채소들의 POD에 비해 당근의 POD가 가장 열에 안정적이라고 하였 다(Morales-Blancas et al., 2002; Soysal & Söylemez, 2005).
초고압 처리 감귤 주스의 경우, 500MPa 처리한 POD (k value = 0.0068, r2= 0.6238)를 제외한 모든 구간에서 반응 속도상수 값도 낮고 r2 값이 현저히 낮았으므로 동역학 모 델에 적용하기에 부적합한 것으로 판단하였다. 열처리로 PPO를 불활성 시키기 위해서는 초고압 처리 500 MPa와 비슷한 시간이 필요했으며 POD의 열에 안정한 부분(k’)은 불안정한 (k) 부분보다 불활성화하는데 더 많은 시간이 걸 린다는 것을 확인하였다(Table 1). 이를 통해서 감귤 주스 의 PPO는 POD보다 상대적으로 열에 더 안정하다는 것을 알 수 있었다. 식 (3)를 이용하여, 활성화에너지(Ea)를 구하 였고, POD의 Ea가 PPO보다 크게 나타나 POD가 PPO보 다 온도 변화에 더욱 민감하게 반응한다는 것을 확인할 수 있었다.
추출한 사과주스에 초고압 처리를 가하여 PPO와 POD 의 활성 변화를 측정한 결과를 Fig. 4에 나타내었다. 사과 주스 POD는 300 MPa로 20분간 처리를 하였을 때 최대 30% 불활성화되었으나, 처리 시간이 지속됨에 따라 불활 성화도가 줄어드는 경향을 보였다. 이는 500MPa에서 가 장 많이 불활성화된 감귤 주스의 결과와는 상이하였다. 또 한 100, 500MPa의 조건에서 60분 미만의 처리에서는 활 성을 유지하였고, 60분처리 하였을 때 20%의 불활성화를 나타내었다.
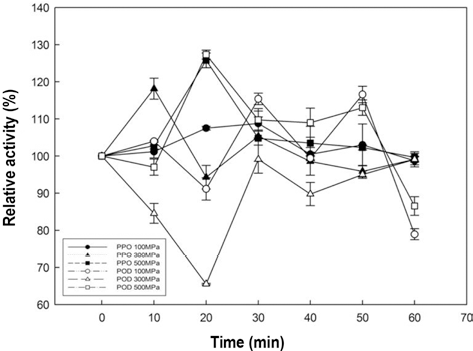
한편 사과 주스 PPO는 감귤 주스 PPO와 동일하게 불활 성화 되지 않았고, 압력에 대해 내성을 가지는 것을 알 수 있었다. 200-600MPa의 조건으로 10분간 압력처리 하고, 처리된 샘플이 상온 조건에서 공기에 노출됨에 따라 사과 의 갈변현상이 일어나 상기 조건에서는 불활성화되지 않았 으며, 800MPa의 조건으로 10분간 처리하였을 때는 상온 에서 1시간 동안 노출되어도 갈변현상이 일어나지 않았다 는 보고(Gomes & Ledward, 1996)로 보아 사과 주스에서 갈변현상을 초래하는 PPO를 불활성화시키기 위해서는 본 연구에서 사용한 조건보다 더 높은 압력을 필요로 한다는 것을 알 수 있었다.
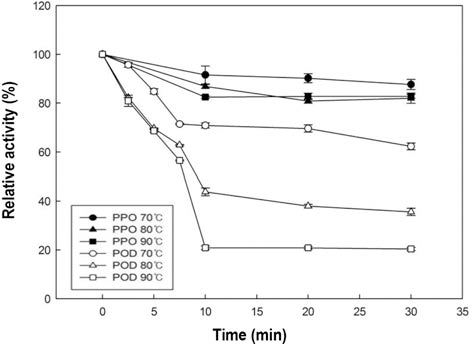
사과 주스 PPO와 POD의 가열처리에 의한 활성변화를 Fig. 5에 나타내었다. 사과 주스를 80°C과 90°C로 처리한 경우 POD는 각각 40% 및 70% 불활성화 되었고, 70°C에 서는 활성의 변화를 볼 수 없었다. PPO는 70°C과 80°C에 서는 불활성화 되지 않고 활성을 유지하였고, 90°C로 처리 하였을 때 약 30%가 불활성화 되었다. 모든 온도에서 감 귤의 POD보다 높은 활성을 나타냈으므로, 사과 주스의 POD는 귤 주스의 POD 보다 열에 대해 안정적이라는 것 을 알 수 있었고, 사과 주스의 POD 또한 귤 주스와 동일 하게 일정 시간 이후로 지속적으로 열처리를 하여도 더 이 상 불활성화되지 않고 유지되는 구간을 보였다(Fig. 5). 당 근의 POD의 경우 75°C 처리하였을 때 100%에 가까운 불 활성화를 보였고, 포도의 PPO 및 POD 모두 80°C로 처리 하였을 때 100%에 가까운 불활성화를 시킬 수 있다고 보 고하였다(Soysal & Söylemez, 2005; Fortea et al., 2009). 일반적으로 본 실험에서 사용한 조건으로 열 처리를 하였 을 때 대부분의 효소들은 불활성 되는 결과들이 많이 있었 지만, 본 연구의 사과주스 PPO는 90°C에서도 불활성화 되 지 않았다. 효소들의 이성질체에 따라 열에 안정적인 효소 와 불안정적인 효소들로 구분된다는 보고(Połata et al., 2009)로 보아 본 연구 결과가 다른 연구들과 상이한 결과 를 보이는 것으로 생각 할 수 있다.
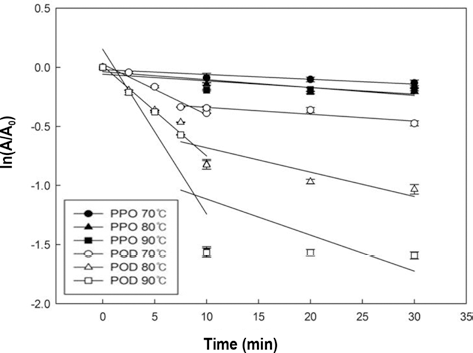
가공처리 후 사과 PPO와 POD의 활성 변화를 좀 더 구 체적으로 알아보기 위해 동역학 모델 식 (2)을 이용하여 Fig. 6의 그래프를 도출하였고, 이 그래프에서 얻은 기울기 (k)와 r2 값을 Table 2에 나타내었다. 500MPa로 처리 하였 을 때, POD의 k value는 0.0010, r2= 0.0329로서 반응속도 상수 값과 r2 값이 현저히 작은 수치를 나타내어 초고압 처 리 결과는 동역학 모델에 적용하기에 부적합하다고 판단하 였다. 딸기의 실험에서도 600 MPa로 압력처리를 하였을 때 k value가 0.0071로 본 실험과 유사한 결과를 보였고 (Anthon & Barrett, 2002), 아보카도 PPO의 결과에서도 500MPa의 조건에서는 활성이 떨어지지 않고 안정을 유지 하고 있으며, 900 MPa로 270분 처리 하였을 때 효소 활성 의 1 log 감소하였다고 보고하였다(Weemaes et al., 1998).
| Thermal treatment | k | R2 | Ea |
|---|---|---|---|
| PPO 70°C | 0.0003 | 0.7380 | 2756.68 J/mol |
| PPO 80°C | 0.0021 | 0.9749 | |
| PPO 90°C | 0.0119 | 0.8487 | |
| POD 70°C | 0.0022 | 0.0781 | 2166.11 J/mol |
| POD 80°C | 0.0165 | 0.8746 | |
| POD 90°C | 0.0393 | 0.8805 |
사과 주스의 PPO와 POD는 모두 온도가 증가함에 따라 불활성화 되는 정도가 높아졌으며, Table 2를 통해서 불활 성 되는 속도가 빨라지는 것을 알 수 있었고, POD를 80°C로 처리 했을 때와 PPO를 90°C로 처리 하였을 때 불 활성화 되는 속도가 비슷한 결과를 보이는 것을 통해서 POD가 PPO 보다 더 낮은 온도에서 비슷한 속도로 불활 성화 된다는 것을 확인 할 수 있었다. 또한 PPO가 POD보 다 더 큰 Ea 값을 보이므로 PPO가 POD 보다 온도변화에 더욱 민감하게 반응한다는 것을 확인 할 수 있었다. 또한 감 귤 주스와 사과 주스의 Ea를 비교 했을 때 감귤 주스 POD (883.69 J/mol)가 사과 주스 POD (2,166.11 J/mol)보다 작은 Ea 값을 보였으므로 감귤 주스 POD가 온도 변화에 따라 더 쉽게 불활성화 된다는 것을 확인 할 수 있었다.
요 약
주스의 품질악화를 초래하는 효소를 불활성화시키기 위 해서 감귤 주스와 사과 주스 추출물에 초고압 처리와 열처 리를 하여 각 시료의 PPO와 POD의 불활성화 정도를 확 인하고 동역학 모델에 적용하여 이들의 불활성화 특성을 연구하였다. 감귤 주스와 사과 주스에서 모두 PPO가 POD 보다 열과 압력에 대해서 상대적으로 내성을 갖는 것을 알 수 있었으며, 초고압 처리 과정을 거쳤을 때 보다는 열처 리 과정을 거쳤을 때 PPO와 POD가 효과적으로 불활성화 되는 것을 확인할 수 있었다. 초고압 기술은 처리 후에도 제품의 영양분과 색의 변화에 영향을 미치지 않기에, 최상 의 상태와 품질로 제품을 제공 할 수 있는 장점을 가지고 있지만, 효소를 불활성시키기에는 부족하다는 단점을 가지 고 있다. 이를 보완하여 산업적으로 이용되어지기 위해서 는 영양분이 파괴되지 않는 열 처리 조건을 잡고, 효소를 효과적으로 불활성시킬 수 있는 초고압 처리 조건과 결합 하여 최상의 결과를 얻을 수 있는 조건을 찾는 연구가 필 요하다고 판단된다.