서 론
액상과당(high fructose corn syrup, HFCS)은 단당류인 포도당과 과당의 액상 혼합물로서 다양한 식품에서 단맛을 내는 첨가물로 사용되고 있다. 정제당은 포도당 한 분자와 과당 한 분자가 결합한 이당류이지만, 액상과당은 전분에 서 추출한 포도당과 이를 이성화한 과당이 단당류의 형태 로 혼합되어 있다. 액상과당은 혼합비의 조절을 통해 HFCS-42, HFCS-55, HFCS-90 등 사용 용도에 따라 다양 한 제품을 생산할 수 있는데, 이 중 HFCS-42와 HFCS-55 가 많이 사용된다. HFCS-42는 42%의 과당과 53%의 포도 당을 포함하며 상대적으로 단맛이 덜하기 때문에 주로 가 공식품, 시리얼, 음료수 그리고 제과제빵에 쓰이며, 1980년 대 이후부터 스프나 과일 통조림제품, 시리얼, 요거트, 젤 리, 조미료, 사탕, 그리고 패스트푸드 등 다양한 가공식품 에 첨가되었다(Latulippe & Skoog, 2011). HFCS-55는 55%의 과당, 42%의 포도당과 3%의 올리고당의 혼합물로 과당의 함량이 정제당보다 높아 단맛이 더 강하며 주로 탄 산음료에 많이 쓰인다. HFCS-90은 90%의 과당과 10%의 포도당으로 구성되어 있어 미량으로 저칼로리 식품 및 산 업용으로 쓰여진다. 한국의 경우 1966년에 일본을 통해 최 초로 액상과당을 공업적으로 생산하기 시작했으며 이를 이 성화당, 이성화액당 또는 전분당이라고 불렀다. 액상과당은 1966년 이후 청량음료, 과실음료, 쿠키, 빵, 아이스크림, 우 유, 통조림, 잼, 그리고 양념 등에 적용하여 정제당을 대신 할 감미료로 활용되었다. 과거에는 첨가 감미료로써 정제 당이 주로 사용되었지만, 액상과당의 저렴한 제조비용과 GMO옥수수 재배의 발전 및 운송의 용이성, 그리고 같은 양의 정제당보다 단맛을 더 낸다는 이점으로 인해 정제당 을 대신하여 사용량이 꾸준히 증가하는 추세이다(Sun & Empie, 2012). 특히 미국 정부는 값싼 옥수수 생산량 증대 에 초점을 맞춘 농림정책으로 옥수수 농가에 후원을 증가 시켜 액상과당으로의 감미료 대체를 장려했다. 하지만, 최 근 들어 액상과당의 섭취 증가에 따른 대사증후군 및 각종 만성질환의 위험성이 증가한다고 알려지면서 이에 대한 논 의가 활발해지고 있다.
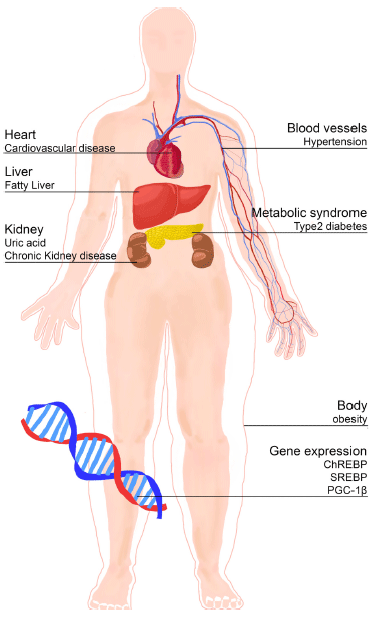
대사증후군은 1988년 syndrome X라는 이름으로 처음 알려지기 시작하여, 현재 인슐린 저항성이라는 용어로도 알려져 있는, 대사성 만성질환의 대표적인 사례이다. 대사 증후군은 허리둘레(동양인의 경우 남성 90 cm, 여성 80 cm 초과), 공복기 혈당(100 mg/dL 초과), 중성지질(150 mg/dL 이상), 고밀도 지단백질(남성의 경우 50 mg/dL 미만, 여성 의 경우 40 mg/dL 미만), 혈압(수축기 130 mmHg 이상, 이 완기 85 mmHg 이하)등 세 가지 이상의 기준을 만족하였 거나, 한가지라도 관련하여 약을 복용하는 경우로 해당자 를 분류할 수 있다(Wood, 2006). 미국의 경우 전체 국민의 21.8%가 대사증후군이고, 국내의 경우에는 6.8%인데, 우리 나라에서는 특히 급격하게 서구화되는 식단의 변화와 생활 방식의 변화에 의해 이러한 추세는 더욱 두드러질 것으로 예상된다(Lee et al., 2004). 대사증후군은 점차 고령 인구 층이 늘어나는 국내 상황에서 건강한 노년을 위협하고 있 으며, 고지혈증, 비만, 심혈관계 질환과 같은 다양한 합병 증을 유발하여 수명을 단축시키는 주요 원인으로 지목되고 있다. 특히 최근 액상과당 섭취 증가에 따른 인슐린 저항 성, 고지혈증, 비만, 고혈압 등 대사증후군 발병률 증가에 대한 많은 연구 결과들이 보고되고 있다(Crescenzo et al., 2013). 하지만 이러한 연구는 대부분 서양인을 대상으로 진 행되었으며 동양인들을 대상으로 한 논문들은 많지 않다. 특히 우리나라는 아직 액상과당에 대한 기초 통계자료 및 건강관련 연구가 많지 이뤄지지 않아 액상과당의 위험성에 대한 과학적 논의가 충분치 않은 실정이다. 따라서 이 논 문은 액상과당의 제조와 이화학적 특성 뿐만 아니라 액상 과당이 대사증후군, 지방간, 고혈압, 비만 등에 미치는 영 향을 종합적인 고찰을 실시하여 우리나라의 액상과당에 대 한 연구의 토대를 마련하고자 한다.
본 론
식품의약품안전처의 식품공전에 따르면 액상과당이란 ‘전 분을 당화, 여과, 정제, 농축하여 얻은 포도당액이나 포도 당을 이성화한 것 또는 정제당을 가수분해하여 얻은 것을 농축한 액상의 것’ 이라고 정의한다. 액상과당 제조에 사 용되는 대표적인 주 전분 재료는 옥수수인데 그 이유는 유 전자조작 기술에 의해 옥수수의 생산성이 크게 증진되었기 때문이다. 또한 액상과당은 사탕수수가 주원료인 정제당에 비해 동일 재배 면적에서 더 많은 양을 수확 할 수 있고, 액체형태로 보관하여 더 적은 공간에 더 많은 양을 저장 할 수 있다. 뿐만 아니라 액체 형태이기 때문에 정제당보 다 혼합과 희석이 용이하고, 식품에 첨가 시 과일의 향을 더해주고 색감과 질감을 보전해준다는 장점 또한 가지고 있기 때문에 주로 사용되고 있다(Parker et al., 2010).
액상과당의 생산과 사용은 미국이 주도하고 있는데, 정 제당을 대체하는 감미료로써 광범위하게 사용되고 있다. 액상과당은 미국 외에도 멕시코, 유럽 및 아시아 등지에서 도 널리 사용되고 있고 여러 식품들에서 정제당을 대신하 고 있다. 미국 통계청 자료에 따르면 조사가 시작된 1970 년부터 2001년까지 액상과당의 소비가 꾸준히 증가하다가 이후 2009년까지 감소하고 있다(Marriott et al., 2009). 국 내에서 액상과당이 정제당과 분리되어 독립된 통계 항목으 로 정확히 조사되기 시작한 것은 비교적 최근인 2007년부 터인데, Fig. 1에서와 같이 액상과당 생산량은 2009년부터 2012년까지 꾸준히 증가하는 경향을 보였다(Korean Statistic Information Service, 2014). 연구결과에 따르면 1990년대에 우리나라의 액상과당 생산량은 22만톤으로 세계 4위를 기 록해서 매우 높은 것으로 나타났으며, 한국농촌경제연구원 의 식품수급표 조사에서도 한국인 한 명이 하루 섭취하는 당류의 양은 2002년 57 g에서 2012년에는 62 g으로 증가하 는 것으로 나타났다(Vuilleumier, 1993). 따라서 당류의 섭 취량이 늘어나는 국내 상황을 고려해 한국영양학회는 한국 인의 1일 총 당류 섭취기준량을 권장 칼로리의 10-20%로 권장했다(Lee HS, 2014). 이처럼 국내 액상과당의 생산과 소비는 매우 높은 편이지만 그럼에도 불구하고 국내 액상 과당 사용현황을 분석한 대한 논문 및 학술통계자료 매우 제한적이며 일반적인 관심 또한 높지 않은 상태여서 추가 적인 관심과 연구가 필요하다.

액상과당의 제조공정은 Fig. 2에 정리되어 있는데, 일반적 으로 전분이 풍부한 옥수수를 주원료로 사용한다. 전분은 포도당이 α-1,4 결합으로 연결된 사슬형 구조의 amylose 와, 포도당이 α-1,4 결합과 α-1,6 결합으로 연결되어 있어 사슬형과 가지형 구조를 가진 amylopectin으로 이루어져 있다. 액상과당의 제조 공정에 사용되는 효소는 크게 1) α-amylase, 2) glucoamylase, 3) glucose isomerase 등 3가 지가 있다. α-amylase는 endoamylase로써 포도당의 α-1,4결 합을 사슬의 안쪽부터 끊어내 전분을 올리고당과 덱스트린 등으로 분해하여 분자량을 낮춰준다(van der Maarel et al., 2002). Glucoamylase는 exoamylase로 α-1,4 결합과 α-1,6 결합을 사슬의 바깥쪽부터 끊는다. 특히 glucoamylase는 긴 다당류 사슬을 가수분해시키는 특징이 있다. Glucose isomerase는 단당류로 분해된 포도당을 과당으로 이성화 시켜주는 효소이다.
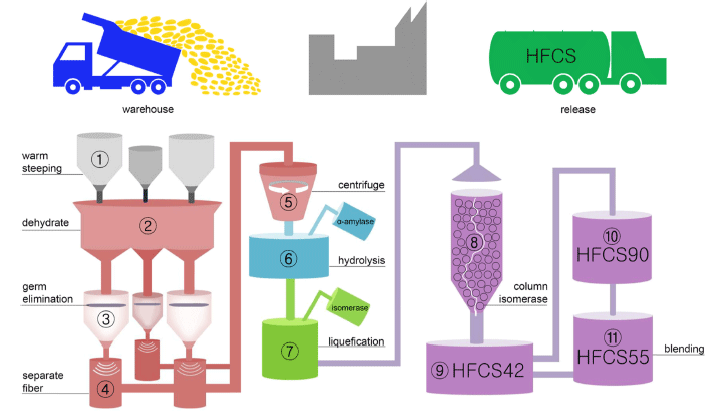
액상과당의 제조공정은 5단계로 나뉜다. 첫 번째는 침지 과정이다. 이 과정에서는 습식도정을 통하여 옥수수로부터 전분을 분리한다. 우선 옥수수 낟알을 이산화황이 들어있 는 따뜻한 물(52℃)에 약 4일 정도 담가 놓는다. 이 과정 은 옥수수 겉껍질을 연화시켜서 껍질 속에 있는 성분들인 전분, 글루텐, 섬유 등의 분리가 용이하게 되도록 해준다. 옥수수 낟알이 물을 흡수하여 부드러워지면 옥수수 안의 글루텐 결합이 느슨하게 되면서 전분이 용출된다. 이 때, 이산화황은 옥수수 내부로 스며들어 전분을 잡고 있는 글 루텐 단백질 변성에 도움을 주고 미생물 발효를 억제시키 는 역할을 한다. 두 번째는 분리과정이다. 침지된 옥수수를 탈수시킨 뒤, 파쇄하여 기름이 풍부한 부분인 배아를 제거 한다. 파쇄물들을 다시 침지시키면 비교적 부력 밀도가 낮 은 배아가 상층에 떠서 분리가 가능하다. 이 때, 배아가 분리된 파쇄물에는 전분, 글루텐, 섬유소 등이 남아 있게 된다. 다음으로는 섬유소를 분리해야 하는데, 오목 스크린 을 통과하게 하여 섬유소만 스크린을 통해 지나가지 못하 고 전분과 글루텐은 스크린을 통과하며 섬유소가 분리된다.
전분과 글루텐으로 구성된 현탁액은 mill starch라 하며 원 심분리 후 밀도차이에 의하여 전분이 분리되어 나온다. 세 번째는 당화과정이다. 당화과정은 α-amylase를 이용하여 옥수수 전분을 일정한 크기로 분해하는 공정으로 짧은 사 슬의 덱스트린이나 올리고당으로 가수분해 시킨다. 올리고 당은 단당류가 3-9개 결합되어 있는 당이며, 덱스트린은 전분에서 말토오즈로 분해될 때까지 생기는 여러 가수분해 산물을 말한다. 네 번째는 액화과정으로 당화과정으로 인 해 분해된 덱스트린과 올리고당 등 일정한 크기로 가수분 해된 전분들을 포도당으로 만들기 위해 glucoamylase를 이 용하여 포도당 사슬의 glycosidic bond를 비환원성 말단으 로부터 α-1,4 결합과 α-1,6 결합을 절단하는 과정이다. 당 화를 마친 용액을 glucose syrup 또는 corn syrup이라고 한 다. 마지막은 이성화과정인데 분해된 포도당을 과당으로 바꿔주는 과정으로 glucose isomerase에 의해 진행된다. glucose isomerase는 α-amylase나 glucomaylase에 비해 가 격이 비싸며 컬럼의 형태로 고정시켜 놓는 역할을 하기 때 문에 glucose syrup에 그 컬럼을 흐르게 하여 효소와 기질 을 접촉시켜준다. 과당은 포도당보다 칼슘염 형태의 강산 성 이온교환수지의 친화력이 더 커서 컬럼에서 이 둘의 분 리가 더 용이하게 된다(White, 2014). 이성화 결과 42%의 액상과당이 생산되고 과당을 더 농축시키면 90%의 액상과 당을 만들 수 있다. 90% 액상과당과 42% 액상과당을 혼 합하여 55%의 액상과당을 제조한다.
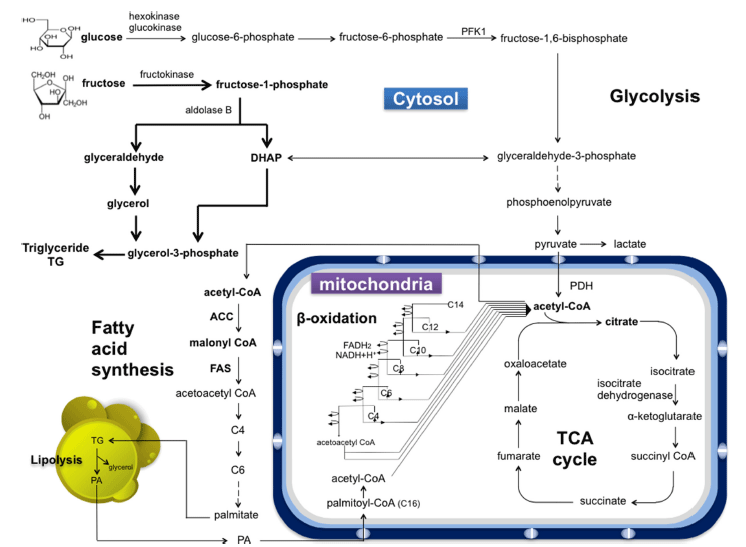
포도당과 과당으로 이루어진 액상과당의 체내 섭취 후 대사과정은 Fig. 3에 정리되어 있다. 이당류인 정제당이 섭 취된 후 소장으로 이동하여 sucrase에 의해 단당류인 포도 당과 과당으로 분해되는 것과 달리 액상과당은 포도당과 과당이 단당류로 혼합되어 있는 형태이기 때문에 추가적인 분해과정을 거치지 않고 소장에서 흡수되어 간문맥을 통해 간으로 이동한다(Uusitupa, 1994). 우리가 섭취한 포도당은 인슐린에 의해 조절되는 glucose transporter type 4 (GLUT4) 를 통해 세포 내로 이동하고 몸의 다양한 기관으로 전달되 어 주요 에너지원으로 사용된다(Bray et al., 2004). 특히 간의 경우 포도당은 해당과정, TCA 회로 등을 거쳐 ATP 생성의 주요 재료로 이용되지만, 필요량을 넘어선 잉여분 의 포도당은 지질합성으로 전환되어 체내에 축적된다. 과당 은 인슐린에 영향을 받지 않는 GLUT5를 통해 세포 내로 이동하게 된다. 이후 과당은 해당과정의 속도조절단계이자 핵심단계인 phosphofructokinase에 의해 진행되는 fructose- 1-phosphate에서 fructose-1,6-bisphosphate로 되는 단계를 건 너뛰며 빠르게 3탄당인 glyceraldehyde-3-phosphate로 산화 된다. 따라서 과당은 보다 빠르게 해당과정에 진입하여 해 당과정 및 지방생합성 과정에 활용된다. 이처럼 과당이 다 량 유입되면 포도당보다 효율적으로 acetyl-CoA를 제공할 수 있으며, 이는 지방산 생합성에 주요 탄소제공자로 작용 하게 되어 중성지방 생성을 증가시키며 초저밀도 지단백질 의 증가로 이어진다(Donnelly et al., 2005).
인슐린은 글루카곤과 더불어 포도당 항상성을 조절함으 로써 에너지 대사에서 중추적인 역할을 할 뿐만 아니라 근 육 발달과 지질 합성 등의 이화작용을 관장하는 중요한 호 르몬이다. 만성적인 포도당의 항상성 교란에 의해 인슐린 에 대한 체내 민감성이 저하됨으로써 정상적인 기능을 상 실한 경우를 인슐린 저항성으로 정의하며, 인슐린 분비량 이 장기간 높은 상태로 유지되다가 췌장이 더이상 충분한 인슐린을 생산하지 못하게 되는 경우를 제2형 당뇨병으로 정의한다(Wood, 2006). 한 연구결과에 따르면 1893에는 당뇨병환자가 십만명 당 2-3명에 불과했으나 2007년에는 7%, 그리고 향후 2020년에는 이 수치의 두 배가 될 것이 라고 예측했다(Osler, 1893). 이처럼 당뇨병은 꾸준히 증가 세를 보이고 있으며 그렇기 때문에 이를 제어하기 위한 다 양한 노력들이 시도되고 있다. 그래서 과당이 가지고 있는 식후에 발생하는 혈당의 변화량이 다른 감미료인 정제당이 나 포도당보다 적은 특성 때문에 과거 당뇨병 환자들을 위 한 감미료로서 각광을 받기도 했으나, 최근들어 이러한 주 장을 반박하는 연구결과들이 지속적으로 보고되고 있다.
액상과당과 인슐린 저항성 및 당뇨병과의 연관성을 밝히 기 위해 액상과당의 주요공급원인 탄산음료의 영향에 대한 연구들이 활발히 진행되었다. 이러한 연구 결과 성인 남성 이 평균적으로 섭취하는 하루 칼로리양의 20%를 과당으로 5주간 섭취했을 시에 인슐린에 대한 민감성이 감소하는 것 으로 조사되었다(Reiser et al., 1989). 그리고 8년 간 20대 에서 40대를 대상으로 진행한 실험에서도 액상과당으로 단 맛을 낸 탄산음료를 1캔 마신 사람은 제 2형 당뇨병에 대 한 상대적인 위험도가 1.5배 더 높아졌다는 결과를 얻었다 (Schulze et al., 2004). 유사한 결과로 한 달 간 탄산음료를 350 mL 마신 사람이 제 2형 당뇨병에 걸릴 확률이 1.5배 더 높게 나타났으며, 또한 하루에 탄산음료를 1캔 이상 마 신 사람들이 그렇지 않은 사람들에 비해서 제 2형 당뇨병 에 걸릴 확률이 1.2배 더 높아졌다(Palmer et al., 2008). 또 다른 연구 결과 하루에 탄산음료를 143 g 섭취하는 사 람들이 그렇지 않은 사람들에 비해 제 2형 당뇨병에 걸릴 확률이 2.9배 높게 나타났으며, 또한 중년의 사람들을 대 상으로 실험한 결과에서도 하루에 2캔의 음료수를 마실 경 우 제 2형 당뇨병에 걸릴 확률이 남성 1.3배, 여성은 1.5배 더 높아졌다는 결과가 나왔다(Montonen et al., 2007). 뿐 만 아니라 탄산음료를 마시지 않은 사람이 제 2형 당뇨병 에 대한 상대적인 위험도가 1.6배 더 낮았다는 결과도 보 고되었다(Odegaard et al., 2010). 결과적으로 탄산음료를 통한 액상과당 섭취가 증가할 경우 인슐린 저항성 및 당뇨 병의 위험이 현저히 높아짐을 알 수 있다.
액상과당을 통한 과당의 과다한 섭취는 고지혈증을 촉진 시킬 뿐만 아니라 궁극적으로 지방간 및 심혈관계 질환의 위험성을 크게 증가시킬 수 있다. 과당이 혈중 중성지질에 미치는 영향에 대한 실험한 결과, 성인 남성이 과당을 섭 취했을 때 포도당 섭취군보다 중성지질이 증가했으나 여성 에게서는 뚜렷한 차이는 없었다(Bantle et al., 2000). 그러 나 또 다른 실험에서는 건강한 여성이 총 에너지의 30%에 달하는 과당을 액상으로 섭취했을 시, 하루 뒤 중성지질 양이 포도당 섭취군보다 유의적으로 높게 조사되었다(Teff et al., 2004). 그리고 건강한 성인 남성이 체중 1 kg당 3 g 의 과당을 7일간 섭취했을 때 간과 혈액에서 중성지질이 증가했다(Tappy & Lê, 2010). 또한 인슐린 저항성을 앓고 있는 남성이 총 에너지의 7.5%를 과당으로 5주 동안 섭취 한 결과 혈중 중성지질이 30% 증가하였고, 총 에너지의 15% 급여했을 시에는 60% 증가했다고 보고했다(Hallfrisch et al., 1983). 이와 유사한 결과로 당뇨병 환자들이 총 에 너지의 20%에 해당하는 과당을 2주 동안 섭취할 경우 중 성지질의 양이 현저히 증가한다는 것 또한 보고되었다 (Crapo et al., 1986).Fig .4
과당은 중성지질뿐만 아니라 지단백질과 콜레스테롤의 함량을 증가시키고 비알코올성 지방간의 위험성을 증가시 킨다. 비만 여성을 대상으로 10주간 총 에너지의 30%에 해당하는 과당을 급여한 결과, 이들에게서 식후 중성지질 과 apolipoprotein B의 양이 증가하였다(Havel, 2005). 또한 4주간 총 에너지의 20% 만큼의 과당을 섭취했을 때, 저밀 도 지단백질과 총 콜레스테롤의 양이 증가했으며, 고인슐 린혈증을 가진 남성과 건강한 남성 모두에게서 과당을 섭 취한 후에 중성지질과 초저밀도 지단백질이 증가했다 (Swanson et al., 1992). 뿐만 아니라 액상과당은 지방간의 형성에도 영향을 미쳤는데, 쥐에게 8주간 액상과당을 급여 한 실험 결과 대조군에 비해 간내 지방량이 증가했으며, 쥐에게 2주간 과당을 식이 급여했을 시 대조군에 비해 간 의 무게와 간내 유리지방산의 양이 유의적으로 증가했다는 결과가 나왔다(Koo et al., 2008). 그러나 액상과당이 정제 당에 비해 지방간을 촉진시키는 교란 원인을 액상 단당류 로 존재하는 물리학적 특성에서 찾는 연구자들도 존재하기 도 한다. 즉 정제당은 포도당과 과당이 결합한 이당류이기 때문에 sucrase와의 반응 이후 소장 내로 흡수되는 반면 액상과당은 단당류로 존재하여 보다 빠르게 체내로 흡수되 고, 따라서 액상과당과 같이 포도당과 과당이 함께 빠르게 유입되면 간이 과당을 활용하는 비중이 크기 때문에 간내 포도당 대사의 방향성은 작아지게 되며 또한 이러한 점이 지질생합성에 이용되기 때문에 비알코올성 지방간을 촉진 시킬 수 있다는 것이 그들의 주장이다. 이처럼 과당은 포 도당과 동일한 분자량과 화학적 조성을 보이면서도 체내에 서는 독특한 대사작용 및 신호전달체계를 자극하기 때문에 액상과당을 과다 섭취할 경우 고중성지질증, 고콜레스테롤 증, 지방간의 발달을 야기할 수 있다.
액상과당의 섭취에 따른 병태생리학적 기전과 관련 인 자들의 역할에 결과들도 지속적으로 보고되고 있다. 널리 알려진 과당의 영양대사적 작용은 지방산 합성을 주관하 는 acetyl CoA carboxylase (ACC)와 fatty acid synthase (FAS)을 활성화시킬 뿐만 아니라, 이들 효소의 조절인자인 peroxisome proliferator-activated receptor gamma coactivator 1 beta (PGC-1β), sterol regulatory element-binding protein- 1 (SREBP-1), SREBP2의 발현을 증가시켰다(Lin et al., 2005). 한 연구 결과에 따르면 쥐에게 4주간 과당을 추가 급여한 경우 혈중 중성지질의 함량이 80% 증가했으며 유 리지방산 농도 또한 유의적으로 상승했는데, PGC-1β를 억 제한 경우에는 이러한 변화가 나타나지 않아 액상과당의 PGC-1β를 통한 지질대사 항상성 교란을 입증했다(Nagai et al., 2009). 또 다른 연구 결과, 과당을 급여한 쥐에서 SREBP-1, stearoyl CoA desaturase-1 (SCD-1), FAS, ACC가 모두 높게 발현되는 것을 확인했다(Miyazaki et al., 2004). 이와 유사한 연구결과로 쥐에게 과당을 급여한 결과 SREBP-1의 발현량이 포도당 섭취군보다 2.2배 높게 나타 났다(Koo et al., 2009). 동물실험 결과 뿐만 아니라 건강 한 성인 남성들도 4주간 잉여의 과당을 섭취했을 때, 근육 내 SREBP-1c가 증가하는 경향을 보였으며, SCD-1 또한 50% 상승했다는 결과를 얻어냈다(Lê et al., 2008).
액상과당에 의한 고지혈증 촉진인자로서 carbohydrateresponsive element-binding protein (ChREBP) 또한 널리 연구되었다. 대표적으로 SREBP-1c를 제거한 쥐에서도 고 탄수화물 급여시 ChREBP가 활성화되어 de novo lipogenesis가 촉진되는 것으로 알려졌다(Liang et al., 2002). 이름 에서 알 수 있듯이 ChREBP는 포도당에 의해 활성화되어 지방생성과 해당과정에 관여하는 ACC, FAS, SCD-1 등 지방산 생합성 관련 효소의 발현을 촉진한다(Ishii et al., 2004). 포도당은 pentose phosphate pathway를 통해 xylulose- 5-phosphate와 protein phosphatase 2A를 작동시키며 이는 ChREBP의 발현을 높힌다(Uyeda & Repa, 2006). 그 러나 과당은 이러한 대사과정에 크게 영향을 미치지 않아 보다 빠르고 효과적으로 ChREBP의 발현을 증가시켰다. 이 를 뒷받침하는 연구결과로 2주간 과당을 섭취한 그룹에서 SREBP1c와 FAS 뿐만 아니라 ChREBP의 발현량이 유의 적으로 증가했으며, 또한 과당을 급여한 쥐에서 포도당 섭 취군보다 pyruvate kinase, ACC, FAS, SCD-1 등의 발현이 높았다(Koo et al., 2009). 이를 통해 과량의 과당 섭취 시 ChREBP가 활성화되어 de novo lipogenesis를 조절하는 경 로로 지방산생성을 높혀 결과적으로 고지혈증을 촉진시킬 수 있다는 것을 확인할 수 있다.
우리 몸은 내분비 호르몬을 통해 대사항상성을 유지하는 데, 호르몬의 불균형에 의한 항상성 교란은 비만을 일으키 는 주된 원인 중 하나이다. 대사항상성에 관여하는 대표적 인 호르몬으로는 인슐린, 렙틴, 그렐린 등이 있는데, 식이 후 혈중 포도당 농도가 증가하면 췌장에서 분비되는 인슐 린과 지방세포에서 분비하는 렙틴 수치는 상승하고, 위에 서 분비되는 그렐린 수치는 감소한다. 정상적인 경우 간으 로 흡수된 포도당은 췌장의 인슐린의 분비를 촉진시키고 연이어 지방세포에서 식욕억제 호르몬 렙틴과 신경전달물 질 neuropeptide Y를 통해 포만감을 유도한다. 하지만 과 당은 포도당과 달리 인슐린 분비 능력이 낮아 포만감 및 식욕억제에 대한 조절 능력이 결여되고 이에 따라 음식물 의 섭취를 조절하지 못해 결과적으로 비만을 유발할 수 있다(Stanhope & Havel, 2008). 또한 혈중 렙틴의 농도는 그렐린의 분비에 영향을 주는데, 인슐린과 달리 과당은 식 후 렙틴 분비를 자극하지 못해 그렐린의 농도가 높게 유 지되고 상대적으로 높은 식욕이 유지되어 비만을 유발할 수 있다.
액상과당의 주된 공급원인 탄산음료 섭취에 따른 비만유 도에 관한 연구도 활발히 진행되었다. 한 연구는 11-13세 학생을 대상으로 하루에 3캔 이상의 액상과당이 함유된 탄 산음료를 마신 경우 BMI 지수와 체지방함량이 높게 나타 남을 증명했다. 또한 1캔 이상 탄산음료를 마시는 사람들 이 그렇지 않은 사람보다 비만이 될 가능성이 더 높았으며, 과당이 40% 들어간 음료수를 섭취한 여학생들에게서 BMI 지수가 높게 나타났다(Øverby et al., 2004). 뿐만 아니라 실험대상에게 과당으로 단맛을 낸 음료수를 19개월 동안 급여한 결과, BMI가 1.2배 증가했다는 결과가 나왔으며, 또한 실험군을 두개로 나누어 1년간 한 실험군은 액상과당 이 함유된 탄산음료의 일일 섭취량을 50 mL 줄이고, 다른 실험군은 17 mL을 늘려 진행한 결과 탄산음료의 섭취량을 줄인 그룹은 비만율이 0.2% 감소했고, 섭취량을 늘인 그룹 에서는 비만율이 7.5% 증가했다(James et al., 2004). 결론 적으로 액상과당이 다량 함유된 탄산음료의 섭취가 내분비 계의 교란을 촉진시키고 BMI 상승 등 비만과 밀접한 관 련이 있음을 확인할 수 있다. 이것은 미국의 통계자료를 통해 확인할 수 있는데, 1890년대 미국 남북전쟁 참전자들 을 대상으로 BMI 지수를 통한 비만을 측정한 결과 3.4% 에 해당하는 사람들만 비만으로 관찰되었다. 하지만 액상 과당이 본격적으로 도입된 이후 미국 내 비만율은 꾸준히 증가해 1976년 경에는 14.5%, 1988년 경에는 22.5%, 2002년 경에는 30.4%로 측정되었다는 것을 통해 액상과당 의 섭취는 비만과 연관이 있다는 사실을 확인할 수 있다 (Helmchen & Henderson, 2004).
미국 시카고 거주자 11,000명을 대상으로 고혈압 여부를 조사한 결과 1939년 11-13%, 1975년 25%, 1990년 28%, 2004년 31%로 꾸준히 증가하고 있는 것으로 나타났다. 1940년대 이전만해도 고혈압은 영국, 프랑스, 독일, 미국 등 일부 선진국을 제외하고는 극히 드문 현상이었는데, 서 구적 식단이 전세계적으로 본격적으로 도입되기 시작한 1940년대를 기준으로 고혈압이 증가하였다. 이처럼 꾸준히 증가하는 고혈압은 비만과 당뇨병의 증가추세와 유사하게 나타나 대사증후군의 주요 지표 중 하나로 인식되고 있다 (Johnson et al., 2007). 실제 설치류를 포함한 동물에게 과 당이 많이 함유된 식품을 급여하면, 인슐린 저항성, 고지혈 증 뿐만 아니라 고혈압 또한 유발되는 것으로 나타났다. 아직 과당이 고혈압을 유발하는 정확한 메커니즘이 규명되 지 않았지만, 과당섭취에 의해 요산생성, 고인슐린혈증, 알 데하이드 생성, 혈관반응성의 변화 등이 진행되면서 고혈 압이 발생할 수 있다. 혈관반응성 변화에 기인한 고혈압의 발병의 경우 약 40주 동안 수컷쥐에게 과당을 급여하면 장간막에 흐르는 동맥이 손상되어 혈관이완에 문제가 관찰 되었으며, 액상과당에 의해 인슐린 저항성이 발생한 경우 교감신경에서의 카테콜아민 농도의 증가로 인해 혈압이 상 승했다(Elliott et al., 2002). 또한 액상과당에 의해 요산 생 성이 증가할 경우 혈관내피세포 endothelial nitric oxide synthase의 활성 및 nitric oxide의 수치를 감소시켜 혈관이 완을 저해해 Gersch(Nakagawa et al., 2006).
액상과당의 섭취는 고혈압 뿐만 아니라 신장질환을 유발 한다는 연구결과들도 보고되어지고 있다. 쥐를 대상으로 한 실험에서도 과당섭취군에서 대조군에 비해 시간이 지남 에 따라 단백뇨, 크레아틴 증가, 사구체경화증, 세뇨관 간 질성질환, 신장팽창, 신장위축, 상피세포 증가 등 다양한 만성신장질환 지표가 나빠졌다는 결과를 얻어냈다(Gersch et al., 2007). 액상과당이 고협압 및 만성신장질환에 악영 향을 미치는 대표적인 원인으로 요산 생성의 증가를 들 수 있다. 과당이 간세포로 들어가서 ketohexokinase에 의해 fructose-1-phosphate가 되는 급격한 인산화 과정을 통해 ATP와 ADP가 생성되고, 이후 AMP가 되는 과정 중에 관 여하는 효소인 AMP deaminase가 자극됨으로써 요산이 생 성된다(Hallfrisch, 1990). 연구결과에 따르면 성인 남성을 대상으로 과당과 포도당 비율을 조절하여 섭취하였을 때 과당의 비율이 높을수록 요산생성비율이 높았으며, 과당이 함유되어 있는 탄산음료를 소비한 양이 높을수록 혈중 요 산 비율이 높게 나타났다(Choi et al., 2008). 또한 과당을 먹인 쥐에서 혈장 요산 수치가 증가된다고 보고되었고, 이 요산 수치를 감소시키면 고인슐린혈증, 인슐린 저항성, 고 혈압이 방지된다는 실험결과가 보고되었다(Tran et al., 2009). 결과적으로 액상과당의 과잉섭취는 혈관수축, 신경 전달물질에 의한 인슐린 증가, 요산 증가 등을 통해 고혈 압 및 만성신장질환을 유발할 수 있다.