서 론
대파(Allium fistulosum L.)는 전세계적으로 널리 재배되 고 있는 allium 속의 다년생 초본식물로, 특히 한국에서는 중요한 식물자원으로 연간 생산량이 500,000톤에 달하고 있다(Sohn et al., 2006). 마늘, 양파, 대파 등이 포함되어 있는 allium 속은 예로부터 우리 식단에서 중요한 부식으 로 소비되어 왔고, 최근에는 다양한 생리적 기능에 관한 연구가 활발히 진행되면서 이들 allium 속에 대한 관심이 높아지고 있다(Song et al., 2009).
Allium 속의 특성은 조직이 분해되는 동안 생산되는 황 함유 휘발물질에 기인하는데, 기존에 수행된 대부분의 연 구는 마늘(Allium sativum)의 추출물에 존재하는 물질인 allicin (diallylthiosufinate)의 생리활성을 규명하는 것에 집 중되어 있다. Allicin은 식물체내에서 불활성 전구체인 alliin (S-allyl-L-cystein sulfoxide)으로부터 alliinase라는 효 소의 작용으로 세포가 파괴되면서 효소적으로 생성되는데, allicin과 비효소적 분해산물인 thiosulfinate기가 생체내의 thiol기와 강하게 반응하여 세포대사를 억제함으로써 항균 작용, 항진균작용, 항암작용, 혈당강하작용, 혈압강하작용, 동맥경화 예방작용 등 다양한 효능을 나타낸다(Shashikanth et al., 1984; Bianchini and Vainio, 2001; Elkayam et al., 2013; Majewski, 2014; Viswanathan et al., 2014).
대파는 항균작용뿐만 아니라 혈소판의 항응집효과, 항산 화 및 항과민작용 그리고 LDL 콜레스테롤의 항산화 및 산화질소 생성 억제효과를 가지고 있는 것으로 발표되고 있다(Chen et al., 2000; Yamamoto et al., 2005; Sohn et al., 2006). 총백(Allii fistulosi Bulbus)은 대파의 흰 밑부분 을 뿌리와 함께 잘라낸 것으로써, 전통적으로 기침, 감기, 두통 등의 치료나, 이뇨제, 독성저감화 등의 목적으로 사용 되어왔고, 중국뿐만 아니라 국내 전통 한약서에도 그 내용 이 기록이 되어 있다(Phay et al., 1999; Lee et al., 2005; Wang et al., 2005; Seo, 2011)
총백의 주요 활성성분인 alliin 및 allicin의 생리활성에 대한 다양한 연구는 진행되어 왔지만, alliin 및 allicin을 효율적으로 추출하는 가공방법에 대한 연구는 미약하다. 특히, alliin은 물의 존재 하에서 효소인 alliinase와 복합체 를 빠르게 형성하는데, 이 복합체는 매우 불안정하여 탈수 작용과 함께 allyl sulfonic acid와 pyruvic acid, ammonia로 전환되어 alliin이 소실된다(Miron et al., 2000). 또한, 이 과정에서 생성된 allyl sulfonic acid는 상온에서 매우 반응 성이 높으며 결과적으로 allyl sulfonic acid 두 분자가 allicin으로 자발적으로 변환된다. 하지만, 추출과정에서 alliin이 allicin 형태로 전환되어 추출되면 휘발성이 큰 allicin은 추출물에서 안정적으로 유지되기 어려우므로(Ilić et al., 2011). allicin으로 전환을 최소화할 수 있는 조건에 서 총백으로부터 alliin을 추출하는 것이 바람직하다.
본 연구의 가설은 총백을 효과적으로 추출하기 위하여 allicin으로 전환을 최소화할 수 있는 조건에서 추출하는 조 건을 확립하는 것인데, alliin-alliinase 복합체 형성에 영향 을 미치는 조건을 제어하여 alliin과 allicin의 효율적 추출 을 달성하는 것이다. 추출용매의 조성, 고형분과 추출용매 의 비율, 온도 등의 추출조건 변화가 alliin-alliinase 복합체 형성에 영향을 미칠 것으로 예상된다. 특히, allicin은 alliin 에 비해 좀더 hydrophobic한 성질로 인하여 추출용매 중 물과 에탄올 비율에 따라 각각이 추출되는 함량이 달라질 수 있다(Miron et al., 2000). 따라서, 기능성 식품으로써 총백의 다양한 활용을 위해서는 alliin과 allicin과 같은 활 성성분 추출을 효율적으로 하는 방법 대한 다양한 연구가 필요한 실정이다. 본 연구의 목적은 (1) 총백으로부터 주요 활성성분인 alliin 및 allicin의 최적 추출조건을 설정한 후, (2) alliinase의 활성에 의한 alliin 및 allicin에 미치는 영향 을 연구하는 것이다. Alliin 및 allicin의 효과적인 추출조건 을 확립하기 위하여, 추출온도, 추출용매조성, 추출시간을 변수로 설정했으며, alliinase 활성화 방법 등을 연구하였다.
재료 및 방법
추출조건 설정에 사용한 총백은 파의 뿌리 부분만 절단 (뿌리로부터 3 cm 이내)하여 건조상태인 것을 경동시장에 서 구입(planted in 2013, Kyungsan, Korea)하여 상온보관 하였고, alliinase 활성화 처리 조건 설정 실험에 사용된 총 백은 (주)제이팜스(harvested in 2014, Kongju, Korea)에서 구입하여 냉장보관하며 사용하였다. 총백의 유용성분 추출 을 용이하게 하기 위하여 시료 모두 분쇄기(HMF-3450S, Hanil, Wonju, Korea)를 이용하여 상온에서 2분간 분쇄하 여 100 mesh 정도의 분말로 제조하였다. 활성성분의 함량 측정에 쓰인 표준물질은 alliin (≥98.0%, Sigma-Aldrich, St. Louis, MO, USA)과 allicin (≥98%, Santa Cruz Biotechnology Inc. Dallas, TX, USA)을 구입하여 사용하였다. 그 외 시 약들은 모두 분석용 등급(analytical grade)을 사용하였다.
총백으로부터 alliin과 allicin 활성성분을 효율적으로 추 출할 수 있는 조건을 확립하기 위하여 추출용매, 추출온도, 추출시간 등을 달리하여 추출물을 제조하였다. 추출용매는 물, 70% ethanol, 100% ethanol 3종류가 준비되었고, 총백 분말에 추출용매를 10배 가한 후 3가지 온도조건(40, 70, 100℃)에서 2시간 또는 4시간 동안 연속 3회 환류 추출하 였다. 추출물은 상온에서 30분간 방냉 후 여과(5 μm filter paper, Advantec, Toyo Roshi Kaisha, Ltd., Tokyo, Japan) 한 다음 50℃ 이하의 온도에서 60-70 °Bx 이상이 되도록 감압 농축하였다. 여과된 추출물은 급속냉동기(DF 9010, Ilshin Lab Co., Ltd., Dongducheon, Korea)를 이용하여 -80℃에서 급속냉동 한 후, 동결건조기(FD5508, Ilshin Lab Co., Ltd., Dongducheon, Korea)에 넣은 후 -45℃에서 동결 건조하였다.
총백의 alliinase 활성화 조건에 따른 allicin의 함량의 변 화를 알아보기 위해 생총백을 Table 1와 같은 조건에서 처 리하였다. 생총백은 분쇄기(HMF-3450S, Hanil)를 이용하여 분쇄한 후 시료와 물 비율 1:1, 1:3, 1:5의 3가지 조건, 수 침온도 20℃, 40℃의 2가지 조건, 진탕시간(100 rpm, shaking water bath, NR-25, Nuriscience, Gunpo, Korea) 30분, 2시간의 2가지 조건에서 처리하여 alliinase을 활성화 시켰다. Alliinase 활성화 조건에서 처리한 시료는 위의 총 백의 alliin 및 allicin 추출물 제조 조건 확립에 서술된 방 법을 이용하였으며, 이때 시료는 70% ethanol을 추출용매 를 이용하여 70℃에서 2시간 추출하였다. 추출용매와 시료 의 비율이 alliin과 allicin의 추출효율에 미치는 영향을 알 아보기 위하여 시료와 추출용매의 비율을 1:2, 1:3, 1:5, 1:7 4가지 조건으로 제조한 후 추출하였다. 제조된 총백추 출물은 50℃ 이하의 온도에서 60-70 brix 이상이 되도록 감압 농축한 후 동결건조하였다.
| Experimental set | Variables |
|---|---|
| Ratio (root : water, w/v) | 1:1, 1:3 and 1:5 |
| Temperature (°C) | 20 and 40 |
| Shaking time (h) | 0.5 and 2 |
동결건조 총백 추출물 분말 0.1 g을 50% methanol 10 mL에 첨가한 다음 자석교반기를 이용하여 충분히 용해시 킨 후, 0.45 μm nylon syringe filter를 이용하여 여과하여 HPLC 분석시료로 사용하였다. 총백추출물에 함유되어 있 는 alliin과 allicin 정량분석 방법(Mohammad, 2010)을 변 형하여 사용하였다. Alliin과 allicin의 HPLC 분석조건은 Table 2와 같다. 분석기기는 Agilent 1200 series HPLC (Agilent Technologies, Foster City, CA, USA)을 사용하였 으며, 컬럼은 Unisol C18 (5 μm, 150 A, 4.6×250mm, Agela Technologies, Wilmington, DE, USA)를 사용하였으며, detector는 alliin 검출을 위해 UV 210 nm를 이용하였으며, allicin의 검출을 위해서는 242 nm 파장에서 측정하였다. 이 동상은 0.04% formic acid in water와 methanol을 이용하여 0-5분간 0% B, 5-10분간 50% B, 10-20분간 100% B가 되도록 gradient 법을 이용하여 1 mL/min 유속으로 흘려주 었고, 시료의 주입량은 10 μL로 하였다. 총백의 alliin과 allicin의 동정은 표준품을 이용하여 각각 5-100 mg/kg 수 준으로 표준용액을 조제하여 검량선을 작성한 후 계산된 함량으로 나타내었다.
| HPLC condition | Alliin | Allicin |
|---|---|---|
| Mobile phase | 0.04% formic acid : methanol | |
| Column | Unisol C18, 5 μm, 150 Å (4.6 × 250 mm) | |
| Flow rate | 1.0 mL/min | |
| Detector | UV 210 nm | UV 242 nm |
결과 및 고찰
총백 특유의 향과 항산화 기능 등으로 알려진 alliin과 allicin의 추출 최적 조건을 정립하기 위해 추출용매, 추출 온도, 추출시간 등을 달리하여 조건별로 alliin과 allicin의 함량을 측정하였다. 두 물질의 표준용액은 각각 5-100 mg/ kg의 농도로 HPLC 분석 후 검량곡선을 그린 결과 상관계수 (r2)은 0.999로 직선성을 보였다. 그리고 다음의 조건(Fig. 1) 으로 총백 추출물로부터의 alliin과 allicin의 함량을 분석할 수 있었다. 본 실험방법을 통해 분석한 결과 총백추출물로 부터의 alliin과 allicin의 함량은 각각 40-90 mg/g, 0.010- 0.150 mg/g에서 대부분 측정이 되었다.
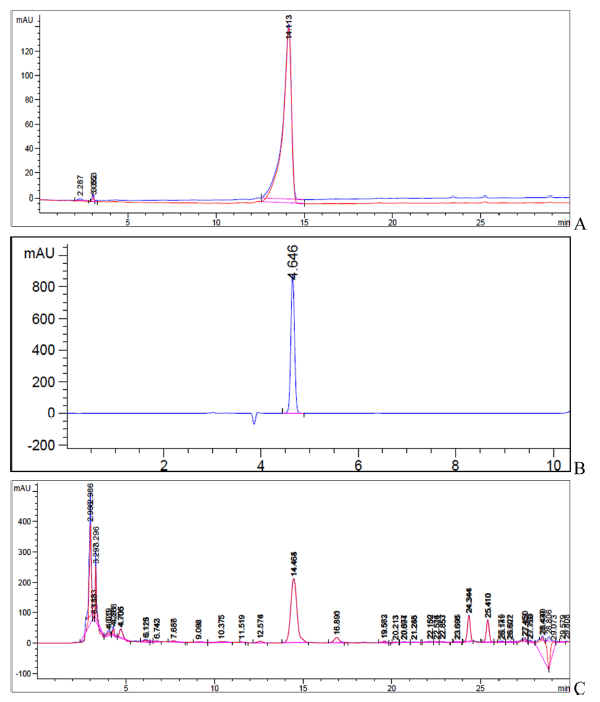
용매와 추출시간 및 추출온도에 따른 추출물의 alliin과 allicin의 함량을 확인한 결과(Table 3), alliin의 경우 총백 추출 조건 중 추출용매로 물을 사용하여 40℃에서 2시간 추출하였을 때, 86.477 mg/g으로 최대함량을 보였으며, 70℃, 100% ethanol, 4시간 조건에서는 alliin의 함량이 측 정이 되지 않았다. 특히, 100% ethanol 추출조건에서는 물 이나 70% ethanol 추출조건에 비해 alliin 함량이 절반 정 도로 감소되는 것을 볼 수가 있었다. 즉, alliin은 ethanol을 함유할수록, 추출 온도가 높고, 시간이 길어질수록 함량이 낮아지는 것을 볼 수가 있었다. Allicin의 경우, 70% ethanol, 70℃, 2시간 추출조건에서 1.371 mg/g으로 최대함량을 보 였으며, alliin과 같이 100% ethanol, 4시간 조건에서는 검 출되지 않았다. Alliin (S-allylcysteine sulfoxide)은 구조상 으로 원소별 구성비를 보았을 때, C 40.66%, H 6.26%, N 7.90%, O 27.08%, S 18.09%로써, allyl기와 sulfoxide기 그 리고 아미노산인 cysteine으로 구성되어 있다. Alliin은 alliinase가 없는 경우에 매우 안정하여 가열처리 후에도 잔 존할 수 있다. 반면에 allicin은 2-propene-1-sulfinothioic acid S-2-propenyl ester, thio-2-propene-1-sulfinic acid Sallyl ester, diallyl disulfide-oxide, diallyl thiosulfinate로 알 려져 있고 원소 구성비는 C 44.4%, H 6.21%, 0 9.86%, 그리고 S 39.52%로 되어 있다(Mohammad, 2010). 따라서, allicin은 alliin에 비해 좀더 hydrophobic 한 성질을 가지고 있어 추출 시 에탄올의 비율이 증가할수록 함량이 높아지는 것을 볼 수가 있었고, 반면에 alliin은 감소하였다. Nikolić et al. (2010)은 FTIR spectrometry를 통해 allicin 함량변화 를 측정한 결과, 80℃에 노출되었을 대 그 기능이 기하급 수적으로 감소됨을 증명한바 있다. 본 실험에서 alliin은 추 출조건을 달리하여도 함량이 크게 변하지 않았으나, allicin 은 추출조건에 따라 상이한 결과를 보였다. 이에, 총백으로 부터 추출된 alliin과 allicin의 총 함량을 고려했을 때, 가 장 많은 함량을 보였던 70% ethanol, 70℃, 2시간으로 추 출조건을 설정하였다.
Alliin을 allicin으로 전환시키는 효소인 alliinase는 대파, 마늘, 양파 등의 allium속의 식물이 crush될 때 활성화된다. Alliin은 물의 존재 하에서 효소인 alliinase와 복합체를 이 룬다. 하지만, 이 복합체는 매우 불안정하여 탈수작용과 함 께 allyl sulfonic acid와 pyruvic acid, ammonia로 전환된다. 그리고, 상온에서 매우 반응성이 높은 allyl sulfonic acid는 두 분자가 allicin으로 자발적으로 응축된다(Miron et al., 2000; Ilić et al., 2011).
이에 본 연구에서는 allicin의 추출을 최적화하기 위해 추출 전 분쇄기로 생총백을 분쇄하고 Table 1과 같은 조건 으로 물과 혼합하여 진탕시키는 alliinase 활성화 처리과정 을 수행하였다. 본 실험에서 설정한 총백 추출조건인 70% ethanol, 70℃, 2시간 조건으로 추출한 결과(Table 4), allicin은 생총백과 물을 1:1 혼합하여 40℃에서 30분간 진 탕하는 alliinase 활성화했을 때 0.111 mg/g로써 최대함량을 보였다. Allicin의 함량은 혼합되는 물의 양과 반응온도가 증가할수록 감소하였다. 이는 alliinase의 최적 반응 조건이 pH 6.5, 33℃이라는 Nikolić et al. (2010)의 실험결과와 일 치한다고 할 수 있다. 단, 반응시간에 있어서는 물과 혼합 비율 1:1의 경우 30분과 2시간 사이에 allicin의 함량에 있 어서 큰 차이가 없었으나, 1:3과 1:5의 혼합비율에서는 2시 간에서 30분에 비해 10배 정도 더 많은 allicin이 확인되었 다. 이는 물에 의한 희석으로 효소와 기질 사이의 반응이 짧은 시간에 제대로 이루어지지 않았기 때문으로 추정된다 .
또한, 생총백의 alliinase 활성화 조건 후 추출 분석한 allicin의 함량은 총백의 건조, 분쇄 후 추출하여 분석했을 때의 결과에 비해 약 10% 수준이었다. 이는 생총백의 수 분함량이 일반적으로 85-90% 수준으로써, 당초 예상한 수 준의 함량결과가 도출되었다고 볼 수 있다.
요 약
본 연구에서는 총백 특유의 향과 항산화 기능 등으로 알 려진 alliin과 allicin의 추출 최적 조건을 정립하기 위해 추 출용매, 추출온도, 추출시간 등을 달리하여 alliin과 allicin 의 함량을 측정하였다. 또한, 총백의 alliinase 활성화 조건 에 따른 allicin의 함량의 변화를 알아보기 위해 생총백을 물과의 혼합비율, 수침온도, 진탕시간을 달리하여 처리하여 allicin 함량을 비교하였다. 결과적으로, alliin은 총백 추출 조건 중 추출용매로 물을 사용하여 40℃에서 2시간 추출 하였을 때, 86.477 mg/g으로 최대함량을 보였으며, allicin의 경우, 70% ethanol, 70℃, 2시간 추출조건에서 1.371 mg/g 으로 최대함량을 나타냈다. 본 실험에서는 총백의 추출 조 건을 alliin의 함량이 크게 감소하지 않고, allicin의 함량이 최대로 추출될 수 있도록 70% ethanol, 70℃, 2시간으로 추출조건을 설정하였다. Alliinase 활성화 처리 조건에서는 생총백과 물을 1:1 혼합하여 40℃에서 30분간 진탕하였을 때, 0.111 mg/g로써 최대의 allicin 함량을 보였다. 본 실험 결과, 다양한 추출조건에서 alliin과 allicin의 함량이 높은 총백추출물을 제조함으로써 원가경쟁력이 높은 총백추출물 기반 기능성 소재 또는 식품을 개발하는데 기여할 수 있을 것으로 사료된다. 또한, alliinase 활성화를 통한 allicin의 최적 추출방법을 확립함으로써, 총백 이외의 마늘, 양파, 대파 등 allium 속 식물을 이용한 allicin 개발을 타겟으로 하는 연구자들뿐만 아니라 전반적인 기능성 식품 산업에 있어서 소재 개발을 위한 기초자료가 될 수 있을 것이다.