서 론
식품제조 및 생산시설의 현대화와 지속적인 식품 과학 기 술의 발전에 따라 가공식품을 비롯하여 즉석섭취 식품 등 다양한 종류의 식품들이 개발되고 있다. 많은 종류의 식품 들이 개발되고 소비자의 이용이 증가함에 따라 식품 안전에 대한 인식 및 규정에 대한 강화가 이루어지고 있으며, 이에 따른 식품 저장 안전성에 대한 관심도 증가하고 있다. 특히, 즉석섭취 식품의 경우 저장 중 미생물에 의하여 쉽게 부패 되어 이를 섭취한 경우 병원성 세균, 곰팡이 및 바이러스 등과 같은 부패성 미생물에 대한 질병을 유발할 수 있는 실 정이다(Sobel et al., 2002). 이러한 문제를 억제 시키기 위하 여 미생물에 의한 강력한 살균력을 가진 항균제의 개발이 활발하게 진행되어 왔으며, 이들 중 독성이 없는 천연항균 물질 개발에 대한 연구가 지속적으로 이루어지고 있다 (Collins et al., 1998). 이러한 천연 추출물 중 자몽종자추출 물(Grapefruit Seed Extracts, GFSE)은 상업적 식품첨가물로 최근 많이 사용되어지고 있으며, limonoid, naringenin, naringin, quercetrin, kaempferol, hesperetin 및 apigenin 등 수종의 flavonoid와 stigmasterol, campesterol 및 β-sitosterol 등의 sterol이 함유되어져 있는 것으로 알려져 있다(Skjak et al., 1992). 특히 naringin 등의 flavonoid는 항균 효과를 비롯 하여 금속 킬레이트화 효과, 항산화 효과 및 항염증 효과 등을 갖고 있는 것으로 알려져 있다(Tokoro et al., 1989). 또한, 자몽종자추출물의 경우 ascorbic acid, ascorbyl palmitate 및 tocopherol 등이 함유되어 부패성 및 병원성 미 생물의 세포벽과 세포막의 기능을 약화시키고 효소활성을 억제한다는 연구 결과와 일반적으로 식품의 첨가물로 사용 되면서 항균활성을 갖고 있다고 알려진 안식향나트륨과 솔 빈산칼륨에 비하여 독성 안전성에 대한 우수성도 연구보고 되고 있다(No et al., 1999; Kim et al., 2006). 이와 같은 연 구 결과에 따라서 자몽종자추출물의 항균 특성을 이용하여 즉석섭취식품에 첨가함으로써 저장 안전성을 증가시키려고 하는 연구에 대한 관심이 증가하고 있다(Sibel, 2003). 즉석 섭취식품은 미국의 경우 매년 평균 7.5%씩 지속적으로 증 가하고 있으며, 우리나라 역시 최근 즉석 밥 시장만 연평균 40%씩 증가하여 1,200억원 규모로 빠르게 변화되고 있다 (Kang, 2005). 이러한 즉석섭취식품을 이용하는 소비자들이 증가하는 주된 이유로는 식사준비의 간소화 및 편리성 그리 고 시간 절약이라는 장점을 말 할 수 있으며, 소비자들이 많이 이용하고 있는 즉석섭취식품으로는 김밥류 68.5%, 햄 버거류 27.8%, 초밥류 27.1%, 샌드위치류 26.1% 및 튀김류 17.8% 순으로 나타났다(Kang, 2005). 이처럼 국민 생활 패 턴의 변화로 인하여 편리를 추구하는 간편화 식생활 양식으 로 변화하면서 김밥, 샌드위치 같은 즉석섭취식품류(readyto- eat food)의 판매가 급증하고 있다. 그러나, 이들 제품들은 복합 조리의 특징 때문에 교차오염에 대한 노출이 쉽고 이 에 따라서 식중독 발생 요인으로 대두될 수 있다(Kim et al., 2003). 이들 즉석섭취식품 중 김밥의 경우 수분이 많이 함유되어 있는 밥, 채소류 및 육류 등과 같은 식자재를 이 용하여 제조되며, 섭취 전 가열 과정 없이 섭취하는 식품으 로 미생물 증식이 쉽고, 보존에 대한 문제점이 있다(Koo et al., 2007). 이와 같은 즉석섭취식품의 안전성에 대한 문제점 을 보완하기 위하여 식품포장 시스템을 이용하는 것이 필수 적이다. 이러한 식품포장 시스템을 구현하기 위하여 식품 포장재에 유해 미생물의 생육을 저해할 수 있으며, 식품과 의 접촉 시 냄새전이에 따른 식품 품질 저하 및 독성에 대 한 문제를 발생시키지 않을 수 있는 항균 물질을 포장재 표 면에 작용시켜 그 효과를 알아보는 것이 필요하다. 이를 위 한 연구로서 종이 포장재에 자몽종자추출물을 높은 농도로 처리하여 식품 포장재에 도포·건조 후, 이를 식품 포장지 내 부에 다시 이중으로 부착하여 식품 포장에 적용한 연구가 진행된바 있으나, 포장과정마다 자몽종자추출물을 도포한 포장재를 제조해야 하는 번거로움 및 원가 상승에 대한 부 담감이 나타나고 있다(KFDA, 1993). 따라서 본 연구에서는 즉석섭취식품 중 김밥을 실험 대상으로 선택하였으며, 포장 시스템에 있어서 김밥의 보존성을 부여해 주는 자몽종자추 출물(GFSE)의 포장재 적용 최소 농도를 규명하고자 하였다.
재료 및 방법
본 실험에 사용된 자몽종자추출물(Grapefruit seed extract, GFSE, DF-100)은 (주)에프에이뱅크에서 2013년 11월 제공 받아 사용하였으며, GFSE의 주요성분은 자몽(70%) 및 글 리세린(30%)이 함유되었다.
본 실험에 사용된 시약은 sodium chloride을 사용하였고, 배지로는 Nutrient Broth, Tryptic Soy Broth, Brain Heart Infusion, Agar (Difco Laboratories, Detroit, MI, USA), Nutrient Agar, Tryptic Soy Agar (AcumediaR, Neogen Co., Lansing, MI, USA)와 3M Plate Count Agar 배지(3M, Maplewood, MN, USA)를 사용하였다.
항균활성 검색에 사용된 균은 일반적인 식품부패 및 병 원성 세균 4종류의 균주들을 사용하였다. 그람 양성균으로 는 Bacillus cereus KCTC 3624와 Listeria monocytogenes KCTC 13064, 그람 음성균으로는 Escherichia coli KCTC 2441와 Salmonella enteritidis KCTC 2514를 계대 배양하 여 균을 활성시킨 후 사용하였다. 즉, 공시 균주의 slant media 상에 배양된 균주를 무균실내에서 1백금이를 취하여 멸균된 nutrient broth, tryptic soy broth 액체배지에 각각 접종하고, 37℃에서 24시간 동안 왕복식 진탕 배양기(SW- 90F, Gaon, Bucheon, Korea)에서 125 rpm으로 배양하여 활성화 시켰다. 각 균에 적용된 배지의 조성은 Table 1과 같다.
부패미생물 생장곡선은 액체배지 희석법으로 측정하였다 (KFDA, 1993). 배양된 공시 균주를 1백금이 취하여 50 mL의 액체배지에 접종한 후, 37℃에서 24시간 동안 배양 하여 600 nm에서 흡광도 값이 0.2-0.3이 되도록 희석하였 다. 희석한 시험균액 0.1 mL를 이미 제조된 9.9 mL 액체배 지에 접종하여 37℃ incubator (SW-90F, Gaon, Bucheon, Korea)에서 72시간(0, 8, 16, 24, 32, 40, 48, 60, 72시간) 동 안 진탕 배양하여 spectrophotometer (Genesys 6, Thermo, USA)를 이용하여 600 nm에서 흡광도를 측정하였다.
공시 균주(그람 양성균, 그람 음성균)에 대한 GFSE의 항균력은 paper disk method를 이용하였다(Lee et al., 1996). 미리 조제된 평판배지에 활성화된 각 공시 균주 배 양액을 희석(흡광도 0.2-0.3)하여 0.1 mL씩 균일하게 도말 하였다. 직경 8 mm의 멸균된 paper disk에 농도(0, 60, 300, 600, 1,000, 2,000, 3000, 4000, 5,000 ppm)별로 50 μL 를 흡수시켜 배지에 올려 놓았다. 그 다음 0.85% 멸균생리 식염수 50 μL를 분주하여 37℃ incubator (BF-135C, Gaon, Bucheon, Korea)에서 2-3일 동안 배양한 후 형성된 paper disk 주변의 투명환(clear zone)의 직경을 측정하여 항균력 을 확인하였다.
농도(0, 60, 300, 600, 1,000, 2,000, 3000, 4000, 5,000 ppm)별로 제조한 GFSE 도포 용액을 포장지 내면에(가로 (50 mm) ×세로(105 mm) ×높이(35 mm)) 1 mL 분주한 후 멸균된 붓을 사용하여 상·하 방향으로 5회, 좌·우 방향으 로 5회 반복하여 균일하게 도포 처리하였다. 이렇게 처리된 GFSE 도포포장지를 직경 6 mm 크기로 자른 후, 도포 처 리된 면을 평판배지 쪽으로 올려 놓았다. 단, 0.85% 멸균 생리식염수를 분주하지 않은 상태로 37℃ incubator (BF- 135C, Gaon)에서 2-3일 동안 배양하여 도포 포장지의 항균 력을 알아보았다.
GFSE의 용해성을 높이기 위하여 중탕 가온(30℃)한 증 류수를 이용하여 GFSE 도포 용액을 제조하였다. 순도 70% GFSE를 1%(v/v)가 되도록 희석하여 농도(0, 700, 1,000, 2,000, 3000, 4000, 5,000, 6000, 7000, 8000, 9000, 10,000 ppm)별 도포용액을 제조하였다. 이때 거품 생성을 억 제하는 방법으로 hot plate stirrer를 이용하여 30℃에서 15 초간 교반하였다.
즉석섭취식품 포장지로는 마닐라지(Doosungpaper, Seoul, Korea)를 사용하여 용기(가로(50 mm) ×세로(105 mm) ×높 이(35 mm))를 제작하였다. 제작된 포장지 내면에 농도(0, 700, 1,000, 2,000, 3,000, 4,000, 5,000, 6,000, 7,000, 8,000, 9000, 10,000 ppm)별로 제조한 GFSE 도포 용액을 1mL씩 분주한 후 멸균 된 붓을 이용하여 상·하 방향으로 5회, 좌·우 방향으로 5회 반복하여 포장지 내면 전체에 균 일하게 도포 처리하였다.
시금치 5 g과 밥 15 g을 김으로 말아서 길이 6 cm, 중 량 20 g이 되도록 실험용 김밥을 제조하였다. 제조된 김밥 을 GFSE를 농도(0, 700, 1,000, 2,000, 3,000, 4,000, 5,000, 6,000, 7,000, 8,000, 9,000, 10,000 ppm)별로 도포 제작한 종이포장지로 포장하였다. 도포된 포장지로 김밥 시료를 37℃ incubator에서 저장하면서 김밥 품질의 변화 시작을 저장 후 8시간 이상으로 판단하여 저장 8시간 이후1시간 간격으로 최대 19시간 동안 저장 시간이 증가할수록 실험 용 김밥에서 발생되는 쉰 냄새(off-flavor)를 관능검사의 방 법을 이용하여 알아보았다. 즉, 시료 특성의 강도를 일정하 게 나누어 각각의 시료들이 포함되는 항목에 대하여 평가 하는 방법을 이용하였다.
결과 및 고찰
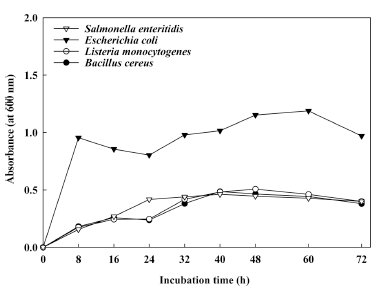
본 실험에 사용된 그람 양성균 및 그람 음성균의 성장 곡선 특성은 Fig. 1과 같다. 그람 양성균인 B. cereus의 경 우 배양 후, 8시간이 경과함에 따라서 급격하게 성장하였 으며, 48시간 경과 후 흡광도 값이 0.48에 도달하였다. 그 러나, 배양 60시간 이후부터는 점차 사멸기에 접어들어 72시간 경과 이후에는 흡광도 값이 감소됨을 알 수 있었 다. 이러한 결과는 B. cereus의 성장이 1시간 이후부터 증 가하여 12시간 이후에도 지속적으로 성장한다는 결과(Park et al., 2005)와 일치하였다. L. monocytogenes 역시 B. cereus와 유사한 형태를 나타냄을 확인할 수 있었다. 즉, L. monocytogenes을 배양한 후, 8시간 안에 유도기에서 증 식기로 접어든 다음 48시간까지 성장하여 72시간 경과 후 점차 흡광도 값이 낮아지는 현상을 확인 할 수 있었다 (Lim, 1992). 그람 음성균인 E. coli 경우 Kim et al. (2006)이 보고한 연구 결과에서와 같이 배양 24시간 경과 후 최대 1.6의 흡광도 값을 나타내었으며, 지속적으로 균 이 증식하면서 최대 168시간까지 사멸하지 않았다는 보고 와 같이 본 실험에서도 배양 8시간 안에 균이 급격하게 증식된 후 안정기에 접어들어 60시간 후, 흡광도 값이 1.0 이상 나타났으며, 그 후 흡광도 값은 감소하였지만, 그 차 이가 유의적인 차이로 나타난 것이 아니므로 균이 사멸기 에 접어들어서 나타나는 현상이라고 판단할 수는 없었다. S. enteritidis의 경우 마찬가지로 배양 후 8시간 안에 균이 증식되기 시작하여 48시간 까지 성장하고 72시간 배양 이 후 점차 사멸하는 경향을 나타내었다. 이와 같은 결과에서 나타난 것처럼 그람 양성균보다 그람 음성균이 상대적으로 증식 속도가 빠르며, 그에 따라서 흡광도 값이 높게 나타 냄을 알 수 있었다(Lee, 1996).
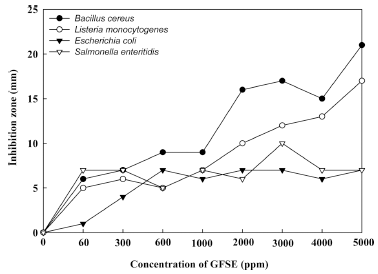
GFSE 및 GFSE를 이용하여 도포한 포장지에 대한 항균 활성을 paper disk method를 이용하여 알아보았으며, 그 결 과 Fig. 2와 같다. GFSE를 농도별(0, 60, 300, 600, 1,000, 2,000, 3,000, 4,000, 5,000 ppm)로 처리하여 식품의 부패에 관여하는 미생물 4종류(B. cereus, L. monocytogenes, E. coli, S. enteritidis)의 항균활성을 측정한 결과 그람 양성균 및 그람 음성균 모두 투명환이 생성됨을 확인하였다. 그람 양성균인 Bacillus cereus는 GFSE를 60-1,000 ppm 처리한 경우 5-10 mm의 투명환을 나타냈고, GFSE를 2,000 ppm 이상 처리한 경우부터는 급격하게 환의 크기가 증가되기 시작하여 최대 21 mm까지 측정되었다. L. monocytogenes 경우도 B. cereus와 비슷한 경향으로 GFSE를 2,000 ppm 이상 처리한 경우부터 환의 크기가 커짐을 확인하였다. 그 람 음성균 E. coli는 GFSE를 300 ppm 처리한 경우부터 항균 효과를 나타내었으며, 600에서 5,000 ppm의 GFSE를 처리한 경우 환의 크기는 6-7 mm로 증가하였다. 또한, S. enteritidis는 GFSE를 60 ppm 처리한 경우부터 항균성이 확인 되었고, 5,000 ppm을 처리한 경우까지 최대 10 mm의 환의 크기를 나타내었다. 그람 양성균과 그람 음성균의 투 명환 크기가 차이 나는 이유는 앞서 실험하였던 부패 미생 물의 특성 결과를 보면 알 수 있다. 그람 양성균보다 그람 음성균이 균 증식 속도와 안정기를 장시간 유지하기 때문 에 paper disk method를 통해서도 GFSE의 영향이 그람 음성균 보다 그람 양성균에서 효과가 더 크다는 것을 투명 환의 크기를 통해 확인 하였다. 또한, 환의 크기 차이는 있으나 그람 양성균과 그람 음성균 모두 항균활성을 나타 냄에 따라 GFSE가 부패미생물에 대한 억제 효과가 있다 고 판단되었다. 또한, GFSE가 식품 변패 미생물에 대하여 항균력이 탁월하며, 천연항균소재(치자, 마두령, 대황, 황금 등) 중에서 생육 억제 저해환 효과가 뛰어나다는 결과와 유사한 결과를 나타내었으며(Shin et al., 1997), GFSE가 항균력을 나타내는 이유에 대해서는 GFSE가 미생물의 세 포벽을 파괴함으로써 미생물의 성장을 억제하는 효과를 갖 는다고 확인되었으며, 일반적으로 세균과 곰팡이에 대하여 세포증식 기작을 방해하여 살균효과를 나타낸다고 하였다 (Cho et al., 2004).
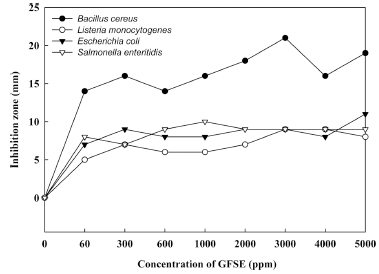
도포 포장지의 경우에는 paper disk method와 차이를 두 어 항균활성을 알아보았다. 즉, GFSE를 농도별(0, 60, 300, 600, 1,000, 2,000, 3,000, 4,000, 5,000 ppm)로 도포된 포장 지에 멸균생리식염수를 분주하게 되면 포장지 자체의 색소 와 GFSE가 흘러내리기 때문에 직접 분주하지 않고 도포 된 부분을 배지로 향하게 하여 배지 위에 올려놓고 항균활 성을 측정한 결과 Fig. 3과 같다. 그람 양성균인 B. cereus 는 GFSE를 60 ppm 처리한 경우 14 mm 크기의 투명환을 나타내었고, GFSE의 처리 농도가 증가함에 따라서 환의 크 기도 최대 21 mm까지 증가하였다. L. monocytogenes도 GFSE를 60 ppm 처리한 경우부터 투명환이 나타났으며, GFSE 처리 농도를 60 ppm에서 5,000 ppm까지 증가함에 따라 투명환의 직경이 5-9 mm로 지속적으로 증가하였다. 그람 음성균인 E. coli, S. enteritidis는 GFSE를 60 ppm 농 도로 처리한 경우 항균 효과를 나타내었으나, 농도가 증가 함에 따라서 투명환의 크기 변화가 그람 양성균 보다 크게 나타나지 않았다. 이러한 도포 포장지의 항균력은 GFSE가 포장지 내면에 효과적으로 정착하여 균의 활성 또는 생육 을 억제시키는데 효율적으로 작용하기 때문이라 판단하였 다. GFSE를 골판지 상자 제조에 처리하여 항균력을 측정 한 결과 6%일 때부터 항균성을 나타냈고, 젤라틴 필름에 제조 시 GFSE를 이용한 경우 0.6%-1.0% 처리한 경우 투 명환을 확인하였다고 보고했다 (Park et al., 2005). 이와 같은 연구결과에 비추어 볼 때, 본 연구결과에서도 부패 미생물에 대한 항균성은 기존의 포장소재보다 낮은 농도에 서도 항균 효과를 확인할 수 있었으며, 포장소재에 GFSE 를 첨가하는 방법보다 GFSE를 도포 처리한 방식이 항균 활성에 효과적임을 확인함에 따라 즉석섭취식품의 포장재 로써 적합하다고 판단되었다.
즉석섭취식품 포장지에 대한 저장안전성 실험결과를 알 아보기 위하여 즉석섭취 식품 중 하나인 김밥을 제조하여 시료로 이용하였다. 즉, 일반적으로 김밥 제조 시 사용되 는 재료들 중에서 시금치의 경우 변패 속도가 가장 빠르 게 나타남을 측정한 후, 다른 재료들을 제외하고 시금치 와 밥만을 이용하여 실험용 김밥을 제조하였다. 제조된 실험용 김밥은 마닐라지로 제조되어 GFSE를 농도별(0, 700, 1,000, 2,000, 3,000, 5,000, 7,000, 9,000, 10,000 ppm)로 각각 처리된 도포 포장지로 포장되었다. 포장된 실험용 김밥은 식품 부패 미생물인 그람 양성균(B. cereus, L. monocytogenes)과 그람 음성균(E. coli, S. enteritidis)을 가장 빠르게 증식되는 온도인 37℃ incubator에서 저장하 면서 저장 안정성에 대한 결과를 김밥의 쉰 냄새(offflavor) 를 평가하는 관능검사의 알아보았다(Table 2). 그 결 과, 김밥을 포장한 포장지에 GFSE를 첨가하지 않은 대조 구의 경우 저장 10시간 경과 후 이취가 발생함을 알 수 있었으며, 포장지에 GFSE를 700 ppm, 1,000 ppm, 2,000 ppm처리한 경우 저장 11시간까지도 김밥의 신선도를 유지 하였다. 또한, GFSE를 5,000 ppm 처리한 포장지의 경우 최대 16시간까지 김밥에 대한 저장 안전성을 나타내었으 며, GFSE를 9,000 ppm 및 10,000 ppm을 처리한 경우 18 시간 동안 김밥에 대한 저장 안전성을 나타내었다. 이는 GFSE로 제작한 젤라틴 필름과 펄프식으로 만든 종이를 박 스 내면에 접착시킨 포장지보다 저장 안전성이 우수한 것 으로 판단되었으며(Choi, 2012), 그 이유는 GFSE 도포용 액을 다른 종류 포장지보다 마닐라지의 흡수력이 높기 때 문에 포장지 내면 전체에 균일하게 도포되어 도포 포장지 내부에 분포되어있는 식품 부패균이 포장지내면의 GFSE로 인하여 억제 효과를 나타낸 것으로 판단되었다. 이와 같은 실험 결과를 통하여 일반적으로 김밥의 저장 안전성에 따 른 유통기한을 연장할 수 있는 방법으로 김밥포장지 내면 의 GFSE의 처리에 대하여 긍정적인 기대를 생각할 수 있 었다.
도포 포장지를 이용한 즉석섭취식품의 일반 세균수 측정 결과를 Table 3에 나타내었다. 즉석섭취식품 중 하나인 실 험용 김밥을 제조 후 즉시 일반 세균수를 측정한 결과 평 균 1.6 log CFU/g의 수준이었다. 시판 김밥의 미생물을 측 정한 결과 일반세균수가 3.3-8.4 log CFU/g를 나타낸다고 보고하고 있으며(Kim et al., 2005; Park et al., 2006), 김 밥 제조 직후 측정한 일반세균수가 3.46 log CFU/g가 나타 난다고 보고하였다(Lee et al., 2005). 이에 본 실험에서는 실험용 김밥을 포장한 포장지에 GFSE를 처리하지 않고 저장한 경우 저장 8시간 경과 후 일반 세균수는 6.8 log CFU/g로 급속도로 증식하였고, 저장 19시간 이후에는 9.7 log CFU/g까지 증가되었다. 또한, GFSE를 10,000 ppm 처리한 포장지를 이용하여 실험용 김밥을 포장하여 저장한 경우 저장 8시간 경과 후 4.7 log CFU/g의 일반세균이 측 정되었으며, 저장 19시간 경과 후에도 4.2 log CFU/g의 일 반 세균수를 측정할 수 있었다. 일반적으로 판매되고 있는 김밥의 경우 36℃에서 저장한 결과 6시간부터 5 log CFU/ g 이상의 일반세균이 증식되어 12시간 경과 후 6.9 log CFU/g 및 24시간 경과 후에는 8.6 log CFU/g까지 증가됨 을 보고되고 있다(Song, 2013). 또한, 유통 초기 단계의 김 밥에서 5-7 log CFU/g의 일반세균수가 나타남에 대한 보 고를 하였으며, 일반음식점과 김밥 전문 음식점의 김밥을 조사한 결과 전반적으로 5-7 log CFU/g, 김밥제조 직후에 5 log CFU/g에서 보존 12시간 이후에는 7 log CFU/g 수준 으로 증가함을 보고하고 있다(Kang et al., 1995; Lee, 2010). 이와 같이 보고된 연구결과에 비하여 본 실험 결과 김밥의 저장 중 일반세균 증식이 현저하게 억제됨을 알 수 있었으며, 이러한 결과는 김밥 포장지에 GFSE를 이용한 것이 일반 세균수 검출량을 현격하게 낮게 나타날 수 있도 록 영향을 미친 것을 알 수 있었다. 김밥의 일반 세균수와 관련하여 우리나라 식품공전에서 김밥과 같은 즉석섭취식 품 일반세균 기준 규격이 5 log CFU/g인 점을 보았을 때 GFSE를 김밥 포장용 포장지에 이용할 수 있는 최적 농도 는 저장 0-19시간까지를 기준으로 보았을 때, 일반 세균수 5 log CFU/g 이하를 나타낸 10,000 ppm임을 알 수 있었다. 또한, GFSE를 식품 포장에 이용할 수 있는 가능성에 대한 연구결과 역시 HACCP 적용 및 키토산 처리 및 녹차 추 출물을 식품 포장 소재에 처리한 경우보다 GFSE를 처리 한 포장지의 경우 미생물 제어에 더 효과적이라는 연구 보 고도 확인된 바 있다(Kim et al., 2008; Jung, 2012). 그러 므로 본 실험 결과에서 미생물에 대한 위생성 및 그에 따 른 저장 안전성에 대한 문제점을 개선하는 방법으로 GFSE를 식품 포장지 제조에 이용할 수 있음을 확인할 수 있었다.
요 약
본 연구는 자몽종자추출물이 도포 포장지의 항균활성에 미치는 영향을 알아보았다. 저장 안전성 중 항균력을 확인 하기 위하여 그람 양성균(B. cereus, L. monocytogenes) 2종 과 그람 음성균(E. coli, S. enteritidis) 2종을 선택하였다. 자몽종자추출물의 농도별(60-5,000 ppm)에 따른 그람 양성 균의 투명환 크기는 최저 5 mm에서 최고 21 mm로 나타내 었다. 또한 그람 음성균의 투명환 크기는 최저 0 mm에서 최고 7 mm로 나타내었다. 자몽종자추출물을 농도별(60- 5,000 ppm)로 도포 포장시킨 경우 그람 양성균의 투명환 크기는 최저 5 mm에서 최고 19 mm로 나타내었다. 또한 그람 음성균의 투명환 크기는 최저 7 mm에서 최고 11 mm 로 나타내었다. 자몽종자추출물을 처리한 도포 포장지를 이용하여 즉석섭취 식품에 대한 저장 안정성을 알아본 결 과, GFSE의 농도(1,000, 5,000, 10,000 ppm) 차이에 따라 각각 11시간, 16시간, 18시간 동안 신선도가 유지 되었고, 일반 세균수 측정 결과, 1,000, 5,000 ppm 및 10,000 ppm 에서 각각 4.5 log CFU/g, 4.8 log CFU/g, 4.2 log CFU/g로 측정되어 저장성을 증가 시킴을 알 수 있었다.