서 론
오늘날 소비자들의 건강에 대한 관심이 높아져 기능성이 강화된 건강기능식품에 대한 요구와 소비가 증가하는 추세 이다. 특히 노화 억제와 성인병 예방을 위한 천연 항산화 제를 함유하는 건강기능식품 개발에 대한 관심이 높아짐에 따라 자유 라디컬을 방어하는 항산화 물질에 대한 연구도 활발히 이루어지고 있다(Imai et al., 1994; Valko et al., 2007). 생물체에서는 대사과정 중 생화학 반응 및 환경적 인자에 의해 생체에 해로운 superoxide radical, hydroxyl radical, peroxyl radical, hydrogen peroxide 등과 같은 활성 산소종(reactive oxygen species, ROS)이 생성되며, 생체 내 ROS의 생성이 증가한 상태인 산화 스트레스(oxidative stress)에 의해 세포 내 구성성분인 단백질 및 지질성분 등 이 기능적으로 손상되어 생체기능이 저하하는 것으로 알려 졌다(Halliwel et al., 1999). 이러한 ROS의 작용에 의한 생체기능 저하는 노화, 당뇨병, 심혈관계질환, 자가면역질 환 및 알츠하이머 질환 등과 같은 다양한 질환의 원인이 되기도 하며, DNA 손상에 따른 발암 과정에도 깊게 관여 하고 있는 것으로 보고되고 있다(Imai et al., 1994; Valko et al., 2007). 산화 스트레스에 의한 세포 구성성분의 산화 손상을 지연시키거나 억제하는 물질을 항산화 물질 (antioxidant)이라 하며, 독성 및 발암성이 제기되는 합성 항산화제 대신 기능성과 안전성 면에서 두각을 나타내는 식물기원 천연 항산화제의 연구가 활발히 진행되고 있는 추세이다(Rice-Evans et al., 1997; Kim et al., 2012).
밀은 약 83%의 배유(endosperm), 15%의 겨(bran) 그리고 2%의 배아(germ)로 구성되어 있다. 이 중 밀기울(wheat bran)은 밀의 제분과정에서 생성되는 주요 부산물로서 과 외피(epidermis)와 씨껍질(seed coat)로 이루어져 있다. 또한 약 40-50%의 풍부한 섬유소를 함유하는 천연식품 소재로 알려졌으며(D’Appolonia, 1979) 항산화 활성을 나타내는 주 된 성분인 페놀성분이 풍부하게 함유되어 있다(Pomeranz et al., 1998). 이러한 밀의 페놀성분은 두 가지 범주로 나눌 수 있다. Gallic, vanillic, syringic 및 p-hydroxybenzoic acid와 같 은 benzoic acid 유도체와 ferulic, p-coumaric 및 caffeic acids 를 포함하는 cinnamic acid 유도체로 나눌 수 있다(Kim 2006; Yu & Cheng, 2007). 이러한 페놀산은 세포의 산화 상 태를 조절하고 산화 손상으로부터 DNA, 단백질, 및 막 지 질과 같은 생물학적으로 중요한 분자를 보호하는 강력한 항산화 활성을 가지고 있다(Yu et al., 2002). 따라서 전립 밀을 섭취함으로써 건강에 큰 도움이 된다는 것이 많은 역 학 연구결과에서 나타나고 있다(Willcox et al., 2004).
최근 식품가공분야에서 micro 및 nanotechnology는 질병 의 예방과 치료에 도움을 주는 약용식품 및 건강기능식품 개발에 큰 역할을 하고 있으며(Chen et al., 2006), 여러 미 세화 기술 중 고압 균질(High-Pressure Homogenizer, HPH) 처리가 주목받고 있다. 이는 고압 상태의 시료가 미세한 관을 통과할 때 순간적으로 저압 상태로 변하면서 생성되 는 cavitation, impact, turbulence 및 shear force에 의해 시 료가 매우 미세한 상태로 쪼개지게 되며 이에 따라 구조와 표면적을 변화시켜 기능적 특성이 향상한다(Kasemwong et al., 2011). 또한, 고압유화기의 일종인 microfluidizer는 고압 과 전단력에 의한 유화의 안정화 이외에 미생물 살균, 단 백질과 전분의 기능성 조절작용 등이 보고되면서 최근 연 구활동이 활발히 진행되고 있다. 그 예로 Zhou et al. (2004)은 밀 호분(aleurone)층의 미세화 처리로 항산화 활 성이 증가함을 보고한 바 있으며, Rosa et al. (2013)은 밀 기울의 ultra-fine grinding 처리를 통해 항산화 활성을 증 가시켰다고 보고 하였다. 또 다른 연구에서는 오렌지 주스 의 열 살균에 의한 생리활성물질이나 항산화 활성의 감소 를 막기 위해 고압 균질 처리를 통해 저장기간 동안 생리 활성물질을 보존하였음을 증명한 연구결과가 있다 (Velázquez-Estrada, 2013). 그러므로 초미세화에 의한 입자 크기의 감소가 밀기울의 항산화 특성에 어떠한 영향을 미 치는지는 중요하다고 볼 수 있다.
따라서 본 연구의 목적은 고압 균질처리에 따른 밀기울의 입자 크기의 감소가 항산화 특성에 미치는 영향에 대해 분 석하고 나아가 천연 항산화제로서의 밀기울의 부가가치 제 고 및 식품 소재화를 위한 기초자료를 제시하기 위함이다.
재료 및 방법
본 연구에 사용된 시약은 Sigma-Aldrich (Sigma-Aldrich, St. Louis, MO, USA)사에서 구매하였으며 시료로 사용한 HRW 밀기울은 동아원(주) 당진공장에서 제공 받은 것으로 제분 시에 생산된 밀기울을 사용하였다. 밀기울에 잔류 되 어 있는 밀가루의 제거와 이물질 분리를 위해 증류수로 세 척한 후 30℃에서 24시간 동안 건조하였다. 건조된 밀기울 은 Labscale grinding mill(Laboratory mill 3100, Perten Instruments AB, Huddinge, Sweden)를 이용하여 평균 입자 가 약 460 μm가 되도록 분쇄하였다. 실험에 사용하기 전 까지 밀폐유리용기에 넣어 -20℃에서 보관하였다.
처리 공정 밀기울의 고압 균질 처리를 위해 밀기울과 증 류수의 비율을 3.5 : 100 (w/v)으로 고르게 분산시켜 고압 균질기(MINI DeBEE, BEE International Inc., South Easton, MA, USA)에 투입하였다. 분산액은 지름이 200 μm(IC 200), 100 μm (IC 100)인 노즐을 통과시켰으며 IC 200 노 즐에서는 20,000 psi의 압력을, IC 100 노즐에서는 30,000 psi의 압력을 가해주었다. 각각의 처리 조건은 IC 200 노즐 1회와 IC 100 노즐 2회, 5회 및 7회 통과로 HPH 처리하였으며 IC 100 노즐을 통과하기에 앞서 IC 200을 1회 통과시킨 후 처리하였다. HPH 처리를 하는 동 안의 시료 온도는 30-40℃였으며, 처리된 각각의 밀기울 시료는 분무건조기(Eyela SD-1000, Tokyo Rikakikai Co., Ltd., Tokyo, Japan)를 이용하여 분말화 하였다. 이때의 분무 건조 조건은 inlet temperature를 140-160℃로 조절하였고 out-let temperature를 80-90℃로 하고 시료공급속도는 12 mL/min으로 하였다. 분무건조 한 시료는 실험에 사용하 기 전까지 밀폐유리용기에 넣어 -20℃에서 보관하였고, 실 험은 2회 반복하였다.
분석 밀기울 분말 약 0.5 g을 취하여 에탄올 약 30 mL에 희석한 후 분산시켜 투입하였으며, 이때 투입되는 시료의 농도는 obscuration 8~12% 내에 있도록 하였다. Laser diffraction particle size analyzer(LS 13 320 SGL, Beckman Coulter, Inc., Anaheim, CA, USA)를 사용하여 입도 분포 를 측정하였으며 실험은 3회 반복 측정하였다. 본 입도분 석 장비는 시료 입자들에 의해 산란한 빛의 패턴을 측정하 여 입자 크기 및 분포를 측정하는 광 산란법에 적합하도록 설계되어 있다. 시료를 투입하면 적정한 농도의 시료가 순 환하는 cell에 레이저가 투사되고 이 레이저는 입자에 의해 표면에서 산란하게 되고, 수십 개의 검출기가 산란하는 레 이저의 빛의 각도를 측정해 입자의 크기 및 분포를 측정하 게 된다.
시료의 표면 반응성 페놀 화합물 함량은 Serpen 등(2008)의 직접측정법과 Singleton 등(1999)의 Foline-Ciocalteau 방법을 일부 변경하여 측정하였다. 원심분리 관에 시료 10mg과 10% Foline-Ciocalteau시약 2.5 mL을 취하여 5분간 반응시 킨 후 2 mL의 7.5%의 Na2CO3 용액을 가한다. 혼합용액을 2시간 동안 상온에서 반응시킨 후 원심분리기(Union 5KR, Hanil Sci. Industrial, Co., Ltd., Incheon, Korea)로 10,000 g에서 15분간 원심분리 하였다. 원심분리 된 상층액 을 725 nm에서 흡광도(Libra S22, Biochrom Ltd., Cambridge, UK)를 측정하였다. 표준물질로 gallic acid 용액을 이용하 여 검량선을 작성하였고 표면 반응성 페놀 화합물 함량은 mg gallic acid equivalent(mg GAE/g d.w.)로 나타내었다.
항산화 활성으로 DPPH(2,2-diphenyl -1-picrylhydrazyl)에 대한 전자공여능으로 시료에 대한 환원력을 측정하였으며 Serpen 등(2008)의 직접측정법을 일부 변경하여 측정하였 다. 시료 10 mg에 64 μM DPPH 용액을 첨가하여 2시간 후에 515 nm에서 흡광도를 측정하였다. DPPH용액은 80% 메탄올로 조제 하였으며 실험 직전에 만들어 사용하였다. 표준물질로 trolox를 이용하여 검량선을 작성하였고, 각 시료 의 라디컬 소거능은 건조시료 g당 μM trolox equivalent(μM Trolox equiv/g d.w.)로 나타내었다.
ABTS(2,2’-azino-bis(3-ethylbenz-thiazoline-6-sulphonate)) 라 디컬 소거활성을 이용한 항산화 활성 측정은 Serpen 등 (2008)의 방법을 변경하여 측정하였다. 7mM/L ABTS 용액 과 2.45mM/L potassium persulfate를 실온의 암소에서 약 14 시간 동안 반응시켜 ABTS 양이온을 형성시켜 ABTS stock solution을 제조한 다음, 734 nm에서 흡광도가 0.7±0.04로 희 석하였다. 희석한 ABTS stock solution 6mL에 시료 10mg 을 첨가하여 주기적으로 교반하며 60분간 방치하였다. 10,000 g에서 10분간 원심분리 한 상층액의 흡광도는 734 nm 에서 측정하였다. 표준물질로 trolox를 이용하여 검량선을 작 성하였고, 각 시료의 라디컬 소거능은 건조시료 g당 μM trolox equivalent(μM Trolox equiv/g d.w.)로 나타내었다.
시료의 Ferrous-ion chelating 효과는 Decker & Welch (1990)와 Wang 등(2009)의 방법을 변경하여 측정하였다. 10 mg의 밀기울 시료에 6 mL의 증류수와 2 mM FeCl2· 4H2O용액 100 μL를 가한다. 5mM ferrozine용액 200 μL를 가 해 10분간 교반하여 실온에서 반응시켰다. 10,000 g에서 15분 간 원심분리 하여 원심분리 된 상층액을 562 nm에서 흡광도 를 측정하였다. 표준물질로 EDTA(ethylenediaminetetraacetic acid) 용액을 이용하여 검량선을 작성하였고 Ferrous-ion chelating 효과는 건조시료 g 당 EDTA equivalent(μM EDTA equiv/g d.w.)로 나타내었다.
공초점 현미경은 생명과학 분야에서 활용되고 있는 대표 적인 광학 계측 장비로서 기존의 광학현미경보다 매우 우 수한 공간 분해능을 가짐과 동시에 시료의 구조적인 이해 뿐만 아니라 생리학적인 기능을 연구하는데 매우 중요한 역할을 하는 첨단 광학 영상장비로 알려졌다(Wilson, 1990). 따라서 고압균질 처리된 밀기울 미세구조의 변화를 관찰하고자 공초점 레이저 주사 현미경을 이용하여 관찰하 였다.
각각의 시료들을 슬라이드글라스에 일정량 놓은 후 커버 글라스로 덮어 고정하여 관찰용 시료로 준비하였다. 시료의 공초점 이미지는 Nikon D-ECLIPSE C1 현미경(Nikon, Tokyo, Japan)과 Nikon ECLIPSE Ti imaging system(Nikon, Tokyo, Japan)으로 관찰하였다. 밀기울에 포함된 자체 형광성 은 두 개의 레이저 파장인 UV argon ion laser, λexc = 405 nm와 blue argon ion laser, λexc = 488 nm로 검출하였다.
통계분석 실험 결과는 3회 반복 측정 후 평균과 표준편 차로 나타내었고, 통계 처리 프로그램 SPSS(ver. 21.0, SPSS Inc., Chicago, IL, USA)를 이용하여 분산분석(ANOVA)을 실 시하였다. 그리고 Duncan 다범위 검증(Duncan’s multiple range test)을 통해 p < 0.05 수준에서 유의성을 검증하였다.
결과 및 고찰
Table 1에 각각의 조건에서 고압 균질 처리한 밀기울의 입자 크기 결과를 나타내었다. 대조군 밀기울의 평균 입자 크기는 463.6 μm로 분석되었으며, 표준편차 값이 190.5 μm 로 상대적으로 광범위한 입자 크기 분포를 나타내었다. IC 200을 사용하여 1회 고압 균질 처리한 결과 87.2 μm로 감소하였으며 평균적으로 약 81% 감소하였음을 알 수 있었 다. IC 100을 사용하여 처리한 결과는 각각 2회 55.2 μm, 5회 27.8 μm 및 7회 19.9 μm였으며, 처리가 증가함에 따라 입자 크기의 감소가 관찰되었고 최종적으로 약 95% 감소 하였음을 알 수 있었다. 또한, 입자 크기 분포도를 나타내 는 표준편차 값도 처리 횟수가 증가함에 따라 감소함을 알 수 있었다.
각각의 조건에서 고압 균질 처리한 밀기울의 표면 반응 성 페놀 화합물의 함량은 Table 2에 나타내었다. 고압 균 질처리가 증가함에 따라 표면 반응성 페놀 화합물의 함량 도 증가하는 것으로 나타났다. 식물계에 널리 분포하는 2차 대사산물인 페놀성 화합물의 함량은 항산화 활성의 간접적인 지표가 되는 것으로 알려졌다. IC 200 노즐을 통 과했을 때 3.4에서 6.9 mg GAE/g d.w.로 증가하였고 IC 200과 IC 100 노즐을 통해 7회 통과 후에는 처리하지 않 은 시료에 비해 약 3.6배가 증가하였다. 표면 반응성 페놀 화합물 함량의 증가는 고압 균질 처리가 섬유소 매트릭스 를 풀어지게 하고 밀기울 입자의 특정 표면적을 효과적으 로 증가시킬 수 있음을 간접적으로 보여주는 것이다. 그러 므로 섬유소에 공유결합 되어 있거나 물리적으로 포획된 불활성 페놀 화합물이 노출되어 반응성 화합물이 되는 것 이라고 사료된다. 최근 Rosa 등(2013)의 연구에 의하면 밀 기울 입자크기의 일부분이 50 μm보다 작아지면 호분 (aleurone) 세포의 파열로 인해 페놀산의 함량을 증가시키 고 그럼으로써 항산화능 또한 향상된다고 보고한 바 있다. 따라서 밀기울 호분(aleurone) 세포의 파열과 방출 또는 입 자 표면적의 증가로 표면 반응성 페놀 화합물의 방출이 촉 진된 것으로 사료된다.
Table 2에 각각의 조건에서 고압 균질 처리한 밀기울의 DPPH 라디컬 소거활성을 나타내었다. 표에 나타난 바와 같이 고압 균질 처리의 정도가 증가할수록 DPPH 라디컬 소거활성이 유의적으로 증가하였고(p < 0.05), 대조군과 IC 100 7회 처리 밀기울의 DPPH 라디컬 소거활성은 각각 8.2, 37.9 μM Trolox equiv/g d.w.로 7회 처리한 밀기울이 대조군 보다 약 4.6배 높게 나타났다. 또한, Pearson 상관 관계 분석에 따르면 표면 반응성 페놀화합물과 DPPH 라 디컬 소거활성 간의 상관계수는 r2= 0.992로 나타나 고압 균질 처리된 밀기울에서 표면 반응성 페놀화합물은 DPPH 라디컬 소거활성에 정의 상관도가 높은 유효성분으로 나타 났다. 이는 고압 균질 처리에 의해 결합 되어 있거나 포획 된 페놀 화합물의 노출을 증가시키고 그럼으로써 항산화 작 용기의 노출 또한 증가하여 DPPH 라디컬 소거 활성이 증 가하는 것이라고 사료된다. 페놀산의 라디컬 소거활성에 영 향을 미치는 인자는 수산기의 위치와 수, 페놀성 수산기에 근접해 있는 다른 물질의 존재의 여부 그리고 구조적 특징 등이라고 보고 되었다(Carrasco-Pancorbo et al., 2005).
Table 2에 각각의 조건에서 고압 균질 처리한 밀기울의 ABTS 라디칼 소거 활성을 나타내었다. 표에 나타난 바와 같이 밀기울의 ABTS 라디칼 소거 활성에 미치는 고압 균 질 처리 효과는 DPPH 라디컬 소거활성과 유사하였다. 고 압 균질 처리를 증가시킬수록 ABTS 라디컬 소거 능력이 증가하고 IC 100 7회 통과 후의 밀기울 시료에서 가장 강 한 소거 활성을 나타내었으며 대조군 보다 약 3.5배 높았 다. Pearson 상관관계 분석에 따르면 표면 반응성 페놀화합 물과 ABTS 라디컬 소거활성 간의 상관계수는 r2= 0.985로 나타나 ABTS 라디컬 소거활성 또한 양의 상관관계를 나타 냄을 알 수 있었다.
밀기울의 고압 균질 처리에 따른 ABTS 라디컬 소거활 성은 DPPH 라디컬 소거활성보다 더 높게 측정되었는데 그 이유는 페놀 화합물의 구조에 따라 각기 다른 라디칼에 대한 소거능을 나타내기 때문이다. Maqsood 와 Benjakul (2010)은 ferulic acid가 caffeic acid보다 효과적인 ABTS 라디컬 소거 활성을 갖고 있다고 하였지만, DPPH 라디칼 소거 활성에서는 그와 반대로 caffeic acid이 ferulic acid보 다 높은 활성을 가진다고 보고한 바 있다. 따라서 밀기울 의 고압 균질 처리로 인해 페놀성 화합물 중 ferulic acid 의 함량이 caffeic acid와 비교하여 상대적으로 증가했을 것이라고 사료된다.
Table 2에 고압 균질 처리에 따른 밀기울의 Ferrous-ion chelating 효과를 나타내었다. Ferrous-ion chelating 효과는 처리가 증가함에 따라 감소하는 경향을 나타냈지만, 그 차 이는 통계적으로 유의성은 나타나지 않았다(p >.05). 즉, 고압 균질 처리가 대조군보다 밀기울의 금속 chelating 효 과가 개선되지 않았다는 것으로 이는 이전의 연구와 일치 한다(Zhou et al., 2004). 본 연구의 결과는 페놀성 화합물 의 Ferrous-ion chelating 효과에서 이전의 연구와 마찬가지 로 라디컬소거 활성의 효과와 관련이 없는 것으로 나타났 다(Maqsood & Benjakul, 2010). 마찬가지로, Graf(1992)는 페룰산의 항산화 활성이 Ferrous-ion chelating 효과보다는 라디컬 소거 능력에 주로 기인한다고 보고했다. 고압 균질 처리가 Ferrous-ion chelating 효과를 감소시키는 것은 금속 chelating에 관여하는 성분의 손실이나 성능 저하가 원인이 거나 미세구조의 변화로 섬유소 매트릭스의 금속 이온 결 합 부위의 수가 감소했기 때문으로 볼 수 있다.
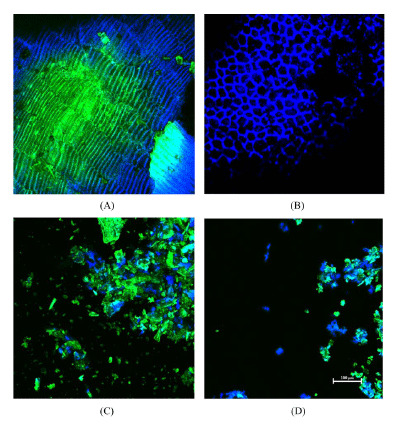
고압 균질 처리에 의한 밀기울의 표면구조 변화를 알아보 기 위해 공초점 레이저 주사 현미경으로 관찰한 결과를 Fig. 1에 나타내었다. 밀기울은 일반적으로 외측의 과피 (pericarp)층, 내측 호분(aleurone)층 그리고 그 사이의 얇은 종피(seed coat)층으로 총 3개의 층으로 구성되어 있다 (Harris et al., 2005). Fig. 1A에 나타나 있듯이 세로형태의 세포인 황록색을 띠는 과피(pericarp)층은 주축이 되는 중 심축과 평행하게 교대로 배열되어 있었고, Fig. 1B의 파란 색을 띠는 호분(aleurone)층은 일반적으로 두꺼운 벽을 형 성하는 층으로 망 형태가 규칙적으로 배열되어 다각형 모 양의 세포를 이루는 것을 관찰할 수 있었다(Antoine et al., 2003). IC 200을 사용하여 1회 고압 균질 처리 후 밀기울 입자는 작은 조각으로 분해 되었고 호분(aleurone)층 세포벽 이 부분적으로 파손 되어 서로 부착되어 있거나 분리된 구 조의 과피(pericarp)층 및 호분(aleurone)층의 일부가 관찰되 었다(Fig. 1C). IC 100을 사용한 7회 고압 균질 처리한 밀 기울은 세포 구조가 거의 분열되거나 분리되어 불규칙한 배 열이 관찰 되었다(Fig. 1D). 고압 균질 처리에 의해 고압 및 높은 전단력이 작용하여 밀기울 입자가 팽창됨으로써 세포 벽의 구조를 변형시키고 섬유소 매트릭스를 분열시키는 등 이러한 과정을 통해 표면적뿐만 아니라 항산화 작용기가 노 출되어 항산화 활성에 영향을 미치는 것으로 사료된다.
요 약
본 연구에서는 밀기울의 천연 항산화제로서의 식품 소재 화를 위하여 밀기울의 고압 균질 처리에 따른 항산화 특성 변화를 연구하였다. 고압균질처리는 밀기울의 입자 크기를 효과적으로 줄일 수 있었고, 처리 정도의 증가에 따라 페 놀성 화합물의 노출을 크게 증가시켰으며 항산화 활성 또 한 연관성 있게 증가시켰다. 이러한 미세화 처리에 의해 입자 크기가 감소함에 따라 밀기울 매트릭스에 결합하거나 바인딩 된 페놀화합물의 항산화 작용기가 노출되어 항산화 활성이 향상한다는 것을 명확하게 증명했다. 고압 균질 처 리가 비록 페놀산과 섬유소 복합체 사이의 공유결합을 풀 거나 페놀 화합물을 방해할 정도로 충분히 강하진 않았지 만, 이는 밀기울의 표면 반응성 페놀 함량, DPPH 라디컬 소거활성 및 ABTS 라디컬 소거활성을 증가시키는 효과가 있었다. 결론적으로 고압균질처리로 밀기울의 페놀 화합물 은 표면반응 메커니즘에 의해 항산화 활성이 향상될 수 있 으며, 나아가 천연 항산화제로써 식품산업에서 기능성소재 로 활용할 수 있을 것이다.