서 론
된장은 대두를 주원료로 하는 한국 고유의 전통발효식품 으로서 곡류 위주의 식생활로 부족하기 쉬운 단백질을 얻 을 수 있는 주요 공급원이다. 이 발효식품은 단백질 함량 이 높아 영양적으로 우수한 발효식품으로서 주요 식품 및 양념장으로서 오랫동안 이용되어 왔으며, 다양한 연구개발 및 기능성이 확인됨에 따라 식품학적 가치가 재조명되고 있다. 된장의 기능성으로는 항고혈압작용, 혈전용해작용, 콜레스테롤저하 등의 심혈관계질환의 예방기능이 밝혀졌으 며, 면역기능 강화작용과 항산화효과 등 질병 및 노화억제 관련기능성이 확인되었다(Hosoi, 1996; Yoo et al, 1998; Iwai et al., 2002). 또한 항암작용과 항 돌연변이작용이 잇 따라 보고됨에 따라 점차 기능성식품소재로서의 가치가 부 각되고 있다(Takahashi et al., 1995). 최근에는 편리성을 추 구하는 소비자의 욕구 때문에 공장에서 생산되는 제품의 수요가 점점 증가되고 있다. 또한 개량식 된장이 소비자의 기호에 맞게 여러 가지 부재료를 첨가하여 기능성을 향상 시키려는 연구가 활발히 진행되고 있다. 된장의 품질은 원 료와 배합비율, 메주의 종류, 부가원료 등에 따라 각 특성 이 다르게 나타나며, 소금의 종류와 농도에 따라서 발효조 건 또한 달라진다(Kim et al, 1989; Joo et al., 1992a; Joo et al. 1992b; Choi et al., 2006). 된장의 원료 중 식염은 보통 12.0% 이상의 소금을 첨가하여 이상발효와 부패를 방지하는데 사용되고, 제조 후 된장의 저장성을 높이는데 기여한다(Mok et al., 2005). 보통 산업적으로는 식염 12.0%를 기준으로 된장을 제조하게 되지만, 전통된장은 공 장에서의 제조처럼 보존제가 첨가되지 않기 때문에 미생물 에 의해 부패되는 것을 억제하기 위하여 15-20% 고염으로 제조된다. 또한 소금은 된장의 짠 맛에 관여하게 되는데, 과다한 사용은 고혈압, 뇌졸중, 위암, 신장병, 간경변증, 만 성신부전증 등 각종 성인병을 유발할 수 있으므로 기호성 향상과 성인병 예방을 위해 식염 함량을 낮출 필요가 있다 (Kim et al., 1995; Park et al., 2002). 본 연구에서는 식염 함량을 달리하여 된장을 제조하고 microflora 분석실험을 진행하였다. 또한 염도를 다르게 제조한 된장의 향미 성분 변화를 함께 분석함으로써, 염도 별 된장의 풍미와 품질을 객관적으로 살펴보았다. 이로써 미생물과 향미 성분에 영 향을 끼치지 않는 한도 내에서 첨가 가능한 최소 식염의 양을 확인하였다.
재료 및 방법
된장의 제조방법은 된장제조의 표준화 연구방법에 준하여 제조하였으며(Park et al., 2002), 사용된 메주(순창발효미생 물센터)는 개당 약 700 g으로 제조된 메주를 사용하였다. 메 주는 물로 2회 세척하여 햇볕에 2-3일 동안 메주표면에 습기가 없어질 때까지 자연건조해준 뒤 된장의 제조에 들어 갔다. 된장의 식염농도는 각각 4.8, 8.4, 12.0, 15.6, 19.2%으 로 달리하여 만들었으며, 각 시료에는 메주 7개씩 사용하 였다. 입이 넓은 20 L 항아리를 짚불을 이용하여 내부를 소 독하여 준 뒤, 항아리 안에 메주를 넣어 식염수를 이용해 침수시켜 주었다. 메주가 침강된 후 2-3일이 지나고 나면 숯 2개와 말린 홍고추 6개를 첨가해주었다. 각 시료를 30일 동안 발효시킨 뒤에 상등액을 제거하고 고형분의 된 장으로 분리하였고, 10 L 항아리에 담아 발효를 진행하였다.
된장의 생균수 측정은 호기성균, 호염성균, 효모균, 유산 균과 곰팡이의 균수를 측정하였다. 사용된 시료액은 각 시 료 10 g을 멸균 생리식염수를 넣어 전체 부피를 100 mL를 맞춘 뒤, 시료를 용해하여 2시간 동안 균질화 하였으며 109배까지 연속적으로 희석한 다음 희석액 0.1 mL을 각 배 지에 도말하여 생균수 측정을 하였다. 각각의 균수 측정에 사 용된 배지와 조건은 다음과 같다. 호기성균 Nutrient agar (Difco Becton Dickinson, Cowley, Oxford, UK), 30°C에서 2일 간 배양; 호염성균 HM agar(KCl 2 g, MgSO4·7H2O 1 g, CaCl2 0.36 g, NaBr 0.23 g, NaHCO3 0.06 g, FeCl3, peptone 5 g, yeast extract 10 g, dextrose 1 g, agar 24 g, NaCl 100 g, distilled water 1 L), 30°C에서 4일간 배양; 효모균수 Yeast Mold agar(Difco Becton Dickinson, Cowley, Oxford, UK) + 20 μg/ mL chloramphenicol, 25°C에서 4일간 배양; 유산균 MRS agar(Difco Becton Dickinson, Cowley, Oxford, UK)에 anaerobic system gas pak(Difco Becton Dickinson, Cowley, Oxford, UK)을 이용하여 혐기조건을 만든 후, 37°C에서 3 일간 배양; 곰팡이 Potato Dextrose Agar(Difco Becton Dickinson, Cowley, Oxford, UK) + 20 μg/mL chloramphenicol, 25°C에서 4일간 배양한 후 형성된 colony 수를 계수하였다.
된장에서 발효초기, 2개월, 4개월, 6개월, 9개월, 12개월에 각각 호기성 세균, 호염성 세균, 효모, 유산균과 곰팡이를 분리 배양한 후 순수 분리된 균들은 Cellular Fatty Acid Composition분석(MIDI)을 통하여 동정하였다 (Sasser, 1990). 분석방법은 다음과 같다. 배양한 cell의 40 mg을 Teflon-lined screw cap tube에 옮긴 후, 50% methanol에 15.6% NaOH를 첨가한 용액 1mL를 넣고 100°C에서 30분간 가열하여 실온에서 식혀 가수분해하였다. 여기에 methanolic-HCl 2mL(6.0 N HCl 325mL과 methanol 275 mL 혼합용액)을 첨가 후, 80°C에서 10분간 가열하여 메틸화하였다. 다음으로 이를 급냉시켜 1.25 mL hexane/ methyl-tert-butylether (1:1:v/v)을 넣어준 뒤 10분간 교반시 켜 CFA를 추출하였다. 실온에서 정치하여 2개의 층으로 분리한 뒤 하등액을 제거하고 3 mL의 dilute NaOH(10.8 g NaOH/900 mL D.W)를 첨가하여 다시 10분간 교반시켜주 었다. 그 후에 washing 단계를 거친 뒤 실온에서 정치하여 상등액의 2/3정도를 screw-capped하였다. 시료의 분석에는 Agilent technologies 6890 gas chromatography(Agilent Technologies model 6890N, Agilent, Palo Alto, CA, USA)를 이용하였다. Separation column은 A30m×0.320mm×0.25 μm Crosslinked Methyl siloxane column(HP-1)(Agilent, Palo Alto, CA, USA)을 사용하였으며, 분석된 profile은 Sherlock MIS Software(Sherlock MIS ver. 6.2, Microbial ID, Inc. (MIDI), Newark, DE, USA)를 이용하였다.
향기성분 분석은 Head-space SPME(Solid Phase Micro Extraction) method를 사용해 GC-MS(Agilent 6890N, Agilent 5973 network mass selective detector, MSD. Agilent Co, Palo Alto, CA, USA)로 분석하였다. SPME Fiber는 50/30 μm DVB / CarbpxenTM/ PDMS Stable FlexTM for Manual Holder gray(Agilent, Palo Alto, CA, USA)를 사용하였다. Column은 DB-5ms(60m length×0.25mm I.D×0.25 μm film thickness: J&W Scientific, Folsom, CA, USA)을 이용하였다. 이동상 gas는 헬륨을 1.0mL/min씩 흘려보냈으며, ionization voltage 은 70 eVm/z의 범위는 33-350, injector temp 200°C, detector temp 250°C로 하였다. 20mL SPME vial에 시료 3 g을 각각 넣어준 뒤 Water bath를 이용해 40°C의 온도에서 30분 동안 equilibrium 시켜주었다. 그 다음으로 equilibrium state의 vial 에 SPME를 주입하고 30분 동안 흡착하였다. 흡착된 SPME 를 GC-MS injector에 주입하여 10분 동안 탈착하였다. Oven temp setting은 40°C에서 5분 동안 유지하며 200°C까 지 5°C/min의 속도로 온도를 올려주었으며 200°C에서 20분 동안 유지하였다.
결과 및 고찰
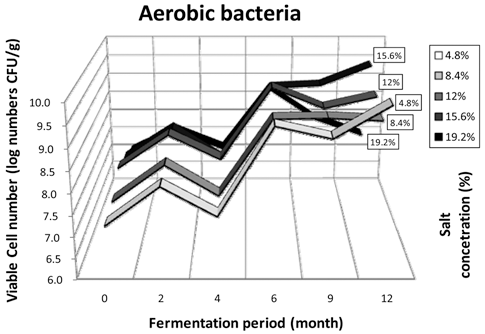
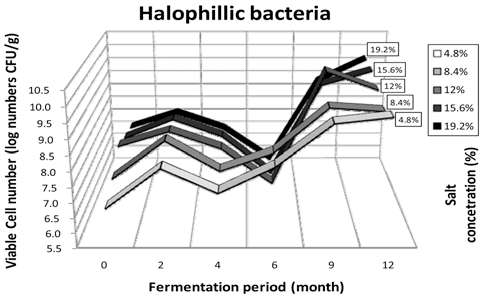
된장에서 발효기간 동안 호기성균, 호염성균, 효모균, 유 산균과 곰팡이의 생균수를 측정하였다. 도말한 각각의 시 료에서 5균주씩 임의로 선정하여 분리하였으며, 호기성균 118종, 호염성균 136종, 효모 10종, 유산균 40종과 곰팡 이 51종으로 총 322종을 지방산분석을 통하여 동정하였 다. 호기성균의 생균수분포는 Fig. 1에 나타냈다. 전체 시 료가 발효 2개월까지는 7.6-8.3 log CFU/g 수준으로 증가 하였지만 발효 4개월 때에는 7.1-7.7 log CFU/g 수준으로 생균수가 감소하였다. 발효 6개월에 전체적으로 가장 많 은 생균수의 변화가 있었으며 8.8-9.5 log CFU/g 수준으로 증가하였다. 이 후 발효 12개월까지는 19.2% 고염 된장을 제외한 모든 시료에서 유사한 생균수를 유지했다. 이와 반 대로 19.2% 된장은 총균수가 약간 감소하는 경향을 보였 다. 그러나 전체적으로 보았을 때 발효기간 동안 크게 증 감하지 않고 유지되는 것으로 확인되었다. 분리한 호기성 세균의 우점종을 살펴보게 되면, 4.8%, 8.4% 저염 된장에 서 발효초기에 Bacillus amyloliquefaciens가 가장 높은 비율 을 차지하고 있었으며, 숙성 2개월에는 B. amyloliquefaciens 와 B. licheniformis가 높은 비율을 차지하였다. 발효 4개월 째에는 B. amyloliquefaciens와 B. subtilis, 발효 6개월에는 B. licheniformis와 Paenibacillus macerans, 발효 9개월에 는 P. macerans, 마지막 발효 12개월에는 4.8% 시료에서 는 P. macerans, 8.4% 시료에서는 B. subtilis가 높은 비율 을 차지하고 있었다. 12.0%, 15.6%, 19.2% 시료에서는 발 효초기 B. subtilis가 가장 높은비율을 차지 하였다. 발효 2개월에는 12.0%와 15.6%가 B. subtilis가 동일하게 높은 비율을 보였고 19.2%에서는 B. amyloliquefaciens, B. licheniformis 와 B. subtilis 균이 동정되었다. 발효 4개월 에는 12.0%와 19.2%의 경우 저염 시료와 마찬가지로 B. licheniformis가 우점종을 차지하였고, 15.6%에서는 B. amyloliquefaciens, B. licheniformis와 B. subtilis등의 균이 동정 되었다. 발효 6개월에는 12.0%와 15.6%에서 P. macerans와 Virgibacillus pantothenticus가 동정되었고, 19.2% 시료에서는 B. amyloliquefaciens, B. subtilis, P. macerans, P. polymyxa, 그리고 V. pantothenticus등 다양한 종이 확인되었 다. 발효 9개월에는 12.0%의 경우 전과 동일하게 P. macerans가 가장 많은 비율을 보였고, 15.6%의 경우 B. atrophaeus가 우점종이며, 19.2%의 경우 B. subtilis가 가장 많이 동정되었다. 12개월에 12.0%에서는 Staphylococcus lentus, V. pantothenticus, B. subtilis, 그리고 B. alcalophilus 등 다양한 균들이 나타났고 15.6%에서는 B. subtilis가 19.2%에서는 V. pantothenticus가 우점종으로 나타났다. 12.0% 된장과 15.6%와 19.2% 고염 된장에서는 발효초기 부터 B. subtilis가 된장발효과정에 크게 관여하는 것을 볼 수 있었다. 발효가 진행됨에 따라 B. subtilis, P. macerans, B. amyloliquefaciens와 B. licheniformis 등 다양한 균들이 발효에 관여하는 것을 관찰할 수 있었다. 4.8%와 8.4% 저 염 된장에서는 B. subtilis가 발효 초기부터 큰 관여를 하지 않았지만, 발효가 지속됨에 따라 B. subtilis의 비중이 점차 커 졌고, 발효가 지속됨에 따라 고염된장들과 비슷한 microbflora 의 경향을 보였다. 각 시료에서 나타난 microbflora 패턴을 보 았을 때 4.8%와 8.4% 시료와 12.0%, 15.6%와 19.2% 시료 는 발효초기에 있어 다른 패턴을 보이지만 발효가 진행됨 에 따라 비슷한 미생물 생장 환경을 갖추게 되는 것으로 생각된다. 호염성균의 생균수 분포는 Fig. 2에 나타냈다. 호기성균 생균수의 패턴에서 4.8%와 8.4% 저염 된장과 12.0%, 15.6%와 19.2% 고염된장은 2가지의 약간 다른 패 턴을 보였다.4.8%와 8.4% 저염 된장의 경우 발효초기 6.58-6.93 log CFU/g 수준에서 발효 2개월째에 7.92-8.22 log CFU/g 수준으로 고염된장에 비해 생균수가 크게 증가 하였다. 발효 4개월에는 7.09-7.20 log CFU/g으로 약간 감 소하였으며, 지속적인 발효가 진행됨에 따라 9.20-9.51 logCFU/g 수준으로 생균수가 증가하였다. 12.0%, 15.6%와 19.2% 고염 된장에서는 저염 된장에 비해 생균수 증감이 많은 변동을 보여주었다. 발효초기부터 2개월까지 7.64- 8.00 log CFU/g 수준으로 생균수가 증가하다가 발효 2개 월부터 6개월까지는 5.83-6.14 log CFU/g 수준으로 생균 수가 크게 감소하였다. 또한 발효가 지속됨에 따라 9개월 까지 8.85-10.07 log CFU/g 수준으로 생균수가 크게 증가 하는 경향을 보여주었다. 이는 전체적으로 발효과정에 있 어 각 시료 내에서 생균수가 두 번의 증감변화를 보여주었 는데, Fig. 1에서의 호기성균의 생균수에서도 비슷한 경향 을 보여주었다. 지금까지 연구되어진 장류 발효연구에 대 한 미생물의 생육 패턴은 1차 발효형태의 생육곡선을 보 였지만 본 연구에서 확인된 미생물의 생육패턴은 지금까지 연구된 자료와는 다른 2차 발효형태의 복합패턴을 보였다. 호염성균의 우점종을 살펴보면 4.8% 시료에서 발효초기와 발효 2개월에 Bacillus licheniformis가 높은 비율을 차지하 고 있었고, 발효 4개월에는 B. amyloliquefaciens와 B. licheniformis가 우점종으로 나타났다. 발효 6개월에는V. pantothenticus가 높은 비율로 분리되었으며, 발효 9개월에 는 Oerskoviaturbata가 높게 동정되었다. 발효 12개월에는 V. pantothenticus가 높은 비율을 보였다. 8.4% 시료에서는 발효 2개월에 B. amyloliquefaciens가 가장 높은 비율을 차지하고, 발효 4개월에는 B. licheniformis가 우점종을 차 지하고 있었다. 발효 6개월에는 B. subtilis, 발효 9개월에 는 B. licheniformis와 P. macerans, 발효 12개월에는 S. cohnii와 B. amyloliquefaciens가 높은 비율을 차지하였다. 12.0% 시료는 발효초기에 S. nepalensis가 높은 비율을 차지 하고 있었고, 발효 2개월에는 B. licheniformis, 발효 4개월 에는 B. licheniformis와 B. amyloliquefaciens, 발효 6개월에 는 B. subtilis와 B. atrophaeus, 발효 9개월에는 B.atrophaeus 와 P. macerans, 발효 12개월에는 B. licheniformis로 각각 큰 비율을 차지하고 있었다. 15.6% 시료는 발효 2개월에 는 S. cohnii가 높은 비율을 차지 하였으며, 발효 4개월에 는 B. subtilis와 B. licheniformis가 우점종이였다. 발효 6개월에는 B. atrophaeus가, 발효 9개월에는 B. subtilis가 가장 많은 비중을 차지하였고, 발효 12개월에는 B. amyloliquefaciens가 높은 비율을 차지하고 있었다. 19.2% 시료 호염성균의 동정 결과를 보게 되면 발효 2개월에는 S. cohnii가 높은 비율을 차지하였으며, 발효 4개월에는 B. subtilis와 B. licheniformis, 발효 6개월에는 B. atrophaeus, 발효 9개월에는 B. subtilis, 발효 12개월에는 B. amyloliquefaciens가 높은 비율을 차지하고 있었다. 효모는 전체적으로 발효 초기에서만 2 log CFU/g 이하의 아주 낮 은 수준의 분포를 보였으며, 발효가 2개월만 진행되어도 생균수가 관찰되지 않는 것으로 보아 아주 낮은 수준으로 존재하거나 존재하지 않는 것으로 생각된다. 또한, 다른 염 도의 시료에서는 전 발효기간에 걸쳐 전혀 효모가 발견되 지 않았으며, 검출된 효모는 모두 Pichia guilliermondii로 동 정되었다(결과 미제시). 된장에서의 유산균은 전체적으로 발 효가 진행됨에 따라 점차 감소하는 경향을 보여주었으며, 4.8% 시료만 제외하고 전체적으로 발효 2개월까지 검출되 었다. 4.8% 저염 된장의 경우 발효 4개월까지 유산균이 분 리되었다. 발효 4개월 이후에는 그 수준이 효모와 마찬가지 로 2 log CFU/g 이하의 낮은 수준으로 존재하거나 검출되지 않았다. 이때 분리된 균주는 초기단계에서는 Pediococcus pentosaceus와 P. acidilactici로 각각 높은 비율로 우점종을 차지하고 있었으며, 발효 2개월과 4개월에는 Enterococcus faecium가 계속적으로 높은 비율로 검출되었다. 8.4% 저염 발효 된장의 경우 동정된 균주는 P. pentosaceus와 P. acidilactici, 12.0% 시료의 경우 P. acidilactici, 15.6% 고염된 장의 경우 E. durans, 19.2% 고염된장의 경우 E. faecalis가 가장 높은 비율로 나타났다. 전체적인 생균수로 보아 유산 균은 발효에는 큰 영향을 미치지 않는 것으로 보인다(결과 미제시). 4.8% 저염 된장의 경우 2개월 시료에서 분리한 모 든 곰팡이가 Aspergillus oryzae로 동정되었고, 발효 6개월에 는 Scopulariopsis brevicaulis가 검출되었다. A.oryzae는 메주 의 대표적 우점종으로 알려져 있다(Mok et al., 2005). 8.4% 시 료의 경우 4개월에 분리된 균주의 우점종은 Eurotiumrubrum 이였고, 발효 6개월에서 분리한 균주는 A. versicolor가 가장 높은 비율을 차지하였다. 12.0%와 15.6% 시료는 전체적으로 A. oryzae가 높은 비율로 동정되었고, 발효초기와 발효 12개월에서 관찰되었다. 19.2% 시료는 발효 2개월에 Penicillium chermesinum와 Eurotium amstelodami가 검출되었 다(결과 미제시).
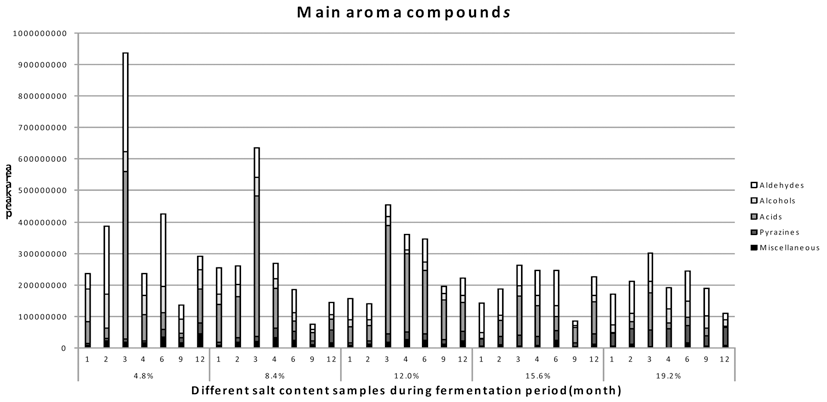
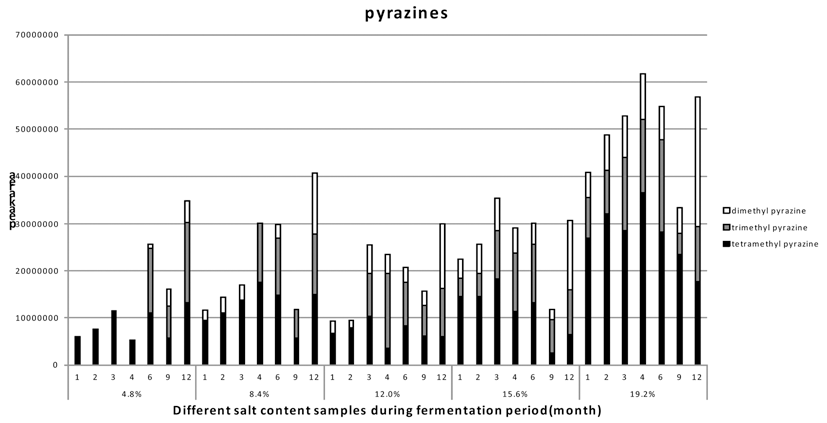
된장의 주요 향기 화합물들은 기존에 연구되어진 문헌들 을 참고하여 Table 1을 통해 나타내었다(Arctander, 1982; Sugawara, 1991; Kim et al., 1992). 본 실험은 주요 향기 성분들을 중심으로 각 시료들의 향미 성분의 변화를 보기 위해 SPME를 이용하여 발효기간 중 변화량값을 GC-MS 통해 비교 분석하였다. 4.8%, 8.4%, 12.0%, 15.6%와 19.2% 된장의 주요 향미성분 분석을 Fig. 3를 통해 나타내 었다. 먼저 aldehydes는 모든 시료에서 발효 초기에는 비슷 한 양이 생성되었지만 발효가 진행됨에 따라 4.8% 저염 시료에서 다른 시료에 비해 월등히 많이 생성되는 것을 확 인할 수 있었다. 그 중 benzaldehyde가 저염 된장일수록 높은 값을 보였으며, 4.8% 저염 시료에서 가장 높은 값을 보였다. Benzaldehyde는 crush bitter almond향을 띄며, 된 장의 기호도에 있어 긍정적인 측면을 보이는 생산물이다 (Kim et al., 1992). 반대로, benzeneacetaldehyde 같은 경우 는 고염의 시료일수록 높은 값을 나타냈다. 하지만 지속적 인 발효가 이루어지면 발효 6개월부터 각 시료들 간의 격 차가 줄어들며 발효 12개월에는 비슷한 수치의 값을 보였 다. Alcohols 중 2,3-butanediol과 1-octen-3-ol은모든 시료 에서 염 농도와 상관없이 비슷한 경향의 수치를 보였다. 하지만 3-octanol은 4.8%와 8.4% 저염 된장의 시료에서만 생성 되어졌으며, phenethyl alcohol은 4.8% 저염 된장에서 만 생성되어졌다. 특히 phenethyl alcohol의 경우에는 hydrocarbon odor 냄새가 나는 화합물로서 대장균등의 세균 세포 표면에 작용하여 DNA복제의 초기단계를 특이적으로 저해하며, 장미유 등에 함유되어 있는 향료 성분중 하나이 다. 이화합물은 4.8% 시료 외에서는 생성되지 않았는데 이 는 다른 시료의 경우에는 높은 염에 의해 다른 외부 균들 의 생육을 억제할 수 있지만, 그렇지 못한 4.8% 시료 내 미생물들이 상대적으로 생육하며 생산한 것으로 판단된다 (Sugawara, 1991). 하지만 phenethyl alcohol 또한 발효가 진행됨에 따라 발효 6개월 이후로는 더 이상 생성되지 않 았으며, 점차 시료들 간의 향기성분이 비슷한 값을 나타냈 다. 3-Octanol은 대두 특유의 풋내를 내는 흙냄새 화합물로 서 대두의 발효과정이 늦어질 경우에 많이 발생하게 되는 데 발효가 진행됨에 따라 8.4% 시료에서는 생성되지 않지 만 4.8% 시료에서는 발효 12개월에서도 관찰되었다. Acids 는 크게 acetic acid와 2-hydroxy-benzoic acid가 측정되었는 데, 발효 기간 중 변화량을 살펴보게 되면 처음 발효기간 3개월 동안에는 저염성의 시료일수록 더 많은 acetic acid 를 생산하였다. 하지만 3개월 이상의 발효가 진행됨에 따 라 고염성 시료들의 acetic acid 생산량이 점차 늘어났고, 4개월 이후부터는 12.0% 된장이 가장 많은 양을 생산하였 다. 발효가 계속 진행됨에 따라 높은 acetic acid의 생산량이 점차 감소되었으며 전체적으로 일정량의 낮은 수치를 유지 하였다. 향미성분 내 acetic acid는 소량으로 있을 때에 단 과일향과 배향을 내는 화합물로서, 많은 양을 생산 시에는 오히려 역한 쉰내를 내며 풍미저하를 가져올 수 있다 (Sugawara, 1991; Kim et al., 1992). 2-hydroxy-benzoic acid 또한 저염의 시료일수록 많은 양을 생산하였으며 발효가 6개월 이상 진행됨에 따라 더 이상 생성하지 않았다. 반면 pyrazines의 경우 에는 고염의 시료 일수록 높은 값을 나타냈 다. Dimethyl pyrazine과 trimethylpyrazine은 된장 내에서 특유 의 향에 크게 기여하는 화합물로 알려져 있다(Sugawara, 1991; Kim et al., 1992). 각 시료 별 pyrazines의 dimethyl pyrazine, trimethylpyrazine과 tetramethylpyrazine을 Fig. 4에 나타냈다. 전체적으로 발효가 진행됨에 따라 pyrazines값 이 증가되어 졌으며, tetramethylpyrazine보다 저분자인 trimethylpyrazine과 dimethtylpyrazine의 비중이 더 많아지 는 경향을 보였다. 15.6%와 19.2% 고염 된장에서는 발효 초기부터 dimethyl pyrazine과 trimethylpyrazine이 생성되었 다. 반면 4.8%와 8.4% 저염 된장에서는 발효 4개월이 지 난 후부터 pyrazine의 생성량이 늘어나기 시작했다. 발효 12개월이 되었을 때는 8.4% 저염 된장의 경우 19.2% 시 료의 생성량보다는 부족하지만 다른 시료와 비교 했을 때 부족하지 않은 pyrazine이 생성되어진 것을 확인할 수 있 었다. 저염화 된장의 전체적인 향기 성분을 보았을 때 저 염의 시료일수록 다양한 향기성분을 추가 생성하는 것을 확인할 수 있었다. 특히 4.8% 저염 된장의 경우에는 benzaldehyde, 2-pentyl-furan, phenethyl alcohol과 3-octanol 등이 보다 높게 나타났다. 또한 초기 발효과정에서는 다양 한 acid가 다른 시료에 비해 많이 생성되어져 보다 다양한 향기성분이 높게 나타났다. 반면 된장의 지표성분인 pyrazine 성분들은 발효초기에는 고염 된장에 비해 많은 양을 생성하지는 못했다. 그러나 발효과정이 지속됨에 따 라 발효 12개월이 되었을 때에는 고염 된장과도 비슷한 수치의 값을 나타냈다. 특히 8.4% 저염 된장의 경우에는 발효 12개월에 고염성 장류와 전체적으로 acids를 제외한 향기 성분에서 비슷한 값을 보였다. 구체적인 향과 성분분 석의 비교를 위해서는 GC-O를 통해 각 시료의 향기분석 과 전문패널을 통한 관능검사를 추가적으로 진행이 필요로 하지만, 이 수치만을 통해서도 된장의 전체적인 향기성분 의 변화와 경향성을 파악할 수 있었다. 이는 최적화 및 관 능적인 추가적 연구를 필요로 하지만, 본 연구에서는 저염 성 된장에 대한 산업적 이용 가능성을 확인할 수 있었다.1
요 약
본 연구에서는 염 농도에 따른 된장의 발효과정 중에 microflora와 향미의 변화를 분석하였다. 염 농도가 4.8%, 8.4%인 저염 된장의 총균수와 균총의 패턴은 염 농도가 12.0%, 15.6%, 19.2%인 고염 된장과 유사하게 나타났다. 호기성균과 호염성균의 경우에는 모든 염도와 전 발효 기 간에 7-11 log CFU/g의 높은 수준에 수치를 보였다. 호기 성 세균과 호염성 세균의 균총을 보았을 때, 저염 된장의 발 효초기에는 Bacillus licheniformis와 Bacillus amyloliquefaciens 가 많은 비중을 차지하였다. 주요 향기성분들을 중심으로 각 시료들의 향미성분에 경향성을 보기 위해 SPME를 이용하 여 발효 기간 중 변화량 값을 GC-MS 통해 비교 분석한 결과, dehydes, alcohols, acids의 경우 발효 초기부터 발효 3개월까지 저염화 시료에서 많이 생성되었으며 발효가 지 속적으로 진행됨에 따라 시료들 간의 격차는 점차 감소하 였다. 발효 6개월 부터 저염 시료에서도 다양한 pyrazine 이 형성되었다.