서 론
호메시스(hormesis)란 ‘잠재적으로 위험한 수단이지만 낮 은 용량으로 주는 자극’이라고 정의한다. 이는 Amdt- Schulz 법칙인 ‘소량의 독은 자극작용이 있다’를 다시 설명 한 것으로서(Luckey, 1980), 어떤 물질의유해량 이하 범위 내에서의 긍정적인 자극을 말한다(Kim and Lee, 1998).
호메시스는 과거 10년이 넘도록 연구자들에게 흥미를 유발시켜왔고(Kaiser, 2003), 다방면으로 연구되어왔다 (Calabrese and Baldwin, 2001; Calabrese and Baldwin, 2003; Calabrese, 2008). 특히 최근 식품 산업분야에서는 호 메시스 이론을 적용시켜 상업적인 효용을 증대시키고자 많 은 노력을 기울이고 있다(Shama and Alderson, 2005). 상 업적인 효용에는 식물체에 호메시스를 적용하여 항균성을 향상시키고, 숙도를 조절하며, 건강기능성 물질을 증폭시키 는 효과를 얻고자 하는 것 등이 포함된다. 식물체의 DNA 가 복원 가능한 수준 내에서자극하여 식물체 세포 내 대사 를 조절함으로써 연구자가 원하는 물질 함량을 증가시킬 수 있으며, 이 자극을 제거하더라도 후속반응은 계속되는 것으로 알려져 있다.
호메시스를 활용함에 있어 유의해야 할 점은 DNA가 손 상되지 않고 복원 상태로 가능한 정도의 자극을 이용하여 유용한 결과를 얻을 수 있도록 자극의 한계를 고려해야 한 다는 것이다(Cho et al., 2008). 호메시스를 이용한 연구를 어렵게 하는 원인 중 하나는 반복실험에 차이가 많다는 것 이고, 또한 수 회의 실험 중 한 두 번 정도만 유의미한 결 과가 도출되는 것이다(Kim and Lee, 1998). 일정 수준의 호메시스를 이용한 반복실험에서 똑같은 반응을 보이지 않 으며, 모든 작용물질의 최고 용량-반응 곡선은 각각 다른 형태를 가지므로 어떤 수준이 가장 좋다고 특정 지을 수가 없다. 그러므로 통계적으로 확실한 결과를 얻을 때까지 많 은 다양한 수준에서 반복실험을 수행하여 넓은 범위의 표 준화가 이루어져 실제적인 규모로 호메시스가 이용되도록 해야 할 것이다.
식품 산업분야에서의 호메시스에 대한 다양한 활용 가능 성이 존재하고 있는 가운데, 아직까지 국내에서는 식품에 서의 호메시스를 활용한 연구들은 많이 수행되고 있지는 않다.따라서 본 연구에서는 최근까지 국내외에서 학술적으 로 발표된 식품에서의 호메시스 연구들을 수집하여, 이들 연구들을 바탕으로 여러 호메시스 식품 처리 기술에 따른 다양한 결과를 정리분석하고자 하였다. 이는 추후 식품에 서의 호메시스 연구를 수행하는 연구자들에게 참고자료로 활용될 수 있을 것이다.
본 론
호메시스 기술과 유전자변형기술은 현대 생명공학기술을 이용하여 생물체의 유전자 발현을 조절함으로써 인간이 원 하는 결과를 인위적으로 유도한다는 점에서 맥락을 같이 한다. 하지만 유전자변형기술은 원하는 특성을 만드는 유 용한 유전자를 선택하여 다른 생물체의 유전자에 결합시키 고 증식시키는 기술로서 현대 생명공학기술 중에서도 유전 자 수준에서 생물체를 다루는 기술을 의미하지만, 호메시 스 기술은 유전자변형기술처럼 유전자 변형을 유도하는 기 술이 아니라 단지 대사를 조절하는 기술이다(Cho et al., 2011).
유전자변형기술은 식량, 환경, 에너지자원 및 의료 분야 등 다양한 분야에 도움을 주는 기술로 각광받고 있으며, 이 기술을 통한 혜택이 많은 반면, 유전자변형기술의 이용 에 따른 자연생태계나 인체 및 동물에게 미치는 다양한 측 면에서의 우려도 많이 제기되고 있다. 미국생태학회에서는 유전자변형생물체가 환경에 방출될 경우 발생할 수 있는 생태학적 문제점들에 대하여 1989년과 2005년에 각각 의 견서를 학회지에 게재하였다(Kim et al., 2003). 의견서에 제시된 유전자변형생물체의 잠재적 위해성은 새롭거나 보 다 강력한 유해생물의 출현, 현존 유해생물과 유전자변형 생물체와의 교배로 인한 악영향 강화, 토양생물, 곤충, 조 류 및 기타 동물과 같은 비표적 생물종에 대한 위해, 농업 생태계를 포함하는 생물군집의 파괴, 종다양성 또는 종내 유전적다양성의 회복 불가능한 손실 또는 변화 등이다. 또 한, 유전자변형생물체가 인체에 미치는 영향에 대해 논할 때에 일반적으로 고려해야 할 사항은 새로운 식품의 영양 학적 조성이 기존의 식품과 다를 가능성, 알러지 요인이 될 수 있는 항원 단백질 발현 가능성, 예상치 못한 숙주의 대사 기전 변화, 내재된 독성 혹은 약리적 물질의 과발현 가능성, 새로운 유전자와 생산물에 대한 내재된 독성 여부 등이 있다고 하였다(Malarkey, 2003). 반면 식품의 호메시 스처리기술은 유전자변형기술과 같은 유전자 조작을 하지 않으며, 외부에서 적당한 자극을 주어 기능성 물질 생합성 유전자를 발현시킴으로써 필요한 물질이 합성되는 유전자 발현을 유도하는 기술이라고 말할 수 있다.
식물의 생육, 증식 및 저항성을 촉진하는 여러 종류의 물질은 크게화학적 작용물질과 물리적 작용물질로 나눌 수 있다. 화학적 작용물질은 항생물질, 호르몬, 비살균성 화합 물, 비소와 비소유도체, 색소, 표면활성제, 농약 및 금속 등 이 포함되어 있다. 물리적 작용물질은 열, 저온처리, 광선, 초음파, 자장 및 전기 등이 포함되며 소량으로도 매우 효 과적인 것으로 알려져 있어, 번식, 생존율, 생장, 호흡, 섭 식효율 및 수명 등에 관해 많이 연구가 되어있다(Luckey, 1980).
식품 산업분야에서는 과일이나 채소의 피토케미칼 (Phytochemical) 함량을 증가시키기 위하여 여러 물리적인 자극을 주는 방법을 사용하여 왔다(Vigneaultet al., 2012). 이들 공정을 적용시킬 때에 고려해야 할 점은 균일성, 효 율성, 조작성 등이 있는데, 자극들을 주기 전에는 실험실 연구를 통하여 각 대상의 특성을 고려한 최적 조건을 정립 하여야 하며, 처리 규모가 증가할 때 발생할 수 있는 여러 문제점을 최소화해야 한다.
압력 호메시스 공정은 High pressure 공정, hypobaric 공 정, hyperbaric 공정으로 분류할 수 있다(Vigneault et al., 2012) (Fig. 1). High pressure 공정은 과일이나 채소의 미생 물 감소나 효소 비활성화를 위해 사용하는 방법이다. Hypobaric 공정은 최근의 기술로서 열을 빨리 제거할 수 있어 진공 예냉 처리공정으로 알려져 있다. 또한, 저장 중 산소 농도를 감소시키고 해로운 가스들을 제거하는 효과도 있다(Wang et al., 2001). Hyperbaric 공정은 산소 농도를 21 kPa보다 높이는 공정이다(Kader and Ben-Yehoshua, 2000).
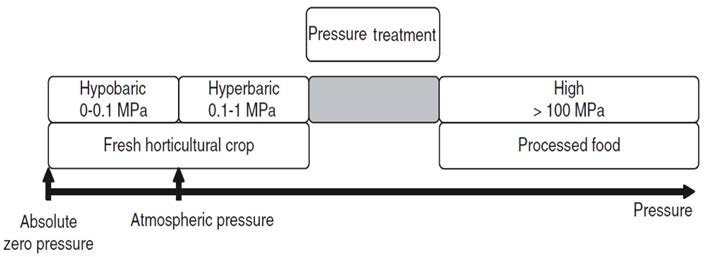
압력 호메시스 공정은 생산품의 형태나 크기에 상관없이 목표로 하는 압력에 쉽게 도달할 수 있다는 장점이 있다.
또한, 단일 혹은 다공정 시스템, 비유동 혹은 유동적 시스 템 모두 적용 가능하고, 공정 시 소모되는 필요 에너지가 매우 적으며, 에너지가 모두 소비될 때까지 상당히 오랜 시 간동안 압력 유지가 가능하다. 단점으로는, 보고된 연구 결 과가 미흡하며, 압력이 최적 상태에 도달할 때까지 방사능 이나 전자기장 공정보다는 상대적으로 오랜 시간이 소요된 다는 것이다. 또한, 압력을 견딜 수 있는 강한 구조물이 필 요하며, 공정이 끝난 후 압력을 원상태로 돌릴 때 주의가 필요하다. 너무 빠르게 압력을 변화시키면 생산품에 좋지 않은 영향을 가져올 수 있다. 압력 호메시스는 연속처리 공 정보다 일괄처리 공정에서 더 적합하다. 압력 호메시스 공 정에 대한 연구 결과는 Table 1과 같이 정리할 수 있다.
| Food (Cultivar) | Experimental conditions | Hormetic effects |
|---|---|---|
| Cabbage (Heckla, Predikant) | • At 400 Mpa, reduced the proportion of soluble fiber in the Heckla at all temperatures whereas no effects were seen at 500 Mpa (Wennberg and Nyman, 2004) | |
| Mango (Haden, Maya) | • Extended shelf life at pressures 0.01 and 0.013 MPa (Apelbaum et al., 1977) | |
| Mume Fruit (Kosyusaisyo) | ||
| Tomato (Roma) |
|
|
| Apple (Law Rome, Granny Smith) | • Reduced scald after 1 mon (Wang and Dilley, 2000) | |
| Asparagus (not mentioned) | ||
| Sweet cherry (Ferrovia), Strawberry (Pajaro), Table grape (Italia) |
|
|
| Sweet cherry (Ferrovia), Table grape (Italia) | • Disease resistance (Romanazzi et al., 2008) | |
| Tomato (DRK 453) | • Hyperbaric treatment Treated 0.1, 0.3, 0.5, 0.7 and 0.9 MPa at 20°C and 0.1 MPa at 13°C | • Reduced weight loss and enhanced firmness retention at 0.5, 0.7 and 0.9 (Liplap et al., 2013) |
방사선 자극작용에 대한 많은 증가가 보고되어 있으나 체계적인 재현성이 어려우며, 자극현상의 존재는 인정되나 변이성이 높아 실제적으로 이용하기가 매우 힘들다. 생물 체는 DNA, RNA, 단백질 합성, 호르몬, 신경전달물질, 대 사조절인자 및 특이한 분자 등이 통합되어 매우 복잡하므 로 방사선 호메시스의작용기작의 각각을 하나의 특이한 이 론으로서 해결하는 것은 매우 어렵다(Kim and Lee, 1998).
방사선 호메시스에 대한 초기 연구는 주로 자연광물의 방 사선을 이용한 것이었다(Kim and Lee, 1998). 혼합 방사선 원인 천연물질은 공기, 물, 유리, 금속, 조직 등의 물질을 통과할 때, α선과 β선은 정지되기 때문에 강한 γ선을 발생 한다. γ선과 x선은 비슷한 영향을 주는 것으로 발생원에 의 한 차이, 즉 핵외전자 수준에서 생성되는 x선은 보통 x선 장치에서 발생되나, γ선은 방사성물질의 핵 내 수준에서 발 생되며, 사용된 대부분의 x선은 γ선보다 에너지가 낮다.
오래전부터 농업분야에서 고선량 γ선이 식품멸균, 살충, 육종, 해충 구제, 발아억제 등을 위해 사용되고 있으며, 저 선량 γ선이 미치는 영향에 대하여도 많은 연구가 진행되었 다. 곡물류 종자와 식물에 γ선 조사를 한 호메시스 연구결 과는 조사 조건에 따라 매우 다양하게 나타났다. γ선을 0.00877~43.87 그레이(Gray, Gy) (0.00000877~0.04387 kGy) 의 범위 내에서 조사하였을 때, 벼는 식물의 키와 생산율이 증가되었으며(Thaung, 1960), 보리와 밀도 생육이 촉진되고, 수량이 증가되었다(Glubrecht and Niemann, 1971; Iqbal, 1980; Sheppard and Evenden, 1986). 밀은 식물체의 수량 증가는 없었으나 인산흡수가 증가되었고(Korosi and Krakkai, 1983), 옥수수는 발아율 증가, 생육이 촉진되었으 며 수량이 증가되었다(Caldera, 1971). 또한, 광합성이 증대 되었으며, 식물의 길이가 길어지고식물의 수량 및 단백질, 지방, 전분함량이 증가되었다. 대두는 숙성이 빨라지고, 수 량이 증가되었다(Stan and Croitoru, 1971). 감자는 수량 증 가, 발아 촉진과 함께 휴면기간 단축으로 한 계절에 1회 이상의 수확할 수 있는 가능성을 보여주었다(Sparrow and Christensen, 1950; Caldera, 1971; Luckey, 1980; Shama and Alderson, 2005). 토마토는 발아가 증가하였으며 생육이 촉 진되고 수량이 증가되었다(Miller and Miller, 1987). 또한, 숙기가 8일 정도 단축 되었으며, 인산흡수, 질소, 탄수화 물, 비타민 C 함량이 증가되었다(Sax, 1955). 상추(Sax, 1955)와 고추(Izvorska, 1973) 등에서도 생육이 촉진되고 수량이 증가되는 등 농업적 가치가 증가하는 것으로 보고 되었다.
x선을 이용한 호메시스 연구들도 식물종자의 발아율 증가, 발아 촉진, 생육 촉진 등의 효과가 있으나, 많은 변수 때문 에 일관된 결과를 얻기 힘들었다(Kim and Lee, 1998). x선 을 0.04385~26.31Gy(0.00004385~0.02631 kGy)의 범위 내 에서 조사하였을 때, 보리는 생육이 증대되었으며(Gaur and Joseph, 1972), 밀은 발아력이 증가하였고, 10일 정도 숙기가 빨라졌으며, 수량도 증가되었다(Kuzin, 1964). 옥수수 는 병에 대한 저항성이 증가하였고(Grisenko and Mazhara, 1968), 대두는 γ선 조사 결과와 비슷하게 발아력, 생육, 수 량이 증가하였다(Gaur and Joseph, 1972). 감자는 발아가 촉진되었으며(Jaarma, 1966), 배추(Kuzin, 1964), 상추(Sax, 1955)는 발아, 생육, 개화, 숙기 촉진 및 수량 증가 등의 효과가 있었다.
상기방사선 호메시스 연구들에 적용된 방사선 조사 수준 은 CODEX 국제식품규격위원회의 방사선 조사처리식품에 대한 일반규격(General Standard for Irradiated Foods. CODEX STAN 106-1983, Rev. 1-2003)에 명시되어 있는 식품으로 흡수되는 방사선 허용량의 최대흡수선량인 10kGy 보다 매우 낮은 수준이다. 그럼에도 불구하고 식물체에서의 방사선 호메시스 효과는 긍정적인 결과를 보여주고 있다. 따라서 식품에 호메시스 효과를 얻기 위하여 시도하는 방사 선 호메시스 방법은 안전성에 대한 문제가 없을 것으로 사 료된다. 다시 말해서, 식물체의 생산성 향상, 피토케미칼 함 량 증가 등 호메시스 효과를 얻기 위하여 방사선을 사용한 다고 하더라도, 그 수준은 CODEX에서 제시한 방사선 조 사범위보다 매우 낮기 때문에, 방사선 호메시스 처리 시 안 전성에 대한 문제는 없을 것이라고 말할 수 있다. 또한, 방 사선호메시스 효과가 돌연변이의 결과일 가능성도 다음과 같은 이유로 낮을 것으로 보인다(Kim and Lee, 1998). 첫째 로, 돌연변이 효과는 대부분 균일하지 않으며 장해가 유발 된다. 하지만 방사선 호메시스 실험 결과들은 균일한 효과 를 보여주며, 돌연변이 유기에 실제 사용했던 선량보다도 훨씬 낮은 선량에서 얻어졌다. 둘째로, 돌연변이 유기효과는 대체로 첫 세대에서 나타나지 않는다. 반면 방사선 호메시 스 실험 결과들은 조사된 개체에서 일어나고, 대체로 다음 세대에서는 나타나지 않았다.
자외선 호메시스 공정은 과일과 채소 표면의 오염물질 제거, 피토케미칼 함량 증가, 생리적 기전(mechanism)을 향상시킴으로써 생산품의 품질과 저장성을 향상시키기 위 하여 개발된 공정이다. 이 공정에 대한 호메시스 연구는 이미 수행되어 있으며, 원예 작물에서 식물 병원체 제거 효과를 확인하였다. 단점으로는, 자외선 호메시스 공정은 균일화하기에 매우 어려우며, 효과와 균일화의 동시 보장 이 힘들다는 것이다. 조사량이 생산품마다 다르게 적용되 어야 하며, 생산품의 작은 온도차이도 결과에 큰 영향을 가져올 수 있다. 또한, 호메시스 연구는 이미 수행이 되어 있지만 모순된 연구결과가 다수 존재하여 정확한 조사량에 대한 정보가 미흡하다.
식물체에 자외선 호메시스를 이용하여 생성을 유도하는 물질들은 대부분 피토알렉신(phytoalexin)이다(Cho and Pyee, 2006). 피토알렉신은 최근 건강기능성 물질로서 관심 의 대상이 되는 물질이다. 그 중, 레스베라트롤(resveratrol) 은 생체방어물질로 작용하는 대표적인 물질로서 인간의 건 강기능성에도 매우 유용한 물질로, 포도류에 다량 들어있 는 것으로 알려져 있다. 레스베라트롤에 대한 자외선 호메 시스 연구 결과, 포도 수확 이후 자외선으로 자극하였을 때, Red globe종에서는 최대 2,316배까지 레스베라트롤 함 량이 증가되었음이 확인되었다(Adrian et al., 2000; Cantos et al., 2003). 한편, Cho et al.(2012)은 포도에 UV 호메시스 를 적용하였을 때 에너지 수준에 따른 다르게 나타나는 레 스베라트롤 증폭현상을 수학적 모형을 개발하여 정량적으 로 표시하였다.
레스베라트롤 이외에도 자외선을 과실류에저선량 조사를 함으로서 해충, 병원균 등의 제거는 물론, 피토케미칼이 생 성된 것을 연구한 자외선 호메시스 연구는 많이 이루어져 있다. Table 2는 식물에서의 자외선 조사에 대한 호메시스 연구 결과들로, 연구자가 ‘최적(optimal)’이라고 제시하였을 경우에만 최적 조건으로 정리하였다. Table 2에 정리된 연 구들은 최적의 자외선 선량을 포도에서 최저 0.125 kJ/m2~ 오렌지에서의 최고 9 kJ/m2로 적용하였다. 최대 자외선 선 량은 부작용을 유발할 위험이 있는데 예를 들어, 고선량 조사를 하였을 경우 토마토에서 탈색 현상(Liu et al., 1993; Maharaj et al., 1999)과 노화(Liu et al., 1993), 딸기 꼭지에서 갈변 및 건조 현상(Marquenie et al., 2002), 복숭 아에서 갈변 부패(Stevens et al., 1998), 망고에서 미숙성 상태의 숙성 현상(Gonzalez-Aguilar et al., 2001) 등이 나 타났다. 이는 자외선이 활성산소를 과잉 생성하여 광산화 (photo-oxidation) 반응을 촉진시킨 것으로 보인다. 상업화 하는 데에 이러한 부작용들을 최소화하거나 발생을 막기 위해서는 각각의 과일마다 최대 자외선 선량을 조절해 주 어야 하지만, 실제로는 과일이 받는 영향은 항상 일정하지 않기에 보다 많은 선행연구들이 요구된다.
| Food (Cultivar) | Experimental conditions | Hormetic effects |
|---|---|---|
| Apple (Red Delicious) | •Disease resistance (de Capdeville et al., 2002) | |
| Cactus Pear (Gialla) | •UV dose: 0.75 kJ/m2 |
|
| Cherry (several un-named cultivars) | •No effect on fungal development (Marquenie et al., 2002) | |
| Grape (Italia) | ||
| Grapefruit (Star Ruby) |
|
|
| Kumquat (Nagami) | •Increased levels of scoparone (Rodov et al., 1992) | |
| Lemon (Eureka) | •Increased levels of scoparone (Ben-Yehoshua et al., 1992) | |
| Mango (Tommy Atkins) |
|
|
| Orange (Biondo Comune, Washington Navel, Tarocco, Valencia Late) | •UV dose: 0.5~3 kJ/m2 |
|
| Orange (Shamouti, Valencia) | •Increased levels ofscoparone (Rodov et al., 1992) | |
| Peach (Elberta) |
|
|
| Pepper (Bell Boy, Delphin) | •Natural infection resistance (Mercier et al., 2001) | |
| Strawberry (Elsanta) |
|
|
| Strawberry (Kent) |
|
|
| Tomato (Capello) | •Delayed ripening and increased putrescence at doses of 3.7 kJ/m2 (Maharaj et al., 1999) | |
| Tomato (Floradade, Better Boy) |
|
아울러, 고용량의 자외선 조사처리는 DNA 사슬을 끊을 수 있으므로 자외선 호메시스의 최적의 결과 도출을 위해 서는 적정량의 선량 산출이 필요하다. 15.0~50.0 KJ/m2 범 위로 자외선을 처리했을 때, DNA의 109 Da 위치의 단일 사슬구조가 깨졌다고 보고한 연구가 있다(Harm, 1980). 이 는 Table 2에 조사된 결과들에서 제시한 최저 선량보다 고 용량인 것으로, 자외선의 식물체에 대한 처리 선량은 최대 15 KJ/m2미만으로 처리해야 DNA 사슬의 깨짐 없이 자외 선 호메시스의 최적의 효과를 볼 수 있을 것이다.
열 호메시스 공정은 열탕(hot water), 수증기(vapor heat), 열기(hot air), 고주파 및 극초단파(radio frequency and microwave) 공정으로 나누어 정리할 수 있다. 열탕 호메시 스 공정은 이미 널리 사용되고 있는 방법으로, 곰팡이 제 거를 위해 처음 사용되었으며, 요즘에는 해충 구제까지 사 용 범위가 확대되었다(Siomos et al., 2005; Tsouvaltzis et al., 2006). 열탕 호메시스공정은 온도의 정밀성과 균일성이 중요하며, 주로 침지와 스프레이 방법이 있다(Vigneault et al., 2012). 이 공정은 온도 조절은 조작이 쉬운 편이며, 규 모가 커지거나 연속 공정 혹은 복잡한 공정이라도 적용시킬 수 있다는 장점이 있다. 단점으로는, 온도는 ±0.5°C의 오차 범위만 허용하며, 온도의 정확한 조절이 필요하다는 것이 다. 이는 생산품의 병원체 성장이나 열로 인한 상해를 막 기 위함이며, 공정 이후에는 반드시 냉각처리를 함으로서 잔열로 인한 생산품의 영향을 최소화 시켜야 한다. 또한, 물의 순환으로 인한 교차 감염의 위험이 있으므로 주의해 야 한다.
수증기 호메시스 공정은 40~50°C의 온수를 수증기로 처 리함으로써 해충 알과 애벌레를 제거하는 방법이다(Shellie and Mangan, 2000). 이 공정 또한 온도의 정밀성과 균일 성이 중요하며, 매우 빠른 열전도가 가능하다는 장점이 있 으며, 규모가 커지거나 연속 공정 혹은 복잡한 공정이라도 적용시킬 수 있다. 또한 열탕 호메시스의 단점이었던 물의 순환으로 인한 교차 감염에 대한 위험이 없다(Vigneault et al., 2012). 단점으로는, 열탕 호메시스 공정과 마찬가지로 온도의 허용 오차범위는 ±0.5°C 이며, 따라서 온도의 정확 한 조절이 필요하다는 것이다. 또한, 열탕 호메시스 보다 조작기술이 어려운 편이며, 일부 국가에서는 전문 기술 인 증 보유자만 사용할 수 있다고 한다.
열기 호메시스 공정은 곰팡이와 해충 제거에 사용되는 방 법으로 이미 38~46°C에서 12~96시간 처리하는 것이 최적이 라는 적당한 호메시스 수준에 대해 밝혀진 상태이다 (Vigneault et al., 2012). 열기 호메시스 공정도 다른 열을 이 용한 공정과 마찬가지로 온도의 정밀성과 균일성이 중요하 며, 규모가 커지거나 연속 공정 혹은 복잡한 공정이라도 적 용시킬 수 있는 장점이 있다. 단점으로는, 다른 열을 이용한 공정과 같이 온도의 정확한 조절이 필요하다는 것이다. 또한, 열탕 호메시스 공정보다는 발생할 확률이 낮지만, 물의 순환 으로 인한 교차 감염의 위험이 있으므로 주의해야 한다.
고주파 및 극초단파호메시스 공정은 유전체 물질 (dielectric materials)에 직접적으로 전자파를 가하여 열을 발 생시키는 방법이다(Wang et al., 2003). 이 공정에서는 전자 파 파장의 균일성이 중요하다고 한다. 주파수 조절은 상시 가능하며, 열처리 호메시스 공정과 같은 공간의 제한이 없 다는 장점이 있고, 생산품의 크기가 클 경우에는 고주파가 극초단파보다 효과적이다(Vigneault et al., 2012). 단점으로 는, 생산품 전체 표면에 전자파 파장 자극이 균일하게 도 달해야 한다는 것이다. 이는 파장으로 발생한 열로 인한 상해가 없는 범위에서의 호메시스 자극을 말한다. 생산품 의 수분함량이 고르지 않을 경우, 비대칭 형태이거나 층이 여러 개로 이루어져 있을 경우 균일성을 보장할 수 없다. 또한, 생산품이 용기 안에 들어있을 경우, 열로 인한 상해 가 발생할 수 있으며, 생산품의 개수가 많을 경우에는 적 용하기 어려운 단점이 있다.
Table 3은 식물에서의 열에 대한 호메시스 연구 결과들 로, 연구자가 ‘최적(optimal)’이라고 제시하였을 경우에만 최적 조건으로 정리하였다.
| Food (Cultivar) | Experimental conditions | Hormetic effects |
|---|---|---|
| Asparagus (Atlas) | •Inhibited postharvest anthocyanin synthesis(Siomos et al., 2005) | |
| Leek (not mentioned) | •Efficiently controlled postharvest leaf extension growth in stalks (Tsouvaltzis et al., 2006) | |
| Potato (Superior) | •Inhibited sprouting or spoilage (Ranganna et al., 1998) | |
| Satsuma mandarins (Gungchun) |
|
|
| Grapefruit (Citrus paradisi) | •Killed insect larvae (Shellie and Mangan, 2000) | |
| Grapefruit (Citrus paradisi), Mango (Mangiferaindica), Orange(Citrus sinensis), Papaya (Carica papaya) | •Observed the highest thermal stress in VFA (Shellie and Mangan, 2000) | |
| Apple (not mentioned) | •Reduced decay (Fallik et al., 1996) | |
| Dragon fruit (BinhThuan) |
|
|
| Almond (Nonpareil), Apple (Red Delicious, Golden Delicious), Grapefruit(Citrus paradisiMacfad), Orange (Citrus sinensis), Sweet cherry (Bing), Walnut (Juglansregia) | •Decreased the dielectric loss factor of fruits and insects with increasing frequency at constant temperatures (Wang et al., 2003) | |
| Peach (Prunuspersica) | •Disease resistance (Karabulut and Baykal, 2002) |
대기 조성 조작 공정은 1920년대에 산소 농도를 낮추고 이산화탄소 농도를 높인 대기 조성이 과일에 미치는 영향을 알아본 연구에서 시작되었으며, 1940년대에 Controlled Atmosphere(CA) 저장법이 개발되었다(Raghavan et al., 2004). CA 저장법은 생산품의 양이 많을 경우(저장 공간이 큰 경우) 를 위해 개발되었다면, Modified Atmosphere Packaging (MAP) 방법은 적은 양의 생산품을 위해 개발되었다.
대기 조성 조작 호메시스 공정은 단기와 장기 조작으로 나눌 수 있다(Vigneault et al., 2012). 단기와 장기 조작 모 두 이미 기술력이 확보되어 있으며, 균일화를 쉽게 이룰 수 있는 장점이 있다. 또한, 규모가 커지거나 연속 공정이 라도 적용시킬 수 있다. 단기 조작의 경우 필요 조작 시 필요한 에너지가 적으며, 처리 시간이 짧을 경우 도관 내 가스 농도의 변화 정도는 무시해도 될 정도이다. 장기 조 작의 경우 시스템의 휴대와 운송이 쉬운 편이며, 공정의 효율성이 높은편이다. 단점은, 단기 조작의 경우 연구 결과 가 미흡하며, 생산품의 종류, 가스 주입 시스템의 효율 등에 의해 공정 결과가 영향을 받을 수 있다는 것이다. 또한, 가 스 조성 조작 및 유지비용이 매우 비싸다. 장기 조작의 단 점으로는 가스 농도를 계속 유지해야 하는 번거로움이 있 으며, 효율성은 도관 내 밀폐성과 밀접하므로 주의해야 한 다는 것이다. 게다가 단기와 장기 조작 모두 일부 가스 종 류는 작업 종사자 건강에 해로울 수 있다. Table 4는 식물 에서의 대기 조성 조작에 대한 호메시스 연구 결과들로, 연구자가 ‘최적(optimal)’이라고 제시하였을 경우에만 최적 조건으로 정리하였다.
| Food (Cultivar) | Experimental conditions | Hormetic effects |
|---|---|---|
| Apple (Jonagold, S'ampion) | •Treated 2% O2 + 2% CO2 at 1°C for 120 d |
|
| Blueberry (Centurion, Maru) | •Treated 2.5 kPa O2+15 kPa CO2 at 1.5°C for 6wk |
|
| Broccoli floret (Iron Duke) | •Treated modified atmosphere packaging (MAP), vent packaging (VP) and automatic misting (AM) at 5°C for 6 d |
|
| Kohlrabi (Kompliment F1) | •Treated 5 kPaO2+5 kPaCO2 and 5 kPaO2+15 kPaCO2 Optimal condition: 5 kPa O2 + 15 kPa CO2 | •Delayed the decline in sugars and organic acids (Escalona et al., 2006) |
| Wild rocket (Diplotaxistenuifolia) | •Treated 5 kPaO2+5 kPa CO2 and 5 kPaO2+10 kPaCO2 at 4°C for 14 d | •Remained level of total flavonoids with 100 mg/100 g (Martnez-S nchez et al., 2006) Incresed level of total vitamin C |
| Peach (Summerset) | •Induced the highest level of ethanol and acetaldehyde at 20°C for 64 h (Polenta et al., 2005) | |
| Strawberry (Allstar) | •Treated 40, 60, 80 and 100 kPa O2 at 5°C for 14 d |
|
고찰 및 결론
본 연구에서는 최근까지 발표된 식품에서의 호메시스 처 리 연구 결과들을 근거로 호메시스 식품 처리기술을 정의 하고, 여러 호메시스 식품 처리 기술에 따른 다양한 결과 를 정리분석 하였다.
연구 결과들은 식품의 품종, 연구 환경에 따라 매우 다 양하게 나타났으며, 이러한 다양성은 호메시스 연구를 하 는 데에 대표적인 어려움이 될 수 있음을 다시한 번 확인 할 수 있었다. 또한, 국내뿐만 아니라 국외에서도 식품에서 의 호메시스 적용에 대한 연구는 많이 이루어지지 않았고, 기존의 연구들도 방법 및 결과가 다양하기 때문에 아직까 지는 식품별호메시스의 적정 수준과 그 결과에 대해 확실 히 논하기에는 어렵다고 사료된다. 동일한 호메시스 처리 를 한다고 하더라도 식물이 자라온 환경, 즉 기온, 기압, 고도, 일조량, 토양 등 다양한 변수들에 의해 그 결과가 상이할 가능성이 높다(Kim and Lee, 1998)
본 연구에서 조사한 식품에서의 호메시스 연구 결과는 크게 두 가지로 나눌 수 있는데, 첫째는 식품의 저장성 향 상을 목적으로 한 호메시스, 둘째는 식품의 피토케미칼 함 량 증가를 목적으로 한 호메시스로 분류할 수 있었다. 호 메시스 자극을 통한 식품의 저장성 향상 및 피토케미칼 성 분 강화 효과 기대는 유전자발현을 조절한다는 점에서 유 전자변형기술과 동일하게 생각될 수 있으나, 사실 유전자 변형기술과는 다른 기전을 통한 것이다. 포도에 자외선 조 사를 하여 레스베라트롤 함량을 증가시킨 연구에 따르면 (Cho et al., 2011), 호메시스 방법 중 하나인 자외선 조사 를 통한 포도에서의 레스베라트롤 함량 증가는 유전자 변 형으로 발생된 과정이 아니며, 단지 포도 세포의 대사를 조절하는 현상이라고 보고하였다. 또한, 이 기술은 유전자 변형기술과는 다르게 간단한 기술력을 통하여 손쉽게 적용 시킬 수 있으므로 경제적으로도 매우 효과적인 방법이 될 수 있다고 한다.
호메시스 처리 처리식품과 유전자변형식품의 또 다른 차 이 중에 하나는 변형된 유전자의 다음 세대에까지 전달 가 능성에 대한 것이다. 유전자변형식품의 경우 유전자를 인 위적으로 조작하는 기술을 처리한 것이기 때문에, 인위적 으로 변형된 유전자가 다음 세대에 전달되어 영향을 미칠 수도 있다. 하지만 호메시스 기술 처리식품의 경우 과도한 자극으로 인하여 유전자 변이가 일어났다고 하더라도 다음 세대로 전달될 가능성은 낮은 것으로 예상된다. 예를 들어, 방사선 호메시스 실험 결과들은 조사된 개체에서만 일어나 고 대체로 다음 세대에서는 나타나지 않는다고 한다(Kim and Lee, 1998). 따라서 열 혹은 압력 같은 물리적 호메시 스 기술 처리로 인해 나타날 수도 있는 식품의 비의도적 유전자 변이들은 다음 세대로 유전되지 않을 것이며, 새로 운 독성 물질, 알러지성 물질도 형성하지 않을 것이다.
국내외 식품의 호메시스 연구들은 아직 보고된 연구 결 과가 미흡하고 연구 조건 및 결과들이 굉장히 다양하여 본 연구에서 자료 수집을 통한 확실한 식품별 호메시스 효과 에 대한 결론 도출은 불가능하였다. 하지만, 본 연구는 국 내에서의 식품의 호메시스 자극에 대한 연구가 부족함에도 불구하고 국내외 각종 연구 자료를 수집분석하여 여러 호 메시스 자극 방법에 대한 결과들을 비교분석한 데에 큰 의 미가 있다. 추후 각 식품별로 각기 다른 조건에서의 호메 시스 자극에 대한 체계적인 wet lab 연구가 필수적으로 수 행되어야 하며, 이들 연구 결과들이 통계학적으로 의미가 있는 정확한 효과를 입증할 수 있도록 노력을 기울여야 할 것이다. 또한, 호메시스 기술은 유전자변형기술처럼 유전자 변형을 유도하는 기술이 아니라 단지 대사를 조절하는 기 술이므로(Cho et al., 2011), 호메시스 기술 처리식품의 안 전성 평가 가이드라인이 반드시 필요하지는 않지만, 향후 식품의 호메시스 처리 기술이 다양해지고 활성화될 가능성 을 고려하여 안전성 평가 가이드라인 마련에 대한 지속적 인 검토가 필요할 것이다.