서 론
최근 소비자들이 건강에 대한 인식이 증가하면서 건강기 능식품에 대한 관심이 높아지고 있다. 이에 따라 건강기능 식품 개발을 위해 건강 관련 기능성 물질 탐구, 기능성 원 료 및 식품 개발에 대한 연구가 꾸준히 진행되고 있고, 기 능성 소재 개발을 위해 천연물, 농수산물 및 약용식물로부 터 생리 활성 평가 및 물질 분리에 대한 연구가 활발히 진행 중에 있다(Lee, 2013). 성인병 및 노화관련 각종 질환 들은 활성산소에 의해 인간의 대사과정 중에 끊임없이 발 생되어 생체를 노화시키는 주요인자로 작용하고 있다고 알 려져 있는데, 활성산소를 방어하는 항산화물질이 노화 및 성인병 같은 질병의 치료 가능성 때문에 주목받고 있으며, 그 중 찰옥수수(Seo et al., 1999), 수삼(Kim et al., 2007), 식용꽃(Park et al., 2007), 국화꽃(Woo et al., 2010), 산채 류(Lee et al., 2011), 맨드라미 (Kim et al., 2012), 더덕 (Jeon et al., 2013), 쑥(Kang & Lee, 2013), 인삼꽃(Kim et al., 2013)등 천연물에서 추출한 천연항산화제에 관한 연구 가 활발하다(Han et al., 2013). 활성산소 생성을 억제하기 위한 항산화물질로서 아스코르빈산, 토코페롤, 카로티노이 드, 플라보노이드, 탄닌 등의 천연 항산화제와 함께 butylated hydroxyanisole(BHA) 및 butylated hydroxytoluene(BHT) 등의 합성항산화제가 개발 되어 식품, 화장품 등에 산화방지제로 많이 사용되고 있다. 천연항산화제들은 항산화력이 비교적 낮고 합성항산화제의 경우는 생체 효소 및 지방의 변이원 성 및 독성으로 인체에 암을 유발할 수 있다는 보고가 있 어 안전하고 강한 천연 항산화제의 개발이 요구되고 있는 실정이다(Han et al., 2013).
아마란스(Amaranth)는 비름과(Amaranthus spp. L.)에 속 하는 일년생 유사 화곡류(cereal)이고 쌍자옆 식물로(Lee et al., 1996a) 국내에서는 관상용으로 강원 일부지역에서 재배 되고 있고 독특한 맛과 영양가치가 높아 국수, 비스킷(종실) 등의 식품개발에도 이용되고 있다(Kim & Ryoo, 2002; Choi, 2011). 아마란스는 다른 곡류에 비해 불포화 지방산 의 함량이 높고 주 지방산은 리놀레산으로 구성되어 있고 (Lee et al., 1996a) 또한 단백질 15-16% 함유하고 있으며 그중 lysine과 황 함유 아미노산이 풍부하다(Lee et al., 1996a). 아마란스의 생리적 연구로는 간과 혈액 내의 총 콜레스테롤, 중성지질과 LDL-콜레스테롤의 수준을 낮춰주 고 apo-lipoprotein A와 HDL-콜레스테롤 수준을 높여주며 콜레스테롤 합성에 관여하는 HMG-CoA reductase를 억제 효 과를 가진 것으로 보고되었다(Qureshi et al., 1996; Caselato-Sousa & Amaya-Farfán, 2012). 그 밖에도 종자 메 탄올추출물에서 위암과 대장암에서 억제효과(Lee et al., 1996b)가 보고되고 있고 아마란스 종자는 식용으로 사용이 가능하나 이에 대한 기능성 연구는 매우 미비하다(Kim & Ryoo, 2002; Choi, 2011).
본 연구에서는 아마란스 종자의 열수 추출물과 메탄올 추출물을 조제하여 총 페놀 및 플라보노이드 함량 측정과 DPPH 및 ABTS 라디칼 소거능을 측정하였으며 세포내에 서 활성산소종 억제효과는 대식세포주인 RAW 264.7 세포 내에서 NO 억제 활성, L-132 세포내에서 H2O2에 의한 산 화적 스트레스에서의 세포 보호 효과를 측정하여 아마란스 종자가 가진 기능성식품소재로서의 개발 가능성을 검토하 고자한다.
재료 및 방법
본 실험에 사용한 열수 추출물은 수직 환류냉각기가 부착 된 추출 플라스크에 건조 시료 30 g과 증류수 10배수(v/w) 를 가하여 autoclave(SJ-220A100, Sejong Scientific Co., Ltd., Bucheon, Korea)를 이용하여 121℃에서 15분 동안 1.23 bar의 압력으로 추출하여 얻었다. 메탄올 추출물은 추 출 플라스크에 건조 시료 30 g과 메탄올 10배수(v/w)를 혼합하여 실온에서 24시간 진탕하여 얻었다. 제조한 추출 물은 감압여과기로 여과한 여과액을 회전식진공농축기(R- 114, Buchi Co., Flawil, Switzerland)를 사용하여 농축시킨 후 동결건조기(Ilshin Co., Seoul, Korea)로 건조 후 분말 상 태로 냉동고(-70℃)에 보관하면서 실험에 사용하였다. 실험 에 사용된 아마란스 추출물은 메탄올추출물(9.4 g, 31.4%) 과 물 추출물(4.69 g, 15.6%)이다.
총 페놀 함량은 Folin-Denis 방법(Singleton & Rossi. 1965)을 변형하여 측정하였다. 각각의 추출물을 증류수에 용해한 시료에 2 N Folin-Ciocalteu's phenol reagent 및 20% Na2CO3(Daejung chemicals & Metals Co., LTD., Gyeonggi, Korea)을 차례로 가한 다음 실온에서 60분간 반응시킨 후 725 nm에서 흡광도를 측정하였다. 표준물질로는 gallic acid(Sigma-Aldrich Co., St. Louis, MO, USA)를 사용하여 시료와 동일한 방법으로 분석하여 얻은 검량선에 근거하여 추출물 g당 mg gallic acid equivalent(GAE, dry basis)로 폴리페놀의 함량을 산출하였다.
총 플라보노이드 함량은 Zhishen et al.(1999)과 Singleton et al.(1999)의 방법을 응용하여 측정하였다. 각 시료를 5% NaNO2(Daejung chemicals & Metals Co., LTD., Gyeonggi, Korea)과 증류수를 혼합하여 5분간 반응시키고 10% AlCl3·6H2O를 첨가하여 다시 6분간 반응시킨 후 1M NaOH(Daejung chemicals & Metals Co., LTD., Gyeonggi, Korea)와 섞어 510 nm에서 흡광도를 측정하였다. 표준물질 은 (+)-catechin hydrate(Sigma-Aldrich Co., St. Louis, MO, USA)를 사용하여 검량선을 작성한 후 추출물의 총 플라보 노이드 함량은 mg (+)-catechin hydrate(CE, dry basis)로 나 타내었다.
탄닌 함량은 AOAC법(1990)에 따라 증류수 75 mL에 시 료 1 mL를 첨가한 뒤 Folin 시약 5 mL와 Na2CO3 용액 10 mL를 가한 다음 증류수를 가하여 100 mL로 정용하여 30분간 반응 후 725 nm에서 흡광도를 측정하였고, tannic acid(Sigma-Aldrich Co., St. Louis, MO, USA)을 표준물질로 사용하였다. 총 탄닌 함량은 mg tannic aicd equivalent (TAE)/g로 나타내었다.
DPPH에 대한 수소공여 효과로 측정하는 라디칼 소거능 은 Blois(1958)의 방법을 변형하여 측정하였다. 일정 농도 로 희석된 시료와 0.2 mM DPPH solution(Sigma-Aldrich Co., St. Louis, MO, USA)을 가하여 잘 혼합한 후 암소에 서 30분간 반응시킨 후 517 nm에서 흡광도를 측정하였다. DPPH 라디칼 소거능 결과 값은 추출물 첨가구와 무첨가 구를 비교하여 라디칼의 소거활성을 백분율(%)로 나타내어 농도에 따른 DPPH 라디칼 소거능을 확인하였다.
ABTS 라디칼 소거능은 Arano et al.(2001)과 Re et al.(1999)의 방법을 변형하여 사용하였다. 7 mM ABTS (Sigma-Aldrich Co., St. Louis, MO, USA)용액에 2.45 mM potassium persulfate(Daejung chemicals & Metals Co., LTD., Gyeonggi, Korea)를 혼합하여 암소에서 약 24시간 반 응 시킨 후 734 nm에서 흡광도 값이 1.0±0.02가 되도록 조절한 ABTS solution을 사용하였다. ABTS solution을 시 료와 혼합하여 암소에서 6분간 반응시켜 734 nm에서 흡광 도를 측정하였다. 결과 값은 추출물 첨가구와 무첨가구를 비교하여 라디칼의 소거활성을 백분율(%)로 나타내었다.
SOD 유사활성 측정은 알칼리 상태에서 pyrogallol의 자 동산화에 의한 발색 원리를 이용한 Marklund & Marklund (1974)의 방법을 변형하여 측정하였다. 일정 농도로 희석된 시료에 pH 8.5로 보정한 tris-HCl buffer(50 mM trisaminomethane+ 10 mM EDTA, pH 8.5, Sigma-Aldrich Co., St. Louis, MO, USA)와 7.2 mM pyrogallol(Sigma-Aldrich Co., St. Louis, MO, USA)을 첨가하여 25℃에서 10분간 반응시 킨 후 1 N HCl(Daejung chemicals & Metals Co., LTD., Gyeonggi, Korea)를 가하여 반응을 정지시키고 420 nm에서 흡광도를 측정하였다. SOD 유사활성은 추출물 첨가구와 무첨가구의 흡광도 차이를 백분율(%)로 나타내었다.
L-132(폐 정상세포)와 RAW 264.7(대식세포) 세포주를 한국세포주은행(Korean Cell Line Bank, KCLB)으로부터 분양받아 100 units/mL의 penicillin-streptomycin(GIBCO, Grand Island, NY, USA)과 10%의 fetal bovine serum (Hyclone, Logan, UT)이 함유된 DMEM 배지(Welgene, Dalseogu, Daegu, Korea)를 사용하여 37℃, 5% CO2 항온기 에서 배양하였다.
L-132 세포에 대한 H2O2에 의해 유도된 세포독성을 측 정하기 위해 MTT assay를 실시하였다. L-132 세포를 96 well plate에 5×104/well로 분주하고, 37℃, 5% CO2 incubator에서 24시간 동안 배양하였다. 다양한 농도의 시 료를 첨가한 L-132 cell을 24시간 동안 배양 후, H2O2 (Daejung chemicals & Metals Co., LTD., Gyeonggi, Korea)를 2 mM의 농도로 첨가하여 30분간 처리하였다. 이 상태의 L-132 cell에 MTT solution(5mg/mL, Sigma-Aldrich Co., St. Louis, MO, USA)을 넣고 37℃에서 4시간 반응시켰 다. 그 후 상등액을 제거하고 각 well에 200 μL의 dimethyl sulfoxide(DMSO)를 첨가하여 생성된 formazan 결정을 용해 시켜 microplate reader로 540 nm에서 흡광도를 측정하였고, 세포독성은 시료의 흡광도를 대조군의 흡광도에 대한 백분 율로 나타내었다.
대식세포주인 RAW 264.7 세포로부터 일산화질소 생산 의 지표로서 배양 상층액 내에 안정된 NO 산화물인 NO2 를 Griess 반응으로 측정하였다(Murakami et al., 2000). 96 well plate에 1×106개의 cell을 PBS로 2번 수세한 후에 무 혈청 배지(Welgene)로 교체 후 LPS(20 μg/mL, Sigma- Aldrich Co., St. Louis, MO, USA), tetrahydrobiopterin (BH4, 10 μg/mL, Sigma-Aldrich Co., St. Louis, MO, USA), 200 mM l-arginine(Sigma-Aldrich Co., St. Louis, MO, USA) 그리고 IFN-γ(100 U/mL, Sigma-Aldrich Co., St. Louis, MO, USA))을 각각의 well에다 첨가하여 자극시 켰다. 그 배지에 시료를 처리하여 실험하였다. NO 생성량 은 supernatant를 모아 griess reagent로 10분간 반응시킨 후에 540 nm에서 흡광도로 측정하였다. 아래의 식에 따라 결과값을 계산하였다. 결과값 산출 후 세포에 대한 시료의 독성여부를 확인하기 위해 MTT solution(5 mg/ml, Sigma- Aldrich Co., St. Louis, MO, USA)를 사용한 MTT asaay 를 사용하여 세포수를 측정하였다.
[(compound Abs540-negative Abs540)/(positive Abs540- negative Abs540)]×100 (%)
결과 및 고찰
페놀 화합물은 다양한 구조와 분자량을 가지며, 항산화 효과 등의 생리활성 기능을 가지는 것으로 알려져 있다. 폴리페놀은 식물의 대표적인 2차 대사산물로 식물계에 널 리 분포되어 있으며, phenolic hydroxyl 그룹 때문에 단백 질, 효소 단백질 또는 기타 거대분자와 결합하는 성질을 가지고 있어 항산화 작용, 항균, 항알레르기 및 항암효과에 관여하는 것으로 알려져 있다(Jeon et al., 2013). 꽃에 함 유되어 있는 항산화물질 중 polyphenolic 화합물들은 우수 한 항산화력을 가지는 것으로 알려져 있으며, 이는 라디칼 을 안정화시킬 수 있는 phenolic ring의 존재 때문인 것으 로 보고되어져있다(Middleton & Kandaswami, 1994).
아마란스 종자 추출물의 총 폴리페놀, 플라보노이드 그 리고 탄닌 함량은 Table 1과 같다. 메탄올 추출물의 폴리 페놀 함량은 1.69±0.12 mg GAE/g이고, 물 추출물은 4.23 ±1.00 mg GAE/g으로 페놀성 물질의 함량이 나타났다. 총 폴리페놀 함량은 메탄올 추출물보다 물 추출물이 3배가량 높았다. 아마란스(Amaranth cruentus) 종자의 폴리페놀 함 량은 400-440 mg/kg, 새싹은 350-370 mg/kg으로 보고되어 있으며(Caselato-Sousa & Amaya-Farfán, 2012) 이번 실험 의 아마란스(Amaranthus spp. L.) 종자 추출물보다는 폴리 페놀 함량이 낮았다. 또한 맨드라미 꽃의 메탄올과 물 추 출물의 폴리페놀 함량은 3.09-6.8 mg GAE/g으로 그 양이 아마란스 종자 추출물과 비슷하였다(Kim et al., 2012). 아 마란스 추출물의 플라보노이드 함량은 메탄올 추출물(1.53 ±0.17 mg CE/g), 물 추출물(0.08±0.00 mg CE/g)으로 나타 났다. 메탄올 추출물은 물 추출물보다 플라보노이드 함량 이 19 배가량 높으며 추출용매에 따른 차이가 생기는 것 은 추출성분이 극성에 따라 극성지수가 5.1 인 메탄올에 극성이 10.2 인 물보다 더욱 잘 추출되기 때문으로 사료 된다(Yun & Jeong, 2012). 이러한 경향은 참당귀 꽃(Park et al., 2011)과 맨드라미 꽃(Kim et al., 2012) 추출물에서 도 확인할 수 있었다. 아마란스(Amaranth cruentus) 새싹의 플라보노이드 함량은 300-690 mg/kg으로 보고되어 아마란 스(Amaranthus spp. L.) 종자의 메탄올 추출물이 아마란스 새싹의 함량보다 높음을 알 수 있었다(Caselato-Sousa & Amaya-Farfán, 2012).
| Sample | Total phenolic content (mg GAE1)/g) | Total flavonoid content (mg CE2)/g) | Tannin content (mg TAE3)/g) |
|---|---|---|---|
| Methanol ext. | 1.69±0.12 | 1.53±0.17 | 0.316±0.048 |
| Water ext. | 4.23±1.00 | 0.08±0.00 | 0.511±0.012 |
탄닌 성분은 과실, 야채류 및 식물종자 등 식물체에 널 리 함유되어 있으며, 수렴성이나 지혈작용 등의 약리성과 더불어 단백질이나 alkaloid와 결합하는 특성을 가지고 있 다(Seo et al., 2000). 최근에는 탄닌성분의 항균, 항산화, 항종양작용 및 중금속 제거능과 같은 유용한 생리활성이 보고되어, 현대인의 식생활 향상에 도움을 줄 것으로 기대된 다(Seo et al., 2000). 아마란스 종자의 탄닌 함량은 메탄올 추출물 0.316±0.048mg TAE/g, 물 추출물 0.511± 0.012mg TAE/g으로 물 추출물이 메탄올 추출물보다 1.6배 가량 그 함량이 높음을 알 수 있었다. 이 함량의 차이는 용매의 극 성에 따라 추출성분이 달라지기 때문으로 사료 된다(Yun & Jeong, 2012)로 내용 수정하였습니다.
천연물의 라디칼 소거활성은 인체 내에서 활성 라디칼에 의한 노화를 억제시키는 역할을 하고 있으며, 라디칼 소거 작용은 인체의 질병과 노화를 방지하는데 대단히 중요한 역할을 한다(Kim et al., 2001). DPPH radical 소거능 측정 은 항산화 활성을 측정하는데 가장 널리 사용되는 방법이 다. 아마란스의 꽃 추출물의 DPPH 라디칼 소거능 결과는 Fig. 1A과 같다. DPPH 라디칼 소거활성은 Ascorbic acid(5 μg/mL)가 43.4% 의 활성을 보인 것과 비교하였을 때 50 μg/mL의 농도에서 메탄올 추출물 추출물(5.8%)이 가장 좋았으며 물 추출물의 활성은 250 μg/mL의 농도에도 활성을 보이지 않았다.

ABTS[2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid)]는 비교적 안정한 free radical로서 DPPH 라디칼과 함께 항산화활성을 측정하는데 많이 이용되고 있다. ABTS 를 peroxidase, H2O2와 반응시켜 활성 양이온인 ABTS+이 형성 되면 추출물의 항산화력에 의해 ABTS+이 소거되어 라디칼 특유의 색인 청록색이 탈색되는데 이를 흡광도 수 치로 나타내어 추출물의 항산화 활성을 평가할 수 있다 (Kim et al., 2013). 아마란스 종자 추출물의 ABTS 라디칼 소거활성을 평가한 결과는 Fig. 1B에 나타내었다. Ascorbic acid는 5 μg/mL의 농도에서 62.7%의 활성을 보여주었고 종 자 메탄올 추출물에서는 농도에 따라 그 활성이 증가되는 경향을 보였으나 물 추출물은 큰 차이를 보이지 않았다. 메탄올 추출물은 250 μg/mL의 농도에서 활성이 11.1%로 가장 좋았으며 물 추출물은 50 μg/mL에서 11.8%으로 가장 높은 활성을 나타내었다. 본 연구의 결과에 따르면 플라보 노이드 함량이 높게 측정된 메탄올 추출물 추출물에서 DPPH 라디칼 소거능이 증가하는 결과를 보여주었다. 그러 나 ABTS 라디칼 소거활성과 DPPH 라디칼 소거활성과는 결과에서 차이를 나타내었는데 이는 반응속도가 빠른 ABTS 라디칼과는 달리 DPPH 라디칼의 반응속도는 화합 물에 따라서 매우 다르다고 알려져 있으며(Huang et al., 2005) ABTS 라디칼은 DPPH 라디칼과 달리 극성과 비극 성 물질 모두와 반응하여 소거되며 ABTS 라디칼과 잘 반 응하는 항산화 물질이 DPPH 라디칼과는 전혀 반응하지 않을 수도 있다고 알려져 있다(Re et al., 1999; Kim et al., 2013). 본 연구 결과, 물과 메탄올의 극성 차이와 용해 되어 나온 활성 성분의 차이로 ABTS 라디칼에서 더 높은 활성을 보인 것으로 사료된다. 또한 물추출물의 폴리페놀 과 탄닌 함량 높은 것이 ABTS 활성에 더 관여하는 것으 로 보여진다.
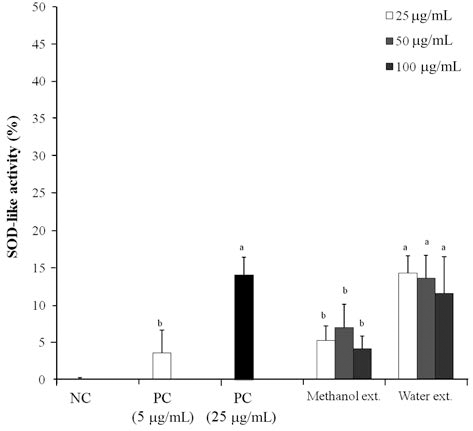
아마란스 추출물들의 SOD 유사활성을 측정 한 결과는 Fig. 2와 같다. 종자 메탄올 추출물은 70 μg/mL농도에서 7.04%으로 가장 높은 활성이 나타났으며 물 추출물은 50 μg/mL 농도에서 13.7%의 활성이 나타났다. 이는 Ascorbic acid(25 μg/mL)의 14.1%과 유사한 활성을 보였다. 산채류 34종의 물과 메탄올 추출물(Lee YM et al., 2011) 이 1 mg/mL 농도에서 SOD 유사활성을 측정하였을 때 거 의 모든 시료의 활성이 나타나지 않았으며 그 농도를 5mg/mL로 높였을 때 활성이 0.4-100%로 나타났다는 연 구와 쑥 추출물(Kang & Lee, 2013)이 10 mg/mL의 농도에 서 44.38-68.29%의 활성을 보인다는 결과와 비교 하면 아 마란스 종자 추출물이 기존에 보고된 여러 종류의 천연물 보다 낮은 농도에서도 더 높은 SOD 유사활성을 보여주었 다. 이와 같이 아마란스 종자의 라디칼 소거능이 매우 우 수하기 때문에 항산화 기능성 소재로의 연구가 요구된다.
아마란스 종자 추출물의 L-132 세포의 산화적 손상에 대한 보효 효과를 알아보기 위하여, H2O2 처리에 의한 손 상을 유발 했을 때 세포 생존율을 측정해보았다. 본 실험 에서 산화적 스트레스 유발 물질로 사용된 H2O2는 쉽게 원형질막을 통과하기 때문에 in vitro 또는 in vivo 실험의 다양한 생리학적 또는 병리학적인 조건에 산화적 손상을 주는 독성 물질로 많이 이용되고 있다(Kim MJ et al., 2013). H2O2에 의해 L-132 세포 생존율은 22%로 감소하였 으며, 산화적 손상에 대한 보호 효과는 500 μg/mL 농도에 서 메탄올 추출물 31.2%, 물 추출물 94.8%로 물 추출물에 서 높은 보호 효과를 보여주었다(Fig. 3).
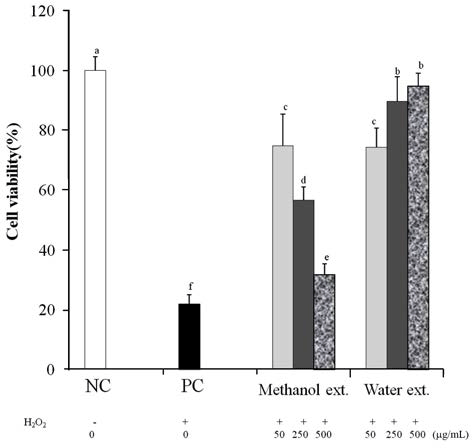
본 연구에 따르면 폴리페놀과 탄닌의 함량이 메탄올 추 출물보다 높은 물 추출물에서 H2O2 세포내 보호활성도 높 게 나타났다. 따라서 폴리페놀과 탄닌 성분이 세포내 산화 적 스트레스에서 보호 효과를 보인 것으로 사료된다. 또한 미나리 발효액과 식초 시료 1000 μg/mL의 농도에서 각각 45.1%와 56.8%의 보호 효과를 보인 것과 비교했을 때 (Kim MJ et al., 2013) 아마란스 물 추출물의 활성이 매우 뛰어난 것으로 판단된다.
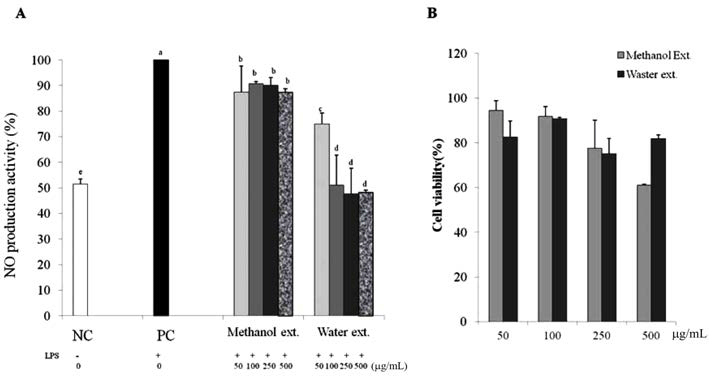
NO는 면역계에서 외부물질에 대한 방어 작용을 하는 중 요한 신호 전달 물질로 nitric oxide synthase(NOS)의 작용 에 의해 L-arginine이 L-citruline으로 변화되는 과정에서 생 성되며 대부분의 조직세포에 영향을 미쳐 순환기계에서는 혈관 이완 물질로, 중추신경계에서는 신경 전달 물질로, 면 역계에서는 방어 물질로 알려져 있다(Kim & Kang, 2008). 본 연구에서는 아마란스 추출물이 세포 내에서 NO 생성에 어떠한 영향을 끼치는지 알아보기 위하여 대식세포 RAW 264.7에 추출물을 25, 50, 100, 250 μg/mL의 농도로 처리 하였고 그 결과는 Fig. 4A와 같다. 추출물들의 RAW 264.7 대식 세포에 대한 독성은 나타내지 않았다(Fig. 4B). 아마란스 종자 추출물은 250 μg/mL의 농도에서 메탄올 추 출물(12.7%)과 물 추출물(51.9%)의 억제활성을 보여주었다. 물 추출물은 시료 농도에 따라 활성이 증가하는 경향을 보 여주었으나 물 추출물은 그러한 경향이 보이지 않았으며 그 억제 활성 또한 10% 내외로 높지 않았다. 이는 700 μg/mL 농도의 보두산 메탄올 추출물이 69.5%의 NO 생성을 감소 시켰고, 보두는 38.9%, 감초는 77.4% 감소시 켰다는 결과와 비교하였을 때(Kim et al., 2009) 물 추출물 의 세포내 NO 생성 억제활성은 다른 천연물보다 낮은 농 도에서도 우수한 활성을 보인다고 판단된다. 이와 같은 아 마란스 종자추출물의 높은 NO 생성 억제활성은 염증억제 효과가 좋은 소재로 활용이 가능할 것으로 판단된다.
요 약
본 연구는 아마란스 종자 물 추출물과 메탄올 추출물의 폴리페놀과 플라보노이드 함량 측정과 DPPH와 ABTS 라 디칼 소거활성, SOD 유사활성을 측정하였으며 H2O2에 의 한 산화적 스트레스에서의 세포 보호효과와 산화질소 생성 억제활성을 분석하여 새로운 식물유래 라디칼 소거활성 물 질을 개발하기 위하여 시행하였다. 물 추출물의 총 폴리페 놀 함량은 4.23 mg GAE/100 g이고 탄닌 함량은 0.511 mg TAE/g으로 메탄올 추출물보다 높았다. DPPH 라디칼 소거 활성은 50 μg/mL의 농도에서 메탄올 추출물 추출물(5.8%) 이 가장 좋았으며 물 추출물의 활성은 250 μg/mL의 농도 에도 활성을 보이지 않았다. ABTS 라디칼 소거활성에서 메탄올 추출물은 250 μg/mL의 농도에서 활성이 11.1%로 가장 좋았으며 물 추출물에서는 50 μg/mL에서 11.8%의 활 성을 나타내었다. SOD 유사활성에서 메탄올 추출물은 100 μg/mL농도에서 14.04%으로 가장 높은 활성이 나타났 으며 물 추출물은 50 μg/mL 농도에서 18.34%의 활성이 나타났다. 아마란스 종자 물 추출물의 경우 산화적 스트레 스(H2O2)에 의한 세포 보호 효과를 갖는 것을 확인하였다. 세포내 NO 생성 억제활성을 조사한 결과에서는 250 μg/ mL의 농도에서 물 추출물이 51.9%의 가장 높은 억제활성 을 보여주었다. 본 연구의 결과, 폴리페놀과 탄닌의 함량이 높은 물 추출물에서 라디컬 소거능은 낮았으나 산화적 손 상에 대한 보호 효과와 NO생성억제능이 높아 강력한 항산 화제로써의 활성을 보여주었다. 이러한 결과로 보아 아마 란스 종자의 새로운 항산화소재로서 개발가능성을 보여주 었다.