서 론
복분자(Rubus coreanus Miq.)는 장미목(Rosales) 장미과 (Rosaceae)의 낙엽관목으로 한반도 남부지방, 중국, 일본 등 지에 분포하고 있으며 열매는 7-8월에 성숙되어 붉은색으 로 익으며 점차 검 붉은색으로 된다(Choung & Lim, 2012). 복분자에 함유되어 있는 안토시아닌(anthocyanin)은 합성착 색제를 대체할 수 있는 천연색소로서 주목을 받고 있으며 색소 기능성 이외의 강한 항산화작용이 혈관계 질환, 암, 당 뇨, 신경계 질환 등의 치료에 효과가 있다는 연구결과가 있 다(Konczak & Zhang, 2004). 안토시아닌은 수용성 flavonoid 색소로서 각종 식물체의 꽃, 과실 등에 존재하며 적색에서 청색에 이르는 다양한 색을 발현하는 색소이다(Choung, 2004). 안토시아닌 천연색소원으로 복분자 이외로 주목 받 고 있는 것들은 자색고구마, 꽃양배추, 포도껍질, 오디, 유색 미, 꽃 베고니아 등이다(Jeong & Seo, 2009). 식물체에서 600여 종 이상이 발견되고 있는 안토시아닌은 모두 안토시아 니딘(anthocyanidin) 배당체로서 안토시아니딘은 flavyilium(2- phenyl-1-benzopyrilim)의 기본구조에 수산기 또는 메톡실기가 치환되어있는 구조를 가진다(Choi, 2010; He & Giusti, 2011). 복분자는 씨앗과 과피가 전체 과실의 20-25%를 차지 하며 착즙 후 가공 과정을 거쳐서 술, 음료, 전병, 환 등으 로 제품화되고 있다. 복분자의 착즙 공정에서 발생되는 복 분자 박의 일부는 사료로 이용되고 있으나 대부분 폐기되고 있는 실정이다(Choung & Lim, 2012).
안토시아닌 추출방법으로 주로 용매추출법을 이용하는데 메탄올 추출은 에탄올, 아세톤, 열수 추출에 비하여 각각 20, 50, 73%의 수율 증가 효과가 있으나 식품에서는 메탄 올의 독성 때문에 일반적으로 에탄올 추출법을 이용한다 (Metivier et al., 1980). 그 이외의 추출방법으로써 초임계 추출, 초음파추출, 유산균발효 추출, 마이크로웨이브추출 등이 연구 보고되었다(Ryu & Kwon, 2013). 안토시아닌 추출과정에서 당류, 유기산, 단백질 등이 동시에 추출됨으 로서 정제(purification) 과정이 요구되어진다. 정교한 정제 방법으로는 countercurrent chromatography(CCC), medium pressure liquid chromatography(MPLC), high performance chromatography(HPLC) 등이 있으나(Castaneda-Ovando et al., 2009) 일반적으로 경제성을 지닌 대규모 정제방법으로 이온교환수지(ion exchange resin)법을 사용하며 안토시아닌 조추출물을 이온에 통과시킨 다음 에탄올이나 메탄올을 이 용하여 용출시킨다.
본 연구에서는 복분자박의 안토시아닌을 천연색소원으로 활용하기 위하여 정제방법으로써 MCX SPE cartridge를 흡 착제(sorbent)로 사용하였으며 pH 조절제로서 HCl 또는 trifluoroacetic acid(TFA)의 농도 변화 및 용출제로서 ethanol 농도 변화에 따른 수율, 색 가 및 총 안토시아닌 함량 등을 분석하였다. 실험 설계는 요인실험법(full factorial design)에 의하여 행하였으며 다중반응표면분석법에 의하여 최적의 안 토시아닌 정제 조건을 분석하였다.
재료 및 방법
본 실험에 사용한 복분자 부산물은 코레아누스(Gochanggun, Jeollabuk-do, Korea)에서 제공받은 것으로 착즙 후 압 착한 시료였으며 분석에 사용한 시약은 모두 Sigma사(St. Louis, USA)의 특급 시약을 사용하였다.
복분자 부산물의 추출 공정은 건물 1 g을 60% 에탄올 200 mL와 함께 sonicator(VC 601, Sonics & Materials Inc., Newtown, CT., USA)를 이용하여 40℃에서 1시간 추출한 후 수율 향상을 위하여 pectinase로 효소 처리를 하였다. 효소 선정 및 처리 공정은 예비실험을 통하여 최적 조건을 찾았으며 pectinase(Pectinex Ultra SP-L)농도 1.5mL/100 L, 효소 처리 온도 40℃, 효소 처리 시간 2시간으로 행한 다음 4000 rpm으로 15분간 원심 분리하여 상등액을 얻었다. 상등 액의 지방 성분을 제거하기 위해 ethyl ether:n-hexane(1:6, v/ v)용액으로 세척한 다음 진공회전농축기(BUCHI rotavapor R-124 and BUCHI water bath B-480, Flawil, Switzerland)로 40℃에서 20 Brix로 농축한 후 deep freezer에 보관하여 사용 하였다. 복분자 추출물의 정제공정은 MCX SPE cartridge (6mL, Waters Corp., Milford, USA)를 sorbent로 행하였고 pH 조절제로 HCl 또는 trifluoroacetic acid(TFA)를 사용하였 으며 용출제로는 ethanol을 사용하였다.
복분자 추출물을 이용한 안토시아닌계 정제공정의 최적 화를 위한 실험 설계는 요인실험법(full factorial design)을 이용하였으며 MCX SPE cartridge를 sorbent로 행하였고 이때 요인은 두 가지로서 HCl 또는 TFA의 농도(X1)와 ethanol의 농도(X2)를 사용하였으며 각 요인에 대한 수준은 Table 1과 같다. 각 독립변수는 수준을 3가지로하여 -1~1 범위의 각 code value를 갖도록 선형화하였다. 또한 처리 조건에 따른 최적화 공정설계는 반응표면분석법(response surface methodology, RSM)을 이용하여 주요 반응 변수(측 정값)의 최적 조건을 다중반응표면분석법에 의하여 찾았다.
| Factors | Code value | |||
|---|---|---|---|---|
| -1 | 0 | 1 | ||
| Concentration of HCl or TFA (%) | X1 | 0.10 | 0.55 | 1.00 |
| Concentration of ethanol (%) | X2 | 60 | 75 | 90 |
각 인자의 수준 변화에 따른 안토시아닌계 정제공정의 최적화를 위하여 분산분석, 이차다항회귀곡선식 및 반응표 면분석법 등의 통계 방법을 이용하였으며 통계분석은 SAS 9.3을 이용하였다(SAS Institute Inc., Cary, NC, USA).
정제수율은 아래의 공식에 의하여 산출하였다.
여기서, A: 칼럼에 통과시킨 시료량, B: 안토시아닌 용 출 시 사용한 용매량, C: 정제물
시료의 흡광도가 0.3~0.7의 범위가 되도록 pH 3.0의 구 연산 인산이나트륨 완충액을 가하여 100 mL로 한 것을 시 험 용액으로 하였으며 원심 분리하여 그 상등 액을 사용하 였다. pH 3.0의 구연산 인산이나트륨 완충액을 대조 액으 로 하여 액 층 1 cm, 파장 500~540 nm 부근의 극대 흡수 파장에서 시험 용액의 흡광도 A를 측정하여 다음 식에 따 라 색가(color value)를 구하였다.
총 안토시아닌 정량은 Hosseinian et al.(2008)의 pH differential method에 따라 측정하였다. 각 추출물 0.5 mL에 0.025 M potassium chloride buffer(pH 1.0)와 0.4M sodium acetate buffer(pH 4.5)를 가하여 최종 부피를 5 mL로 한 다 음 510 및 700 nm에서 반응 액의 흡광도를 각각 측정하여 아래의 식으로 결과를 얻었다.
여기서, A(absorbance value) = (A510nm-A700nm)pH1.0-(A510nm- A700nm)pH4.5, MW(molecular weight of cyanidin-3-glucoside) = 449.2, D(dilution factor) = dilution ratio of sample, ε(cyanidin- 3-glucoside molar absorbance) = 26,900M-1cm-1, V = final volume of sample
결과 및 고찰
안토시아닌 정제공정에서 MCX SPE cartridge를 sorbent 로 사용하였고 두 가지 요인으로 pH 조절제로서 HCl 또 는 TFA의 농도(0.1-1.0%)와 용출제로서 ethanol의 농도(60- 90%)에 따른 정제된 안토시아닌의 외형 사진은 Fig. 1과 같다. MCX sorbent는 강력한 양이온 교환과 역상 흡착 작 용(reversed phase adsorption)의 특성을 지니고 있으며 chokeberry로부터의 안토시아닌 정제공정에서 optimized C18, original C18, LH20 및 HLB 등의 sorbent들 보다 높 은 안토시아닌 순도 및 회수율을 얻었다는 연구결과가 있 다(He & Giusti, 2011). 정제공정에서의 안토시아닌 안정성 을 위하여 pH 조절제로서 HCl 또는 TFA를 사용하였다. 안토시아닌은 pH에 따라서 색상이 변화되는데 pH 1에서 는 붉은 색상을 나타내고, pH 2-4에서는 푸른 색상을 보이 고, pH 5-6에서는 무색화가 이루어지며, pH가 7 이상에서 는 aldehyde와 phenolic acid로 분해된다(Fleschhut et al., 2006). pH가 낮을수록 붉은색을 띄게 되는 것은 red flavyilium ion에 기인된다고 하였다(Cooper-Diver, 2001). 용출에 사용되는 것으로는 에탄올, 메탄올, 증류수 등이 이 용되고 있으며 독성과 수율을 고려하여 식품산업에서는 주 로 에탄올이 사용된다. 분리된 안토시아닌의 색상 측면에 서 관능적으로 HCl이 TFA보다 붉은색이 강하였으며 HCl 의 농도가 1%, 용출에 이용되는 에탄올은 0.75% 조건에서 붉은색이 가장 진하게 나타났다.
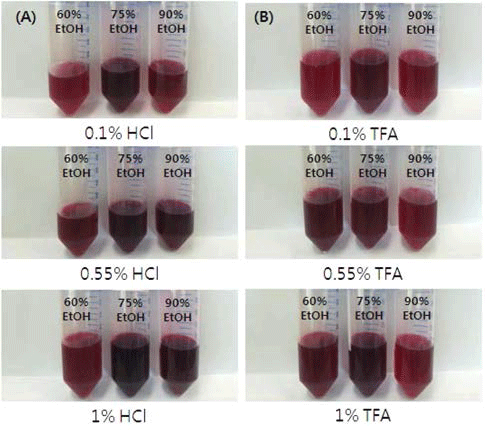
두 가지 요인으로서 HCl 또는 TFA의 농도와 ethanol의 농도에 따른 정제된 안토시아닌의 수율, 색가 및 총 안토 시아닌 함량을 조사한 결과 Table 2와 같다. 안토시아닌의 수율 측정은 추출물과 용매 량의 무게에서 MCX SPE cartridge에 통과된 추출물을 농축하여 얻은 정제물의 무게 비율로 나타내었으며, 색가 측정은 일반적으로 3-Oglucosylated 안토시아닌의 최대 흡수 파장대인 510-530 nm 를(He & Giusti, 2011) 이용하거나 단일 파장으로서 malvidin 3-O-glucoside의 최대 흡수 파장대인 540 nm (Guillotin et al., 2009)로 측정하지만 본 실험에서는 식품첨가물공전에서의 파장 폭인 500-540 nm의 흡수파장 대에서의 흡광도로 분 석하였다. HCl의 경우에는 본 실험의 흥미영역 구간 실험 점에서의 수율은 HCl 1%, ethanol 60%의 조건에서 63.47%로 가장 높았으며 색가는 HCl 1%, ethanol 75%의 조건에서 0.996으로 가장 높은 값을 보였다. 총 안토시아 닌 함량은 HCl 1%, ethanol 75%의 조건에서 19.69 mg/kg 으로 가장 높았다. 반면에 TFA의 경우에는 수율은 TFA 1%, ethanol 60%에서 63.39%이었으며 색가는 TFA 1%, ethanol 75%에서 0.813, 총 안토시아닌 함량은 TFA 1%, ethanol 75%에서 16.86 mg/kg으로 가장 높은 함량을 나타 내었다. 정제된 안토시아닌의 수율, 색가 및 총 안토시아닌 함량을 분석한 결과 pH 조절제로서 HCl이 TFA보다 우수 하게 나타났으며 용출제로서의 ethanol의 농도로는 60-75% 수준이 가장 좋은 결과를 얻었다.
흥미구역 안에서 HCl 또는 TFA의 농도와 ethanol의 농 도에 따른 정제된 안토시아닌의 수율, 색가 및 안토시아닌 함량에 미치는 정도를 분산 분석한 결과 Table 3과 같다. pH 조절제로서 HCl을 사용한 경우 수율, 색가 및 총 안토 시아닌 함량에 미치는 영향은 ethanol의 농도 변화가 HCl 의 농도 변화보다 큰 것으로 나타났다. Ethanol의 농도는 수율, 색가 및 총 안토시아닌 함량에서 모두 0.1% 이내에 서 유의성 차이를 보였다. pH 조절제로서 TFA를 사용한 경우는 수율에서만 ethanol의 농도 변화가 TFA의 농도 변 화보다 큰 것으로 나타나 0.1% 이내에서 유의성 차이를 보인 반면 색가와 총 안토시아닌 함량에서는 ethanol의 농 도 변화보다 TFA의 농도 변화에 영향이 큰 것으로 나타났 다. 안토시아닌 색소의 정제공정에서의 pH 조건에 따른 가 공 및 저장 안정성과 선명한 적색을 나타내는 안토시아닌 색소의 특성에 기인하여 HCl이나 유기산을 첨가하며 안토 시아닌 색소는 일반적으로 pH가 낮을수록 추출 효율 또한 우수하다고 알려져 있다(Fuleki & Francis, 1968; Jackman et al., 1987). 처리 요인의 수준에 대하여 종속변수인 수율, 색가 및 총 안토시아닌 함량을 예측하기 위한 이차다항회 귀곡선식의 회귀계수를 계산한 결과 Table 4와 같다. 수율, 색가 및 총 안토시아닌 함량에 대하여 이차다항회귀곡선식 에의 일차다항회귀(linear), 이차다항회귀(quadratic) 및 교차 회귀(cross product)의 기여도를 검정한 결과(Table 5) pH 조절제로서 HCl 또는 TFA에 관계없이 수율, 색가 및 총 안토시아닌 함량 기여도는 모두 일차다항회귀, 이차다항회 귀 및 교차회귀 순으로 나타났으며 이차다항회귀곡선식 적 합성 검정에서의 total regression은 모두 1% 이내에서 유 의성 차이를 보였다.
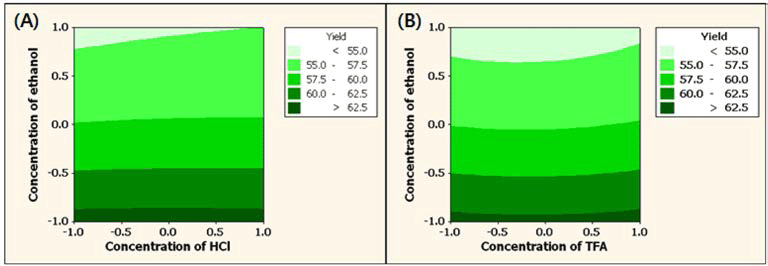
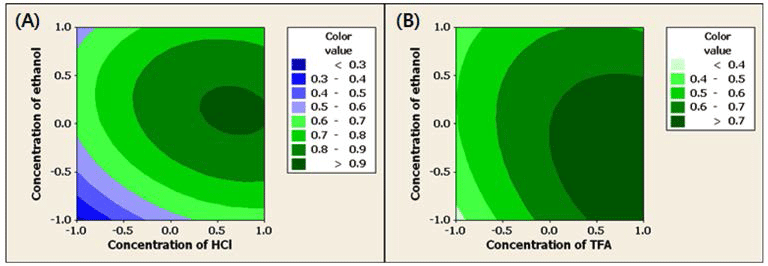
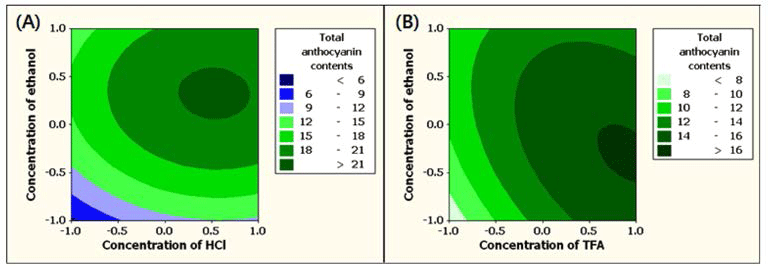
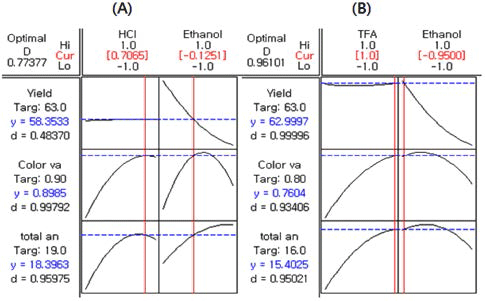
HCl 또는 TFA의 농도와 ethanol의 농도에 따른 정제된 안토시아닌의 수율에 미치는 영향을 반응표면분석법으로 분 석한 결과 Fig. 2와 같다. 복분자 주를 생산하고 남는 찌꺼 기를 이용하여 안토시아닌을 얻고자 열수추출 하였을 때 안 토시아닌(1.36 g/100 g)보다 높은 함량의 uronic acid(41.88 g/ 100 g)를 비롯하여 glucose, glycerol, succinic acid, citric acid 등이 함께 추출되었으며(Ku & Mun, 2008) 열수를 포함한 용매 추출한 안토시아닌의 경우 순도를 높이기 위하여서는 정제공정이 필요하다. 안토시아닌 정제공정에서 HCl 또는 TFA의 농도보다는 ethanol의 농도에 영향을 크게 받는 것 을 알 수 있었으며 ethanol의 농도가 높아짐에 따라서 수 율 또한 증가하는 것으로 나타났다. pH 조절제로서 HCl의 농도 변화와 용출제로 ethanol 농도 변화에 따른 정제된 안 토시아닌의 수율을 반응 표면 분석한 결과 HCl 0.41%, ethanol 60% 일 때가 최적 조건으로 63.45%로 예측되었다. 반면 TFA의 경우에서는 TFA 1.00%, ethanol 60% 일 때 63.34%로 예측되었다. 정제된 안토시아닌의 색가에 미치는 영향을 분석한 결과 Fig. 3과 같으며 HCl과 ethanol의 농 도에 따른 변화(Fig. 3-A)에서는 두 요인이 색가에 유사하 게 영향을 미치는 것을 알 수 있었으며 TFA와 ethanol의 농도에 따른 변화(Fig. 3-B)에서는 TFA의 농도 변화에 대 한 영향력이 더 큰 것으로 나타났다. HCl과 ethanol 농도 변화에 따른 정제된 안토시아닌의 색가의 최적 조건은 HCl 0.84%, ethanol 77.58% 일 때 0.91로 예측되었으며 TFA의 경우는 TFA 1.0%, ethanol 68.16% 일 때 0.78로 예측되었다. 정제된 안토시아닌의 총 안토시아닌 함량에 미치는 영향을 분석한 결과 Fig. 4와 같으며 HCl과 ethanol의 농도에 따른 변화(Fig. 4-A)에서는 ethanol의 농도 가 영향력이 컸으며 TFA와 ethanol의 농도의 변화(Fig. 4- B)에서는 TFA의 농도가 영향력이 더 큰 것으로 나타났다. 최적 조건으로 HCl 0.44%, ethanol 73.81% 일 때 정제된 안토시아닌의 총 안토시아닌 함량은 19.69 mg/kg로 예측되 었다. 반면 TFA의 경우는 TFA 1.0%, ethanol 70.06% 일 때 16.12 mg/kg로 예측되었다. HCl 또는 TFA의 농도와 ethanol의 농도에 따른 정제된 안토시아닌의 수율, 색가 및 총 안토시아닌 함량을 다중반응표면의 최적화방법으로써 만족 함수(desirability function)를 이용하여 종속변수들의 가중치를 1로 놓고 종합적으로 판단한 결과 pH 조절제가 HCl인 경우(Fig. 5-A) 최적 정제 조건은 HCl 0.84%, ethanol 73.12%의 조건이었으며 전반적인 만족도(overall desirability)는 0.77이었다. TFA에서의(Fig. 5-B) 최적 정제 조건은 TFA 1.00%, ethanol 60.75%의 조건이었으며 전반 적인 만족도는 0.96이었다.
요 약
본 연구는 복분자박의 안토시아닌을 천연색소원으로 활 용하기 위하여 MCX SPE cartridge를 흡착제로 사용하였 으며 pH 조절제로서 HCl 또는 trifluoroacetic acid(TFA)의 농도 변화 및 용출제로서 ethanol 농도 변화에 따른 수율, 색 가 및 총 안토시아닌 함량 등을 반응표면분석법에 의하 여 최적화하였다. 정제된 안토시아닌의 수율, 색가 및 총 안토시아닌 함량을 전반적으로 분석한 결과 pH 조절제로 서 HCl이 TCA보다 우수하게 나타났으며 용출제로서의 ethanol의 농도로는 60-75%수준에서 가장 좋은 결과를 얻었 다. 다중반응표면의 최적화방법으로써 만족함수(desirability function)를 이용하여 종속변수들의 가중치를 1로 놓고 분석 한 결과 pH 조절제가 HCl인 경우 최적 분리정제 조건은 HCl 0.84%, ethanol 73.12%의 조건이었으며 전반적인 만 족도는 0.77이었다. TFA에서의 최적 분리정제조건은 TFA 1.0%, ethanol 60.75%의 조건이었으며 전반적인 만족도는 0.96이었다.